Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.21 no.2 Medellín Apr./June 2008
Farmacocinética plasmática de la balofloxacina en terneros¶
Plasma pharmacokinetic of balofloxacin in calves
Farmacocinética plasmática de balofloxacin em bezerros
Hugo García Ovando1*, MV, Dr. Cienc. Biol; Guillermo F Prieto1, MV, Esp Cienc. Clin; Carlos F Lüders1, MV, MS; Carlos A Errecalde1, MV, Esp Cienc. Clin.
1Farmacología, Departamento Clínica Animal, Facultad de Agronomía y Veterinaria, Universidad Nacional de Río Cuarto. Ruta Nacional 36, km 601 (5800) Río Cuarto, Córdoba, Argentina.
(Recibido: 21 febrero, 2007; aceptado: 21 mayo, 2008)
Resumen
Los parámetros farmacocinéticos de absorción y disposición de balofloxacina se determinaron en terneros hembras raza holando-argentino (n = 6), luego de una dosis única de 5 mg/kg administrada en bolo intravenoso y subcutáneo, en un diseño cruzado de tratamiento. El analito se determinó en muestras de plasma por método microbiológico de difusión en agar utilizando como microorganismo detector una solución de esporas de Bacillus subtilis BGA y medio de cultivo Antibiotic Nº 1. Las concentraciones plasmáticas de balofloxacina en función del tiempo se analizaron por el modelo cinético no compartimental utilizando el software PK Solution 2.0. Los parámetros farmacocinéticos obtenidos fueron para la vía intravenosa: t1/2 β = 2.3 ± 1.1 h; Cltotal área= 10.2 ± 3.4 ml/min/kg; Vdárea= 1.8 ± 0.3 L/kg; ABCárea= 551.3 ± 247.0 µg/min/ml. Excepto para CltotaL área y ABCárea, los valores obtenidos para la administración intravenosa difirieron significativamente de los obtenidos del ensayo por vía subcutánea (p<0.05), para el cual se obtuvo un Cmáx= 1.3 ± 0.4 µg/ml, con un tmáx= 51 ± 12.1 minutos y una biodisponibilidad cercana al 98%. El valor de Vdárea superior a 1 l/kg obtenido con ambas vías de aplicación indica buena capacidad para difundir a territorios extravasculares y tejidos.
Palabras clave: Bos taurus, farmacocinética de balofloxacina, farmacocinética en terneros
Summary
Pharmacokinetic parameters of absorption and disposition of balofloxacin were determined in female Holando-Argentinean calves (n = 6), after a 5 mg/kg single dose, administered as both intravenous and subcutaneous bolus, in a crossed-over design treatment. The analyte was determined in plasma samples by microbiological method in agar diffusion, using a Bacillus subtilis BGA spore solution as microorganism detector in agar Antibiotic Nº 1. The plasmatic concentrations of balofloxacin based on the time were analyzed by a non compartimental kinetic model using software PK Solution 2.0. The intravenous pharmacokinetic parameters obtained were: t1/2β= 2.3 ± 1.1 h; Cltotal area= 10.2 ± 3.4 ml/min/kg; Vdárea= 1.8 ± 0.3 L/kg; and AUCárea= 551.3 ± 247.0 µg/min/ml. Except for Cltotal area and AUCarea, the values obtained for the intravenous administration significantly differed from the obtained ones for the subcutaneous route (p<0.05), for which Cmax= 1.3 ± 0.4 µg/ml, tmax= 51 ± 12.1 minutes and bioavailability values close to 98% were obtained. The Vdarea value was superior to 1 l/kg for both routes of application and indicates good capacity to spread to extravascular area and tissues.
Key words: balofloxacin pharmacokinetic, Bos taurus, pharmacokinetic in calves
Resumo
Os parâmetros farmacocinéticos de absorção e eliminação dos balofloxacin foi determinada nos bezerros Holando-argentina (n = 6), depois de uma dose única de 5 mg/kg, uma vez que ambos foram administrados em bolus por via intravenosa e subcutânea, em um design de tratamento cruzado. O analito foi determinado em amostras de plasma por método microbiológico de difusão em ágar, utilizando uma solução de esporos de microorganismo Bacillus subtilis BGA como detector em ágar antibiótica Nº 1. As concentrações plasmáticas de balofloxacin com base no tempo não foram analisados por um modelo de cinética compartimental usando software PK Solução 2,0. O parâmetros farmacocinéticos da via intravenosa obtidos foram: t1/2 β = 2.3 ± 1.1 h; Cltotal área = 10.2 ± 3.4 ml / min / kg; Vdárea = 1.8 ± 0.3 l/kg; e AUCárea = 551,3 ± 247,0 µg/min/ml. Exceto para Cltotal área e AUCárea, os valores obtidos para a administração intravenosa diferiu significativamente do obtido para a via subcutânea, (p<0,05), para a qual Cmax = 1.3 ± 0.4 µg/ml, tmax = 51 ± 12.1 minutos e biodisponibilidade perto de 98% foram obtidos. O valor Vdarea foi superior a 1 l/kg para ambas as vias de aplicação e indica uma boa capacidade de propagação de espaço extravascular e tecidos.
Palavras chave: Bos taurus, farmacocinética de balofloxacin, farmacocinética em bezerros
Introducción
El desarrollo de fluoroquinolonas ha posibilitado disponer de una importante opción en terapéutica antibacteriana veterinaria. Las mismas poseen propiedades farmacológicas superiores a su precursor, el ácido nalidíxico, y los atributos cercanos al de un antimicrobiano ideal, tales como dosificación oral y parenteral, espectro amplio de actividad que comprende bacterias gram negativas y positivas, anaerobios facultativos y micobacterias (1, 4, 17). Clínicamente presentan reducida incidencia de efectos colaterales, excepto el riesgo de condrotoxicidad en animales en crecimiento (5, 10, 11). En dosis convencionales alcanzan niveles útiles en plasma y en diferentes tejidos y órganos, por lo que están indicadas en una amplia variedad de patologías infecciosas tanto de etiología como de localización (6, 18, 19), ejerciendo una actividad bactericida dosis dependiente debido a la interacción con las enzimas bacterianas DNAgirasa y topoisomerasa IV, indispensables para la replicación celular (4, 18, 19). A pesar de estas características, el empleo indiscriminado de las fluoroquinolonas ha favorecido la difusión de resistencia en bacterias de interés zoonótico particularmente Campylobacter jejuni, lo que ha producido el retiro de la autorización para el empleo de estos compuestos en animales de producción en los Estados Unidos (8), mientras en otros países se sugiere limitar su uso (18).
Actualmente, en Argentina, como recursos antimicrobianos en terapéutica veterinaria se emplean danofloxacina, norfloxacina, enrofloxacina y ciprofloxacina. Balofloxacina es una fluoroquinolona de cuarta generación (12, 13), de la cual existen escasos reportes en la bibliografía. Posee en su estructura un grupo metoxi en posición 8, que a diferencia de la mayoría de las fluoroquinolonas le confiere la ventaja de producir mínimas reacciones de fotosensibilización (6, 13). Su perfil antimicrobiano corresponde al grupo de las fluoroquinolonas, presenta un espectro amplio de acción antibacteriana y un perfil cinético, estudiado en ratas, ratones y perros, caracterizado por buena absorción oral, amplia distribución tisular y eliminación, principalmente urinaria (13). En la actualidad no existen antecedentes respecto de su cinética plasmática en especies de interés productivo, por lo cual se efectuó el presente estudio en terneros, con el objetivo de aportar información sobre valores de los distintos parámetros que caracterizan la cinética de absorción y disposición de la balofloxacina en terneros lactantes con el propósito de considerar su aplicación como recurso terapéutico en medicina veterinaria.
Materiales y métodos
Aval del Comité de ética
Los animales fueron tratados durante la presente experiencia según normas internacionales vigentes en la República de Argentina, respecto de la defensa y cuidado de animales de experimentación.
Población de estudio y muestra
Como sujetos experimentales se utilizaron terneras de la raza holando-argentino clínicamente sanas, seleccionadas al azar (n = 6) de una población homogénea de 100 animales sin antecedentes de tratamientos recientes con antimicrobianos, de edad promedio 43 ± 5 días y de 50.5 ± 9.3 kg de peso vivo, pertenecientes a un establecimiento de crianza intensiva ubicado en Sampacho, Departamento de Río Cuarto, Provincia de Córdoba, Argentina. El experimento se realizó en los meses de verano (diciembre a febrero), en los cuales se registró una temperatura media de 24 ºC y humedad relativa ambiente del 66%. Los animales se sometieron a un mismo régimen de manejo y alimentación, consistente en dos raciones diarias de dos litros de sustituto lácteo y 0.4 kg de alimento balanceado cada una, con acceso a pasturas naturales durante el día y agua ad libitum. Para el estudio se empleó balofloxacina base en polvo liofilizado con 100% de pureza (Chugai Pharmaceutical, Japón), a partir de la cual se preparó una formulación inyectable al 2.5% en HCl 0.1 N, ajustando el pH a 6.0 con NaOH 1 N y filtrada por membrana de nylon de 0.22 µm.
Protocolo experimental. El preparado se administró a los animales en dosis única de 5 mg/kg en forma de bolo en vena yugular derecha o bien en el tejido subcutáneo por detrás de la escápula izquierda. En el estudio se utilizó un diseño cruzado de tratamiento, consistente en que un grupo recibió la dosis por vía intravenosa (n = 3) y otro por vía subcutánea (n = 3). Un mes después ambos grupos recibieron la droga intercambiando la vía de administración y utilizando la misma dosis. Previamente (tiempo 0) y posterior a su administración, se tomaron muestras de sangre de vena yugular izquierda en tubos heparinizados, en tiempos prefijados: 0.08, 0.16, 0.25, 0.33, 0.41, 0.5, 1, 2, 4, 6, 8, 10 y 12 h. Las muestras de sangre se centrifugaron a 4000 rpm/15 min/4 ºC para obtener los plasmas correspondientes, los que se conservaron a -20 ºC hasta el momento del ensayo.
Mediciones de balofloxacina. La determinación de balofloxacina en las muestras problema se realizó mediante el método microbiológico clásico de difusión en agar según Bennett et al (2), utilizando como organismo detector una solución de esporas de Bacillus subtilis BGA, con densidad óptica de 0.5 a 580 nm. Las muestras y una curva de calibración de 8 diluciones estándares de balofloxacina (0.039 a 5 µg/ml) confeccionada en plasma de terneras libre de antimicrobianos, se sometieron simultáneamente y por triplicado al ensayo microbiológico utilizando medio de cultivo Antibiotic Nº 1 (Merck). Las placas sembradas se refrigeraron durante 60 minutos y luego se incubaron a 33 ºC/18 h. Los halos de inhibición producidos se midieron con un calibre digital con resolución de décimas de mm y error de 0.01 mm a temperatura ambiente de 25 ºC. Previo al análisis de las muestras problema se procedió a validar la metodología estableciendo linealidad, límite de cuantificación, reproducibilidad y repetibilidad. Las concentraciones de balofloxacina en las muestras de plasma se calcularon empleando los valores de intercepto y pendiente de la curva de calibración obtenida por regresión no lineal, de los diámetros de los halos de inhibición vs. las concentraciones estándares respectivas. Ambas variables, cuyos valores se transformaron en logarítmos decimales, mostraron un mejor ajuste a un modelo exponencial, en concordancia con lo expuesto por Nouws y Ziv (14), ya que este exhibe los mejores coeficientes de correlación de las variables citadas, expresado como:
Y = Ao.XB
Donde,
Y: diámetro de halo inhibición (mm)
X: concentración (µg/ml)
Ao: intercepto en la ordenada
B: corresponde a la pendiente de la curva
Mediante el valor de halo de una determinada muestra y los valores de intercepto y la pendiente de su curva de calibración, se calculó la concentración respectiva mediante sustitución de los valores en la fórmula precedente.
Análisis estadístico
Los datos individuales de concentraciones plasmáticas en los distintos tiempos se sometieron a un análisis farmacocinético por el modelo no compartimental (16) mediante el programa PK-Solution versión 2.0 (7) el cual calcula los parámetros cinéticos “robustos” como área bajo la curva de concentración versus tiempo (ABCo-∞) y la constante de velocidad de eliminación (β). Conjuntamente con el dato de dosis utilizada, se determinaron otros parámetros importantes como volumen de distribución (Vdárea), Clearance total (Cl total) y vida media de eliminación (t½β). La biodisponibilidad sistémica por vía subcutánea se estimó considerando el valor de área bajo la curva en relación a la intravenosa (ABCsc/ABCiv x 100). Para comparar los parámetros farmacocinéticos obtenidos por vía intravenosa con los resultantes de la vía subcutánea se utilizó la prueba de diferencias de media , “t de Student” con un nivel de significancia p<0.05 (15).
Resultados
La aplicación de balofloxacina fue bien tolerada en todos los animales y no provocó reacciones en el sitio de aplicación. Las concentraciones plasmáticas de balofloxacina se determinaron en terneros, en distintos tiempos, después de administrar por vía intravenosa o subcutánea, una dosis única de 5 mg/kg, para lo cual se utilizó el método microbiológico clásico propuesto por Bennett et al (2), sin extracción del analito del plasma. El límite de cuantificación obtenido fue de 0.15 µg/ml, considerado aceptable para determinaciones en estudios de cinética plasmática y urinaria. Los coeficientes de variación de repetibilidad y reproducibilidad se situaron en 1.4 y 2.8 %, respectivamente, inferiores a los obtenidos en otros ensayos realizados con este antimicrobiano (13). La distintas curvas de calibración resultaron lineales en el rango de concentraciones de 0.15 a 5 µg/ml de balofloxacina, situación confirmada por los elevados coeficientes de determinación obtenidos (R2>0.99). La figura 1 representa las curvas promedio originadas con ambas vías de administración.
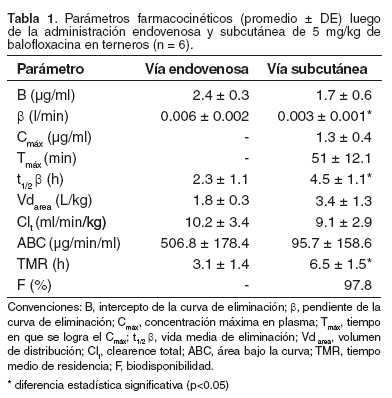
Las concentraciones plasmáticas obtenidas en cada vía de administración y en cada animal fueron analizadas mediante el programa PK-Solution versión 2.0 (7). Los datos mostraron un mejor ajuste a una función bi-exponencial, cuyo R2 para la fase de eliminación fue mayor de 0.98 (± 0.01); en consecuencia, se adoptó esta función para el cálculo de los parámetros cinéticos cuyos valores se indican en la tabla 1. Los resultados indicaron una importante absorción de balofloxacina para la aplicación subcutánea y, elevada difusión tisular, no obstante la permanencia del antimicrobiano en el organismo fue restringida, tal como expresan los valores encontrados en los parámetros t1/2 β y MRT.
Discusión
Bottcher et al (3) sostienen que el HPLC debería ser el método de elección para determinar quinolonas, aunque bajo condiciones óptimas los ensayos microbiológicos pueden dar resultados comparables; en éste, estudio utilizando B. subtilis como detector, se consideró apropiado por cuanto el diámetro de los halos de inhibición fue lineal entre concentraciones de 0.078 a 5 µg/ml, considerando el primero como valor aceptable como límite de cuantificación y los coeficientes de variación de repetibilidad y reproducibilidad del método, se situaron dentro de valores que son aceptados para validar este tipo de metodología aún cuando no discrimina entre balofloxacina y metabolitos activos. El análisis farmacocinético no compartimental resultó adecuado, considerando las variaciones individuales de los animales utilizados en cuanto al estado general y peso corporal, lo que se refleja en variaciones significativas de las concentraciones plasmáticas de balofloxacina entre los animales de cada tratamiento.
El presente análisis hace que el valor de los parámetros que representan la distribución y eliminación, que se calculan en base al área bajo la curva, no sean tan sensibles a estas variaciones (16), como ocurre cuando se utiliza un análisis compartimental. Asimismo, éste análisis puede aplicarse a datos generados por cualquier vía de administración. La absorción experimentada por administración subcutánea tuvo un Cmáx de 1.3 ± 0.5 µg/ml con un tmáx promedio calculado de 51 ± 12.1 minutos, lo que refleja moderada velocidad de absorción y una significativa variación individual de este proceso, sin que exista un componente patológico responsable de esta variación. La absorción subcutánea es un proceso cuya velocidad es menor e irregular respecto la vía intramuscular, posiblemente por la calidad de la irrigación comparada a otros sectores (16). Sin embargo, la biodisponibilidad sistémica calculada para la vía subcutánea fue de 97.8%, valor superior al obtenido por Nakagawa et al (13) para la aplicación oral en caninos, empleando una dosis de 10 mg/kg y cuyo valor fue 87%. En cuanto a los parámetros cinéticos que representan el proceso de eliminación (Véase Tabla 1) como el t1/2 β, los valores fueron significativamente superiores (2.3 ± 1.1 versus 4.5 ± 1.1 h), para la aplicación intravenosa respecto de la subcutánea (p<0.05) y fueron inferiores a los informados en caninos por Nakagawa et al (13) quienes utilizaron una dosis de 10 mg/kg por las vías endovenosa y oral, correspondientes a 6.3 ± 0.3 h y 5.8 ± 0.4 h y a las 7.8 h informadas en el hombre joven aplicando una dosis total de 200 mg por vía oral (9).
Los valores promedio de volumen de distribución (Vd), obtenidos por los ensayos de ambas vías, tal como se muestran en la tabla 1, son significativamente diferentes (p<0.05), en tanto no difirieron el ABCsc y el ABCev, en concordancia con el valor de F obtenido. En cuanto al perfil farmacocinético exhibido por balofloxacina obtenido en terneros, se corresponde con los de la familia de las fluoroquinolonas (1, 4, 19) y se considera que posee una buena absorción subcutánea, cuya biodisponibilidad es próxima al 98%. Así mismo, el valor de volumen de distribución promedio, superior a 1 l/kg en ambas vías de aplicación, indica una buena capacidad para difundir a las regiones extravasculares y los tejidos, característica importante en el tratamiento de infecciones bacterianas de distinta localización. Sin embargo, a partir de los datos obtenidos no se puede inferir que los niveles terapéuticos sean los adecuados en todos los tejidos. No obstante esta limitación, este medicamento, aún no incorporado en medicina veterinaria en Argentina y otros países latinoamericanos, es un recurso de interés para someterlo a futuros estudios de eficacia antimicrobiana en los modelos in vitro y así disponer de mayores antecedentes para proponer regímenes de dosificación basados en los predictores de eficacia clínica para las fluoroquinolonas, como ABC24/CIM (área bajo la curva durante 24 h/concentración inhibitoria mínima de la bacteria patógena) (19) y considerar su uso en medicina veterinaria.
Referencias
1. Anadón A. Les fluoroquinolones: aspects pharmacologiques et toxicologiques. Bull Acad Vet France 1992; 65:207-216. [ Links ]
2. Bennett J, Brodie J, Brenner E, Kirby W. Simplifield accurate method for antibiotic assay of clinical specimens. Appl Microbiol 1966; 14:170-177. (Abstract) (Html) (Pdf) [ Links ]
3. Bottcher S, Baum H, Hope-TIchy T, Benz C, Sonntag H. An HPLC assay and a microbiological assay to determine levofloxacin in soft tissue, bone, bile and serum. J Pharm Biomed Anal 2001; 25:197-203. (Pdf) [ Links ]
4. Brown S. Fluoroquinolones in animal health. J Vet Pharmacol Therapy 1996; 19:1-14. (Abstract) [ Links ]
5. Burkhardt J, Hill M, Carlton W, Kesterson J. Histologic and histochemical changes in articular cartilages of inmature beagle dogs with difloxacin, a fluoroquinolone. Vet Pathol 1990; 27:162-170. (Abstract) [ Links ]
6. Domagala J. Structure activity and structure side effects relationships for the quinolone antibacterials. J Antimicrob Chemother 1994; 33:685-706. (Abstract) [ Links ]
7. Farrier A. PK Solution 2.0. Noncompartmental pharmacokinetic analysis. Ashland: Summit; 1999. (Html) [ Links ]
8. Food and Drug Administration (FDA). Center for Veterinary Medicine. Risk assessment on the human health impact of fluoroquinolones resistance Campylobacter associated with the consumption of chickens. 2000; 1-113. (Html) [ Links ]
9. Kozawa O, Tuemats U, Matsuno H, Niwa M, S Nagashima, et al. Comparative study of pharmacokinetics of two new fluoroquinolones, balofloxacin and grepafloxacin in elderly subjects. J Antimicrob Agents Chemother 1996; 40:2824-2828. (Pdf ) [ Links ]
10. Machida M, Kusajima H, Alijima H, Maeda A, Ishida R, et al. Toxicokinetic study of norfloxacin-induced arthropaty in juvenile nimals. Toxicol Appl Pharmacol 1990; 105:403-412. (Abstract) [ Links ]
11. Mont M, Mathur S, Frondoza C, Hungerford D. The effect of ciprofloxacin on human condrocytes in cell culture. Infection 1996; 24:151-155. (Abstract) [ Links ]
12. Morejon García, M. Actualización en quinolonas. Electron J Biomed 2003; 1:170-178. (Html) [ Links ]
13. Nakagawa T, Ishigai M, Kato M, Hayakawa N, Kinoshita H, et al. Pharmacokinetics of the new fluoroquinolone balofloxacin in mice, rats and dogs. Arzneim Forsch 1995; 45:719-722. (Abstract) [ Links ]
14. Nouws J, Ziv G. The effect of storage at 4°C with antibiotic residues in kidney and meat tissues of dairy cows. Tijdschr Diergeneesk 1976; 101; 20:119-127. (Abstract) [ Links ]
15. PRISM, Graphic Pad Sofware, San Diego, USA, 1997 (Html) [ Links ]
16. Ritschel W. AUC-RPP: Basic computer program for compartmental model independent pharmacokinetic analysis. Meth Findings Exp Clin Pharmacol 1986; 8:633-640. [ Links ]
17. Stein G. The 4-quinolone: past, present and future. Pharmacotherapy 1988; 6:301-314. (Abstract) [ Links ]
18. Walker R. The use of fluoroquinolones for companion animal antimicrobial therapy. Aust Vet J 2000; 78:84-90. (Pdf) [ Links ]
19. Wolfson J, Hooper D. The fluoroquinolones: structures, mechanisms of action and resistance, and spectra of activity in vitro. Antimicrob Agents Chemother 1995; 28:581-587. (Abstract) (Pdf) [ Links ]
¶ Para citar este artículo: García Ovando H, Prieto GF, Lüders CF, Errecalde CA. Farmacocinética plasmática de balofloxacina en terneros. Rev Colomb Cienc Pecu 2008; 21:259-264.
* Autor para el envío de la correspondencia y la solicitud de separatas: Departamento Clínica Animal, Facultad de Agronomía y Veterinaria, Universidad Nacional de Río Cuarto. Ruta Nacional 36, km 601 (5800) Río Cuarto, Córdoba, Argentina. E-mail: hovando@ayv.unrc.edu.ar