Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Ciencias Pecuarias
versão impressa ISSN 0120-0690versão On-line ISSN 2256-2958
Rev Colom Cienc Pecua v.22 n.2 Medellín abr.//jun. 2009
Artículos originales
Comparación de las propiedades de osteoconducción y osteointegración de una hidroxiapatita reabsorbible comercial con una hidroxiapatita reabsorbible sintetizada.*
Comparation of osteoconduction and osteointegration properties of a commercial reabsorbable hydroxypatitie with respect to a synthetyzed one.
Comparação das propriedades da osteocondução e osteointegração de uma hidroxiapatita reabsorvivel comercial sintetizada.
Carlos D Jaramillo1*, MV, Esp Clin; Jairo A Rivera2, MVZ, D Sc VM; Alejandro Echavarría3, Ing Met, PhD; Johan O'byrne 4,Est QF; Diego Congote5, Est MV; Luis F Restrepo B1, Estad, Esp.
1 Docente, Escuela de Medicina Veterinaria, Facultad de Ciencias Agrarias, Universidad de Antioquia, AA 1226, Medellín, Colombia. 2 Investigador independiente en el área de la salud. Medellín, Colombia. 3 Docente, Facultad de Ingeniería, Universidad de Antioquia, AA 1226, Medellín, Colombia. 4Estudiante de Química Farmacéutica, Facultad de Química Farmacéutica, Universidad de Antioquia, AA 1226, Medellín, Colombia. 5Estudiante de Medicina Veterinaria, Escuela de Medicina Veterinaria, Facultad de Ciencias Agrarias, Universidad de Antioquia, AA 1226, Medellín, Colombia.
(Recibido: 25 septiembre, 2008; aceptado: 12 marzo, 2009)
Resumen
En el presente artículo se evalúan las propiedades de osteoconducción y osteointegración de una hidroxiapatita reabsorbible (OseoU), procesada a dos temperaturas diferentes de calcinación (Tipo A y Tipo B), con el propósito de compararlas con un preparado comercial de hidroxiapatita (Osteogen®), utilizado para múltiples procedimientos quirúrgicos en los cuales se involucra la pérdida de tejido óseo. La síntesis se realizó en los laboratorios de la Universidad de Antioquia por el método de precipitación acuosa de la mezcla de nitrato de calcio y de fosfato de amonio. Los productos obtenidos y la hidroxiapatita comercial fueron caracterizados por microscopia electrónica de barrido (SEM), difracción de rayos X (DRX), espectroscopia de infrarrojo transformada de Fourier (FTIR) y espectrometría por energía dispersiva (EDS). Las características de osteoconducción y osteointegración fueron medidas de acuerdo a la capacidad de los productos para inducir la diferenciación de células locales a células formadoras de hueso. Dichas características, se evaluaron en implantes de hidroxiapatita realizados en 70 conejos de la raza Nueva Zelanda distribuidos en siete grupos de 10 animales cada uno, evaluados a los 7, 14, 21, 28, 42, 60 y 90 días de efectuado el procedimiento quirúrgico. Los resultados obtenidos demostraron que el OseoU y el Osteogen®, presentaron características similares en cuanto a la estructura cristalina, la composición química y la adsorción, con apreciables diferencias morfológicas con respecto a la forma de las partículas. Al realizar el análisis de varianza no se encontraron diferencias estadísticas significativas para las variables histopatológicas evaluadas en las dos hidroxiapatitas (p>0.05), indicando que las hidroxiapatitas sintetizadas en la Universidad de Antioquia (OseoU) tuvieron el mismo resultado que la hidroxiapatita comercial (Osteogen®) en la osteoconducción y la osteointegración del tejido óseo.
Palabras clave: hidroxiapatita, osteoconducción, osteointegración, regeneración ósea, sustitutos sintéticos de hueso.
Summary
In the following article the effects of two types of hydroxiapatites on bone synthesis and properties were evaluated. One of them (OseoU) was synthesized at two different temperatures to compare it to a commercial mixture of hydroxiapatite (Osteogen®) commonly used in several surgical procedures in which loss of bone tissue is present. The synthesis was carried out in the laboratories of the Universidad de Antioquia by precipitating the mixture of calcium nitrate and ammonium phosphate. The final products and the commercial hydroxiapatite were characterized by sweeper electronic microscopy (SEM), X ray diffraction (XRD), Fourier transformed infrared spectroscopy (FTIR), and energy dispersed spectrometry (EDS). The properties of osteoconduction and osteointegration were measured according to the capacity of the products to induce the differentiation of local cells into bone forming cells. Such characteristics were evaluated in hydroxiapatite implants in 70 New Zealand breed rabbits distributed in seven groups, ten rabbits in each group, which were evaluated at days 7, 14, 21, 28, 42, 60 and 90 after the surgical procedure. The results demonstrated that the hydroxiapatites synthesized in the laboratories of the Universidad de Antioquia and the commercial hydroxiapatite showed similar characteristics in terms of the crystal structure, chemical composition and absorption properties with slight morphological differences in particle shape and size. Using variance analysis, no meaningful statistical differences were found between the histopathological variables evaluated in the several hydroxiapatite groups (p>0.05), indicating that results obtained with both the OseoU and the commercial hydroxiapatite equally affected bone synthesis and properties.
Key words: bone regeneration, hydroxiapatite, osteoconduction, osteointegration, synthetic bone substitutes.
Resumo
No presente estudo foram avaliadas as propriedades de ostecondução e osteointegração de uma hidroxiapatita reabsorvivel (OseoU), processada a duas temperaturas de calcinaçao (Tipo A e B), como propósito de serem comparadas com um produto comercial (Osteogen®), utilizado para múltiples procedimentos cirúrgicos nos quais se envolve a perda do tecido osso. Asíntese foi realizada nos laboratórios da Universidad de Antioquia pelo método de precipitação aquosa da mistura de nitrato de cálcio e fosfato de amônio. Os produtos obtidos e a hidroxiapatita comercial foram caracterizados por microscopia eletrônica de barrido (SEM), difração raios X (DRX), espectroscopia de infravermelho transformada de Fourier (FTIR) e espectrometria por energia dispersiva (EDS). As características de osteocondução e osteointegração foram mensuradas de acordo à capacidade dos produtos para induzir a diferenciação das células locais formadoras do osso. Estas características foram avaliadas em implantações de hidroxiapatita realizadas em 70 coelhos da raça Nova Zelândia distribuídos em sete grupos de 10 animais cada um, avaliados aos 7, 14, 21, 28, 42, 60 e 90 dias de efetuado o procedimento cirúrgico. Os resultados obtidos demonstraram que o OseoU e o Osteogen® apresentaram características similares em quanto à estrutura cristalina, a comparação química e à absorção, com apreciáveis diferenças morfológicas com respeito à forma das partículas. Ao realizar as análises de variâncias não foram encontradas diferencias estatísticas significativas para as variáveis histopatológicas avaliadas nas duas hidroxiapatitas (p>0.05), indicando que as hidroxiapatitas sintetizadas na Universidad de Antioquia (OseoU) tiveram o mesmo resultado que a hidroxiapatita comercial (Osteogen®) em osteocondução e osteointegração do tecido ósseo.
Palavras chave: hidroxiapatita, regeneração óssea, substitutos sintéticos para osso
* Para citar este artículo: Jaramillo CD, Rivera JA, Echavarría A, O'byrne J, Congote D, Restrepo LF. Rev Colomb Cienc Pecu 2009; 22: 117-131
* Autor para correspondencia: Facultad de Ciencias Agrarias, Carrera 75 No 65 -87, Ciudadela Robledo, Universidad de Antioquia, Medellín, Colombia. Email: cadaja78@hotmail.com.
Introducción
En las áreas de ortopedia y traumatología, odontología veterinaria y humana, cirugía plástica y maxilofacial, son recurrentes los problemas a nivel del sistema óseo en los cuales se involucra pérdida de tejido, ocasionado por enfermedades degenerativas, envejecimiento, tumores, traumas, reabsorciones en pacientes edéntulos, deformidades óseas congénitas, entre otras, que requieren la utilización de injertos biológicos para ser reparadas (7).
Los injertos biológicos son materiales colocados en el organismo para colaborar o asumir temporal o permanentemente la función de una parte del cuerpo. Están hechos de sustancias relativamente inertes que estimulan una respuesta biológica que realza su función prevista. La respuestas del organismo a estos injertos dependen de factores como material del injerto (con sus características de porosidad, rigidez, forma y tipo de injerto) y su microentorno (2, 3, 25).
Un injerto de hueso autólogo es el material de elección óptimo para ayudar a completar la cicatrización ósea en la reparación de deformidades, sin embargo, su uso es problemático debido a la morbilidad del sitio donador, cantidades insuficientes de material y resorción incontrolada. Por tal razón, se han buscado alternativas a los injertos tomados del propio individuo que posean excelente capacidad de osteointegración, mínima respuesta inmunogénica, que sean biocompatibles, no tóxicos y de gran disponibilidad (5, 6).
Debido a la poca disponibilidad de autoinjertos y a las numerosas complicaciones experimentadas con la utilización de aloinjertos (injertos provenientes de otros individuos), otras alternativas están siendo ensayadas para la reconstrucción de defectos óseos. Entre estas encontramos, el uso de hueso desmineralizado, la aplicación de proteínas formadoras de hueso y la utilización de sustitutos óseos sintéticos.
El uso del hueso desmineralizado se obtiene al tomar hueso cortical de aloinjerto, eliminando los lípidos de la superficie y deshidratando el hueso con etanol y éter etílico. El hueso es procesado por medio de ácido clorhídrico. Este proceso elimina las proteínas del hueso solubles en ácido, las cuales pueden dar problemas de rechazo si no son retiradas totalmente en dicho proceso. Sin embargo, este tipo de material tiene un alto costo y proviene de un banco de hueso, lo que puede presentar reacciones adversas en el paciente al ser implantados (4, 11).
Los materiales cerámicos de reemplazo óseo consisten principalmente en fosfato, carbonato o sulfato de calcio, y han sido ampliamente utilizados en reparación ósea. Algunas sustancias cerámicas se degradan y otras no. Así, el espacio ocupado por la masa cerámica no puede ser rellenado por hueso viable, y además las partículas cerámicas introducen concentradores de estrés que impiden la vascularización (5, 15, 20).
Las cerámicas, como material de injerto óseo, pueden ser un impedimento a la infiltración de tejidos blandos en el injerto. Además, como en el hueso, estas cerámicas ocupan espacio alrededor del implante en competición con el tejido blando que se infiltra. Esto puede impedir una infiltración ósea por parte del injerto, por lo que estas dos circunstancias pueden retrasar el tiempo de consolidación del injerto. Adicionalmente, estos materiales también pueden proveer de material para aumentar el volumen del injerto autógeno. Algunos sustitutos cerámicos requieren médula ósea para combinarse con el implante antes del uso (5, 15, 20).
Otro material utilizado, son los polímeros como materiales de reemplazo óseo. Los polímeros utilizados como material de reemplazo en el hueso son de colágeno natural o sintético. Como cualquier material de injerto, ocupa un espacio en el defecto que puede ser llenado con hueso, pero generalmente se degrada en respuesta a una reacción inflamatoria crónica moderada o a un ataque de células gigantes. Esta inflamación, puede ser no específica en su acción, lo que impide la neo formación ósea y se erosiona el hueso viable adyacente del huésped (5, 8,18).
Los materiales colágenos que se utilizan como implantes para reemplazar hueso, comúnmente, presentan un grado medio de rechazo inmunológico, respuesta que puede impedir la formación de nuevo hueso. Los materiales colágenos tienen un uso limitado (5, 8, 18).
Entre los avances en la síntesis de materiales biocerámicos como alternativa a los injertos autólogos, se encuentra la hidroxiapatita que es el componente inorgánico principal de los tejidos óseos tales como hueso, dientes, esmalte y de algunas calcificaciones patológicas como los cálculos dentales y urinarios en todos los vertebrados (10, 18, 22). Es un compuesto de fosfato de calcio estable a temperatura ambiente, con una proporción calcio/ fósforo de 1.67. Su cristalinidad depende de la temperatura utilizada en la calcinación (13).
La hidroxiapatita se comporta como una estructura osteoconductiva que permite ser invadida por tejido conectivo proveniente del hueso circundante para posteriormente osificarse, manteniendo en su interior las características de su origen, lo que la hace una plataforma idónea sobre la cual se puede dar el crecimiento del nuevo tejido óseo, confiriéndole excelentes propiedades de osteointegración (14, 16, 17).
Según Wagner (25), otras formas y aplicaciones diferentes de material continúan generando gran interés dentro del área de la salud.
El objetivo de esta investigación fue evaluar las propiedades de osteoconducción y osteointegración de una hidroxiapatita reabsorbible sintetizada en la Universidad de Antioquia y compararla con una hidroxiapatita comercial (Osteogen®).
Materiales y métodos
Comité de Bioética
Este Trabajo de investigación tuvo la aprobación del Comité de Ética para la Experimentación con Animales de la Universidad de Antioquia, según consta en el Acta No 39.
Síntesis de las hidroxiapatitas de la Universidad de Antioquia
Para la síntesis de las hidroxiapatitas reabsorbibles de la Universidad de Antioquia, se utilizó el Laboratorio de Biomateriales, de la Facultad de Ingeniería, utilizando un procedimiento denominado hidrotermal, descrito por Rivera (20, 21), en el que se usaron reactivos puros de Ca (NO3)2.4H2O (Merck, NJ) y NH4H2PO4 (Merck, NJ).
En el proceso de obtener las hidroxiapatitas Tipo A y Tipo B se realizaron ensayos previos para asegurar que el producto final a ser implantado en los animales, fuera de óptima calidad. Para cada una de las hidroxiapatitas se realizaron seis baches de producción de 80 g cada uno, analizando posteriormente el producto obtenido mediante las pruebas de caracterización enunciadas posteriormente.
Con los reactivos mencionados, se prepararon las soluciones de Nitrato de Calcio y de Fosfato de Amonio y se realizó el procedimiento de reacción entre estas dos soluciones que permitió obtener al final un sobrenadante que fue sometido a varios lavados con agua destilada, logrando un precipitado final que sirvió para determinar el porcentaje de sólidos de la muestra, basados en el peso en húmedo y en seco.
Una vez se obtuvo la hidroxiapatita, se secó y fue sinterizada a dos temperaturas diferentes (Temperatura A y Temperatura B), dando origen a la OseoU Tipo A y a la OseoU Tipo B.
Caracterización de materiales
Tanto la hidroxiapatita reabsorbible OseoU (Tipo A y Tipo B), como el producto comercial (Osteogen®) fueron analizados por las siguientes técnicas de caracterización:
La morfología y distribución del tamaño de las partículas, así como el análisis de espectroscopia de energía dispersiva (EDS) fueron analizadas por microscopia electrónica de barrido (SEM), utilizando un equipo marca JEOL JSM-590LV (Japan). Para el análisis de difracción de Rx se utilizó el equipo Rigaku Miniflex (Japan), utilizando los siguientes parámetros: Barrido 2, velocidad 2 grados/minuto, radiación con lámpara de cobre, longitud de onda 1.5418 ºA y 100 conteos/segundo. La espectroscopia infrarroja (FTIR), método apropiado para determinar los grupos funcionales presentes en la hidroxiapatita, se realizó con un equipo Perkin Elmer, modelo Spectrum One Detector Dtgs (PerkinElmer, NJ).Por último, se realizaron cultivos micológicos y bacteriológicos a las diferentes hidroxiapatitas sintetizadas en este ensayo antes de ser implantadas en los animales. Las siguientes fueron las pruebas realizadas: recuento total de mesófilos sembrados por profundidad en platecount; adicionalmente, para hongos se realizaron diluciones y se sembraron en profundidad en Agar YGC.
Muestra de individuos
La investigación se realizó en 70 conejos machos, adultos, de la raza Nueva Zelanda, adquiridos en el criadero del Servicio Nacional de Aprendizaje (SENA), en El Centro Agropecuario La Salada (Caldas, Antioquia), cuyo peso promedio fue de 1.9 kg. Al momento de la compra se practicó el examen clínico a cada uno de los animales, encontrando que estos estaban sanos. Los conejos se distribuyeron aleatoriamente empleando la distribución uniforme en el paquete estadístico SAS, en siete grupos de 10 individuos cada uno. De los 10 individuos incluidos en cada grupo, a cinco animales se les implantó en la tibia proximal derecha OseoU Tipo A y en la tibia proximal izquierda se les implantó el Osteogen®.A los cinco animales restantes se les implantó en la tibia proximal derecha OseoU Tipo B y en la tibia proximal izquierda se les implantó el Osteogen®.
Procedimiento quirúrgico
Los individuos fueron preparados para la intervención quirúrgica de acuerdo al protocolo seguido en los quirófanos de La Escuela de Medicina Veterinaria de La Facultad de Ciencias Agrarias, de la Universidad de Antioquia. Previa depilación y lavado de la zona con Gluconato de Clorhexidina al 0.2%, los animales fueron sedados y anestesiados con Diazepam (dosis 0.2 mg/kg) y Ketamina (dosis 8.5 mg/kg).
A nivel proximal, cara medial de la tibia en ambos miembros posteriores, se efectuó una incisión longitudinal de 1.5 cm., con el fin de exponer la tibia respectiva y realizar una perforación de 5 mm de diámetro con una pieza de mano odontológica, para luego depositar directamente en el orificio en la tibia derecha 0.05 g de OseoU y 0.05 g de Osteogen® en la tibia izquierda. Una vez realizado este procedimiento, se suturó el periostio con sutura 4/0 poliglactina 910. Finalizada la implantación, se aplicó por vía intramuscular Cefalexina a una dosis de 8 mg/kg cada 12 horas, durante 3 días; además, se practicó una limpieza diaria en la incisión con Clorhexidina al 0.2%.
Estudio histopatológico
La eutanasia de todos los animales se realizó en las instalaciones del Centro Agropecuario La Salada del SENA, en condiciones éticas, mediante el uso de la mezcla de pentobarbital sódico y difenilhidantoina (80 mg y 10 mg, respectivamente, por vía I.V).
Para el estudio histológico de los implantes de hidroxiapatita realizado en las tibias de los animales, se sacrificaron la totalidad de los individuos pertenecientes a cada uno de los grupos, de la siguiente manera:
Grupo 1: a los 7 días de la implantación.
Grupo 2: a los 14 días de la implantación.
Grupo 3: a los 21 días de la implantación.
Grupo 4: a los 28 días de la implantación.
Grupo 5: a los 42 días de la implantación.
Grupo 6: a los 60 días de la implantación.
Grupo 7: a los 90 días de la implantación.
Cada una de las muestras de tejido tomadas para el estudio histopatológico, fue fijada en formalina neutralizada y estabilizada al 10%, descalcificada en ácido nítrico al 5% y embebida en parafina. Luego, se realizaron cortes de 4 µm de espesor que se colorearon con hematoxilina - eosina, para luego ser evaluadas al microscopio de luz con un aumento de 400 X.
La selección de los campos de evaluación se realizó utilizando en el corte histológico, la cara medial de la tibia con un aumento de 40X y localizando la presencia del implante o de procesos de reparación o remodelación ósea cuando éste no fue evidente. Alrededor del implante o de las áreas mencionadas, se evaluaron cinco campos con aumento de 400X para determinar la presencia de elementos celulares y de la matriz conectiva relacionados con inflamación, reparación o remodelación ósea. La presencia de esos elementos se categorizó de la siguiente manera:
Leve: cuando los elementos descritos se encontraron distribuidos de forma focal, en menos del 30% de área de los campos evaluados. Moderada: los elementos se distribuyeron de manera multifocal en hasta el 60% del área de los campos evaluados. Severa: los elementos se distribuyeron de forma difusa en más del 60% del área de los campos evaluados.La evaluación histopatológica, se realizó en el Laboratorio de Patología Animal de la Facultad de Ciencias Agrarias, de la Universidad de Antioquia, por un patólogo veterinario debidamente certificado.
Para la descripción microscópica se tuvieron en cuenta las siguientes variables: macrófagos, fibrina, linfocitos, edema, congestión, fibroblastos, fibrosis, vascularización, células osteoprogenitoras, osteoides, trabéculas, osteocitos, osteoclastos, cartílago, lagunas, osteonas y presencia de implante.
Análisis estadístico
El diseño experimental se efectuó por medio del método Manova (Análisis multivariado de la varianza), cuyo objetivo fue comparar si existía diferencia estadística entre los tratamientos efectuados en animales con la OseoU Tipo A y Tipo B, con el tratamiento con Osteogen® en cuanto a las propiedades de osteointegración y osteoconducción, convalidándose los supuestos de normalidad, aleatoriedad e indepencia de los errores experimentales, homogeneidad de varianzas, independencia de medias y varianzas.
Adicionalmente, se complementó dicho análisis multivariado, con un análisis de varianza unidimensional con prueba de comparación de Tukey, con base en un 5% de nivel de significancia estadística, cuyo objetivo fue detectar en forma individual (para cada variable), si existía divergencia estadística o no entre los tratamientos, anotando que el Manova toma en conjunto todas las variables y efectúa una comparación multidimensional. Para tal efecto se empleó el paquete estadístico SAS versión 9.0.
Resultados
Caracterización de las hidroxiapatitas
Las pruebas para caracterizar las hidroxiapatitas sintetizadas en la Universidad de Antioquia (Tipo A y Tipo B), mostraron que ambas poseen características similares en cuanto a estructura cristalina y grupos funcionales, con respecto a la hidroxiapatita comercial (Osteogen®). Sin embargo, tienen diferencias morfológicas en cuanto a la forma de las partículas.
Las hidroxiapatitas sintetizadas en la Universidad (Tipo A y Tipo B), tienen una distribución en placas con características subangulares, mientras que en el Osteogen® se observan gránulos angulares aglomerados en forma de rosetas, con una distribución cristalina hexagonal claramente definida. En las Hidroxiapatitas OseoU Tipo A y Tipo B, no se observó porosidad superficial y se hace evidente una estructura compacta (véase Figura 1).
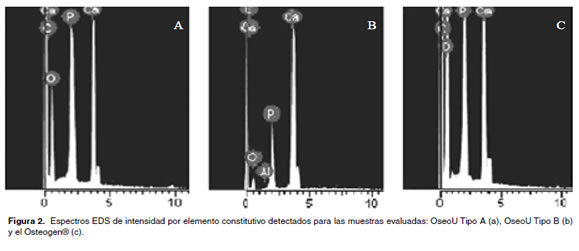
En la figura 2 se muestran los resultados de los análisis de las técnicas de caracterización EDS empleadas en la Oseomatrix UdeA (Tipo A y Tipo B) y el Osteogen®. De manera general se observa la presencia Ca, P y O, lo cual corrobora que las muestras obtenidas son Hidroxiapatita. La presencia de Carbono sugiere la presencia de carbonatos en la muestra. Adicionalmente, se observa como la OseoU Tipo A y el Osteogen®, tienen una relación Ca/P similar, pero inferior a la OseoU Tipo B.
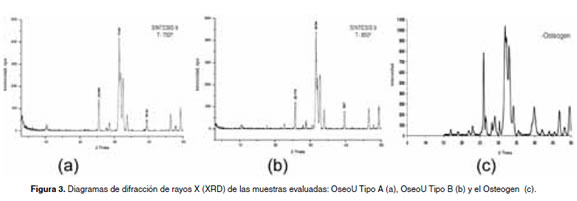
La figura 3 muestra los resultados DRX de las muestras de la OseoU Tipo A, la OseoU Tipo B y el Osteogen®. En los difractogramas obtenidos, se establece que en los tres casos no se consigue una alta cristalinidad puesto que no están definidos claramente los tres picos característicos de la hidroxiapatita que se sitúan entre 31.5 y 33.5º 2θ.
En la muestra de OseoU TipoB, se alcanza a percibir un pico incipiente a 30.5º 2θ que se asocia al fosfato tricálcico. En el caso del Osteogen®, se percibe un pico similar a 30.2º 2θ asociado a un tipo (no determinado) de un fosfato de calcio. De acuerdo a estos resultados, se concluye que las cristalinidades de las hidroxiapatitas evaluadas son similares.
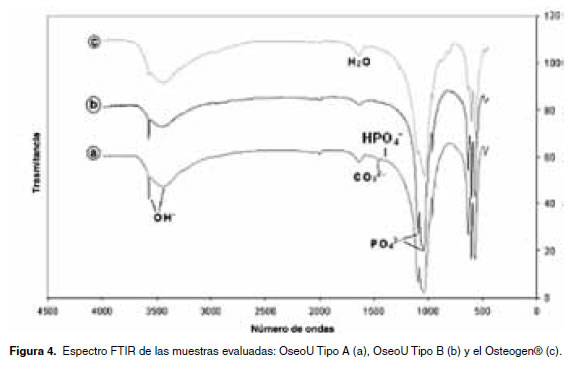
De la figura 4 se deduce que todos los espectros los grupos funcionales PO4-3 y OH-, y de manera FTIR de las muestras evaluadas son similares, menos evidente, la presencia de los grupos HPO4-2 identificándose claramente las contribuciones de y CO3-2 en la hidroxiapatita Tipo A.
Cultivos micológicos y bacteriológicos
Los cultivos micológicos y bacteriológicos realizados a todas las hidroxiapatitas utilizadas para los implantes OseoU Tipo A, OseoU Tipo B y Osteogen®, no evidenciaron crecimiento de ninguno de estos microorganismos.
Procedimiento quirúrgico
Todos los animales se recuperaron satisfactoriamente de la cirugía bilateral y alcanzaron su fecha de sacrificio sin eventos adversos. No se evidenciaron signos de inflamación, ni de infección de los animales a lo largo del estudio.
Análisis histológico
Las variables histológicas analizadas en este estudio para la OseoU Tipo A, OseoU Tipo B y el Osteogen® (macrófagos, fibrina, linfocitos, edema, congestión, fibroblastos, fibrosis, vascularización, osteoides, osteoblastos, trabéculas, osteocitos, osteoclastos, cartílago, lagunas, osteonas y presencia de implante), no se presentaron diferencias estadísticas significativas entre las hidroxiapatitas sintetizadas en la Universidad de Antioquia, ni entre cada una de ellas y el producto comercial en los períodos de evaluación (p>0.05).
Al aplicar la prueba de comparación por el método de Tukey entre los tres tratamientos (OseoU Tipo A, OseoU Tipo B y el Osteogen®), se concluyó que entre los mismos no existió ninguna diferencia.
A continuación se presenta el patrón histológico de las hidroxiapatitas evaluadas:
Respuesta celular de la OseoU Tipo A en los diferentes periodos de evaluación
Macrófagos. A los 7 días se presentaron altos porcentajes de ausencia de este tipo de células; a los 14 días, el 25% de los casos se declaró alta su presencia, incrementándose a un 33.3% en el día 21 y a medida que fue avanzando comenzaron a desaparecer, encontrando que al día 60 el 100% de los casos estaban ausentes.
Fibrina. A los 21 días el 100% de los casos es ausente.
Linfocitos. Desaparecieron a los 28 días.
Congestión. A los 60 días desaparece por completo presentando algunos casos en los 7, 14 y 21 días.
Fibroblastos. A los 60 días se observa una ausencia de fibroblastos, pero hasta el día 42 se presentaron niveles desde leves a moderados.
Fibrosis. Al día 21, el 83.3% no muestra este tipo de material y desaparece totalmente a los 90 días.
Vascularización. Se presentó hasta el día 42.
Células progenitoras. En el 50% de los casos fue alta su presencia hasta los 14 y 21 días y en adelante disminuyó el efecto.
Osteoide. El 50% de los casos, su presencia fue de moderada a alta (día 21), tendiendo a disminuir con el paso del tiempo.
Trabéculas. A partir del día 21 se notó que un 50% de los casos fue moderada su presencia y en el día 60 fue del 100%.
Osteocitos. A partir de los 21 días comienza un aumento de casos entre moderados y alto, siendo al día 60 y 90 del 100%.
Osteoclastos. El 50% de los casos su presencia fue alta a los 21 días tendiendo a disminuir con el tiempo, para finalmente desaparecer a los 60 días.
Lagunas. Se observó una presencia entre moderada y alta al día 60 de tratamiento.
Osteona. Presencia del 100% al día 90 de tratamiento.
Cartílago. 100% de los casos al día 28 tuvieron una presencia moderada, conservando este valor hasta el día 90.
Implante. Presencia del 100% de los casos fue leve hasta el día 42 pasando a ser moderado a los días 60 y 90.
Respuesta celular de la OseoU Tipo B en los diferentes periodos de evaluación
Macrófagos. A los 7 y 14 días se presentaron altos porcentajes de ausencia, no se presentó a 7 y 14 dias. Mostrando incrementos de leves a moderados hasta el día 42, siendo ausentes desde el día 60.
Fibrina. A los 14 días el 100% de los casos es ausente.
Linfocitos. Desaparecen a los 14 días de tratamiento.
Congestión. Desaparece totalmente al día 60 y 90 de tratamiento.
Fibroblastos. A los 60 días existe ausencia de fibroblastos donde hasta el día 42 se presentaron patrones entre leve a moderado.
Fibrosis. A los 21 y 42 días es alta con un 50% y desaparece a los 60 y 90 días.
Vascularización. Se presentó hasta el día 60 de tratamiento.
Células progenitoras. El 50% de los casos presentó este tipo de células con una presencia entre alta y moderada a los 14, 21 y 28 días, para luego disminuir a leve en el día 90.
Osteoide. El 40% de los casos se consideró entre moderado y alto desde el día 21 al 28.
Trabéculas. A partir del día 21 se notó que un 33.33% de los casos presentaron una presencia moderada de esta variable, para ser del 100% a los 60 días.
Osteocitos. Se incrementan a partir de los 21 días entre moderado y alto siendo del 100% a los 60 y 90 días.
Osteoclastos. Se declaró su presencia entre moderada y alta con un 50% entre los 21 y 28 días terminando como leve a los 60 y 90 días.
Laguna. Presencia alta con un 100% al día 90 de tratamiento.
Osteona. 100% al día 90 de tratamiento.
Cartílago. 100% de los casos fue declarada su presencia como moderada al día 28 de tratamiento conservando este valor hasta el día 90 de tratamiento.
Implante. Moderada presencia hasta el día 60 y 90 de tratamiento.
Respuesta celular del Osteogen® durante los diferentes periodos de evaluación
Macrófago. Se reportó un 44% de ausencia a los 7 días para pasar a un 33% de leve a los 21 días, disminuyendo progresivamente hasta ser ausentes a partir del día 60 de tratamiento.
Fibrina. A partir del día 21 en el 100% de los casos estuvo ausente.
Linfocito. Células ausentes a partir del día 21.
Congestión. Entre leve y moderada los 7 primeros días de tratamiento para desaparecer totalmente al día 60 y 90 de tratamiento.
Fibroblastos. Patrones entre leve y moderado hasta el día 42 de tratamiento, siendo ausentes el día 60 y 90 de tratamiento.
Fibrosis. Hasta el día 28 de tratamiento se dan patrones entre moderada y alta fibrosis, siendo en el 72% de los casos alta su presencia al día 42 de tratamiento.
Vascularización. Se presenta hasta el día 60 de tratamiento.
Células progenitoras. Entre moderada y alta hasta el día 28 de tratamiento en donde empieza a disminuir su presencia.
Osteoide. Un 30% de los casos se declaró entre moderado y alto a los 21 días para disminuir a partir de esta fecha.
Trabéculas. Se incrementan en el tiempo llegando a ser moderadas con 40% a los 42 días, siendo del 100% a los 60 días.
Osteocitos. Se incrementan a través del tiempo para ser del 100% alto a los 90 días de tratamiento.
OseoU Tipo A
Osteoclastos. El 30% de los casos a los 42 días estuvo entre leve y moderado, siendo leve a los 90 días de tratamiento.
Lagunas. Entre moderada y alta presencia al día 90 de tratamiento.
Osteona. 100% de presencia al día 90 de tratamiento.
Cartílago. 100% leve al día 28 de tratamiento, y sin presencia al día 90 de tratamiento.
Implante. Se declaró leve su presencia en el 100% de los casos hasta el día 42 de tratamiento, terminando como moderado al día 90 de tratamiento.
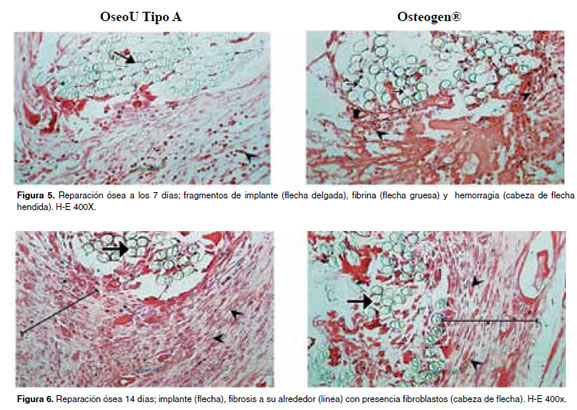
En las figuras 5 -11 se muestran las condiciones histológicas del tejido óseo en los diferentes períodos de evaluación después de haber sido implantado con la hidroxiapatita OseoU Tipo A y la hidroxiapatita comercial (Osteogen®).
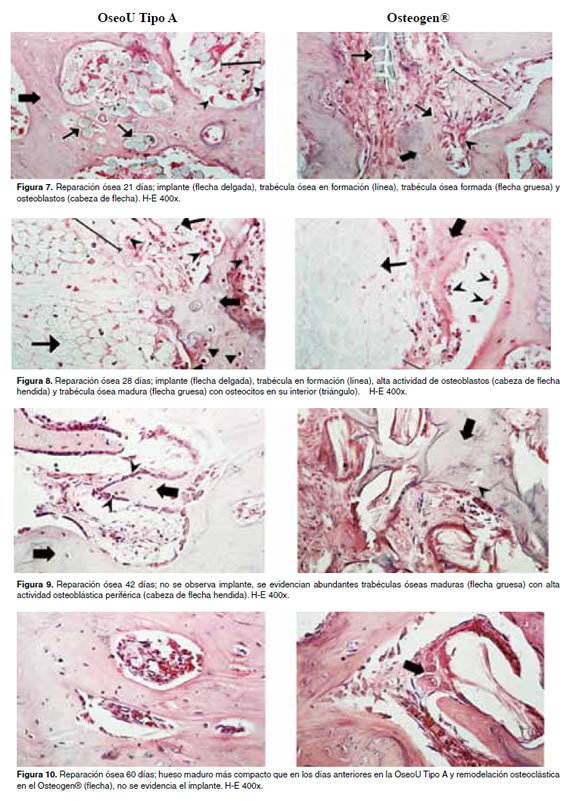
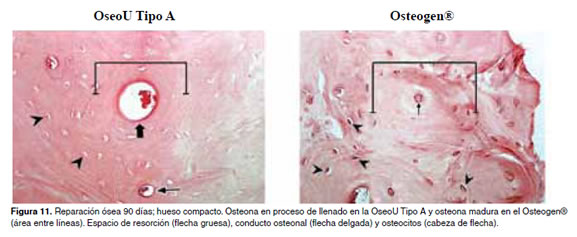
Discusión
Las propiedades de osteoconducción y osteointegración son importantes al momento de evaluar un implante que pueda ser utilizado en procedimientos quirúrgicos en los cuales exista pérdida del tejido óseo, lo que implica realizar una evaluación rigurosa de los materiales que podrían ser implantados en los animales, debido a que si estos no cumplen con las características necesarias para una buena reparación, podría no mejorar las condiciones del paciente y por lo tanto en vez de un beneficio, se podría causar una situación perjudicial para el mismo.
Aunque al caracterizar las hidroxiapatitas sintetizadas en la Universidad de Antioquia (OseoU Tipo A y Tipo B) y compararlas con el Osteogen® se determinó que existía una diferencia en cuanto a la forma de las partículas, las similitudes encontradas en la respuesta final de los implantes son resultado de la semejanza en la granulometría de dichas partículas (300 µm en promedio para todos los implantes). Este tamaño de partícula es el más utilizado por los cirujanos (15), lo que no impide la respuesta en la osteoconducción y osteointegración para ninguna de las hidroxiapatitas evaluadas en este ensayo, a pesar de las diferencias en su forma.
La mayor relación Ca/P de la OseoU Tipo B, procesada a más alta temperatura que la Tipo A, está relacionada con la mayor cristalinidad de la hidroxiapatita a medida que se incrementa la temperatura de calcinación, la cual aumenta hasta la relación teórica Ca/P=10/6=1.67 en el máximo de la cristalinidad de la hidroxiapatita. Según Lemhman y Rougraff (12), la relación Ca/P está determinada por la disolubilidad de la hidroxiapatita en los fluidos corporales y por ello, se espera que las OseoU Tipo A y Tipo B presenten mayor reabsorbibilidad que una muestra altamente cristalina. Esto les confiere la propiedad de reabsorberse a través del tiempo, dada la menor relación Ca/P asociada a la menor cristalinidad con respecto a la teórica, lo cual según Artzi (1), ofrece la ventaja de servir como reservorio de minerales. Esto además, provee rigidez y sirve de puente a la nueva formación ósea y al reabsorberse lentamente promueve el proceso de angiogénesis, factor fundamental para la reproducción, desarrollo y reparación tisular que depende del crecimiento de los vasos sanguíneos.
En el análisis histológico, el porcentaje de fibrosis a través de los períodos de evaluación de la OseoU es tan sólo del 30%, mientras el producto comercial es del 50%. Según Valenzuela et al (23), esta característica es favorable y deseada por muchos cirujanos, ya que el exceso de fibrosis produce barreras císticas en el sitio de la lesión y retarda los procesos de regeneración ósea.
Los cambios en las variables histopatológicas descritos en los resultados son los que acompañan el proceso de reparación ósea, el cual sigue un patrón similar al proceso inflamatorio, y los fenómenos se suceden en forma de cascada, con el objetivo de eliminar detritos celulares, restablecer el riego sanguíneo y formar tejido óseo nuevo, los cuales pueden ser agrupados en tres etapas (20): 1) inflamatoria, 2) reparación y 3) remodelación. Las dos primeras duran aproximadamente 21 días y la tercera tiene una duración aproximada de un año.
Se han reportado estudios donde luego de 6 a 12 meses post implantación, las partículas de Osteogen® no se reabsorbieron (22). Otros autores reportaron que en estudios realizados en caninos, aproximadamente el 80% de las partículas de Osteogen®, se reabsorben a las 12 semanas (11). En un estudio realizado en humanos, se comprobó histológicamente que a los 12 meses hay presencia de células fagocitarias similares a macrófagos y/o células gigantes en la superficie de partículas de Osteogen® (15). Esto se debe probablemente a que el proceso de reparación en humanos es cualitativamente diferente y mucho más lento de lo que se piensa (22).
Respecto al proceso de reabsorción de los biomateriales, se afirma teóricamente que todo biomaterial después de su implantación puede reabsorberse mediante un proceso de disolución fisiológica y/o un fenómeno celular fagocítico dependiente (9, 22). No se ha determinado cual de los dos procesos es predominante. Lo que sí está claro es que para el Osteogen®, existe una fuerte respuesta celular mediada por células mono-multtinucleadas (22). Al comparar estos resultados con los obtenidos en este estudio, se confirma el predominio de esta respuesta celular ante los biomateriales implantados en el ensayo y destacamos que la reabsorción a los 90 días (12 semanas) fue del 60% aproximadamente. Sin embargo, Ricci et al (11) afirma que existe una baja reabsorción de la hidroxiapatita a las 12 semanas.
Los resultados de esta investigación, muestran que se alcanzó el 50% en la reparación del defecto a los 14 y 21 días, observando hueso neoformado, y se hace evidente, una más rápida reparación ósea con el producto OseoU en comparación con otras investigaciones donde reportaron que la reparación ósea se logró a los 28 días alcanzando el 50%.
A los 90 días del implante, se reportó formación de canales, engrosamiento, remodelación lamelar, osteonas y tejido conectivo maduro, lo que concuerda con los cambios histológicos obtenidos en otras investigaciones (11).
Otra investigación (5), reportó que a las cuatro semanas se hace evidente la formación ósea de nuevo hueso en un 20% utilizando hidroxiapatita y gránulos de fosfato de calcio. En el presente estudio, se encontró que el porcentaje de formación ósea fue cercano al 50% a las cuatro semanas de realizado el implante. Los anteriores resultados ratifican la calidad del producto OseoU en su comportamiento clínico, al no producir reacciones celulares diferentes a las del producto comercial Importado, confirmando su compatibilidad y buena integración al tejido óseo.
El producto OseoU tiene el potencial de ser utilizado en la implantación de los alvéolos post extracción dental para mantener e incluso mejorar la altura del reborde sobre todo en los pacientes que se les realiza extracciones múltiples de dientes afectados periodontalmente (17, 21), por lo que se recomienda seguir investigando en esta área del conocimiento.
La fabricación de la OseoU implica menores costos de producción, lo que se verá reflejado en el precio final. Este producto de fabricación local, de igual calidad y de menor costo que las otras hidroxiapatitas disponibles, podrá ser empleado por los profesionales que laboren con población de bajos recursos.
Teniendo en cuenta que los beneficios que se obtienen con la OseoU Tipo A y Tipo B son similares en cuanto a osteoconducción y osteointegración, se recomienda la producción y utilización de la OseoU tipo A por tener un menor costo asociado a la menor temperatura de calcinación utilizada en el proceso y una menor relación Ca/P.
Agradecimientos
A la Médica Veterinaria Claudia Patricia Alzate Álvarez, por su colaboración desde el inicio del proyecto; Al Médico Veterinario Héctor Augusto Jiménez Arboleda, por la revisión y corrección del texto; Al personal docente y no docente de los Laboratorios de Patología y Microbiología de la Facultad de Ciencias Agrarias de la Universidad de Antioquia, por el procesamiento y los análisis histológicos y microbiológicos de las muestras,
Referencias
1. Artzi Z, Nemcovsky CE, Tal H, Dayan D. Histopatological morphometric evaluation of 2 different hydroxyapatite-bone derivates in sinus augmentation procedures: A comparative study in Humans. J Periodontol 2001; 71:911-920. [ Links ]
2. Bay, RA. The pathophysiology and anatomy of edentulous bone loss. En Fonseca R., Davis, W. (eds): Reconstructive Preprosthetic Oral and Maxillofacial surgery. Philadelphia, W. B. Saunders. 1985. [ Links ] 3. Block MS, Kent JN. Long term radiographic evaluation of hidroxilapatite augmentation of deficient mandibular alveolar ridges. J Oral Maxillofac Surg 1984; 42:793-796. [ Links ] 4. Block, M.S., Kent, J.N., Ardoin, RC., Davenport, W.: Mandibular augmentation in dogs with hidroxilapatite combined with demineralizes bone. J Oral Maxilofac Surg 1987; 45:414-420. [ Links ] 5. Callan DP, Rohrer MD. Use of bovine derivared hydroxyapatite in the treatment of edentulous ridge defects. A human clinical and histopatological case report. J Periodontol 1993; 64:575-582. [ Links ] 6. Cardona, JJ. Obtención y caracterización de hidroxiapatita sintética. Tesis de grado. Universidad de Antioquia. Facultad de Ingeniería. Departamento de ingeniería metalúrgica y materiales. Medellín 1997: 67. [ Links ] 7. Dasso G, Fernández MS, Arias JL. Reparación ósea mediante aloimplantes sometidos a diferentes métodos de conservación en conejos. Arch med vet 1998; 30:57- 64 [ Links ] 8. De campos V, Sinteses de hidroxiapatite e sua aplicacao como biomaterial. Tesis PhD.Universidad de São Paulo. 1999. [ Links ] 9. Dee K, Puleo D. An introduction to tissue biomaterial interactions. John [ Links ] 10. Wiley & sons inc, Hoboken, New Jersey, 2002. p. 239. [ Links ] 11. Echavarrìa A, Riano C, Noreña A. Hidroxiapatita sintética de porosidad inducida. Comparación con el hueso calcinado. Rev Fac Ing 1999; 11:56-64 [ Links ] 12. Guerra LJ, González SR. Efectos de los sustituyentes en la estructura de las hidroxiapatitas biológicas. Rev CENIC, Ciencias Químicas, 1997; 28:158-168. [ Links ] 13. Lemhman D, Rougraff B. Recent advances in bone grafting 2002; (Marzo 23 de 2004) URL: http://www.medlib.iupui.edu/bcr/recadv.htm. [ Links ] 14. Linkow LI, Wagner JR. Management of implant related problems and infections. J of Oral Implantol 1993; 29:321- 335 [ Links ] 15. López E, Echevarría A, Súarez R, Herrera N.Hidroxiapatita macroporosa obtenida en la U de A, síntesis, caracterización y comparación con el hueso esponjoso y calcinado de bovino. Rev Fac Ing 2003; 30:109-124. [ Links ] 16. López VC, Javer M, Arroya PS, Oyarzun D. Análisis ultraestructural de la formación ósea en relación con el osteogen. Av Periodoncia 2002; 14:29-36. [ Links ] 17. Pinholt M. Healing of experimentally created defects: A review. 1995. Br J Oral Maxillofac Surg 1995; 33:312-315. [ Links ] 18. Quintana D. Utilización de la hidroxiapatita en cirugía maxilofacial. Actualización bibliografica. Rev Cubana estomatol1998; 35:16-20 [ Links ] 19. Ricci Jl, Blumenthal NC, Spivak JM, Alexander H . Evaluation of a low temperature calcium phosphate particulate implant material: physical -chemical properties and in vivo bone response. J Oral Maxilofacial surg 1992; 50:969-978 [ Links ] 20. Rivera J. Obtención de proteínas morfogenéticas óseas (pmo) e hidroxiapatita sintética y evaluación de las características de dichos materiales y de sus mezclas, utilizados como material de injerto óseo en un modelo experimental lapino. Tesis doctorado. Universidad de León, España, 2005. 155p [ Links ] 21. Rivera J, Riaño CH, Echavarría A, Monsalve PA, Alzate G, Restrepo LF, Jaramillo CD. Injertos óseos -nueva alternativa. Fase III. Obtención, caracterización y evaluación de Hidroxiapatita sintética porosa - Proteínas Morfogenéticas Óseas en un modelo experimental lapino. Rev Colomb Cienc Pec. 2004; 17:21-28. [ Links ] 22. Tavera F. Patología general veterinaria. 2ed, México, ed interamericana; 1993. [ Links ] 23. Tobón SI, Arismendi JA, Marín ML, Valencia Ja. Comparison between a conventional technique and two bone regeneration techniques in periradiuclar surgery. Int Endod J 2002; 35:635-641. [ Links ] 24. Valenzuela C, et al. Análisis ultraestructural de la formación ósea en relación con el osteogen. Av Periodon Implantol. 2002; 14,1:29-36. [ Links ] 25. Wagner JR, A clinical and histological case study using resorbable hidroxylapatite for the repair of osseous defect prior to endosseous implant surgery. J Oral Implantol. 1989, 15:186-192. [ Links ] 26. Wagner, JR. An osteoconductive resorbable hydroxilapatite graft material (OsteoGen®). J Florida State Dental Assn1990; 2:4c-5c. [ Links ]