Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.22 no.4 Medellín Oct./Dec. 2009
Artículos originales
El papel de la insulina en la regulación de la síntesis de proteínas lácteas en bovinos¤
The role of insulin in the regulation of milky protein synthesis in cattle
O papel da insulina na regulação da síntese das proteínas lácteas em bovinos
Héctor J Correa C1,*, Zoot, MSc; Nancy P Echeverri R2, Zoot.
1Departamento de Producción Animal, Universidad Nacional de Colombia, Sede Medellín. 2Zootecnista, Universidad Nacional de Colombia, Sede Medellín.
(Recibido: 14 noviembre, 2007; aceptado: 4 agosto, 2009)
Resumen
No obstante la importancia nutricional e industrial de las proteínas lácteas, aún no están completamente comprendidos los mecanismos que controlan su síntesis y concentración. Entre las distintas hormonas que regulan el metabolismo de la glándula mamaria, la insulina ha recibido mayor atención debido a su estrecha relación con el metabolismo energético y proteico de los animales y debido al marcado efecto que ha mostrado tener sobre la producción y concentración de proteínas lácteas. Existen al menos tres mecanismos a través de los cuales esta hormona parece contribuir al incremento en la síntesis y concentración de proteínas lácteas, los cuales son revisados en este documento: distribución de nutrientes hacia la glándula mamaria, regulación en la expresión de genes de caseínas e incremento en la tasa de iniciación de la síntesis de las proteínas a nivel postranscripcional.
Palabras clave: control hormonal, glándula mamaria, homeorresis.
Summary
In spite of the nutritional and industrial importance of milk proteins the mechanisms that control their synthesis and concentration still are not completely understood. Among the different hormones that participate in the mammary gland metabolism, insulin has received higher attention due to its close relationship with the energetic and protein metabolism in dairy cows and to its marked effect on the production and concentration of milk proteins. There are at least three mechanisms by which this hormone seems to contribute to increase in the synthesis and concentration of milk protein that are reviewed in this paper: nutrient distribution to mammary gland, regulation of gene expression of caseins and the rate of initiation of protein synthesis at post-transcriptional level.
Key words: homeorhesis, hormonal control, mammary gland.
Resumo
Não obstante a importância nutricional e industrial das proteínas lácteas, ainda não estão completamente compreendidos os mecanismos que controlam seu interesse e concentração. Entre os diferentes hormônios que regulam o metabolismo da glândula mamaria, a insulina há recebido maior atenção devido a sua estreita relação com o metabolismo energético e protéico dos animais e devido ao mercado, efeito que tem mostrado sobre a produção e concentração das proteínas lácteas. Existem pelo menos três marcadores a traves dos quais este hormônio parece contribuir ao incremento na síntese e concentração das proteínas lácteas, os quais são revisados: distribuição de nutrientes até a glândula mamária, regulação na expressão de genes de caseínas e incremento na taxa de iniciação da síntese das proteínas a nível pós transcripcional.
Palavras chave: controle hormonal, glândula mamaria, homeorresis.
Introducción
Las proteínas lácteas además de ser una excelente fuente de aminoácidos esenciales (National Dairy Council, 2006) y de compuestos bioactivos (National Dairy Council, 2006; Sukkar and Bounous, 2004), son el pilar de la industria quesera (Van Dam et al., 2005) y se han constituido en uno de los componentes sobre los cuales las principales empresas lácteas del país pagan bonificaciones a los productores (Ministerio de Agricultura y Desarrollo Rural, 2007).
A pesar de su importancia, aún no están totalmente comprendidos los mecanismos que controlan la síntesis y la concentración de las proteínas lácteas (Bequette et al., 2001; Hanigan et al., 2002; Mackle et al., 2000). Aunque se han identificado varias hormonas y factores de crecimiento que afectan el funcionamiento de la glándula mamaria (Akers, 2000; Bauman and Currie, 1980; Tucker, 2000) y la síntesis de proteínas en la leche (Vonderhaar and Ziska, 1989), la insulina ha recibido mayor atención en los últimos años debido a su estrecha relación con el metabolismo energético y proteico de los animales (Bauman, 2000; Kaneko, 1997) y debido al marcado efecto que ha mostrado tener sobre la producción y concentración de proteínas lácteas (Griinari et al., 1997; Mackle et al., 1999; McGuire et al., 1995). Aún no son claros, sin embargo, los mecanismos a través de los cuales esta hormona regula la síntesis y secreción de las proteínas de la leche.
El objetivo de este documento es revisar los posibles mecanismos mediante los cuales la insulina afecta la concentración de proteína en la leche bovina.
Papel de la insulina en la partición de nutrientes en la vaca lactante
La insulina, hormona sintetizada en las células β de los islotes de Langerhans del páncreas de mamíferos (Morimoto, 2000; Wang et al., 1997), está compuesta por 51 aminoácidos distribuidos en dos cadenas unidas por dos enlaces disulfuro (Brange and Langkjoer, 1993; Hua et al., 2002; Morimoto, 2000). Esta hormona es importante en la homeorresis durante la lactancia (Bauman and Currie, 1980) cuando un aumento en su concentración sanguínea genera cambios en el metabolismo del animal y de la glándula mamaria, modificando el volumen de leche y su composición, favoreciendo la concentración de proteína en la leche. Se desconocen, sin embargo, los mecanismos mediante los cuales ejerce esta función (Bequette et al., 2002; Johnston et al., 2004; Moo Choi et al., 2004).
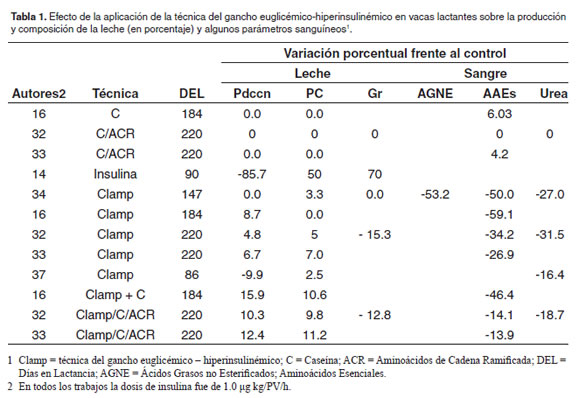
En los primeros trabajos en los que se investigó el papel de la insulina sobre el metabolismo de la vaca lactante, se observó un efecto positivo de esta hormona sobre el contenido de proteína en la leche en animales bien alimentados (Gowen and Tobey, 1931; Gowen and Tobey, 1931) (Tabla 1) con una reducción significativa en el volumen de leche producida lo que fue confirmado en trabajos posteriores (Hayirli et al., 2002; Léonard et al., 1992; Shepherd et al., 1998) en los que, además, fue evidente la disminución en la concentración de glucosa en la sangre. La disminución en el volumen de leche producida se asoció a la reducción en la cantidad y concentración de lactosa sintetizada, principal componente que genera presión osmótica en la leche y que determina la cantidad de leche producida (Gowen and Tobey, 1931; Harris and Bachman, 2003). En estos trabajos se observó un incremento notable en el contenido de grasa y de proteína en la leche sugiriendo que la insulina estaría regulando la partición de nutrientes, favoreciendo la síntesis de grasas y proteínas en detrimento de la síntesis de lactosa.
Debido a que el incremento en el contenido de proteína en la leche al aplicar insulina sola, se confunde con el efecto que ejerce la disminución en la producción de leche sobre esta variable (McGuire et al., 1995), se comenzaron a realizar experimentos utilizando la técnica del gancho euglicémico–hiperinsulinémico (“clamp”) desarrollada originalmente para evaluar la resistencia a la insulina en humanos (DeFronzo et al., 1979). En esta técnica, mientras se inyecta simultáneamente una cantidad fija y alta de insulina vía intravenosa, se inyecta glucosa a una tasa variable pero suficiente para mantener su concentración sanguínea normal. Esto permite estimar la cantidad de glucosa que es utilizada por el organismo bajo un estado hiperinsulinémico.
Al utilizar la técnica “clamp” el incremento en la concentración de proteína en la leche ha sido muy modesto y variable oscilando entre 0.0% (Griinari, 1997; Mackle, 1999; Mackle, 2000) y 11.2% (Mackle, 2003) (Tabla 1). Los valores más altos se han obtenido cuando la aplicación de la técnica ha sido acompañada de la infusión de caseína y aminoácidos a nivel duodenal en cuyo caso la concentración de aminoácidos esenciales en la sangre se ha reducido marcadamente. Esto sugiere que parte de los aminoácidos aportados por la caseína se dirigen hacia la glándula mamaria y se utilizan en la síntesis de proteínas lácteas pero una parte importante de estos son utilizados por tejidos extramamarios. La infusión de proteína sola a nivel duodenal no muestra ningún efecto sobre el contenido de proteína en la leche (Tabla 1). La inducción de la hiperinsulinemia sobre la producción de leche ha sido igualmente variable, reportándose desde una disminución del 9.9% al utilizar la técnica sola (Molento et al., 2002) hasta un incremento del 15.9% cuando la técnica “clamp” fue acompañada de la infusión de caseína en el duodeno (Griinari et al., 1997) (Tabla 1). En general, la inducción de un estado de hiperinsulinemia genera disminución en la concentración sanguínea de aminoácidos esenciales y de urea siendo menor esta disminución cuando la técnica es acompañada por la infusión de proteínas y aminoácidos ramificados (Mackle et al., 1999; Mackle et al., 2000) lo que significa que se está reduciendo la oxidación de aminoácidos al tiempo que se incrementa su uso por los tejidos extramamarios. En uno de estos trabajos se midió la concentración de ácidos grasos no esterificados en la sangre (McGuire et al., 1995) reportándose una disminución en su concentración con la aplicación de la técnica. En cuanto al contenido de grasa en la leche (Mackle et al., 1999) reportaron una reducción en esta variable mientras que McGuire et al. (McGuire et al., 1995) no hallaron ningún cambio ante la inducción de la hiperinsulinemia.
Otras dos aproximaciones metodológicas han sido utilizadas para estudiar el efecto de la insulina en el metabolismo de los rumiantes: la prueba de tolerancia a la glucosa y la prueba de demanda por glucosa. La primera consiste en el suministro de cantidades altas y variables de glucosa seguidas por la medición de la glicemia y la concentración de insulina en la sangre (Sakai et al., 1996). En la segunda técnica se reduce la reabsorción de la glucosa a nivel renal aplicando Fluorizina, un compuesto que inhibe el transportador de glucosa dependiente de sodio (SGLT) en los túbulos renales proximales (Dimitrakoudis et al., 1992) con lo que se incrementan las pérdidas urinarias de glucosa y, en consecuencia, se incrementan las demandas por glucosa en el individuo (Sakai, et al., 1996). Sakai et al., 1996) evaluaron la prueba de tolerancia a la glucosa en vacas lactantes con o sin cetosis encontrando que luego de inyectar 500 mL de una solución de glucosa al 50% en las vacas normales, las concentraciones de glucosa e insulina en la sangre se incrementaron siete veces mientras que en las vacas cetócicas la glucosa se incrementó seis veces y la insulina tres veces sugiriendo que la cetosis es un factor que genera resistencia a la insulina (Amaral-Phillips et al., 1993). Amaral-Phillips et al. (1993), por su parte, evaluaron el efecto de la aplicación subcutánea de 0.0, 2.0 y 4.0 g/d de Fluorizina durante dos días a seis vacas Holstein con seis semanas de lactancia y encontraron que la excreción de glucosa en orina fue de 0.0, 225.0 y 337.0 g/d, respectivamente. La aplicación de esta droga, sin embargo, no afectó la producción de leche (29.8 L), ni el contenido de proteína (2.84 %) y lactosa en la leche (4.97 %), pero sí incrementó linealmente la concentración de grasa (3.34, 3.56 y 3.70%, respectivamente) y de AGNE en la sangre mientras redujo la concentración sanguínea de glucosa e insulina en la sangre. Estos resultados sugieren que las vacas al inicio de la lactancia tienen alta capacidad de realizar ajustes metabólicos necesarios para suministrar los substratos requeridos para la síntesis de los componentes de la leche y compensar incrementos repentinos en la demanda por glucosa.
Como se señaló anteriormente, no se conocen claramente los mecanismos a través de los cuales la insulina actúa en la partición de nutrientes entre los tejidos y en el uso de los nutrientes en distintas rutas metabólicas dentro de un mismo tejido. El efecto de la insulina sobre las proteínas transportadoras de glucosa explica parcialmente la acción de esta hormona sobre la partición de los nutrientes entre los tejidos.
Mecanismos moleculares de acción de la insulina
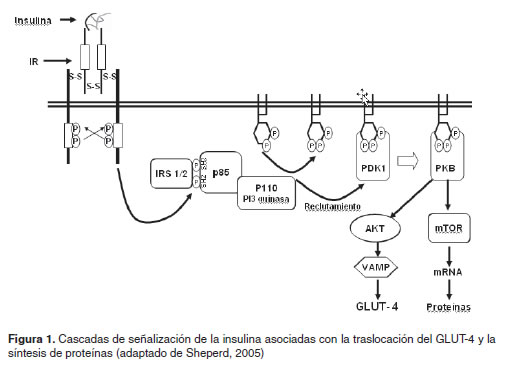
El receptor de la insulina es una glicoproteína transmembranal que pertenece a la familia de los receptores tirosina quinasa (García, 1998; Hubbard and Till et al., 2000), el cual es homólogo al receptor del Factor de Crecimiento Insulinoide tipo 1 (Shepherd et al., 1998). Este receptor está constituido por dos subunidades (α y β) ricas en cisteínas que se combinan para formar un heterodímero unido por puentes disulfuro (Freychet, 1990; Shepherd et al., 1998) (Figura 1). La subunidad α es exclusivamente extracelular y contiene el sitio de unión con la insulina, mientras que la subunidad β contiene una secuencia transmembranal y posee elementos de tirosina quinasa en su dominio citoplasmático (Freychet, 1990).
En general, los receptores tirosina quinasa se caracterizan por catalizar la transferencia de un grupo fosfato proveniente del ATP a sus residuos de tirosina, autofosforilándose y activando, con ello, su acción quinasa (García, 1998; Hubbard and Till, 2000). El receptor activado puede fosforilar diversos sustratos intracelulares, principalmente los denominados substratos receptores de insulina (IRS, insulin receptor substrate) desencadenando, de esta manera, una variedad de cascadas de señales intracelulares corriente abajo (Hubbard and Till, 2000; Su et al., 2006). Aunque se han identificado cuatro variantes, el IRS-1 y el IRS-2 han sido los más estudiados, conociéndose que median los efectos “tróficos” y “metabólicos” de la insulina, respectivamente (Mendivil et al., 2005). Los IRS son proteínas adaptadoras y, por lo mismo, no poseen actividad catalítica, pero son fosforilados en residuos de tirosina por el receptor de insulina (Hubbard and Till, 2000; Su et al., 2006). Una vez fosforilados, en los IRS se crean sitios de reconocimiento a los que se ligan efectores que tengan dominios SH2 o fosfotirosina (García, 1998, Su et al., 2006). Entre estos efectores están las proteínas p85, que son unidades reguladoras de la fosfatidilinositol 3 cinasa (PI3K), permitiendo, de esta manera, la activación de la subunidad catalítica p110 de la PI3K (Shepherd, 2005), la cual es la enzima de la cascada de señalización de insulina más extensamente estudiada (Mendivil and Sierra, 2005) (Figura 1).
La subunidad p110 desinhibida fosforila varios fosfolípidos de membrana, principalmente el fosfatidilinositol 4,5 bifosfato (PI 4,5P) para generar fosfatidilinositol trifosfato (PIP3). El PIP3 es el encargado de fijar a la membrana y activar a PDK1 y Akt, dos enzimas quinasas que median la mayoría de los efectos metabólicos de la insulina (Mendivil and Sierra, 2005). Akt, a su vez, fosforila a VAMP y a otras proteínas de fusión presentes en las vesículas de almacenamiento de los GLUT-4, ocasionando la traslocación de los GLUT-4 a la membrana y por tanto la captación de glucosa (Van Dam et al., 2005) (Figura 1).
La regulación de la síntesis de proteínas por la insulina también esta mediada por la ruta del PI3K quien activa la proteína quinasa B (PKB) encargada, a su vez, de fosforilar el complejo TSC1 (tuberous sclerosis complex 1) – TSC2 con lo que permite que mTOR (mammalian target of rapamycin) active los procesos de traducción y elongación de la cadena peptídica (Proud, 2006) (Figura 1). Este esquema general, sin embargo, aún plantea muchos interrogantes sobre el mecanismo preciso a través del cual mTOR regula la maquinaria traduccional.
Transportadores de glucosa
Dado que la glucosa es una molécula hidrofílica que no difunde libremente al interior de las células requiere algún mecanismo de transporte específico (Nishimoto et al., 2006). Los mecanismos identificados hasta el momento se clasifican en dos grandes familias: los transportadores de glucosa dependientes de sodio (SGLT, sodiumglucose transporters) y los facilitadores de glucosa (GLUT, glucose transporters) (Díaz and Burgos, 2002; Nishimoto et al., 2006; Zhao et al., 2004). Los SGLT se localizan principalmente en el borde de cepillo del epitelio intestinal y en las células epiteliales del riñón mientras que los transportadores GLUT se encuentran distribuidos en todos los tejidos existiendo al menos 13 isoformas (Wood and Trayhurn et al., 2003). De estas, los GLUT1, 2, 3, 4 y 5, son las más importantes en los animales domésticos (Hocquette, 2000). Estas, a su vez, se han clasificado en dos grupos en función de su sensibilidad a la insulina: las isoformas insensibles a insulina (GLUT 1, 2, 3 y 5) y una isoforma sensible a la insulina (GLUT4) (Hocquette, 2000; Sasaki, 2002). No todos los tejidos de los mamíferos expresan las distintas isoformas de los GLUT lo que ha conducido a clasificar a los tejidos como dependientes o independientes de insulina según expresen las diferentes isoformas de GLUT (Nishimoto et al., 2006). Así, mientras que el tejido muscular, el tejido adiposo (Díaz and Burgos, 2002; Sasaki, 2002; Xiao and Cant, 2005), los folículos ováricos y el cuerpo lúteo (Hiromi et al., 2004; Williams et al., 2001) expresan GLUT4 y son sensibles a la insulina, los eritrocitos (GLUT1), la placenta (GLUT1), la glándula mamaria (GLUT1), el cerebro (GLUT1 y 3), el hígado (GLUT2 y 3), las células β del páncreas (GLUT2) y los intestinos (GLUT5) son insensibles a la insulina (Díaz and Burgos, 2002; Sasaki, 2002; Xiao and Cant, 2005). Esto significa que mientras que el transporte de glucosa desde la sangre al interior de las células del tejido muscular y adiposo depende de la concentración sanguínea de insulina, en los demás tejidos el transporte de glucosa depende más de la concentración de glucosa que de insulina en la sangre.
Tal es el caso de las células epiteliales de glándula mamaria que expresan únicamente el GLUT1 y por lo tanto, toman glucosa de la sangre independientemente de la concentración sérica de insulina (Komatsu et al., 2005; Zhao et al., 2004). Durante la lactancia, el epitelio mamario requiere un suministro continuo de glucosa para la síntesis de los diferentes componentes de la leche: lactosa, lípidos y proteínas (Reynolds et al., 1994; Xiao and Cant, 2005) por lo que es capaz de absorber glucosa aún en estado de hipoinsulinemia e hipoglicemia (Komatsu, 2005). Komatsu et al. (2005) hallaron que la concentración de insulina en la sangre es menor durante toda la lactancia (10.0 μU/mL) comparada con el periodo seco (17.0 μU/mL) y que la expresión de GLUT1 en la glándula mamaria de vacas lactantes es tres veces superior que en vacas secas. También reportaron que este transportador se expresa en el tejido adiposo en vacas secas y en vacas al final de la lactancia. En el tejido muscular, por el contrario, no se evidenció la expresión de este transportador en ningún estado de la lactancia. GLUT4, por el contrario, se expresó en el tejido adiposo y muscular independientemente del estado de lactancia mientras que en la glándula mamaria no hubo evidencia de su expresión.
Estos hallazgos revisten gran importancia para comprender el papel de la insulina en la distribución de la glucosa entre los tejidos durante la lactancia pero, así mismo, generan algunos interrogantes. La expresión constante y alta de GLUT1 en las células epiteliales de la glándula mamaria durante toda la lactancia sugiere que estas células presentan alta capacidad de transporte de glucosa a su interior. Sin embargo, el incremento en la expresión de GLUT1 en el tejido adiposo al final de la lactancia, sugeriría una menor distribución de glucosa hacia la glándula mamaria en vista de la competencia que ejercería el tejido adiposo por este nutriente a través de este transportador.
Resulta sorprendente que en el músculo no se exprese este transportador de glucosa toda vez que su ausencia implicaría una limitante en la capacidad de este tejido de tomar glucosa de la sangre y, por lo tanto, en realizar actividades anabólicas. Esta hipótesis, sin embargo, contrasta con los datos de Komaragiri y Erdman (Komaragiri MVS and Erdman RA, 1997) que señalan que la movilización de la proteína muscular se detiene en la quinta semana de lactancia. Resulta más sorprendente aún que tanto el tejido adiposo como el muscular expresen GLUT4 invariablemente durante la lactancia y el periodo seco ya que esto capacitaría a dichos tejidos para captar glucosa de la sangre sin dificultades. Sin embargo no lo hacen (Komatsu et al., 2005). Komatsu et al. (2005), sugieren que aunque este transportador se expresa durante la lactancia en estos tejidos, no transfiere la glucosa al interior de la célula debido al estado de insulinoresistencia característico de las vacas durante la lactancia.
Es necesario considerar, sin embargo, que la concentración de insulina durante la lactancia fue más baja que durante el periodo seco y que, por lo tanto, quizá el nivel de insulina necesario para que este transportador se exprese es más bajo que la mostrada por las vacas experimentales. Pero también sugiere que el nivel de insulina necesario para que estos transportadores actúen es más alto. Otra posibilidad que debe ser considerada es que no obstante que estos transportadores se expresen y funcionen adecuadamente, la glucosa que ingresa al interior de las células diana no sería retenida completamente debido a la baja expresión de la hexoquinasa (Kaneko, 1997). Es claro que en el caso de la glándula mamaria de bovinos la hexoquinasa es responsable de al menos el 80% del control en el metabolismo de la glucosa mientras que el transportador (GLUT1) es responsable del 20% restante (Xiao and Cant, 2005) indicando una clara diferencia en la importancia relativa de estos dos componentes en el metabolismo de la glucosa a nivel de la glándula mamaria. En el caso de las células musculares de bovinos estas estimaciones aún no se han realizado.
Otro aspecto adicional en la regulación del metabolismo extramamario asociado a la expresión y actividad de los GLUT, tiene que ver con su eventual papel en las diferencias que existen en el metabolismo del tejido adiposo de acuerdo a su localización. Sohlström y Forsum (Sohlström and Forsum, 1995) establecieron que la deposición y movilización de tejido adiposo en mujeres cambia según su localización y que, además, cambia durante la preñez y la lactancia. Estos autores encontraron que la grasa subcutánea representa el 76% del tejido adiposo total y que este porcentaje no cambia durante la gestación. Sin embargo, durante la lactancia, se aprecia una pérdida significativa de la grasa subcutánea mientras que la grasa no subcutánea, la mayor parte de la cual es grasa visceral, se incrementa ligeramente en este periodo.
Hood y Allen (1973), por su parte, reportaron que el tejido adiposo subcutáneo y perineal presentan patrones de deposición diferentes en bovinos en crecimiento. Este tipo de fenómenos no se han estudiado en el caso del tejido muscular y dado que la síntesis de proteínas de la leche dependen parcialmente de las proteínas corporales movilizadas, resulta de sumo interés esclarecer la relación entre la expresión de los GLUT’s y la regulación del metabolismo en el tejido muscular a lo largo de la lactancia (Moorby et al., 2000). Moorby et al. (2000) señalan que cuando la concentración sanguínea de insulina es baja y la de hormona del crecimiento es alta, se incrementa la movilización de proteínas corporales y, por ende, la disponibilidad de aminoácidos para la síntesis de proteínas lácteas. Sus resultados muestran que la concentración sanguínea de estas dos hormonas responde a la dieta de manera inversa y que, por lo tanto, su respuesta en movilización o síntesis de proteínas corporales es manipulable a través de la dieta.
El papel de la insulina en la regulación de la expresión de los GLUT, no explica satisfactoriamente los cambios en la producción y composición de la leche, lo que necesariamente lleva a tener que explorar otros mecanismos como son aquellos asociados con la expresión de los genes de las proteínas lácteas en las células epiteliales de la glándula mamaria.
Mecanismos moleculares asociados a la síntesis de proteínas lácteas
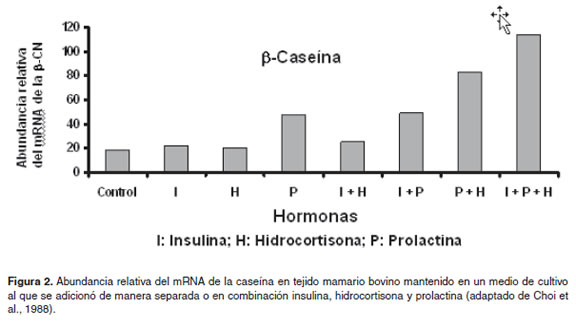
Choi et al. (1988) evaluaron la expresión de los genes (mRNAs y proteínas) de la α-S1-caseína y β-caseína en células epiteliales de glándulas mamarias bovinas que fueron mantenidas en un medio de cultivo al que se le adicionó insulina, hidrocortisona y prolactina solas o en combinación. Sus resultados indican que la insulina sola no afecta la expresión de estos genes pero sí ejerce un efecto aditivo cuando se combina con las otras dos hormonas (Figura 2). Los mecanismos moleculares que explican estas interacciones podrían encontrarse a nivel de las vías de señalización que asocian estas hormonas con la expresión de los genes de las proteínas lácteas (Rosen et al., 1999; Vonderhaar and Ziska, 1989). Estas vías de señalización están bien descritas en el caso de la prolactina (Su et al., 2006) y los glucocorticoides (Gupta and Lalchhandama, 2002) así como la interacción entre estas dos hormonas a nivel de las rutas de señalización (Rosen et al., 1999; Su et al., 2006). En el caso de la insulina se han postulado algunos de los posibles componentes de esta ruta de señalización en la glándula mamaria de ratas (Moo Choi et al., 2004) y en el metabolismo de los rumiantes (Sakai et al., 1996).
Moo Choi et al. (2004) revisaron la interacción entre las rutas de señalización de la prolactina y la insulina en la síntesis de β–caseína sugiriendo que esta no se encuentra en las cascadas de señalización pretranscripcionales, si no a nivel postranscripcional, estimulando el alargamiento de la cadena poli-A y, por lo tanto, incrementando la estabilidad del mRNA y su vida media (Kuraishi et al., 2000). Un incremento en la vida media de esta molécula ha sido correlacionado, a su vez, con el incremento en la tasa de iniciación traduccional y, en consecuencia, con la tasa de síntesis de proteínas lácteas (Moo Choi et al, 2004).
Conclusiones
Existen al menos tres mecanismos a través de los cuales la insulina parece contribuir al incremento en la síntesis y concentración de proteínas lácteas: distribución de nutrientes entre tejidos extramamarios y la glándula mamaria a través de la regulación de los transportadores de glucosa; interacción con glucocorticoides y prolactina en la regulación de la expresión de genes de caseínas, e incremento en la tasa de iniciación de la síntesis de las proteínas a nivel postranscripcional. Los trabajos revisados sugieren que la acción de la insulina es más el resultado del sinergismo con otras hormonas en la glándula mamaria, que un efecto aislado de dicha hormona.
Agradecimientos
Al Dr. Juan Carulla F. PhD. y a la Dra. Martha Pabón R. PhD. por sus valiosos aportes y orientación en la elaboración de este documento como parte del trabajo realizado dentro del curso Tópicos Especializados en Nutrición Animal del programa de Doctorado en Ciencias de la Producción Animal de la Universidad Nacional de Colombia, Sede Bogotá.
Referencias
Akers RM. Selection for Milk Production from a Lactation Biology Viewpoint. J Dairy Sci 2000; 83:1151-1158. [ Links ]
Amaral-Phillips DM, McGilliard AD, Lindberg GL, Veenhuizen JJ, Young JW. Effects of decreased availability of glucose for dairy cows. J Dairy Sci 1993; 76:752-761. [ Links ]
Bauman DE, Currie WB. Partitioning of nutrients during pregnancy and lactation: a review of mechanisms involving homeostasis and homeorhesis. J Dairy Sci 1980; 63:1514-529. [ Links ]
Bauman DE. Regulation of nutrient partitioning during lactation: homeostasis and homeorhesis revisited. In: Cronjé PB, editor. Ruminant physiology: digestion, metabolism, growth and reproduction. CAB International; 2000. p. 311-328. [ Links ]
Bequette BJ, Kyle CE, Crompton LA, Buchan V, Hanigan MD. Insulin regulates milk production and mammary gland and hind-leg amino acid fluxes and blood flow in lactating goats. J Dairy Sci 2001; 84:241-255. [ Links ]
Bequette BJ, Kyle CE, Crompton LA, Anderson SE, Hanigan MD. Protein metabolism in lactating goats subjected to the insulin clamp. J Dairy Sci 2002; 85:1546-1555. [ Links ]
Brange J, Langkjoer L. Insulin structure and stability. Pharm Biotechnol 1993; 5:315-350. [ Links ]
Choi YJ, Keller WL, Berg IE, Park CS, Mackinlay AG. Casein gene expression in bovine mammary gland. J Dairy Sci 1988; 71:2898-2903. [ Links ]
DeFronzo RA, Tobin JD, Andres R. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol 1979; 237: E214-223. [ Links ]
Díaz DP, Burgos LC. ¿Cómo se transporta la glucosa a través de la membrana celular? Iatreia 2002; 15:179-189. [ Links ]
Dimitrakoudis D, Vranic M, Klip A. Effects of hyperglycemia on glucose transporters of the muscle: use of the renal glucose reabsorption inhibitor phlorizin to control glycemia. J Am Soc Nephr 1992; 3:1078-1091. [ Links ]
Freychet P. Pancreatic hormones. In: Baulieu E-E and Kelly PA editors. Hormones, from molecules to disease. London, UK: Hermann, publishers in arts and science; 1990. p. 491-532. [ Links ]
García JA. Hormonas: mensajeros químicos y comunicación celular. México DF: Fondo de Cultura Económica, SA de CV; 1998. 119 p. [ Links ]
Gowen JW, Tobey ER. Studies on milk secretion: The Influence of Inanition. J Gen Physiol 1931; 15:45-66. [ Links ]
Gowen JW, Tobey ER. On the mechanism of milk secretion: the influence of insulin and phloridzin. J Gen Physiol 1931; 15:67-85. [ Links ]
Griinari JM, Mcguire MA, Dwyer DA, Bauman DE, Barbano DM et. al. The role of insulin in the regulation of milk protein synthesis in dairy cows. J Dairy Sci 1997; 80:23612371. [ Links ]
Gupta BBP, Lalchhandama K. Molecular mechanisms of glucocorticoid action. Current Sci 2002; 83:1103-1111. [ Links ]
Hanigan MD, Crompton LA, Metcalf JA, France J. Modelling mammary metabolism in the dairy cow to predict milk constituent yield, with emphasis on amino acid metabolism and milk protein production: model evaluation. J Theor Biol 2002, 217:311-330. [ Links ]
Harris B, Bachman KC. Nutritional and management factors affecting solids-not-fat, acidity and freezing point of milk. University of Florida, Institute of Food and Agricultural Sciences, Florida Cooperative Extension Service. 2003. 5 p. [ Links ]
Hayirli A, Bertics SJ, Grummer R. Effects of slow-release insulin on production, liver triglyceride, and metabolic profiles of Holsteins in early lactation. J Dairy Sci 2002; 85:2180-2191. [ Links ]
Hiromi S, Sawa Y, Tsuyoshi T, Ken-Go H, Akio M, Seizo H, Masa T. Expression of glucose transporter 1 (GLUT1) and 4 (GLUT4) in bovine follicles and corpora lutea. Vancouver, Canada: 37th Annual meeting of the society for the study of reproduction, University of British Columbia. 2004. 1p. [ Links ]
Hocquette J. F., Abe H. Facilitative glucose transporters in livestock species. Reprod Nutr Dev 2000; 40:517-533. [ Links ]
Hood RL, Allen CE. Cellularity of bovine adipose tissue. J Lipid Res 1973; 14:605-610. [ Links ]
Hua Q-X, Chu YC, Jia W, Phillips NF, Wang RY, et. al.. Mechanism of insulin chain combination. Asymmetric roles of A-chain alpha-helices in disulfide pairing. J Biol Chem 2002; 277:43443-43453. [ Links ]
Hubbard SR, Till JH. Protein tyrosine kinase structure and function. Annu Rev Biochem 2000; 69:373-398. [ Links ]
Johnston SL, Kitson KE, Tweedie JW, Davis SR, Lee J. y-Glutamyl transpeptidase inhibition suppresses milk protein synthesis in isolated ovine mammary cells. J Dairy Sci 2004; 87:321-329. [ Links ]
Kaneko JJ. Carbohydrate metabolism and its diseases. In: Kaneko J. J., Harvey JW, Bruss ML, editors. Clinical biochemistry of domestic animals. 5th edition. San Diego, Cal: Academic Press; 1997. p. 45-81. [ Links ]
Komaragiri MVS, Erdman RA. Factors affecting body tissue mobilization in early lactation dairy cows. 1. Effect of dietary protein on mobilization on body fat and protein. J Dairy Sci 1997; 80:929-937. [ Links ]
Komatsu T, Itoh F, Kushibiki S, Hodate K. Changes in gene expression of glucose transporters in lactating and nonlactating cows. J Anim Sci 2005; 83:557-564. [ Links ]
Kuraishi T, Sun Y, Fugaku A, Imakawa K, Sakai S. The poly(A) tail length of casein mRNA in the lactating mammary gland changes depending upon accumulation and removal of milk. Biochem J 2000; 347:579-583. [ Links ]
Léonard M, Burchard J, Gallo G, Block E. Effects of long term infusions of glucose and/or insulin in bST-treated cows before peak milk on nutrient and hormonal profile. J Dairy Sci 1992; 75 (Suppl 1):182. [ Links ]
Mackle TR, Dwyer DA, Ingvartsen KL, Chouinard PY, Lynch JM, et. al. Effects of insulin and amino acids on milk protein concentration and yield from dairy cows. J Dairy Sci 1999; 82:1512-1524. [ Links ]
Mackle TR, Dwyer DA, Ingvartsen KL, Chouinard PY, Ross DA et. al. Effects of insulin and postruminal supply of protein on use of amino acids by the mammary gland for milk protein synthesis. J Dairy Sci 2000; 83:93-105. [ Links ]
McGuire MA, Griinari JM, Dwyer DA, Bauman DE. Role of insulin in the regulation of mammary synthesis of fat and protein. J Dairy Sci 1995; 78:816-824. [ Links ]
Mendivil CO, Sierra ID. Acción insulínica y resistencia a la insulina: aspectos moleculares. Rev Fac Med Univ Nac Col 2005; 53:235-243. [ Links ]
Ministerio de Agricultura y Desarrollo Rural (MADR)-Resolución 0012, Sistema de pago de la leche cruda al productor- 2007. [ Links ]
Molento CFM, Block E, Cue RI, Petitclerc D. Effects of insulin, recombinant bovine somatotropin, and their interaction on insulin-like growth factor-i secretion and milk protein production in dairy cows. J Dairy Sci 2002; 85:738-747. [ Links ]
Moo Choi K, Barash I, Rhoads RE. Insulin and Prolactin Synergistically Stimulate b-Casein Messenger Ribonucleic Acid Translation by Cytoplasmic Polyadenylation. Mol Endocrinology 2004; 18:1670-1686. [ Links ]
Moorby JM, Dewhurst RJ, Tweed JKS, Dhanoa MS, Beck NFG. Effects of altering the energy and protein supply to dairy cows during the dry period. 2. Metabolic and hormonal responses. J Dairy Sci 2000; 83:1795-1805. [ Links ]
Morimoto S. Mecanismos moleculares que intervienen en la regulación de la síntesis de insulina por glucosa. Rev Hosp Gral Dr M Gea González 2000; 3:118-120. [ Links ]
National Dairy Council. Emerging health benefits of dairy proteins. Dairy Council Digest 2006; 77:19-24. [ Links ]
Nishimoto H, Matsutani R, Yamamoto S, Takahashi T, Hayashi K-G, et. al. Gene expression of glucose transporter (GLUT) 1, 3 and 4 in bovine follicle and corpus luteum. J Endocrinology 2006; 188:111-119. [ Links ]
Proud CG. Regulation of protein synthesis by insulin. Biochem Soc Trans 2006; 34:213-216. [ Links ]
Reynolds CK, Harmon DL, Cecava MJ. Absortion and delivery of nutrients for milk protein synthesis by portal drained viscera. J Dairy Sci 1994; 77:2787-2808. [ Links ]
Rosen JM, Wyszomierski SL, Darryl Hadsell. Regulation of milk protein gene expression. Annu Rev Nutr 1999; 19:407-436. [ Links ]
Sakai T, Hamakawa M, Kubo S. Glucose and xylitol tolerance test for ketotic and healthy dairy cows. J Dairy Sci 1996; 79:372-377. [ Links ]
Sasaki S. Mechanism of insulin action on glucose metabolism in ruminants. Animal Sci J 2002; 73:423-433. [ Links ]
Schmidt GH. Effect of insulin on yield and composition of milk of dairy cows. J Dairy Sci 1966; 49:381-385. [ Links ]
Shepherd PR, Withers DJ, Siddle K. Phosphoinositide 3-kinase: The key switch mechanism in insulin signalling. Biochem J 1998; 333:471-490. [ Links ]
Shepherd PR. Mechanisms regulating phosphoinositide 3-kinase signaling in insulin-sensitive tissues. Review. Acta Physiol Scand 2005; 183:3-12. [ Links ]
Sohlström A, Forsum E. Changes in adipose tissue volume and distribution during reproduction in Swedish women as assessed by magnetic resonance imaging. Am J Clin Nutr 1995; 61:287-295. [ Links ]
Stoecklin E, Wissler M, Moriggl R, Groner B. Specific DNA binding of STAT5, but not of glucocorticoid receptor is required for their functional cooperation in the regulation of gene transcription. Mol Cell Biol 1997; 17:6708-6716. [ Links ]
Su X, Lodhi IJ, Saltiel AR, Stahl PD. Insulin-stimulated interaction between insulin receptor substrate 1 and p85{alpha} and activation of protein kinase B/Akt require Rab5 J Biol Chem 2006; 281:27982- 27990. [ Links ]
Sukkar SG, Bounous G. The role of whey protein in antioxidant defence. Riv Ital Nutri Parent Enter. 2004; 22:193-200. [ Links ]
Tucker HA. Hormones, mammary growth, and lactation: a 41year perspective. J Dairy Sci 2000; 83:874-884. [ Links ]
Van Dam EM, Govers R, James DE. Akt activation is required at a late stage of insulin-induced GLUT4 translocation to the plasma membrane. Mol Endocrinology 2005; 19:10671077. [ Links ]
Vonderhaar BK, Ziska SE. Hormonal regulation of milk protein gene expression. Annu Rev Physiol 1989; 51:641-652. [ Links ]
Wang J, Shen L, Najafi H, Kolberg J, Matschinsky FM, et. al. Regulation of insulin preRNA splicing by glucose. Proc Natl Acad Sci USA 1997; 94:4360-4365. [ Links ]
Williams SA, Blache D, Martin GB, Foot R, Blackberry MA, et. al. Effect of nutritional supplementation on quantities of glucose transporters 1 and 4 in sheep granulosa and theca cells. Reproduction 2001; 122: 947-956. [ Links ]
Wood IS, Trayhurn P. Glucose transporters (GLUT and SGLT): expanded families of sugar transport proteins. Br J Nutr 2003; 89:3-9. [ Links ]
Xiao CT, Cant JP. Relationship Between Glucose Transport and Metabolism in Isolated Bovine Mammary Epithelial Cells. J Dairy Sci 2005; 88:2794-2805. [ Links ]
Zhao F-Q, Millera PJ, Walla EH, Zhenga Y-C, Donga B, et. al. Bovine glucose transporter GLUT8: cloning, expression, and developmental regulation in mammary gland. Bioch Bioph Acta 2004; 1680:103-113. [ Links ]