Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.22 no.4 Medellín Oct./Dec. 2009
Alimento vivo enriquecido con ácidos grasos para el desarrollo larvario de peces¤
Live feed enriched with fatty acids for larval fish development
Alimento vivo e seu enriquecimento com ácidos graxos no desenvolvimento larvário em peixes
Carlos M Rivera1, IP, cMSc; Mónica Botero1*, Zoot, Dr. Sc
1Grupo GRICA, Facultad de Ciencias Agrarias. Universidad de Antioquia. AA. 1226. Medellín, Colombia.
(Recibido: 30 mayo, 2008; aceptado: 28 julio, 2009)
Resumen
La nutrición de las larvas representa uno de los principales problemas en la producción de peces a gran escala; el objetivo principal de esta revisión es profundizar en el conocimiento de los factores que intervienen en el desarrollo orgánico y digestivo de los peces y en cómo éstos, pueden afectar su desarrollo y sobrevivencia. El desarrollo del tracto digestivo en las larvas de peces está condicionado por aspectos de tipo anatomo-fisiológico, que permiten a la poslarva adaptarse bioquímica e histológicamente a los períodos de transición entre la finalización de la reabsorción del vitelo y el inicio del consumo de alimento vivo, y en la transición de alimento vivo a dieta comercial balanceada. Las especies empleadas en la primera alimentación de la poslarva, afectan su sobrevivencia y desarrollo, debido a que un suministro inadecuado, podría ocasionar una alta mortalidad, ya que las especies zooplanctónicas que proliferan, no siempre satisfacen los requerimientos nutricionales de la poslarva, se producen en un volumen inferior al requerido y/o un mal manejo en su producción, favorece la proliferación de especies planctónicas depredadoras. Entre los principales nutrientes que aporta el alimento vivo, están los ácidos grasos insaturados y poliinsaturados. Así mismo deficiencias nutricionales en el alimento vivo pueden ser complementadas mediante enriquecimiento con ácidos grasos, esenciales en los procesos de pigmentación, producción de prostaglandinas, respuesta inmunológica, desarrollo retinal entre otras.
Palabras clave: ácidos grasos, alimento vivo, desarrollo larvario.
Summary
The larvae nutrition represents one of the main problems in the great scale production of fish. The primary objective of this review is to enlarge the knowledge of the factors that take part in the organic and digestive development of fish and the way these factors can affect their growth and survival. The development of digestive tract in the larvae of fish is conditioned by anatomo-physiological aspects that allow pos-larvae to adapt biochemical and histologically to periods of transition between the end of the reabsorption of the yolk sac and the beginning of consumption of live feed, and from the consumption of live feed to a balanced commercial diet. The species used in the first feeding of post-larvae affect their survival and development. An inadequate provision could cause a high mortality due to the fact that the zooplankter species that proliferate everywhere not always satisfy the growing fish nutritional requirements, their volume growth is inferior to the required volume and, on top of that, a wrong production handling favors the proliferation of depredating planktonic species. Bearing in mind that one of the main nutrients t0hat live feed contributes, are the non-saturated and polyunsaturated fatty acids, nutritional deficiencies in the live feed can be complemented with the enrichment of fatty acids, which are essential components in the processes of pigmentation, production of prostaglandins and immunological defenses, plus retinal development required to improve visual capacity and sharpness, among others.
Key words: fatty acids, larval development, live feed.
Resumo
A nutrição das larvas representa um das principais problemas na produção de peixes a grande escala; o objetivo principal de esta revisão é afundar no conhecimento dos fatores que influenciam o desenvolvimento orgânico e digestivo dos peixes e como estes fatores podem afetar o seu desenvolvimento e sua sobrevivência. O desenvolvimento do trato digestivo nas larvas dos peixes está condicionado aos aspectos do tipo anatomo-fisiológico que permitem à póslarva adaptar-se bioquímica e histologicamente aos períodos de transição entre a finalização da reabsorção do vitelo e o inicio do consumo de alimento vivo e na transição do alimento vivo na dieta comercial balanceada. As espécies usadas na primeira alimentação póslarva afetam sua sobrevivência e desenvolvimento devido a que uma inadequada alimentação poderia ocasionar uma alta mortalidade, já que as espécies zooplanctônicas que proliferam, não sempre satisfazem os requerimentos nutricionais da póslarva, as quais se produzem em volume inferior ao requerido e/ou uma mal manejo na sua produção, favorece a proliferação de espécies planctônicas depredadoras. Entre os principais nutrientes que aporta o alimento vivo, estão os ácidos graxos insaturados e poliinsaturados. Também as deficiências nutricionais no alimento vivo podem ser complementadas mediante enriquecimento com ácidos graxos essenciais no processo de pigmentação, produção de prostaglandinas, respostas imunológicas, desenvolvimento retinal entre outras.
Palavras chave: ácidos graxos, alimento vivo, desenvolvimento larvário.
Introducción
En la piscicultura a gran escala, los periodos larvario y poslarvario, representan una de las principales dificultades debido al escaso conocimiento sobre los requerimientos nutricionales de éstas. Durante el desarrollo del pez, la fase larvaria se inicia al momento de la eclosión, donde depende nutricionalmente de las reservas presentes en el saco vitelino. Además, se ve expuesto a fuerzas como abrasión, corrientes y ondas hídricas e incluso a cambios de comportamiento, así como a potenciales depredadores. La finalización de la nutrición a expensas del vitelo (endógena) y el inicio de la alimentación exógena son cruciales para su desarrollo. En este punto, se puede considerar que finaliza la etapa de larva y se inicia la de poslarva, que culmina al iniciar la etapa de alevinaje. No obstante, este cambio de etapa (larva a poslarva), es difícil de definir, percibir y determinar en algunos peces, ya que abarca un corto período con dieta mixta (alimento vivo y artificial) mientras agotan los remanentes de vitelo e inician el consumo de plancton, como es el caso de la carpa (Panush and Delafuente, 1985).
La sobrevivencia de las larvas presenta altas fluctuaciones debido a diversos factores, como los fisicoquímicos (temperatura, iluminación, flujo de agua, corrientes, oxígeno disuelto, amonio, salinidad, pH, etc.), considerados los más importantes para la sobrevivencia y crecimiento (Merchie et al., 1996); y a factores genéticos, etológicos (relacionados directamente con el comportamiento alimenticio y los procesos de huída), biológicos (competencia y depredación) y nutricionales (ácidos grasos y vitaminas), los cuales confieren a las larvas la energía necesaria para mantener su metabolismo, crecer y asegurar su sobrevivencia (Civera et al., 2004).
Desarrollo anatómico y fisiológico del sistema digestivo en larvas
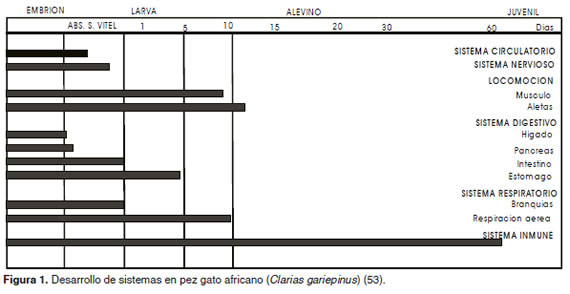
Desde el punto de vista de la alimentación, la larva se enfrenta a la necesidad de capturar su alimento con rapidez, lo que se dificulta al no tener su sistema locomotriz completamente formado (Figura 1). Durante este periodo, el desarrollo del canal alimentario abarca cambios morfológicos, fisiológicos e histológicos (Figura 2) que están sincronizados por procesos genéticos y ambientales (Civera et al., 2004).
El momento en el que termina la fase vitelina y comienza la alimentación exógena es crítico, debido a las limitaciones morfológicas, como el tamaño de la boca y a limitaciones fisiológicas, como el incompleto desarrollo de las glándulas digestivas que permiten la digestión de los alimentos artificiales (Meza et al., 2002; Sánchez et al., 2005); pero al mismo tiempo la larva está capacitada para perseguir, capturar, tragar y digerir la presa (alimento vivo) (Verreth, 1999).
Al eclosionar, el canal alimentario de la larva, es un tubo recto histológicamente indiferenciado que pasa por encima del saco vitelino y está cerrado hacia la boca y el ano en muchas especies (Vu, 1983).
El desarrollo del tracto digestivo involucra la apertura de la cavidad bucal, la formación de la conexión entre el esófago y el intestino, y la funcionalidad del hígado y el páncreas, para hacer posible a la poslarva la ingestión, la digestión y la asimilación del primer alimento exógeno antes de que el saco vitelino sea completamente reabsorbido (Ostaszewska, 2002; Sánchez et al., 2005) (Figura 2).
El tamaño de la boca determina la cantidad y el tipo de presas consumidas por la larva, además otras características morfológicas asociadas al aparato mandibular, como presencia de faringe suctora y boca protráctil. Igualmente ojos pigmentados, sistema digestivo funcional (hígado y páncreas) (Figura 1) y una buena capacidad natatoria favorecen la captura, la ingestión y la asimilación de las presas (Meza y Figueroa, 2002).
Aunque el sistema natatorio no está totalmente desarrollado al momento de comenzar a comer, muchas veces se completa durante el estadio larval (variando de especie a especie) o en el estadio juvenil, permitiendo distinguir larvas de alevinos y/o juveniles (Verreth, 1999) (Figura 1).
El hígado es uno de los primeros órganos en desarrollarse, al estar involucrado en la reabsorción vitelina. Mientras que el páncreas y la vesícula biliar, relacionados con la digestión de proteínas, lípidos y carbohidratos, se diferencian después, siendo completamente funcionales en el momento en el que se inicia la alimentación exógena (Lazo, 2000) (Figura 1).
El intestino al no estar diferenciado al momento de la eclosión, debe estar listo para digerir y absorber al empezar la alimentación exógena; en la eclosión ya hay presencia de insulina y glucagón (Verreth, 1999). Las enzimas que participan en estos procesos pueden estar localizadas en el lumen intestinal (enzimas secretadas por el páncreas como la tripsina y la quimotripsina), adheridas a la membrana del epitelio intestinal (borde en cepillo) (la aminopeptidasa o la fosfatasa alcalina) o en el interior de las células (catepsinas). En términos de regionalización intestinal, las proteínas son digeridas y absorbidas en la parte posterior, mientras que la digestión de lípidos ocurre principalmente en la parte anterior (Govoni et al., 1986). La digestión intracelular se realiza principalmente en la región posterior del intestino y ha sido puesta en evidencia por Watanabe (Watanabe, 1985), quien observó la absorción de proteínas (peroxidasa del rábano) por medio de pinocitosis y su posterior digestión intraenterocítica por medio de lisosomas. Este mecanismo de digestión es más importante en larvas que en juveniles o en adultos, y se cree que la digestión intracelular compensa la baja digestión extracelular observada durante la etapa larvaria (Cahu et al., 2003; Watanabe, 1985).
Las enzimas que degradan los lípidos son principalmente de dos tipos, lipasa neutra no específica activada por sales biliares y lipasa pancreática específica activada por co-lipasa y sales biliares (Gjellesvik et al., 1992; Izquierdo et al., 2000). Los lípidos son emulsificados por las sales biliares para facilitar su digestión. Las enzimas actúan sobre sus respectivos sustratos lipídicos liberando ácidos grasos, los cuales son absorbidos por las células de la pared del intestino anterior y resintetizados intracelularmente antes de su transporte al hígado, a donde llegan esencialmente por vía linfática (Guillaume J et al., 2004; Smith L, 1989). También, se ha encontrado actividad de tipo amilasa y maltasa en especies como Oncorhyncus mykiss, Cyprinus carpio y Acanthopagrus shlegelii entre otras (Civera et al., 2004).
Meza et al. (2002) encontraron que para el pez blanco (Chriostoma humboldtianum), a lo largo del epitelio intestinal se presentan enterocitos maduros que sugieren que estas larvas pueden digerir y asimilar el alimento. Aunque no se evidenció la presencia de glándulas digestivas, la estructura de los enterocitos sugiere que son capaces de secretar enzimas digestivas (Civera et al., 2004; Lazo et al., 2000; Zambonino and Cahu, 2001). Igualmente el páncreas se presenta como un órgano anatómicamente reconocible, donde se observan las porciones exocrina y endocrina, en el epitelio de la parte exocrina se observan gránulos de zimógeno lo que puede indicar que estas células son capaces de secretar enzimas digestivas como lipasas, proteasas y amilasas (Lazo et al., 2000; Zambonino and Cahu, 2001). En la parte endocrina se reconoce un islote de Langerhans que indica que estas larvas son capaces de asimilar azúcares. En esta especie la apertura de la boca al cuarto día después de la eclosión, coincide con el desarrollo de los órganos internos, lo que facilita la ingestión y la absorción de los alimentos (Meza et al., 2002).
Los lípidos son aparentemente digeridos a ácidos y monoglicéridos en el lumen del tubo medio (región del tracto digestivo indiferenciado, que posteriormente se convertirá en intestino anterior), absorbidos dentro del epitelio del tubo medio, resintetizados en el retículo endoplásmico granular y depositados en grandes gotas lipídicas (Watanabe and Sawada, 1985). La presencia de gotas de grasa en los enterocitos de pez se ha observado en varias especies de peces marinos y de agua dulce, no sólo en estado larval (Sarasquete et al., 1995; Watanabe, 1985).
Al comienzo de la alimentación exógena las larvas de muchas especies son capaces de absorber lípidos por el epitelio intestinal. Se han detectado diferentes secciones de absorción, que varían para cada especie. Así, las larvas de Coregonus lavaretus absorben lípidos principalmente en la parte anterior del intestino (Segner et al., 1989), mientras que en Dicentrarchus labrax se marca en la porción distal, permaneciendo durante todo el período larvario y ha sido relacionado a la diferenciación incompleta del tracto digestivo, especialmente por la ausencia de un estómago funcional (Deplano et al., 1991).
La habilidad de las larvas de absorber lípidos se mantiene hasta el final de la fase lecitotrófica a través de los enterocitos, aunque éstos están pobremente desarrollados, mostrando un escaso retículo endoplásmico y aparato de Golgi (Deplano et al., 1991). De esta manera, solamente una pequeña proporción de los lípidos es absorbida e incorporada dentro de partículas lipoproteínicas. Lo anterior sugiere una reducción en la capacidad de transporte de lípidos. En los días subsecuentes de la alimentación con zooplancton, un mayor número de vacuolas lipídicas son observadas. En Dicentrarchus labrax la eficiencia de transporte de lípidos mejora a partir del día 9 en adelante, cuando una clara intensificación de la síntesis de lipoproteínas se conjunta con un incremento del depósito de glicógeno en el hígado (Deplano et al., 1991).
Para comprender los avances de la absorción de lípidos durante la ontogenia temprana de Dicentrarchus labrax, Sparus aurata, Stizostedion lucioperca (Díaz et al., 2002). Díaz et al., 2002), clasificaron este proceso dividiéndolo en tres fases: 1) endotrófica, donde la larva se alimenta exclusivamente de las reservas vitelinas. La vesícula vitelina localizada en el borde del tracto digestivo contiene dos tipos de reserva, el vitelo externo y el glóbulo de aceite interno. Durante este período, la circulación vitelina se establece por la presencia de una gran cantidad de vasos sanguíneos que rodean la vesícula y están ligadas cercanamente con la red de circulación del hígado. El periblasto absorbe el vitelo y una gran cantidad del glóbulo de aceite desde la eclosión hasta los primeros días después de la apertura de la boca, 2) endo-exotrófica, donde la larva todavía usa las reservas vitelinas pero inicia el proceso de alimentación; este proceso se caracteriza por la absorción del glóbulo de aceite, sin embargo no se lleva a cabo la síntesis ni liberación de lipoproteínas. La completa desaparición de la vesícula vitelina marca el fin de este período y 3) exotrófica, que inicia con la acumulación de glucógeno en el hígado, con la completa formación del tracto digestivo. Las actividades hepáticas, pancreáticas e intestinales de la larva son realizadas como en los adultos. En este período se observan dos tipos de inclusiones lipídicas en los hepatocitos, los primeros son las lipoproteínas de bajo peso molecular (VLDL) que tienen de 20 a 70 nm y los quilomicrones que tienen de 70 a 500 nm y los segundos, que probablemente sean triglicéridos de un diámetro mayor a 6 μm.
Los ácidos grasos absorbidos son reesterificados en el enterocito a triacilglicerol (TAG) y a fosfolípidos. Los lípidos reesterificados son incorporados en partículas de naturaleza lipoproteíca análogas a los quilomicrones de los mamíferos y a los VLDL (lipoproteínas de muy baja densidad). Estas lipoproteínas son transportadas hacia el hígado esencialmente por vía linfática, pero también por vía portal acopladas a la albúmina (carpa y trucha). Los lípidos que llegan al hígado de esta manera se acoplan con las apoproteínas y con el colesterol libre y esterificado para formar nuevas lipoproteínas (Guillaume et al., 2004; Verreth, 1999).
Especies planctónicas usadas como alimento vivo
Para asegurar el crecimiento de las larvas, la presa deberá cumplir con determinadas características como son: tamaño adecuado, movimiento lento, alta disponibilidad, apariencia y estímulo químico, lo que varía en función de la especie (Civera et al., 2004); además deberá cubrir los requerimientos nutricionales mínimos y ser de fácil digestión. La mayoría de las larvas de peces son cazadoras planctónicas sin importar los hábitos alimenticios que tendrán cuando sean adultas (Hunter, 1981).
Las larvas se caracterizan por tener una tasa de crecimiento muy alta. A medida que la larva crece, el tamaño de la comida debe crecer y es necesario adaptar rápidamente el tamaño del alimento al tamaño de la boca. El alimento natural presenta una alta diversidad, lo que da la oportunidad a las larvas para que puedan satisfacer sus requerimientos nutricionales y especialmente para que puedan escoger lo que necesitan (Verreth, 1999).
Para algunas especies la desventaja de una talla pequeña, puede ser compensada con el tamaño de la boca, el tipo de dentición o que las larvas se desarrollen donde exista una gran abundancia y diversidad de presas (Civera et al., 2004).
En cultivo, la ingestión de plancton se ha reducido a un pequeño número de presas como microalgas (2-20 μm), rotíferos (50-250 μm), nemátodos (Panagrellus redivivus; 0.2-2mm), crustáceos (artemia spp.; 200-500 μm), copépodos (Civera et al., 2004).
Las ventajas que presentan los copépodos comparados con los rotíferos y las artemias, son poseer los nutrientes esenciales que las larvas requieren, por lo que no necesitan ser enriquecidos; sin embargo, el inconveniente de estos es que presentan ciclos de vida largos, comparados con las demás especies usadas como alimento vivo (Civera et al., 2004; Shields et al., 1999).
Existen muchas experiencias y ensayos respecto a diferentes tipos de alimento vivo empleado, con resultados similares y/o antagónicos (Anguas et al., 2000; Lauff and Hoffer, 1984; O’Brien-MacDonald et al.), lo cual revela la dificultad de estandarizar las dietas basadas en él, ya que son muchos los aspectos adicionales que inciden en la especie a alimentar y la(s) especie(s) a emplear, encontrándose algunos reportes importantes de resaltar tales como:
En un estudio realizado en cabrilla arenera (Paralabrax maculatofasciatus) para determinar el momento adecuado para realizar la transición a una dieta seca, y su sobrevivencia sin el suministro de alimento vivo (Anguas et al, 2000) se observaron mejor sobrevivencia y crecimiento en larvas alimentadas con alimento vivo e iniciadas con pescado crudo que en larvas iniciadas con alimento inerte (Anguas et al, 2000).
Un estudio realizado por Lozano et al (Lozano et al., 2004) evaluaron el crecimiento de larvas de hurta (Pagrus auriga) alimentadas con artemia y con alimento inerte, a partir del día 20 después de la eclosión hasta el día 30 poseclosión, encontrando diferencias significativas (p<0.05) en ganancia de peso entre las larvas alimentadas con artemia y las alimentadas con pienso (2598.54 y 1121.88 μg respectivamente).
O’Brien-MacDonald et al. (2006), reportaron una cantidad significativamente alta en los niveles de enzimas digestivas para larvas de bacalao común (Gadus morhua) alimentadas con rotíferos enriquecidos con lípidos. Esto describe los niveles de actividad enzimática en el alimento vivo (rotíferos) y su potencial contribución a la funcionalidad digestiva de la larva de bacalao (Kurokawa et al., 1998). Se ha sugerido que las enzimas exógenas (presentes en el alimento vivo) compensan la deficiencia digestiva de las larvas ya sea digiriendo los nutrientes directamente o activando los zimógenos producidos por las larvas (Lauff and Hoffer, 1984). En larvas de Coregonus sp alimentadas con Moina sp, el 80% de la actividad de la tripsina se atribuyó a la presa, pero fue disminuyendo con el desarrollo de la larva a <20% (Lauff and Hoffer, 1984). Kurokawa et al. (1998) sugieren que las larvas no dependen de las enzimas exógenas para la digestión, pero indican que el alimento vivo estimula la secreción de enzimas digestivas desde el páncreas.
Ácidos grasos esenciales, poliinsaturados y altamente insaturados en larvas
Los lípidos son particularmente importantes en la nutrición del pez no sólo por la energía calórica proporcionada, ya que excede el valor proporcionado por el catabolismo de las proteínas (Verreth, 1999), sino por proveer ácidos grasos poliinsaturados (AGPI) y altamente insaturados (AGAI) requeridos para el normal funcionamiento de la membrana celular (Izquierdo et al., 1989; Sargent et al., 1995). Así mismo, son indispensables en los estadios tempranos de los peces ya que son la fuente principal de energía desde la formación de la gástrula hasta la eclosión del embrión (Vetter et al., 1983). Los AGAI de la serie 3 (w-3) mejoran el crecimiento y la sobrevivencia de las larvas de peces marinos (Izquierdo et al., 1992; Watanabe et al., 1989). La cantidad de ácidos grasos requeridos difiere de especie a especie, principalmente entre peces de agua dulce y peces marinos (Díaz, 2004).
Los ácidos grasos de mayor importancia a considerar en un estudio de requerimiento nutricional en larvas de peces son: AGAI w-3 y w-6, ácido docosahexaenóico (ADH, 22:6 w-3), ácido eicosapentaenóico (AEP, 20:5 w-3) y ácido araquidónico (AA 20:4 w-6). Estos ácidos grasos son esenciales ya que no pueden ser sintetizados por el organismo (Farndale B et al., 1999), aunque se ha detectado que una buena cantidad de peces tiene la capacidad de transformar el ácido linolénico en ADH y AEP; sin embargo, la velocidad a la cual convierten es demasiado baja para satisfacer los requerimientos durante el desarrollo larval (Sargent et al., 1995; Verreth, 1999). Otros peces dulce acuícolas son capaces de alargar y posteriormente desaturar ácidos 18:2 w-6 ó 18:3 w-3 (AGPI) responsables de funciones metabólicas atribuidas a los AGE (ácidos grasos esenciales), de hecho, para la mayoría de los peces, los AGAI tienen una mayor actividad de AGE que sus unidades básicas (18:2 w-6 ó 18:3 w-3) (Sargent et al., 1993).
El ADH tiene un alto valor biológico durante el desarrollo larval y es selectivamente incorporado dentro del tejido neural contribuyendo a la pigmentación, agudeza visual y órganos reproductivos (Díaz, 2004; Watanabe, 1993). El AEP juega un papel esencial en ciertas respuestas inmunológicas ya que está involucrado en la producción de eicosaniodes, que a su vez permiten la proliferación de células T y B. Las células T son las responsables de controlar la respuesta inmunológica, secreción de citocinas, necesarias para la liberación de anticuerpos (inmunoglobulinas) por parte de las células B, así como de reconocer y destruir patógenos (Fast et al., 2006; Secombes et al., 1994).
Los ácidos grasos son componentes que se encuentran en cantidades menores en peces marinos, excepto los de la serie w-3 (AGAI) que son ácidos grasos predominantes en el ambiente marino. Por lo mismo, la biomembrana de las células en peces contiene principalmente ácidos grasos de cadena larga (mayor o igual a 20 carbonos), tal es el caso de los AGAI, principalmente el ADH y AEP (Díaz, 2004).
En general, los peces dulceacuícolas de agua fría, muestran un requerimiento casi exclusivo para los AGAI de las series w-3 en su dieta, tal es el caso de los salmónidos, mientras que las especies dulceacuícolas de zonas cálidas, requieren ambas series de ácidos grasos altamente insaturados (tanto del tipo w-3 como del w-6) por ejemplo carpas y anguilas, o únicamente las series w-6 como es el caso de la tilapia. ADH y AEP son ácidos grasos esenciales para las especies marinas, debido a que estas no tienen o tienen muy poca actividad de Δ5 desaturasa, la cual es necesaria para convertir AGPI C-18 a cadenas largas de AGAI (Sargent et al., 1993).
Los requerimientos de AGAI w-3 son mayores en estados larvarios por el rápido crecimiento y el desarrollo temprano de células especializadas y tejidos. Estevez and Kanazawa, 1996; Izquierdo et al., 1989; Watanabe y Kiron, 1995) reportaron requerimientos de AGAI w-3 para 5 especies de larvas de peces marinos desde 1.2 - 3.9% de peso seco.
Takeuchi et al. (1994), estudiaron los requerimientos de AGAI en peces marinos y sugieren que ADH es más eficaz que AEP como promotor del desarrollo y sobrevivencia larval. Brinkmeyer and Holt (1998) en estudios con las larvas de corvina roja (Sciaenops ocellatus) alimentadas con una relación ADH/AEP de 3.78 encontraron gran resistencia al estrés por cambios de salinidad a diferencia de las larvas alimentadas con una baja relación entre dichos ácidos. Otros estudios han demostrado que una relación de 1.13 es suficiente para aumentar la sobrevivencia de las larvas (Watanabe et al., 1989). Takeuchi et al. (1991) mostrraron una mayor sobrevivencia y vitalidad en larvas de besugo (Pagellus bogaraveo) alimentadas con artemia enriquecidas con ADH (relación ADH/AEP=3,8) vs aquellas alimentadas con artemia enriquecida con AEP.
Las larvas dulceacuícolas a diferencia de las marinas necesitan mayores niveles de AEP que de ADH (Watanabe, 1993), esto se debe a que el ADH modula la respuesta del cortisol en procesos de osmoregulación.
El AA tiene un efecto en la sobrevivencia, siendo un importante promotor del crecimiento de larvas y post-larvas marinas, mejora la resistencia al estrés y aplicado en las proporciones óptimas junto al AEP y ADH se logra una normal metamorfosis y pigmentación de la piel (Estévez et al., 1997). En experimentos realizados con larvas de dorada (Sparus aurata) se observó una mayor sobrevivencia en larvas alimentadas con rotíferos enriquecidos con AA que con los rotíferos enriquecidos con ADH (Koven et al., 2001; Sargent et al., 1999), esto probablemente se deba a que el AA esta involucrado en la síntesis de eicosanóides con alta actividad biológica denominados serie-2 prostanoides y serie 4 leucotrienos y tromboxanos (Copeman et al., 2002; Estévez et al., 1997; Koven et al., 2001). Estos metabolitos están involucrados en varios procesos de regulación celular incluyendo el control de fluidos y el flujo de electrolitos, procesos de coagulación, anti-inflamación, sistema cardiovascular, funciones reproductivas, en la modulación de la transmisión en el sistema neural, el funcionamiento del hipotálamo y regulación del flujo sanguíneo cerebral (Bell et al., 1994; Sargent et al., 1997), así como la producción de hormonas involucradas en la metamorfosis y la pigmentación (Estévez et al., 1997).
Efectos adversos de los ácidos grasos altamente insaturados y sus proporciones en larvas de peces
El exceso, la deficiencia y la proporción entre los niveles de ácidos grasos, provocan crecimiento tardío, erosión de la aleta dorsal, degeneración del hígado, daño en las branquias combinado con sangrado y oscurecimiento de la superficie dorsal (Bell et al., 1996).
La deficiencia de la relación ADH/AEP produce anormalidades en el opérculo, afectando la morfología y funcionamiento biológico del pez (Bell et al., 1996; Han et al., 2000). El ADH es encontrado mayoritariamente en tejidos neurales de peces con pigmentación normal que en aquellos peces no pigmentados, bajos niveles en la dieta de ADH puede interferir en la síntesis de rodopsina en la retina (Bell et al., 1996; Copeman et al., 2002; Watanabe, 1993). Esta deficiencia puede interrumpir la transmisión desde la retina al sistema nervioso central de la señal requerida para accionar la producción de la hormona estimuladora de los melanóforos (MSH). Sin esta señal endocrina, la síntesis de melanina no puede continuar, dando como resultado deficiencias en la pigmentación (Estevez and Kanazawa, 1996).
Un desequilibrio en las proporciones AEP/AA, puede ocasionar estados de estrés generalizados en los peces, debido a la alta concentración de eicosanoides. Estos estados de estrés pueden influenciar deficiencias en el proceso de pigmentación y afectar funciones neurales (Lochman and Gatlin, 1993; Sargent et al., 1999), como en el caso del puye (Galaxias maculatus) un adelantamiento de este proceso, provoca una pigmentación deficiente (Copeman et al., 2002; Sánchez, 2005).
Es importante considerar que al manipular las proporciones AEP/ADH, indirectamente se estará modificando la proporción AEP/AA. Altos niveles de AEP pueden inhibir la producción de prostaglandinas a partir del AA por inhibición enzimática competitiva afectando el proceso de pigmentación, dado que EPA y AA compiten por la enzima ciclooxigenasa, involucrada en la síntesis de prostaglandinas (Lauff and Hoffer, 1984; Sargent et al., 1999). Por el contrario estudios realizados en larvas de lenguado japonés (Paralichthys olivaceus) se observó que una relación baja de AEP/AA (0.3) ocasiona problemas en la pigmentación, mientras que una relación AEP/ AA de 4.1 resulta benéfica para estas (Estevez et al., 2001). De lo anterior se concluye una relación negativa entre la cantidad de AA y la pigmentación (Bell et al., 2003), probablemente por que los eicosanoides metabolizados del ácido araquidónico (prostaglandinas E2 y F2), afecte la actividad de la tirosinasa, enzima esencial involucrada en la producción de melanina a partir de L-tirosina. (Slominski et al., 2004).
Conclusiones
Conociendo la complejidad que representa el período larvario y poslarvario en cuanto a la calidad y cantidad de los nutrientes necesarios que garan ticen la sobrevivencia, la nutrición celular y los procesos de desarrollo de las estructuras neuromotoras, se hace indispensable continuar investigando sobre especies que sirvan de alimento vivo, que brinden los nutrientes requeridos por las larvas para que se desarrollen adecuadamente haciendo que el porcentaje de sobrevivencia aumente.
Aunque las larvas de peces no están completamente desarrolladas al momento de la reabsorción del saco vitelino, estas se encuentran en capacidad de capturar y digerir a sus presas al momento de iniciar la alimentación exógena. Adicionalmente el consumo de éstas, estimula la producción de enzimas digestivas que permitirán una mejor diferenciación bioquímica, histológica y maduración de tracto digestivo.
Los lípidos además de ser fuente importante de energía, proveen los ácidos grasos, los cuales son constituyentes importantes de las membranas celulares, y ayudan a mejorar el crecimiento y la sobrevivencia de las larvas. Los ácidos grasos insaturados más importantes y que deben ser tenidos en cuenta para brindar a las larvas los nutrientes adecuados son el ADH, AEP y el AA, pues contribuyen a la formación del tejido neural, la pigmentación, la agudeza visual, al sistema inmunológico y al sistema cardiovascular entre otros.
Aunque todos los ácidos grasos insaturados son importantes para las larvas de peces, es importante tener en cuenta que los requerimientos entre las especies dulceacuícolas y las especies marinas varían. De igual manera se debe tener en cuenta que la relación entre los AGAI varía de una especie a otra, y se hace indispensable determinar el valor adecuado para cada especie, ya que un desequilibrio entre estos puede provocar efectos adversos en las larvas alimentadas.
Otras consideraciones
En el país, el ciclo biológico de muchas especies de interés comercial ha obtenido grandes avances en cuando al manejo de la reproducción en cautiverio; sin embargo, estos progresos han tenido un impacto relativamente exiguo, al no haberse obtenido igual éxito en el manejo de la larvicultura en especial para las especies que son dependientes de alimento vivo como primera dieta.
Con el fin de enfrentar los retos y las oportunidades comerciales que el TLC ofrece, se hace necesario garantizar una adecuada sobrevivencia de larvas de peces para consumo, para repoblamiento de cuencas y producción de ornamentales que fortalezcan y amplíen la cadena piscícola.
Se hace necesario cuantificar los ácidos grasos esenciales y determinar la proporción (AEP/AA), para lograr el mejor desarrollo de las larvas de cada especie que se vaya a producir.
Se hace necesario conocer el mecanismo de participación de los ácidos grasos en la pigmentación de la poslarva y su relación con la sobrevivencia.
Se deberá tratar de establecer una hipótesis sobre los mecanismos y procesos metabólicos lo más certero posible para relacionar el nivel de pigmentación en piel y posiblemente en retina, que permitan validar los hallazgos obtenidos por los diferentes investigadores
Referencias
Anguas B, Civera R, Contreras M, Rueda R, Guillaume J. Preliminary study on the timing of weaning of spotted sand bass (Paralabrax maculatofasciatus) larvae with a prepared diet: effects on growth and survival. J Appl Aquacult 2000; 10:11-15. [ Links ]
Bell J, McEvoy L, Estevez A, Shields R, Sargent J. Optimising lipid nutrition in first-feeding flatfi sh larvae. Aquaculture 2003; 227:211-220. [ Links ]
Bell M, McEvoy L, Navarro J. Deficit of docosahexaenoyl phospholipid in the eyes of larval sea bass fed an essential fatty acid deficient diet. J Fish Biol 1996; 49: 941-952. [ Links ]
Bell J, Tocher D, Sargent J. Effect of Supplementation whit 20 :3 -6, 20 :4 -6 and 20:5 -3 on the Production of Prostaglandins E and F of the 1-, 2- and 3- series in Turbot (Scopthalmus maximus) Brain Astroglial Cells in Primary Culture. Biochim Biophys Acta 1994; 1211:335-342. [ Links ]
Brinkmeyer R, Holt G. Highly unsaturated fatty acids in diets for red drum (Sciaenops ocellatus) larvae. Aquaculture 1998; 161:253-268. [ Links ]
Cahu C, Zambonino J and Takeuchi T. Nutritional components affecting skeletal development in fi sh larvae. Aquaculture 2003; 227:245-258. [ Links ]
Civera R, Alvarez C, Moyano F. Nutrición y alimentación de larvas de peces marinos. VII memorias del VII simposium internacional de nutrición acuícola. Hermosillo, Sonora, México. 2004. [ Links ]
Copeman L, Parrish C, Brown J, Harel M. Effects of Docosahexaenoic, Eicosapentaenoic, and Arachid onic Acids on the Early Growth, Survival, Lipid Composition and Pigmentation of Yellowtail Flounder (Limanda ferruginea): a Live Food Enrichment Experiment. Aquaculture 2002; 210:285-304. [ Links ]
Deplano M, Díaz J, Connes R, Kentouri-Divanach M, Cavalier F. Appearance of lipid absorption capacities in larvae of the sea bass Dicentrarchus labrax during transition to the exotrophic phase. Mar Biol 1991; 108:361-371. [ Links ]
Díaz N. Efecto de la relación EPA/ADH en larvas de Puye (Galaxias maculatus, Jenyns. 1842), cultivadas en diferentes salinidades. Universidad Católica de Temuco. Tesis de grado, Facultad de Acuicultura y Ciencias Veterinarias, Chile; 2004. 70 p. [ Links ]
Díaz J, Mani-Poset L, Blasco C, Connes R. Cytological detection of the main phases of lipid metabolism during early post-embryonic development in three telost species: Dicentrarchus labrax, Sparus aurata and Stizostedion lucioperca. Aquat Liv ing Resour 2002; 15: 169-178. [ Links ]
Estévez A, Ishikawa M, Kanazawa A. Effects of Arachidonic Acid on Pigmentation and Fatty Acid Composition of Japanese Flounder, Paralichthys olivaceus (Temminck and Schlegel). Centro de Experimentación en Acuicultura. Ribeira. La Coruña, Spain. Aquaculture Research. 1997; 28: 279-289. [ Links ]
Estevez A, Kaneko T, Seikai T, Tagawa M, Tanaka M. ACTH and MSH production in Japanese flounder (Paralichthys olivaceus) larvae fed arachidonic acid-enriched live prey. Aquaculture. 2001; 192: 309-319. [ Links ]
Estevez A, Kanazawa A. Fatty acid composition o neural tissues of normally pigmented juveniles of Japanese flounder using rotifer and Artemia enriched in -3 HUFA. Fish Sci 1996; 62: 88-93. [ Links ]
Fast M, Muise D, Easy R, Ross N, Johnson S. The effects of Lepeophtheirus salmonis infections on the stress response and immunological status of Atlantic salmon (Salmo salar). Fish & Shellfish Immunology 2006; 21: 228-241 [ Links ]
Farndale B, Bell J, Bruce M, Bromage N, Oyen F, et al. Dietary lipid composition affects blood leucocyte fatty acid compositions and plasma eicosanoid concentrations in European sea bass (Dicentrarchus labrax). Aquaculture 1999; 179: 335-350. [ Links ]
Gjellesvik D, Lombardo D, Walther B. Pancreatic bile salt dependent lipase from cod (Gadus morhua): purification and properties. Biochim Biosphys Acta 1992; 1124:123-134. [ Links ]
Govoni J, Boehlert G, Watanabe Y. The physiology of digestion in fish larvae. Environ Biol Fishes 1986; 16:59-77. [ Links ]
Guillaume J, Kaushik S, Bergot P, Metailler R. Nutrición y Alimentación de peces y Crustáceos. 1ra edición. Madrid España. Ediciones Mundi-prensa; 2004 [ Links ]
Han K, Geurden I, Sorgeloos P. Enrichment strategies for Artemia using emulsions providing different levels of -3 highly unsaturated fatty acids. Aquaculture. 2000, 183, 335-347. [ Links ]
Hunter J. Feeding ecology and predation of marine fish. In: Marine Fish Larvae: Morpholog, Ecology, and relation to fisheries. Ed. by R. Lasker. Washington sea grand program, Seattle.1981 p. 34-77. [ Links ]
Izquierdo M, Socorro J, Arantzamendi L, Hernández C. Recent advances in lipid nutrition in fish larvae. Fish Physiol Biochem 2000; 22: 97-107. [ Links ]
Izquierdo M, Arakawa T, Takeuchi R, Haroun R, Watanabe T. Effect of -3 HUFA levels in Artemia on growth of larval Japanese flounder (Paralicthys oliÍaceus) . Aquaculture 1992; 105: 73-82. [ Links ]
Izquierdo M, Watanabe T, Takeuchi T, Arawa T, Kitajima C. Optimal EFA levels in artemia to meet the EFA requirements of red seabream (Pargos major) Proc. 3rd int. Symp. Feeding and Nutrition in Fish. Toba (Japan). 1989. p 221-232. [ Links ]
Koven W, Barr Y, Lutzky S, Ben-Atia I, Weiss R, et. al. The Effect of Dietary Arachidonic Acid (20:4n-6) on Growth, Survival and Resistance to Handling Stress in Gilthead Seabream (Sparus aurata) Larvae. Aquaculture 2001; 193: 107-122. [ Links ]
Kurokawa T, Shiraishi M, Suzuki T. Quantification of exogenous protease derived from zooplankton in the intestine of Japanese sardine (Sardinops melanotictus) larvae. Aquaculture 1998; 161: 491-499. [ Links ]
Lauff M, Hoffer R. Proteolitic enzymes in fish development and the importance of dietary enzymes. Aquaculture 1984; 37: 335-346. [ Links ]
Lazo J, Holt G, Arnold C. Ontogeny of pancreatic enzymes in larval red drum (Sciaenops ocellatus). Aquaculture Nutr ition 2000; 6:183-192. [ Links ]
Lazo J. Conocimiento actual y nuevas perspectivas en el desarrollo de dietas para larvas de peces marinos. In: Cruz S, Ricque-Marie L, Tapia D, Olvera M, Civera R, (Eds.). Avances en Nutrición Acuícola V. Memorias del V Simposium Internacional de Nutrición Acuícola. 19-22 Noviembre, 2000. Mérida, Yucatá n, México.. [ Links ]
Lozano I, Plazuelo A, Cañavate J, Cárdenas S. Crecimiento con alimento vivo e inerte de larvas de Hurta, Pagrus auriga (Pisces : Sparidae), en cultivo masivo. CIVA, 2004: 446-455. [ Links ]
Lochman R, Gatlin D. Essential fatty acid requirement of juvenile red drum Sciaenops ocellatus. Fish Physiol Biochem 1993; 12: 2 [ Links ]
Merchie G, Lavens P, Storch P, Übel U, Nelis H, et al. Influence of dietary vitamin C dosage on rodaballo (Scophthalmus maximus) and European sea bass (Dicentrachus labrax) nursery stages. Comp Biochem Physiol 1996; 114:123-133. [ Links ]
Meza O, Benítez J, Paredes B, Gonzales M. Descripción histológica del sistema digestivo en larvas de Chirostoma humboldtianum en la primera alimentación exógena. CIVA, 2002: 313-322. [ Links ]
Meza O, Figueroa G. Crecimiento, Supervivencia y Desarrollo mandibular en Larvas del Pez Blanco Chirostom humboldtianum (Valenciennes) (Atheriniformes: Atherinopsidae), bajo condiciones de Laboratorio. CIVA, 2002: 606-616 [ Links ]
O’Brien-MacDonald K, Brown JA, Parrish CP. Integrating growth, behavior and digestive enzyme activity in larval Atlantic cod (Gadus morhua): response to rotifer lipids. ICES Mar Sci 2006; 63:275-284. [ Links ]
Ostaszewska T. The sequential differentiation and formation of hepatic and pancreatic structures in asp (Aspius aspius L.) LARVAE Electronic Journal of Polish Agricultural Universities, Fisheries. 2002; 5, Issue 1. Available Online http://www.ejpau.media.pl 2002. [ Links ]
Panush R, Delafuente J. Vitamins and Immunocompetence. World Review of Nutrition and Dietetics 1985; 45: 97-132. [ Links ]
Sánchez J. Efecto del acido araquidónico (20:4n-6) en la pigmentación, parámetros productivos e índice de anguiliformidad del puye (Galaxias maculatus, Jenyns, 1842). Tesis de grado. Facultad de Recursos Naturales, Escuela de Acuicultura, Universidad católica de Temuco, Chile, 2005. 71p. [ Links ]
Sánchez M, Ortiz J, Cárdenas S, Sarasquete C. Organogénesis larvaria de la hurta, Pagrus auriga: aproximación histológica e histoquímica del tracto digestivo. En: Libro de Resúmenes del X Congreso Nacional de Acuicultura, Gandía (Valencia). 2005. Editorial de la Universidad Politécnica de Valencia, p. 426-427. [ Links ]
Sarasquete M, Polo A, Yufera M. Histology and histochemistry of the development of the digestive system of larval gilthead seabream, Sparus aurata L. Aquaculture 1995; 130:79-92. [ Links ]
Sargent J, Bell J, Bell M, Henderson R, Tocher D. The metabolism of phospholipids and polyunsaturated fatty acids in fish. In: aquaculture fundamental and applied research. Coastal and Estuarine Studies. (Lahiou B & Vitiello P. eds) American Geophysical union. Washington D.C. 1993; 43:103-124. [ Links ]
Sargent J, Bell J, Bell M, Henderson R, Tocher D. Requirement criteria for essential fatty acids. J Appl Ichthyol 1995; 11:183-198. [ Links ]
Sargent J, Bell J, Bell M, Henderson R, Tocher D. Evolution and roles of (-3) polyunsaturated fatty acids in marine organisms in: phospholipids: characterization metabolism and Novel Biological Applications 1995. Pp. 248-259. AOCS Press. Champaign ll. [ Links ]
Sargent J, Bell J, McEvoy L, Tocher D, Estevez A. Recent developments in the essential fatty acid nutrition of fish. Aquaculture 1999; 177:191-199. [ Links ]
Sargent J, McEvoy L, Bell J. Requirements, presentation and sources of polyunsaturated fatty acids in marine fish larval feeds. Aquaculture 1997; 155: 117-127. [ Links ]
Secombes C, Clements K, Ashton I, Rowley A. The effect of eicosanoids on rainbow trout (Oncorhynchus mykiss), leucocyte proliferation. Vet. Immunol. Immunopathol. 1994; 42:367-378. [ Links ]
Segner H, Rosch R, Schmidt H, Von Poeppinghausen K. Digestive enzymes in larval Coregonus lavaretus L J Fish Biol 1989; 35:249-263. [ Links ]
Shields R, Bell J, Luizi S, Gara B, Bromage N, et. al. Natural copepods are superior to enriched Artemia nauplii as feed for Halibut larvae (Hippoglossus hippoglossus) in terms of survival, pigmentation and retinal morphology: Relation to dietary essential fatty acids. J Nutr 1999; 129:1186-1194 [ Links ]
Slominski A, Tobin DJ, Shibahara S, Wortsman J. Melanin pigmentation in mammalian skin and its hormonal regulation. Physiol Rev 2004; 84:1155-1228. [ Links ]
Smith L. Digestive Functions in Teleost Fishes In Fish Nutrition. J. Halver (Ed.) Academic Press, Inc. London; 1989. p 332-422. [ Links ]
Takeuchi T, Toyota M, Watanabe T. Dietary value to red sea bream of Artemia nauplii enriched with EPA and DHA. Abstracts of the Annual Meeting of Japanese Society of Scientific Fisheries, Tokyo, 1991; p. 243. [ Links ]
Takeuchi T, Feng Z, Yoseda K, Hirokawa J, Watanabe T. Nutritive value of DHA-enriched for larval cod. Nippon Suisan Gakkaishi 1994; 60:641-652. [ Links ]
Verreth J. I curso internacional sobre nutrición de larvas de peces. Universidad de Antioquia. Medellín, Marzo 15-17. 1999. [ Links ]
Vetter R, Houdson R, Arnold C. Energy metabolism in a rapidly developing marinefish eggs the red drum Scienops ocellata. Can J Fish. Aquat Sci 1983; 40: 627-634. [ Links ]
Vu T. Etude histoenzymologique des activities proteasiques dans le tube digestif des larves et des adultes de bar, Dicentrarchus labrax (L). Aquaculture 1983; 32: 57-69. [ Links ]
Watanabe T, Izquierdo M, Takeuchi S, Kitajima C. Comparison between eicosapentaeoic acid and docosahexaenoic acid in terms of essential fatty acid efficacy in larval red sea bream. Nippon Suisan Gakkaishi 1989; 55: 1635-1640. [ Links ]
Watanabe T. Importance of docosahexaenoic acid in marine larval fish. J World Aquaculture Soc 1993; 24: 152-161. [ Links ]
Watanabe T. Histological changes in the liver and intestine of freshwater goby larvae during short-term starvation. Bull Jpn Soc Sci Fish. 1985; 51: 707-709. [ Links ]
Watanabe T, Kiron V. Red sea bream Pagurus major. En: Bromage, N.R., Roberts, R.J. Eds., Broodstock Management and Egg and Larvae Quality. Blackwell, Cambridge, MA. 1995; p 398-413. [ Links ]
Watanabe T, Sawada N. Larval development of digestive organs and intestinal absorptive functions in the freshwater goby Chaenogobius annularis. Bull. Tohoku Reg Fish Res Lab 1985; 37:1-10. [ Links ]
Zambonino J, Cahu C. Ontogeny of gastrointestinal tract of marine fish larvae. Comparative Biochemistry and Physiology 2001; 130:477-487. [ Links ]