Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.22 no.4 Medellín Oct./Dec. 2009
Interacción de los suelos sulfatados ácidos con el agua y sus efectos en la sobrevivencia del bocachico (Prochilodus magdalenae) en cultivo¤
Interaction of acid sulphate soils with water and its effects on the survival of bocachico (Prochilodus magdalenae)
Interação dos solos sulfatados ácidos com a água e seus efeitos na sobrevivência do bocachico (Prochilodus magdalenae) em cultivo
Sandra C Pardo Carrasco, PhD1*; Héctor Suárez Mahecha, PhD2, Profesional en Acuicultura; Vicente M Pertuz Buelvas3, Esp.
1FCA/DPA, Universidad Nacional de Colombia, Sede Medellín. Carrera 59ª#63-20 Bloque 50 oficina 313, tel 4309044. 2Universidad Nacional de Colombia, Sede Bogotá. Carrera 59ª #63-20, Bloque 52 oficina 306, tel 4309146. 3FMVZ/DCA/Centro de Investigación Piscícola de la Universidad de Córdoba, Carrera 6 #76-103 Montería.
(Recibido: 15 agosto, 2008; aceptado: 28 julio, 2009)
Resumen
La acuicultura en zonas costeras crece rápidamente y para la construcción de estanques se utilizan mangles, ciénagas y humedales. En la construcción, el suelo es excavado y usado como material para la conformación de los diques, originando frecuentemente la exposición de suelos sulfatados ácidos (SSA) que poseen extrema acidez, porcentaje de saturación menor de 50% y aluminio intercambiable mayor de 5 Cmol+Kg-1 de suelo. Cuando este suelo es expuesto al aire, la pirita de hierro (FeS2) se oxida (FeSO4) liberando H2 SO4, cuya disociación en el agua reduce el pH a valores inferiores a 4. Los SSA pueden tener pH de 5 a 7 cuando permanecen inundados, pero si son drenados y expuestos al aire, este puede disminuir a 2 o 3. En el municipio de Cotorra (Córdoba), fue construido un estanque (1.5ha) removiendo y exponiendo suelo. Posteriormente fue inundado con agua de un humedal (pH 6.5; OD 3 mg/l; alcalinidad 120 mg/l) y sembrados 10.000 alevinos de bocachico. Una hora después, todos los peces habían muerto. Con el objetivo de determinar la posible causa de muerte, fueron analizados suelo, agua y branquias. El análisis de suelo revela un SSA con pH ácido, alto contenido de materia orgánica, niveles altos de S, Fe, y Mn. El análisis de agua muestra un pH letal para la mayoría de peces, Fe, Al y CO2 por encima de máximos aceptables. En branquias fue encontrada alteración microcirculatoria en lamelas branquiales. Se sugiere que la causa de muerte de los bocachicos fue la acidez del agua, debido a la inhibición del intercambio Na+/H+ en las branquias por el exceso de H+ y de Al+, afectando la permeabilidad del epitelio branquial incrementando la pérdida de iones alterando todavía más la osmoregulación. Es evidente que los SSA absorben y liberan nutrientes, intercambiando sustancias con el agua afectando su calidad.
Palabras clave: bocachico, pH, Prochilodus magdalenae, suelos sulfatados ácidos.
Summary
Aquaculture in coastal areas grows rapidly. For fish ponds construction, soil is dug and used as material for the conformation of dikes, frequently originating the exposure of Acid Sulphate Soils (ASS) containing extreme acidity, a saturation percentage less than 50% and exchangeable aluminum higher than 5 Cmol+Kg-1. When ASS is exposed to air, iron pyrite (FeS2) oxidizes (FeSO4) and produces H2SO4 whose dissociation in water reduces pH values inferior to 4. Flooded SSA may have a pH between 5 and 7; nevertheless, when they are drained and exposed to air pH drops to 2 or 3. A 1.5ha pond was built in the municipality of Cotorra (Córdoba), removing and exposing soil. Then, it was flooded with wetland water (pH 6.5; OD 3 mg/l; alkalinity 120 mg/l) and cultured with 10.000 bocachico alevins; an hour later, all fish were dead. In order to determine the possible cause of death, soil, water and gills were analyzed. The soil analysis showed an ASS with acid pH, high content of organic matter and high levels of S, Fe and Mn. Water analysis showed a lethal pH for most of the fish; likewise Fe, Al and CO2 levels were above acceptable maximum. Microcirculatory alteration in gill’s lamellar was found. It is suggested that the cause of death of bocachicos was the acidity of water due to the Na+/H+ exchange inhibition in gills caused by H+ and Al+ excess. This situation affected the permeability of gill epithelium increasing the loss of ions and the alteration of osmoregulation. It is evident that ASS absorb and release nutrients, exchanging substances with water and, this way, affecting their quality.
Key words: pH, Prochilodus magdalenae, pyrite oxidation, sulfate soil acids.
Resumo
A aqüicultura nas zonas costeiras cresce rapidamente e para a construção de estanques utilizamse manguezais pantanais e banhados. Na construção, o solo é escavado e usado como material para a conformação dos diques, originando freqüentemente a exposição de solos ácidos (SSA) que possuem extrema acidez, porcentagem de saturação menor ao 50% e alumínio intercambiável maior de 5 Cmol+Kg-1 de solo. Quando este solo é exposto ao ar, a pirita de ferro (FeS2) oxida-se (FeSO4) liberando H2SO4, o qual ao dissociar-se na água reduz o pH a valores inferiores de 4. Os SSA podem ter pH de 5 a 7 quando permanecem inundados, mas, sim são drenados e expostos ao ar, podem diminuir a 2 ou 3. No município de Cotorra (Córdoba), foi construído um estanque (1.5ha) removendo e expondo o solo. Posteriormente foi inundado com água de um pântano (pH 6.5; OD 3 mg/l; alcalinidade 120 mg/l) e foram plantados 10.000 alevinos de bocachico. Uma hora depois, todos os peixes morreram. Com o objetivo de determinar a possível causa de morte, foram analisados: o solo, a água e as brânquias. A análises do solo revela um SSA com pH ácido, alto conteúdo de matéria orgânica e níveis altos de S, Fe e Mn. A análises da água mostra um pH letal para a maioria de peixes, Fe, Al e CO2 por acima dos máximos permitidos. Nas brânquias foram encontradas alterações microcirculatória em lamelas branqueais. Sugere-se que a causa de morte dos bocachicos foi a acidez da água, devido à inibição do intercambio Na+/H+ nas brânquias por excesso de H+ e de Al+, afetando a permeabilidade do epitélio branquial incrementando a perda de íons, alterandomais a osmoregulação. É evidente que os SSa absorvem e liberam nutrientes, intercambiando sustâncias com a água afetando a qualidade.
Palavras chave: bocachico, pH, Prochilodus magdalenae, solos sulfatados ácidos.
Introducción
El departamento de Córdoba en Colombia ha sido pionero en la formación de recurso humano para la acuicultura, con fortaleza en la producción de semilla de peces nativos de la cuenca del río Sinú. Las especies más importantes han sido hasta el momento, bocachico Prochilodus magdalenae, dorada Brycon sinuensis y blanquillo Sorubim cuspicaudus. El destino de esta semilla producida en cautiverio ha sido predominantemente para los programas de repoblamiento que se realizan en la región, pero una parte ha sido dedicada a la producción piscícola en sistemas extensivos de producción, utilizando estanques construidos como abrevaderos de ganado o al interior del complejo cenagoso del Bajo Sinú con ayuda de taludes artificiales.
En la producción acuícola el agua recibe especial atención, ya que es esta el medio en el cual el pez satisface, entre otras, las necesidades de intercambio gaseoso y de intercambio iónico para el mantenimiento de la presión osmótica (Baldisserotto, 2002). Por estas necesidades fisiológicas, es tan importante el mantenimiento de la calidad de agua del cultivo dentro de los parámetros ideales para cada especie en particular (Wedemeyer, 1996).
De otra parte el suelo, además de proporcionar el material de construcción del estanque, también absorbe y libera nutrientes interactuando con el agua e influyendo en su calidad y es considerado el laboratorio químico del estanque (Hickling, 1974), por esta razón debe ser analizado de forma paralela al agua.
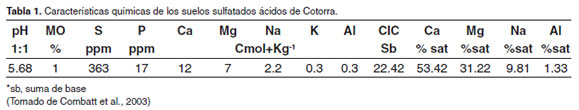
Los suelos sulfatados ácidos (SSA) son aquellos que poseen extrema acidez, porcentaje de saturación menor de 50% y aluminio intercambiable mayor de 5 Cmol(+)kg-1 de suelo (Dent, 1986), esta acidez es desarrollada naturalmente como resultado de cambio en los niveles hidrológicos (Combatt et al., 2003). En el departamento de Córdoba existen aproximadamente 20.000 Ha con SSA (Combatt, 2004), no recomendadas para las actividades agrícolas y pecuarias, por existir condiciones químicas muy adversas como son: alta acidez, alto contenido de aluminio, formación de sales tóxicas y principalmente rangos excesivos de azufre que evitan el normal desarrollo de los cultivos. La formación geológica de estos suelos es fluvio lacustre con muchos complejos cenagosos, encontrándose subórdenes de suelos sulfatados ácidos como los sulfaquents, sulfaquepts (Combatt et al., 2003). El municipio de Cotorra está situado en la parte noroeste del departamento de Córdoba, en el bajo Sinú, (9°; 03´49´´ de Latitud Norte y 75°; 45´49´´ de Longitud Oeste), próximo al Complejo Cenagoso del Bajo Sinú, con una altura sobre el nivel del mar de 50m y de acuerdo con Combatt et al (2003) en este lugar se encuentran SSA (Tabla 1). Gran parte de sus suelos fueron parte de los humedales del Complejo Cenagoso del Bajo Sinú, que hoy son playones ricos en materia orgánica. Esta desecación se debió a la construcción de canales de drenaje que recogen las aguas en todo el territorio y son llevadas al Complejo Cenagoso del Bajo Sinú.
La acuicultura en zonas costeras se está expandiendo rápidamente suministrando alimento y generando empleo. Ambientes aluviales y de deltas han sido tradicionalmente considerados disponibles para la construcción de estanques para peces (Macintosh, 1982), por esta razón estanques nuevos son construidos en muchos países tropicales utilizando áreas de mangle y humedales, trayendo problemas debido a los suelos ácidos sulfatados. A causa de estos suelos, millones de hectáreas de tierras en la zona costera son inadecuadas para el cultivo de peces. La mayoría de estos suelos contienen pirita de hierro que cuando es expuesta al aire se oxida liberando ácido sulfúrico. Los SSA cuando permanecen inundados y reducidos pueden tener un pH entre 5 y 7, pero cuando son drenados y expuestos al aire, el pH puede caer a 2 o 3 (Combatt et al., 2003; Enserink et al., 1991; Fleming and Alexander, 1961). Los problemas en piscicultura relacionados con suelos ácidos son bajo crecimiento, baja sobrevivencia, baja productividad y muerte aguda de peces ocurrida por un incremento en las concentraciones de aluminio y manganeso tóxicos (Boyd and Zimmermann, 2000). Los metales presentes en el suelo son liberados en el agua, y dependiendo del pH de la misma y de la interacción con otros iones pueden causar toxicidad en los peces, interfiriendo directamente sobre los procesos fisiológicos de intercambio gaseoso e iónico (Carvalho and Fernandes, 2006).
En un teleósteo típico el sistema respiratorio consiste de las cavidades bucal y opercular y las branquias suspendidas entre ellas. La ventilación es proporcionada por la expansión y contracción coordinada de las cavidades bucales y operculares, que operan como una doble bomba, proporcionando un constante flujo de agua entre las branquias. Por su estructura anatómica, la branquia proporciona una gran superficie para el movimiento de oxígeno, CO2, electrolitos, agua, amonio e hidrogeniones entre la sangre y el agua (Heath, 1995), constituyéndola como la superficie expuesta más delicada del pez. Por esta razón es de vital importancia garantizar parámetros de calidad de agua dentro de los rangos ideales para cada especie.
De otra parte, la osmoregulación se refiere al proceso por medio del cual la presión osmótica de los fluidos corporales y el volumen del agua en el pez, se mantienen relativamente constantes. Esta presión osmótica de la sangre en peces es proporcionada por sales inorgánicas. En peces de agua dulce la concentración de sales interna es mayor que la del medio externo, debiendo excretar el agua ganada por ósmosis a través de la producción de orina altamente diluida (5 ml/kg/h) (Heath, 1995). La pérdida de iones por difusión branquial, por la piel y en parte por la orina, debe ser recuperada por transporte activo desde el agua hacia la sangre, a través de las células del cloro ingresa sodio y cloro intercambiándolos por amonio, hidrogeniones, bicarbonato y otros productos de desecho (Payan and Girard, 1984).
En virtud de todo lo anteriormente expuesto, es importante determinar la interacción de los SSA sobre la calidad del agua y los efectos sobre los tejidos de los peces, en especial en el aparato branquial. Por lo tanto, y ante la muerte repentina de unos alevinos de bocachico cultivados en estanques en el municipio de Cotorra, Córdoba, se realizó el presente estudio para determinar la causa de muerte y contribuir con el desarrollo de la piscicultura en el departamento.
Materiales y métodos
Al laboratorio de Sanidad Acuícola del Centro de Investigación Piscícola de la Universidad de Córdoba (CINPIC), fue reportada una mortalidad del 100% de alevinos de bocachico Prochilodus magdalenae una hora después de haber sido sembrados en un estanque localizado en la vereda Puerto Grande del municipio de Cotorra, departamento de Córdoba (9°02´42.21” N, 75°46´41.18” W y 366.6 msnm). El estanque fue construido cerca de un humedal de forma excavada, es decir que para levantar los taludes se extrajo material del fondo y se colocó en forma de talud.
En 200 litros de agua llevados al CINPIC por el productor, el cual se denominó “agua problema”, se realizó un bioensayo para observar los efectos sobre los peces, estudiar las lesiones tisulares en branquias e intentar dilucidar la causa de muerte de los bocachicos, así como para hacer un análisis completo de la misma. También fueron tomadas muestras de suelo del fondo y del talud del estanque problema para su análisis en el laboratorio de suelos de la Universidad de Córdoba.
Bioensayo
En nueve acuarios de vidrio con capacidad total de 40 litros fueron desarrollados tres tratamientos con tres réplicas de la siguiente forma: Tratamiento 1 (T1): 100% agua problema; Tratamiento 2 (T2): 50% agua problema 50% agua CINPIC; y Tratamiento 3 (T3): 100% agua CINPIC. El agua del CINPIC fue captada directamente del río Sinú cerca a la Universidad de Córdoba. El T3 fue un control negativo, siendo que el agua CINPIC es la usada para la producción de alevinos, sin problema alguno, y las concentraciones T1 y T2 fueron definidas en virtud del desconocimiento total, tanto de los tóxicos presentes en el agua problema como a sus concentraciones.
Los alevinos de bocachico utilizados en el bioensayo provinieron de reproducción en cautiverio realizada en el CINPIC (el mismo origen de los alevinos del piscicultor) con 1.1 ± 0.3 g de peso y 3.9 ± 0.45 cm de longitud total. En cada réplica fueron colocados 10 peces en 20 litros de agua sin aireación, para mantener similares condiciones de oxigenación a las del estanque del agua problema. Se tomó una muestra de agua de cada uno de los tratamientos al iniciar el experimento y se envió para su análisis al Instituto Regional de Aguas (IRAGUAS) de la Universidad de Córdoba. Al laboratorio de ictiopatología del Instituto de Acuicultura de la Universidad de los Llanos (IIAL) fueron enviadas cuatro muestras de branquias de peces así: Muestra 1 (M1) constituida por cinco peces del lote que se usó en el experimento, en la hora cero, para verificar la condición de partida de los peces; Muestra 2 (M2), constituida por cinco peces muertos 70 minutos después de iniciado el T1; Muestra 3 (M3), constituida por cinco peces muertos 120 minutos después de iniciado el T2 y Muestra 4 (M4), constituida por dos peces sobrevivientes a las 24 horas del T2 pero en mal estado, sin reflejo de huida, fijados con solución acuosa de formol al 3.7% (100 ml de formol 37%, 900 ml agua destilada, 4 g de fosfato de sodio monobásico y 6.5 g de fosfato de sodio dibásico). Los peces sobrevivientes moribundos de M4 fueron tranquilizados, antes de ser fijados, sumergiéndolos en agua a 5 °C y posteriormente fueron demedulados con un corte dorsal y caudal al opérculo (Eslava et al., 2007).
Resultados
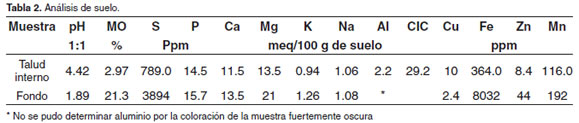
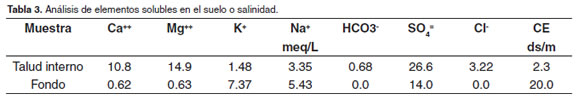
Los resultados de los análisis de las muestras de suelo aparecen descritos en las tablas 2 y 3. Es importante resaltar el bajo valor de pH en el suelo (1.89 - 4.42), así como el alto contenido de Fe (364 y 8032 ppm), Zn (44 ppm), Mn (192 ppm) y de S (789 – 3894 ppm). El contenido de Al no pudo ser determinado en la muestra del suelo por la coloración oscura de la misma, pero el valor encontrado en el talud interno indica que este puede ser también alto en el fondo del estanque. Sobre los elementos solubles llama la atención el SO4= por su alto contenido a diferencia del HCO3-y de Cl-que aparecen ausentes en el fondo del estanque.
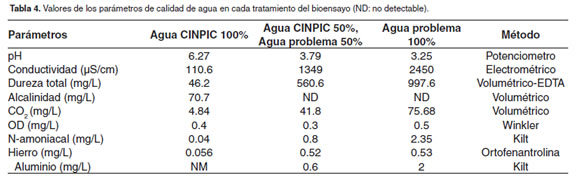
En la tabla 4 aparecen descritos los resultados de los análisis de agua en cada tratamiento. Es de resaltar en el agua problema el bajo pH, los altos contenidos de CO2, aluminio, hierro, dureza y conductividad. Es importante también resaltar los valores no detectables de alcalinidad.
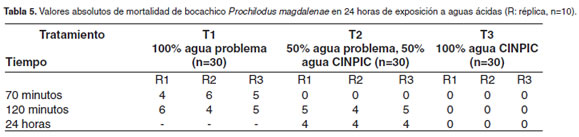
En la tabla 5 se muestra la mortalidad absoluta que fue registrada en cada réplica de los 3 tratamientos. En T1 y T2 a los 30 minutos de haber iniciado el bioensayo los peces se encontraron en la superficie con manifiestos signos de angustia respiratoria, a diferencia de los de T3 que se encontraban en el fondo del acuario. En el T1, 70 minutos después ocurrió el 50 ± 10% mortalidad y 120 minutos después el restante 50 ±10%. En T2 a los 120 minutos había el 46 ± 5.7% de mortalidad y en 24 horas 40 ± 0.0% de mortalidad. Para T3 la mortalidad fue de 0% 24 horas después, cuando se cerró el experimento.
Los resultados de mortalidad fueron analizados con medidas repetidas considerando dos factores, el primer factor fue los tratamientos y el segundo factor, los tres tiempos en los cuales se registró mortalidad sobre las mismas unidades experimentales (70 minutos, 120 minutos y 24 horas). Mediante un modelo mixto que incluyó efectos fijos y aleatorios; se ajustó la estructura de covarianzas y se estimaron los errores estándar más adecuados para las diferentes comparaciones; previamente se hizo una transformación angular para la variable, respuesta. El posterior análisis de varianza se hizo tal y como sucede en todos los experimentos cuyos tratamientos incluyen una estructura factorial. El análisis indicó diferencia estadística entre los tratamientos (p<0.01) (SAS 9.0).
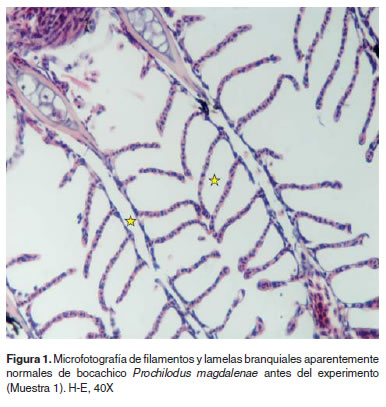
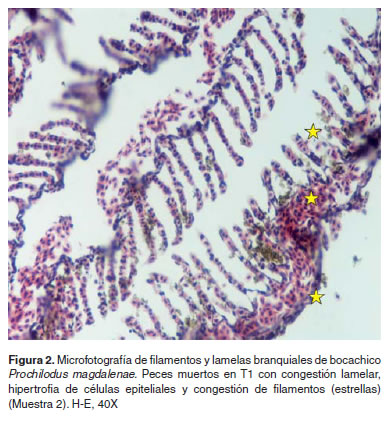
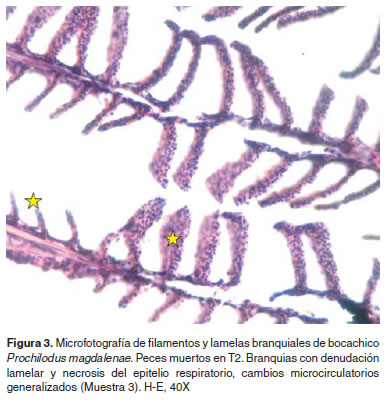
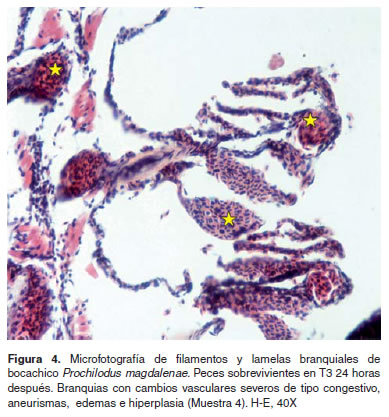
Los resultados de histopatología branquial fueron los siguientes: La M1 presentó branquias con una estructura aparentemente normal (Figura 1). En M2 branquias con congestión lamelar y acúmulo de pigmentos en algunas lamelas a nivel subepitelial, en algunos casos los pigmentos son supraepiteliales. Se hallaron aneurismas así como hipertrofia de células epiteliales y congestión severa de los filamentos (Figura 2). En la muestra M3 se encontraron branquias con áreas de denudación lamelar y necrosis del epitelio respiratorio, congestión y cambios microcirculatorios generalizados y necrosis de algunas células epiteliales (Figura 3). En M4 se observaron cambios vasculares severos de tipo congestivo en las lamelas, así como pequeños aneurismas (este patrón microcirculatorio es más notorio como cambio morfológico), igualmente necrosis y edemas aislados en células epiteliales con algunos cambios hiperplásicos de las mismas (Figura 4).
Discusión
Suelo
Los resultados de las tablas 2 y 3 ponen en evidencia la presencia de SSA, pH extremadamente bajo, así como valores altos de aluminio, hierro y manganeso. El análisis de fondo del estanque mostró pH de 1.89, valor extremadamente bajo para el cultivo de peces. Es recomendado que el pH del suelo esté por encima de 6 para lo cual se utiliza la aplicación de cal agrícola, siempre y cuanto el valor a corregir no sea inferior a 4 (Tacon, 1989; Vinatea, 2004), de ser así, se consideran suelos inservibles para la acuicultura, la cantidad de cal que debería ser aplicada hace demasiado costosa esta operación, según Tacon (1989) las recomendaciones de corrección de pH con cal agrícola inician con pH por encima de 4.
De acuerdo con las recomendaciones de la Comisión para la Fertilidad del Suelo (NRS-SBCS, 1995) los requerimientos del suelo para la vida acuática deben ser menores a 17.0 ppm de hierro y pH mayor a 4.5. En el caso del presente estudio, los valores de hierro para los dos suelos analizados en el estanque fueron de 364 y 8032 ppm, muy superiores a los requeridos para que la vida acuática se desarrolle sin problemas. El pH en ambos casos se constató menor a 4.5, especialmente en el suelo del fondo del estanque que fue de 1.89.
La acidez en los suelos de estanques de agua dulce es, generalmente, debida a la gran cantidad de iones de aluminio ligados a los cationes intercambiables (Boyd and Zimmermann, 2000), en el presente estudio esta situación es sin duda alguna debida a la presencia de SSA. Los estanques para acuicultura de agua dulce construidos en áreas que antiguamente estuvieron cubiertas por salinas, mareas de agua salada o pantanos siempre contienen pirita de hierro (FeS2) y son altamente ácidos. Mientras los sedimentos que contienen pirita se encuentren sumergidos y en condiciones relativamente anaeróbicas, permanecen reducidos y experimentan pocos cambios químicos. Sin embargo, si éstos son drenados y expuestos al aire, ocurre una oxidación que acabará formando ácido sulfúrico (ácido fuerte, H2SO4), tal como se muestra en las siguientes ecuaciones:
FeS2 + H2O + 3.5 O2 → FeSO4 + H2SO4
2FeSO4 + 0.5 O2 + H2SO4 → Fe2(SO4)3 + H2O
FeS2 + 7Fe2(SO4)3 + 8H2O → 15 Fe2SO4 + 8H2SO4 (45).
La disociación del H2SO4 en el agua libera hidrogeniones reduciendo el pH a valores inferiores a 4 (Singh, 1981). De acuerdo con Vinatea (2004) estos valores son letales para la mayoría de los peces. Boyd et al (2002) recomiendan no usar SSA para acuicultura si existen otras alternativas
El potencial que un suelo ácido-sulfático posee para la producción de ácido, depende en gran medida de la cantidad y tamaño de partícula de la pirita, de la presencia o ausencia de bases intercambiables y carbonatos con la cantidad de pirita, el intercambio de oxígeno y solutos con la pirita y la abundancia de Thiobacillus (bacterias) (Vinatea, 2004). En el agua problema no fueron detectados valores de alcalinidad, por lo que el efecto buffer que los carbonatos y bicarbonatos pudiesen otorgar, prácticamente, no existió en ese estanque. En el suelo tampoco fueron encontrados bicarbonatos ni cloruros.
De acuerdo con Morales et al (Morales et al., 1992), la reducción microbiana de los iones sulfatados para sulfuros depende del potencial redox del sedimento y del pH predominante. No llegan a producirse grandes cantidades de sulfuros cuando el potencial redox está por encima de -150 mV o a valores de pH entre 6.5 a 8.5. Los valores del potencial redox pueden variar entre 400 y 700 mV en sedimentos al aire libre (oxidados) y entre -250 y -300 mV en los sumergidos en agua (reducidos). Aunque en este estudio no fue medido el potencial redox en el suelo para determinar si las condiciones eran de oxidación (aeróbicas) o de reducción (anaeróbicas), el color de la muestra (negra) indica un suelo reducido (Boyd, 2000) y el color resulta de la presencia de hierro (Booth et al., 1988). Es bueno recordar que si el sedimento del estanque de cultivo tiene altos niveles de hierro ferroso (Fe+2), inclusive con potenciales redox muy bajos, el H2S no llegará a formarse pues el componente ionizado S-2 reaccionará con el Fe+2 para formar sulfuro de hierro (FeS2), el cual es inerte y se precipita rápidamente; de hecho, uno de los tratamientos en acuicultura para aguas con abundante H2S es aplicar suelos ricos en hierro para que reaccione con el S y forme pirita (FeS2) (Lahav et al., 2004).
El contenido de materia orgánica en el suelo del fondo del estanque fue superior al 21%, muy alto considerando que la descomposición de ésta es uno de los procesos que más afectan la producción de peces. Si este proceso ocurre anaeróbicamente, se forman compuestos potencialmente tóxicos como sulfuro de hidrógeno. De acuerdo con Boyd et al (2002) los suelos orgánicos tienen un 15 a 20% de carbono, con contenidos de materia orgánica entre 30 y 40%, no siendo apropiados por lo que deben ser evitados para acuicultura. Concluyen que contenidos de 10% de materia orgánica son perfectamente aceptables siempre y cuando esta sea lábil, pero siendo refractaria, debe ser inaceptable. El análisis de materia orgánica no indicó si esta era lábil o refractaria.
Calidad del agua
El experimento, en los tres tratamientos, transcurrió con agua hipóxica. El agua CINPIC se toma así del afluente (río Sinú) y solamente cuando se usa en el laboratorio de reproducción se sedimenta, filtra y airea para mejorar los niveles de oxígeno disuelto. En los estanques en tierra se usa tal cual; allí con el tiempo mejora por el aporte fotosintético y por la difusión atmosférica de oxígeno. Ahora, el agua problema traía esa concentración de oxígeno disuelto y fue necesario mantener dichas características para no alterar las interacciones con los demás parámetros fisicoquímicos.
En el presente estudio varios parámetros de calidad de agua se encontraron fuera de los rangos establecidos para el cultivo de peces de agua dulce. En primer lugar el pH en el agua problema fue 3.25, valor extremadamente bajo, considerando específicamente que para alevinos de Prochilodus lineatus Zaniboni (Zaniboni-Filho et al., 2002), reportaron mortalidades del 100% cuando el pH del agua fue de 3.58. Lawson (1995), dice que valores de pH deseables para el cultivo de peces deben estar entre 6.5 - 8.0. De otra parte, hierro y aluminio presentan valores altos comparados con los reportes de Lawson (1995), quien asegura que el aluminio (Al) debe ser menor a 0.01 mg/L, hierro (Fe) menor a 0.01mg/L, dureza entre 10 y 400 mg/l, entre otros.
En el agua, pH bajo o alto per se, es potencialmente tóxico para peces; a pH bajo se inhibe la entrada de Na+ y Cl-a través de las branquias y se estimula la difusión pasiva hacia el exterior de estos iones, mientras que a pH alto se bloquea la excreción de amonio y se acelera la excreción de CO2 (Wood, 2001). De acuerdo con Potts (1994) la causa de la muerte de peces en aguas ácidas es la inhibición del intercambio Na+/H+ en las branquias debido al exceso de H+. De otra parte las altas concentraciones de H+ afectan la permeabilidad del epitelio branquial incrementando la pérdida de iones (Gonzalez, 1996) alterando todavía más la osmoregulación en el pez. El pH del agua es un parámetro muy importante en el mantenimiento del balance iónico (Zaions and Baldisseroto, 2000).
Adicionalmente al problema del bajo pH tanto en agua como en suelo, se encuentran los altos contenidos de aluminio y hierro (agua y suelo), manganeso y zinc (suelo), que, de acuerdo a la concentración y situación de otros parámetros, tienen efectos tóxicos para los organismos acuáticos (Heath, 1995). Los principales metales que muestran incrementos en concentración, como respuesta a la acidificación ambiental, son Al y Zn (Nelson and Campbell, 1991). Entonces, las poblaciones de peces en ambientes acidificados tienen la tendencia a ser expuestos no solamente al ión hidrógeno, sino también a elevadas concentraciones de más de un metal, siendo este el caso del presente estudio. Es más, la disminución de poblaciones de peces en respuesta a la acidificación ambiental han sido asociadas con la movilización de aluminio (Driscoll et al., 1980; Henriksen et al., 1984).
A un pH neutro, la toxicidad de una mezcla de metales es generalmente aditiva, cada metal contribuye proporcionalmente, dependiendo de la concentración, a la toxicidad de la mezcla (Enserink et al., 1991; Finlayson and Verrue, 1982). Lo que sucede a pH bajo cuando existen mezclas de metales, como fue lo sucedido en el presente estudio, debe ser analizado.
El Al+ y los H+ son irritantes y producen un incremento en la actividad del pez, lo que es visto como una reacción de huida. La presencia de Al causa un mayor y más consistente cambio, dependiente de la dosis, en la tasa de ventilación que el estrés ácido solo. La pérdida pasiva y la inhibición en la toma de sodio y cloro son los efectos más marcados del estrés ácido sobre la ionoregulación en peces (McDonald et al., 1989; Playle et al., 1988), esta reducción es probablemente debida a la inhibición por el aluminio de la ATPasa de Na+ y K+ en las branquias (Staurnes et al., 1984).
La mayoría de estudios a pH bajo han considerado al Al como el principal metal responsable de la toxicidad, restando importancia a los efectos de otros metales. Sin embargo, Hutchinson y Sprague (1986) reportaron que una mezcla de Zn, Al y otros cinco metales afectaron severamente la reproducción de flagfish Jordanella floridae a pH 5.8. Ensayos con diferentes combinaciones de metales, sugieren que Al y Zn son los principalmente responsables de los efectos observados.
Otros metales también han sido reportados como afectados por el pH del agua, así Carvalho y Fernandez, 2006 y Carvalho et al., 2004, confirmaron que la toxicidad de Cu en P. scrofa es dependiente del pH del agua y Weatherley et al (1988) concluyen que la toxicidad del Zn para organismos acuáticos es alta bajo condiciones de pH bajo, baja alcalinidad, bajo nivel de oxígeno disuelto y elevada temperatura.
Con respecto al CO2 Wedemeyer (1996), reporta que el CO2 debe estar entre 5 - 10 mg/l, sin embargo Moreira et al. (2001) reportan que este gas no siempre es tóxico para los peces, la mayor parte de las especies pueden sobrevivir por varios días en agua con más de 60 mg/l, siempre que los valores de oxígeno disuelto sean apropiados, lo cual no fue una condición del agua problema en este estudio. Los mismos autores señalan que cuando la alcalinidad es baja, cantidades de CO2 superiores a 20 mg/l generan lesiones en los peces y mayores de 30 mg/l pueden llevar el pH de la misma a 4.8.
Como una regla general, los contaminantes químicos son más tóxicos a niveles más bajos de oxígeno disuelto (OD) (Rattner and Heath, 1994). Esto puede ser debido a una toma más rápida del tóxico por la hiperventilación generada por la hipoxia (Heath, 1995). A medida que el OD en el agua disminuye, en la mayoría de las especies, se inicia un incremento de la ventilación branquial. Para el caso del agua problema del presente estudio, el nivel de OD estaba extremadamente bajo, sin embargo, el agua CINPIC mostró un nivel similar sin que los peces tuviesen signos de asfixia o angustia respiratoria. Es probable que el bajo nivel de OD en el agua problema haya potencializado la toxicidad de los metales presentes.
Mortalidad y lesiones branquiales
Se evidenció la existencia de un efecto tóxico en el agua del estanque. El tiempo al cual se manifestó tal efecto estuvo en función de la concentración de la misma, bastando 2 horas para eliminar el 100% de los individuos cuando la concentración del agua problema fue del 100% y no se observó ningún efecto tras 24 horas de observación cuando estuvo ausente el agua problema. En el tiempo 1 (70 minutos), aún no se había manifestado el efecto tóxico en el tratamiento 2, y para el tiempo 3 (24 horas) ya se habían muerto todos los individuos de tratamiento 1.
Los efectos de los tóxicos en el agua sobre la osmoregulación tienen que ver, especialmente, con la permeabilidad y la toma activa de iones (Fromm PO, 1980; Heath, 1995) y entre los más frecuentes para peces de agua dulce, se reporta disminución de la osmolalidad del plasma y disminución de Na+, K+ y Cl-en plasma; para el caso de aluminio en aguas ácidas se provoca una pérdida masiva de iones de Na+, Cl-y K+, la cual puede ser el doble de la causada solamente por aguas ácidas (Gonzalez et al., 2006). Las branquias son el principal órgano blanco y la muerte es debida a la combinación de disfunciones iónicas, osmoreguladoras y respiratorias (Heath, 1995). Estas disfunciones resultan en una acelerada necrosis celular y muerte del pez. Este mecanismo de muerte de células epiteliales es propuesto como un mecanismo general de muerte celular acelerada inducida por aluminio (Neville, 1985). Esto concuerda con los cambios tisulares más significativos observados en las muestras M2, M3 y M4, siendo destacables los de tipo microcirculatorio en lamelas branquiales, los cuales inducen desbalance de líquidos y electrolitos a nivel sistémico, causando inclusive la muerte. Las respuestas pueden ser más marcadas con ciertos metales, de los cuales, el más tóxico es el aluminio y también el más estudiado (Playle et al., 1988).
Dietrich y Slatter (1989) evaluaron en trucha diferentes concentraciones de aluminio a pH bajo, concluyendo que la mortalidad a las 96 h fue debida al pH y a la concentración del aluminio. Los daños tisulares encontrados tuvieron una mayor severidad directamente relacionada con la concentración del Al. Concentraciones entre 100 y 200 μg/L y pH de 5.4 originaron pérdida de iones debido a la interacción del Al con enzimas y con las uniones epiteliales de las branquias. Estos autores reportaron una elevada necrosis celular, proliferación y fusión de las lamelas secundarias en las branquias, resultando en una obstrucción del espacio interlamelar. Concentraciones mayores a 200 μg/L a pH 5.4 dejaron las branquias repletas de moco impidiendo el intercambio gaseoso. Esto fue causado por la irritación física de las branquias por la acumulación del aluminio polimerizado (Dietrich and Schlatter, 1989). Posteriormente Laitinen y Valtonen (1995) reportaron resultados similares para Salmo trutta, el estrés ácido solo y en combinación con aluminio causó una inmediata respuesta aguda en las tasas cardiacas y ventilatorias. Los peces experimentaron un ligero estrés ionoregulatorio. La solubilidad y la especiación de aluminio, así como su toxicidad depende del pH del agua y ha sido frecuentemente encontrada mayor a pH alrededor de 5 (Neville, 1985). De la misma forma en el presente estudio, el grado de severidad de las lesiones branquiales aumentó con el tiempo de permanencia en el T2 y las más altas concentraciones de los tóxicos en T1, los peces de estos tratamientos se ubicaron en la superficie del agua manifestando angustia respiratoria.
Las branquias son el principal sitio de entrada y salida de electrolitos, amonio, gases y muchos contaminantes en peces de agua dulce (Wood, 1992). Ha sido reportada una lista de lesiones tisulares en branquias debido a contaminantes orgánicos e inorgánicos. Las lesiones incluyen separación del epitelio, necrosis, fusión lamelar, hipertrofia lamelar, hiperplasia lamelar, ruptura del epitelio, inflamación e hipersecreción de moco (Thophon et al., 2004). La cronología del daño causado por una exposición aguda a un tóxico inicia con una separación de la capa externa de la lamela (epitelio), iniciando usualmente en el área de las células de cloro (Thophon et al., 2004). Se forman espacios edematosos entre las capas del epitelio y se infiltran leucocitos. Eventualmente el epitelio puede desprenderse y la lamela perder su arquitectura y colapsar. Así, la exposición a tóxicos puede causar una rápida destrucción lamelar en unas pocas horas (Heath, 1995), tal cual ocurrió en el presente estudio y se muestra en las figuras 3 y 4. No han sido halladas lesiones específicas para un contaminante en particular, actualmente es aceptado que todas estas alteraciones estructurales corresponden a una reacción fisiológica hacia estresores ambientales. Además otros estresores como hipoxia y cambios en la temperatura, pueden producir cambios similares en los tejidos (Mallatt, 1985).
En intoxicaciones con cobre se acepta que el efecto primario es sobre las branquias, causando un desbalance en el contenido de iones (Wood, 2001; Grosell et al., 2002). Adicionalmente el cobre afecta la morfología branquial, directamente induciendo necrosis, hipertrofia, hiperplasia y alta producción de mucus (Mazon et al., 2004) e indirectamente estimulando la proliferación de las células de cloro en las lamelas (Wendelaar, 1997), reduciendo la superficie respiratoria efectiva. Las lesiones branquiales reportadas en el presente estudio concuerdan con las originadas por intoxicación con ácidos o metales como aluminio, cadmio, zinc y cobre, como es reportado en la literatura (Finlayson and Verrue, 1982; Kirk and Lewis, 1993; Thophon, 2003; Wangsongsak et al., 2007).
Para el caso del presente estudio se pudo observar que luego de presentado este episodio, el piscicultor insistió en colocar peces como indicadores; cuando al cabo de 12 semanas los bocachicos no murieron, sembró nuevamente e inició el cultivo. Es probable que con el tiempo y sin exponerlo nuevamente al aire, el H2S04 se agotara y la condición reducida volviese a imperar en el suelo, dejando el FeS2 inerte y precipitado. Sin embargo, hace falta verificar que pasó con el aluminio, el zinc y el manganeso, si estos formaron complejos con los iones de sulfato y cloruro y fueron inactivados. También es necesario hacerle seguimiento al cultivo para analizar el crecimiento de los peces, lo que indicará si estos se encuentran aún bajo alguna situación estresante.
Se puede concluir que los suelos sulfatados ácidos interactúan con el agua del estanque, afectando en primer lugar el pH de ésta y en segundo lugar haciendo disponibles una serie de iones que también resultan tóxicos para los peces, como el aluminio, el zinc y el manganeso. Se concluye también que la acidez del agua puede causar lesiones branquiales de tal grado de severidad que ocasionan la muerte en los individuos de cultivo.
Agradecimientos
Al Instituto de Acuicultura de la Universidad de los Llanos por la lectura y elaboración de los cortes histológicos. Al Instituto regional del agua y al Laboratorio de suelos de la Universidad de Córdoba por los análisis de agua y suelo, respectivamente.
Referencias
Baldisserotto B. Fisiologia de peixes aplicada à piscicultura. Editora UFSM, 2002. 212p. [ Links ]
Booth CE, McDonald DG, Simons BP, Wood CM. Effects of aluminum and low pH on net ion fluxes and ion balance in the brook trout (Salvelinus fontinalis). Can J Fish Aquat Sci 1988; 45:1563-1574. [ Links ]
Boyd CE, Wood CW, Thunjai T. Aquaculture pond bottom soil quality management. Pond Dynamics/Aquaculture Collaborative Research Support Program Oregon State University, Corvallis, Oregon. 2002. [ Links ]
Boyd CE, Zimmermann S. Grow-out systems: water quality and soil management. In: New, M.B. & Valenti, W.C. (Edit), Freshwater Prawn Culture. Blackwell Science, Oxford, England. 2000. 221-238. [ Links ]
Carvalho CS, Fernandes MN. Effect of temperature on copper toxicity and hematological responses in the neotropical fish Prochilodus scrofa at low and high pH. Aquaculture 2006; 251:109-117. [ Links ]
Carvalho CS, Selistic de Araujo HS, Fernández MN. Hepatic metallothionein in a teleost (Prochilodus scrofa) exposed to copper at pH 4.5 and pH 8.0. Comp Biochem Physiol Part B 2004; 225-234. [ Links ]
Combatt EM, Palencia G, Marin N. Clasificación de suelos sulfatados ácidos según azufre extraíble en los municipios del medio y bajo Sinú en Córdoba. Temas Agrarios 2003; 8:22-29. [ Links ]
Combatt E. Efecto del encalamiento y el lavado sobre algunas propiedades químicas de un suelo sulfatado ácido magnésico del valle del río Sinú. Tesis M.Sc. Universidad Nacional de Colombia - Universidad de Córdoba, Montería. 2004. [ Links ]
Dent D. Acid Sulfate Soils: A Baseline for Research and Development. International Institute of Land Reclamation and Improvement, Wageningen, The Netherlands, Publication 39, 1986. [ Links ]
Dietrich D, Schlatter C. Aluminium toxicity to rainbow trout at low pH. Aquatic toxicol 1989; 15:197-212. [ Links ]
Driscoll CT, Baker JP, Bisogni JJ, Schotield CL. Effect of aluminum speciation on fish in dilute acidifi ed waters. Nature (Land) 1980; 2134:161-164. [ Links ]
Enserink EL, Maasdiepeveen JL, Vanleeuwen CJ. Combined effects of metals and ecotoxicological evaluation. Water Res 1991; 25:679-687. [ Links ]
Eslava PR, Ramírez WF, Rondón I. Sobre los efectos del glifosato y sus mezclas: impacto en peces nativas. Universidad de los Llanos. 2007. 150p. [ Links ]
Finlayson BJ, Verrue KM. Toxicities of mixtures of copper. LC and cadmium mixtures to juvenile chinook salmon. Trans Am Fish Sot 1982; 1 II. p. 645-650. [ Links ]
Fleming JF, Alexander LT. Sulfur acidity in South Carolina tidal marsh soils. Soil Sci Soc Amer Proc1961; 25:94-95. [ Links ]
Fromm PO. A review of some physiological and toxicological responses of freshwater fish to acid stress. Environ Biol Fish 1980; 5:79-93. [ Links ]
Gonzalez RJ. Ion regulation in ion poor waters of low pH. In: VAL, A.L. et al. (Ed.). Physiology and biochemistry of the fishes of the Amazon. Manaus: INPA. 1996. [ Links ]
Gonzalez RJ, Wilson RW, Wood CM. Ion regulation in tropical fishes from ion poor, acid black waters. In: VAL AL, DE Almeida-VaL VMF, Randall D. (Ed.). The physiology of tropicarl fishes, Vol 21 Fish Physiology series, 2006. p. 397-442. [ Links ]
Grosell M, Nielsen C, Bianchini A. Sodium turnover rate determines sensitivity to acute copper and silver exposure in freshwater animals. Comp Biochem Physiol 2002; 133(C):287-303. [ Links ]
Heath A. Water pollution and fish physiology. 2nd edition. CRC Press, Boca Raton. 1995. [ Links ]
Henriksen A, Skogheim OK, Rosseland BO. Episodic changes in pH and aluminum speciation kill fish in Norwegian salmon river. Vatten 1984; 40:255-260. [ Links ]
Hickling CF. Recommendations for constructions and management of brackishwater aquaculture ponds in areas with acid sulfate soils. FAO Fisheries Circular No. 658, 1974. pp. 243-260. [ Links ]
Hutchinson NJ, Sprague JB. Toxicity of trace metal mixtures to American flagfish (Jordanella floridae) in soft acidic water and implications for cultural acidification. Can J Fish Aquat Sci1986; 43:647-655 [ Links ]
Kirk R, Lewis J. An evaluation of pollutant induced changes in the gills of rainbow trout using scanning electron microscopy. Environ Technol; 1993; 14: 577-585. [ Links ]
Lahav O, Ritvo G, Slijper I, Hearne G, Cochva M. The potential of using iron-oxide-rich soils for minimizing the detrimental effects of H2S in freshwater aquaculture systems. Aquaculture 2004; 238:263-281. [ Links ]
Laitinen M, Valtonen T. Cardiovascular, ventilatory and haematological responses of brown trout (Salmo trutta L), to the combined effects of acidity and aluminium in humic water at winter temperatures. Aquatic Toxicol 1995; 31:99-112. [ Links ]
Lawson T. Fundamentals of aquacultural engineering. New York: Chapman & Hall, 1995. [ Links ]
Macintosh DJ. Fisheries and aquaculture significance of mangrove swamps with special reference to the Indo-West Pacific Region. In: J H Muir and R J Roberts (Editors). Recent advances in aquaculture. Westview Press, USA, 1982. p. 3-85. [ Links ]
Mallatt J. Fish gill structural changes induced by toxicants and other irritants: a statistical review. Can J fish Aq Sci 1985; 42: 630-648. [ Links ]
Mazon AF, Nolan DT, Lock RAC, Fernandes MN, Wendelaar Bonga SE A short-term in vitro gill culture system to study the effects of toxic (copper) and non-toxic (cortisol) stressors on the rainbow trout, Oncorhynchus mykiss (Walbaum). Toxicol In Vitro 2004;18:691-701. [ Links ]
McDonald DG, Reader JP, Dalziel TRK. The combined effects of pH and trace metals on fish ionoregulation. In: Morris, R., Taylor, E.W., Brown, D.J.A., Brown, J.A. (Eds.), Acid Toxicity and Aquatic Animals. Cambridge University Press, Cambridge, 1989. p. 221-242. [ Links ]
Morales J, Gertrudix L, Rodriguez J, Berrocal D, Chien Y. Problemática de los fondos en el engorde de peces y crustáceos marinos en tanques de tierra. In: Engorde y Maduración de Camarones Peneidos. Vol. II. Programa Iberoamericano de Ciencia y Tecnología para el desarrollo. Subprograma II, Acuicultura, CITED-D. San José, 1992. p. 15-22. [ Links ]
Moreira Márquez HL, Vargas L, Ribeiro PR, Zimmermann S. Fundamentos da moderna aqüicultura. Canoas: Ed. ULBRA (Bra). 2001. [ Links ]
Nelson WO, Campbell PGC. Review of the effects of acidification the geochemical of Al, Cd, Pb and Hg in freshwater environments. Environ Pollut 1991; 71:91-130. [ Links ]
Neville CM. Physiological response of juvenile rainbow trout Salmo gairdneri, to acid and aluminum prediction of field responses from laboratory data. Can. J Fish Aquat Sci 1985; 42:2004-2019. [ Links ]
NRS-SBCS. COMISSÃO DE FERTILIDADE DO SOLO. Recomendações de adubação e calagem para os estados do Rio Grande do Sul e de Santa Catarina. Passo Fundo: 1995. [ Links ]
Payan P, Girard JP. Branquial ion movements in teleosts: the roles of respiratory and chloride cells. In Fish Physiology Vol XB, Hoar WS, Randall DL Edis. 1984. [ Links ]
Playle RC, Goss GG, Wood CM. Physiological disturbances in rainbow trout (Salmo gairdneri) during acid and aluminum exposures in soft water of two calcium concentrations. Can J Zool 1988; 67:314-324. [ Links ]
Potts WTW. Kinetics of sodium uptake in freshwater animals: a comparison of ion exchange and proton pumphypothesis. Am J Physiol Bethesda. 1994; 226:315-320. [ Links ]
Rattner BA, Heath AG. Factors affecting contaminant toxicity in aquatic and terrestrial vertebrates. In: Handbook of Ecotoxicology. Hoffman DJ, Rattner BA, Burton AG, Cairns J. Eds., Lewis Publishers, Boca Raton, Fl. 1994. [ Links ]
Singh VP. Kinetics of acidification during drying and inundation of acid sulfate soil material. Implications for the management of brackishwater fish ponds. In: H. Dost (Editor). Proc Int. Sym Acid Sulfate Soils; Publication 31. International Institute for land Reclamation and Improvement. Bangkok, Thailand. 1981 pp. 33I-351. [ Links ]
Staurnes M, Sigholt T, Reite OB. Reduced carbonic anhydrasa and Na-K-ATPase activity in gills of salmonids exposed to aluminum-containing acid water. Experientia 1984; 40:226-234. [ Links ]
Tacon A. Nutrición y alimentación de peces y camarones cultivados. Manual de Capacitación- GCP/RLA/102/ITA. Proyecto Aquila II. Documento de Campo N° 4. FAO, Brasilia, Brasil; 1989. [ Links ]
Thophon S, Kruatrachue M, Upatham ES, Pokethitiyook P, Sahaphong S, Jaritkhuan S. Histopathological alterations of white seabass, Lates calcarifer, in acute and subchronic cadmium exposure. Environmental Pollution 121 (2003) 307-320. [ Links ]
Vinatea L. Principios químicos de qualidade da água para peixes e camarões. UFSC, Florianópolis; 2004. [ Links ]
Wangsongsak A, Utarpongsa S, Kruatrachue M, Ponglikitmonkol M, Pokethitiyook P, Sumranwanich T. alterations of organ histopathology and metallothionein mRNA expression in Siver barb, Puntius gonionotus during subchrinic cadmium exposure. J Environ Sci, 2007; 19:1341-1348. [ Links ]
Weatherley AH, Lake PS, Stahal PL. Zinc pollution and ecology of the environment. In: Nriagu JO, ed. Zinc in the environment. Part 1: Ecological cycling. New York, NY: John Wiley; 1988. p. 337-417. [ Links ]
Wedemeyer GA. Physiology of Fish Intensive Culture Systems. Chapman and Hall, New York; 1996. 231p. [ Links ]
Wendelaar Bonga SE. The stress response in fish. Physiol Rev 1997; 77: 591-625. [ Links ]
Wood CM. Flux measurements as indices of H+ and metal effects on freshwater fish. Aquatic Toxicol 1992; 22:239-253 [ Links ]
Wood CM. Toxic responses of the gill. In: Schlenk DS, Benson WH. (Eds.), Target Organ Toxicity in Marine and Freshwater Teleosts, vol. 1. Taylor and Francis, London; 2001. pp. 1-89. [ Links ]
Zaions MI, Baldisseroto B. Na+ and K+ body levels and survival of fingerlings of Rhamdia quelen (Siluriformes, Pimelodidae) exposed to acute changes of water pH. Ciência Rural 2000; 30:1041-1045. [ Links ]
Zaniboni-Filho E, Meurer S, Golombieski J I, Silva L V F, Baldisserotto B. Survival of Prochilodus lineatus (Valenciennes) fingerlings exposed to acute pH changes. Acta Scientiarum Maringá 2002; 24:917-920. [ Links ]