Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.22 no.4 Medellín Oct./Dec. 2009
Casos Clínicos
Falla ovárica en una yegua de paso fino colombiano: tratamiento combinado homeopático antihomotóxico y hormonal. Reporte de un caso¤
Ovulation failure in a Colombian Paso fino Mare: A combined antihomotoxic homeopathic therapy and hormonal treatment. A case report
Fracasso ovário em uma égua de passo colombiano: manipulação homeopática antihomotoxica e hormonal combinada. Reporte de um caso
Luis J Otálvaro1,2*, Claudia J Correa1, Carlos E Velásquez1,2, Juan G Maldonado-Estrada2,3
1Equimevet, Carrera 71 Nº 74-065, Medellín, Colombia. 2Grupo de Investigación en Ciencias Veterinarias Centauro, Escuela de Medicina veterinaria, Facultad de Ciencias Agrarias, Universidad de Antioquia. Carrera 75 Nº 65-87. Medellín, Colombia. 3Grupo de investigación EquiCES, Universidad CES, Calle 10-A Nº 22-04, Medellín, Colombia.
(Recibido: 21 julio, 2008; aceptado: 28 julio, 2009)
Resumen
La falla ovulatoria es una de las principales causas de infertilidad en yeguas cíclicas. En el presente caso, se describe el seguimiento de una yegua nulípara de paso fino colombiano de seis años que ingresó a consulta para ser sometida a reproducción. Al examen ecográfico se le halló el ovario izquierdo de 15 x 13 cm con una estructura patológica de aspecto anecóico y contenido líquido de 13 x 11 cm, el ovario derecho sin estructuras y el útero flácido. La yegua fue sometida a tratamiento con antihomotóxicos del tipo Ovarium compositum®, Damiana injeel®, Cerebrum compositum®, y Phosphor hommacord® durante 1½ mes, y terapia FK (terapia neural, dos en 15 días), lo cual disminuyó el tamaño del folículo y del ovario, indujo ablandamiento de la pared folicular y leve respuesta uterina. Un mes y medio después, el ovario izquierdo tenía 13 x 11 cm y un folículo de 9 x 8 cm, y el ovario derecho estaba multifolicular. Las concentraciones de progesterona, estradiol y testosterona eran características de anestro. La yegua fue tratada con eCG (3.000 UI/3 días, i.v.), cuatro días después la progesterona ascendió a 14.91 ng/ dl, el examen ecográfico reveló un cuerpo lúteo en el ovario izquierdo y a los siete días fue tratada con PGF2α (9 μg/kg/2 días) intramuscular. Cinco días después la yegua presentó estro, fue inseminada y tuvo una gestación que perdió a los 40 días; luego presentó un nuevo estro a los 20 días, fue inseminada, se le confirmó gestación a los 20 días y tuvo una gestación a término con un potro viable al momento del parto. Este caso sugiere la posibilidad de combinar terapia hormonal con medicina alternativa para el tratamiento de algunos tipos de anormalidades en el funcionamiento ovárico en las yeguas.
Palabras clave: anestro, anovulación, ovarios problema en yeguas, progesterona, testosterona, tumor ovárico.
Summary
Ovulation failure is one of the most frequent causes of infertility in mares. In the present case we report a six-year-old Colombian Paso Fino maiden Mare that was attended for breeding purposes with a previous history of ovulation failure. At ultrasound (US) examination of the reproductive tract and ovaries the left ovary measured 15 x 13 cm and a pathologic 13 x 11 cm diameter anecoic structure was diagnosed. The right ovary was found of normal size, and the uterus was found flacid. An anti homotoxic theraphy with Ovarium compositum®, Damiana injeel®, Cerebrum compositum®, and Phosphor hommacord® for 1½ months and FK (neural) therapy (twice/15 days) were then established, the ovary size was reduced, and softening of the follicular wall and a slight uterine response were observed. After 1½ month, the left ovary had 13 x 11 cm diameter and showed a 9 x 8 cm follicle, whereas the right ovary was multifollicular. Serum progesterone, estradiol and testosterone levels were those characteristics of an anestrous mare. The mare was treated with hCG (3.000 UI, i.v./3 days) and 4 days later a corpus luteum was diagnosed by US in the left ovary and serum progesterone levels raised to 14.91 ng/dl. At day 7 after hCG treatment the mare was given PGF2α (9 μg/kg/for two days) intramuscular, estrous was evident 5 days later, and artificial insemination (AI) with fertile semen was practiced resulting in a viable pregnancy as evaluated by ultrasound at day 20; however, this pregnancy was lost at 40 days after AI. The mare returned to estrus 20 days later, she was then inseminated and the resulting pregnancy was confirmed at day 20th resulting in a successful gestation and foaling of a full term viable foal. This report suggests hormonal therapy and alternative medicine could be successfully combined for treatment of specific ovarian pathologies in mares.
Key words: anestrous, ovarian problems in mares, ovarian tumor, progesterone, testosterone.
Resumo
O fracasso ovulatório é uma das principais causas de infertilidade em éguas cíclicas. Neste caso, se descreveu o acompanhamento de uma égua nulípara da paso fino colombiano, de seis anos idade que consultou para serem sujeitos a reprodução. No exame ultra-som que ele encontrou o ovário esquerdo, 15 x 13 cm, com uma estrutura patológica de 13 x 11 cm, o ovários direito sem estruturas e útero mau. A égua sofreu tratamento com drogas Ovarium compositum®, Damiana injeel®, Cerebrum compositum®, e Phosphor hommacord® durante 1½ mês, FK terapêutica (terapia neural, duas em 15 dias), o que diminuiu o tamanho do folículo e do ovário, induzida amolecimento da parede uterina e leve resposta folicular. Um mês e meio depois, o ovário esquerdo tinha 13 x 11 cm e um folículo 9 x 8 cm, e do ovário direito foi multifolicular. As concentrações de progesterona, estradiol e testosterona foram características do anestro. A égua foi tratada com eCG (3.000 UI IV/3 dias), quatro dias após a progesterona ascendeu a 14.91 ng/dl, e foi visto por ultra-som corpo lúteo no ovário esquerdo. Em sete dias, a égua foi tratada com PGF2α (9 μg/ kg/2 dias) i.m., introduzido estro após cinco dias, foi inseminada e teve uma gestação que perdeu a 40 dias; introduziu um novo estro em 20 dias, foi inseminação, a gravidez foi confirmada em 20 dias e atualmente mantém um 9 meses de gestação. Este caso sugere a utilidade da terapia hormonal combinando com medicina alternativa para o tratamento de certos tipos de anomalias no funcionamento do ovário em éguas.
Palavras chave: anestro, anovulação, ovários problema em égua, progesterona, testosterona, tumor ovariano.
Introducción
La falla ovárica en yeguas es un proceso de alta frecuencia dentro de las causas de infertilidad, su causalidad es compleja y exige un reto continuo para el médico veterinario, quien debe afrontar las alternativas terapéuticas más apropiadas de conformidad con cada caso en particular. La falla ovulatoria de folículos con diámetro ovulatorio y los folículos hemorrágicos persistentes, pueden ser parte de un proceso fisiológico normal, un evento patológico o ser el resultado de la pérdida de respuesta a un agente inductor de ovulación (Ginther et al., 2005). El desarrollo de folículos anovulatorios es común durante los períodos de transición otoño – primavera (Ginther et al., 2003; Van Niekerk and Van Niekerk, 1997) y en algunas yeguas en su posparto (Van Niekerk and Van Niekerk, 1997).
La dificultad de las yeguas para ovular durante la estación reproductiva normal es menos común, pero representa una causa importante de pérdidas económicas (McCue, 2007). La incidencia de la falla ovulatoria durante la temporada reproductiva fisiológica se calcula del 3.1 al 8.2%, y puede oscilar entre 5 y 20% entre el inicio y el final de la estación reproductiva (Ginther et al., 2007). La falla ovulatoria es un evento fisiológico normal para la yegua durante la primavera y los períodos de transición del otoño; el desarrollo de folículos anovulatorios puede ocurrir ocasionalmente durante la estación reproductiva, los cuales pueden ser completamente grandes (5 a 15 cm de diámetro) y persistir hasta por dos meses (Gastal et al., 2004).
En Colombia no hay estudios publicados sobre este tema, a pesar de que muchos veterinarios de equinos lo tratan con alta frecuencia, en donde se incluyen esquemas hormonales convencionales (Dr. Sigifredo Varela, médico veterinario Equimevet, Medellín, Colombia; y experiencia propia de los autores). El diagnóstico diferencial en yeguas que presenten aumento unilateral o bilateral del tamaño de los ovarios, incluye condiciones patológicas tales como los tumores ováricos (Maurice KT, 2005; McCue et al., 2006), los hematomas ováricos, la falla ovárica (McCue, 2007; McCue, 1998; Vanderwall et al., 1993), el envejecimiento (Vanderwall et al., 1993) o el posparto en algunas yeguas (Caldas et al., 1994), y condiciones ambientales propias de las estaciones en países templados (Donadeu and Watson, 2007) o al momento del tratamiento con hormonas exógenas (Chen FJ et al., 1993). La estimulación hormonal inadecuada durante el diestro temprano, aumenta la probabilidad de que las yeguas presenten folículos anovulatorios (Irvine et al., 2000).
En un estudio fueron hallados folículos anovulatorios en el 8.2% de los ciclos estrales en yeguas; la incidencia de folículos anovulatorios incrementó con la edad, donde las yeguas de 16 a 20 años de edad desarrollaron folículos anovulatorios en el 13.1% de los ciclos estrales durante la temporada reproductiva fisiológica (McCue, 2007). El 43.5% de las yeguas que desarrollaron folículos anovulatorios experimentaron ciclos estrales subsiguientes sin la formación de folículos anovulatorios, durante la misma temporada reproductiva, con un intervalo entre ovulaciones de 38.5 días en yeguas que desarrollan folículos anovulatorios (McCue, 2007).
En virtud de la experiencia propia de uno de los autores en el uso de las terapias alternativas para el manejo de diversas alteraciones reproductivas en yeguas, el objetivo del presente trabajo es presentar un caso clínico de falla ovárica persistente en una yegua de paso fino colombiano, que fue sometida a tratamiento combinado con terapia neural, homeopatía antihomotóxica y terapia hormonal convencional. A pesar de parecer un enfoque terapéutico contradictorio, el esquema aplicado permitió observar un efecto favorable sobre el desarrollo folicular de la yegua, que abrió la posibilidad de utilizar el tratamiento convencional con una hormona glicoproteica para inducir la luteinización del folículo anovulatorio y reactivar el ciclo reproductivo para hacer la inseminación y lograr una gestación a término de la yegua, con el nacimiento de un potro viable.
Evaluación del paciente
Anamnesis
Paciente equino hembra, de paso fino colombiano, seis años de edad con 380 kg de peso, una condición corporal de 8.0 (escala de 1 a 9), sin ninguna anormalidad del estado clínico general. Esta yegua estuvo dedicada a competencia en pistas para el juzgamiento de paso fino colombiano durante varios años, razón por la que nunca se le hizo un seguimiento reproductivo ni fue sometida a un programa de reproducción por monta natural o inseminación artificial. En una ocasión cuando presentó estro fue inseminada con una dosis de semen que había llegado desde otra ciudad, con la casi totalidad de los espermatozoides muertos, lo que resultó en falla de la fertilización.
La yegua presentaba el estro de duración normal en forma cíclica y en las ocasiones en las que fue sometida a evaluación por palpación transrectal, nunca fueron halladas anormalidades aparentes en el útero o los ovarios. La yegua cambió de propietario y, aproximadamente un mes después, un nuevo médico veterinario fue encargado de hacerle seguimiento reproductivo para iniciar su reproducción. Al detectarla en estro el Médico Veterinario encargado le hizo un examen ultrasonográfico, encontró un folículo en desarrollo que había alcanzando tamaño preovulatorio pero no se deformaba para ovular, su pared se mantuvo gruesa, no ovuló y mantuvo su crecimiento hasta alcanzar un tamaño anormal. En este momento fue cuando nos fue remitido el caso.
Hallazgos al examen clínico
Palpación. Mediante el examen ginecológico transrectal, en el ovario izquierdo fue hallada una estructura cuyo diámetro no se pudo determinar por su gran tamaño, de pared muy gruesa y de consistencia líquida, bastante dolorosa al tacto, la cual, debido a su peso, había logrado desplazar el ovario por debajo del nivel del piso pélvico. El ovario derecho fue hallado de tamaño pequeño (aproximadamente de 2 x 2 x 1 cm), liso y sin estructuras palpables. El útero presentaba una pared delgada y era de consistencia flácida.
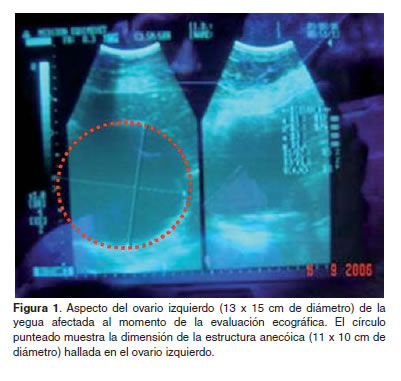
Ecografía. Al realizar una evaluación ultrasonográfica transrectal (Hinrichs y Hunt, 1990) utilizando un transductor lineal de 5 Mhz (Sonovet 600), sólo fue posible observar en el ovario izquierdo una estructura redonda de aspecto anecoico, con pared gruesa (borde hiperecoico) de apariencia anecoica hacia su borde inferior. Ante la imposibilidad de delimitar la estructura, se procedió a realizar una ultrasonografía transabdominal utilizando un transductor sectorial de 3.5 Mhz, que permitió observar una estructura esférica de 15 x 13 cm, con una gran estructura anecóica llena de líquidos de 13 x 11 cm el ovario izquierdo (Figura 1).
Dado que las yeguas criollas colombianas presentan folículos preovulatorios cuyo diámetro oscila entre 35 y 40 mm (Otálvaro, 1996), el hallazgo de una estructura anecoica de un diámetro superior a estos valores permitió considerar los diagnósticos presuntivos siguientes: el tumor de células de la granulosa (McCue et al., 2006) y el folículo hemorrágico anovulatorio (Ginther et al., 2007). Por consiguiente, se procedió a tomar muestra de sangre para cuantificar el perfil hormonal que permitiera descartar o confirmar la condición tumoral o la condición anovulatoria.
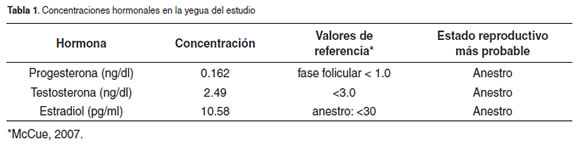
Evaluación hormonal. A la yegua le fue tomada una muestra de sangre venosa periférica mediante punción de la vena yugular usando un tubo de vacío con aguja de 21G, para medir las concentraciones séricas de estradiol, progesterona y testosterona. Los resultados informados por el laboratorio para las mediciones hormonales son presentados en la tabla 1.
Enfoque de tratamiento
Terapia neural segmental en la yegua
Inyección del ganglio de Frankenhausser (“plexo útero-vaginal”) – “Técnica del FK”. Luego de preparar el material necesario para la infiltración intracervical, la región de la vulva y el periné fue desinfectada con cloruro de bezalconio; enseguida fue introducido el espéculo de valvas a la vagina, el cual se abrió para poder visualizar el fondo de vagina y el cérvix; el fondo vaginal fue iluminado con linterna y se introdujo un catéter de inseminación al cual se le había acoplado en un extremo una aguja hipodérmica y en el otro extremo la jeringa con la procaína; luego fueron inyectados aproximadamente 0.5 cm de procaína al 1% (diluida al 0.5% en solución de Hartman) en el cérvix: imaginando que esta estructura era un reloj, fueron aplicadas inyecciones a las 3:00 y a las 9:00 ó a las 4:00 y a las 8:00; luego fue retirado el catéter con la aguja y el espéculo.
Tratamiento homeopático antihomotóxico detallado
Los medicamentos homeopático antihomotóxicos utilizados en la terapia fueron aplicados bajo el siguiente esquema: 1) Ovarium compositum® (ampollas de 2.2 ml, Nº 10) y Damiana injeel® (ampollas de 1.1 ml, Nº 10), cuyo contenido fue mezclado en una jeringa hipodérmica desechable de 5 ml, fue sujetado en la palma de la mano y agitado en posición vertical en siete ocasiones; luego fue aplicado por vía intravenosa, intramuscular o subcutánea, una vez al día, bajo el siguiente esquema: primera semana, lunes, miércoles y viernes; segunda semana, lunes y viernes; y a partir de la tercera semana y hasta terminar las ampollas, sólo los días lunes. 2) Cerebrum compositum® (ampollas de 2.2 ml, Nº 10) y Phosphor hommacord® (ampollas de 1.1 ml, Nº 10), utilizando el mismo sistema de aplicación para las ampollas anteriores, fueron aplicados bajo el siguiente esquema: primera semana, martes, jueves y sábado; segunda semana, martes y jueves; y a partir de la tercera semana y hasta terminar las ampollas, los días jueves.
Terapia hormonal convencional
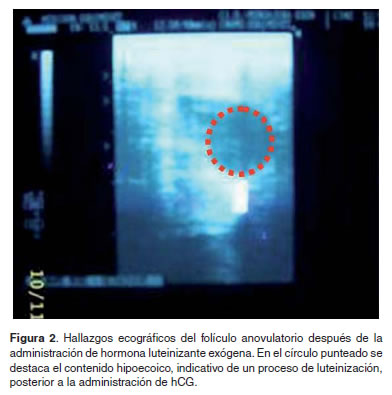
Después de haber realizado las dos terapias segmentales y aplicado el protocolo homeopático antihomotóxico, a la yegua le fueron administradas tres dosis por vía i.v. de 10.000 UI de gonadotropina coriónica humana (Chorulon, Intervet, Bogotá), una cada 24 horas (Bergfelt, 2000) como fuente de hormona luteinizante (LH). A los cuatro días de la última aplicación, la yegua fue sometida a una nueva evaluación ultrasonográfica del ovario izquierdo cuyo resultado reveló una luteinización completa del folículo (Figura 2). Adicionalmente, fue realizada una nueva medición de la progesterona sérica, cuyo valor fue cual de 14.91 ng/ml, lo que confirmaba la luteinización del folículo anovulatorio. Por consiguiente, para causar la lisis del tejido lúteo inducido por la LH exógena y el retorno de la yegua al estro, dos dosis de un análogo de la PGF2α (Dinoprost, 9 μg/kg vía intramuscular) fueron administradas cada una con un intervalo de 24 horas.
Evolución
Una semana después de la última aplicación de la prostaglandina la yegua presentó signos de estro; a la palpación rectal el ovario izquierdo se hallaba deformado, ya no presentaba la estructura redondeada grande de las semanas anteriores, y era menos sensible al tacto; el ovario derecho presentó múltiples folículos pequeños y una estructura folicular de 25 mm de diámetro en desarrollo; el útero adquirió forma tubular y presentó leve cantidad de edema; a los dos días siguientes, el ovario izquierdo tenía un tamaño de 9 x 7 cm, de forma redondeada, con la estructura lútea en proceso de formación, mientras que el folículo en crecimiento del lado derecho había alcanzado un tamaño de 32 mm, estaba en proceso de deformación y tenía paredes delgadas, hallazgos sugestivos de ovulación inminente; en el útero fue diagnosticado un edema moderado. Con estos hallazgos, la yegua fue inseminada con semen de un semental fértil y la ovulación fue confirmada mediante examen ultrasonográfico transrectal realizado al día siguiente.
A los 15 días de la ovulación, fue practicada una evaluación ultrasonográfica transrectal que reveló la presencia de un embrión viable; el examen fue hecho de nuevo a los 30 días de gestación cuando fue confirmada la gestación. Sin embargo, en un examen hecho a los 45 días no fue hallado el embrión, por lo que fue diagnosticada la pérdida embrionaria. A los 20 días de este hallazgo, la yegua presentó un nuevo estro, durante el cual tuvo un comportamiento normal; la yegua fue apareada de nuevo con un semental fértil, ovuló y a los 18 días del servicio un nuevo embrión fue hallado al examen ultrasonográfico transrectal, el cual prosiguió su desarrollo gestacional completo hasta llegar a término. La yegua parió un potro vivo (Figura 3-B), no presentó alteraciones reproductivas en el periodo postparto y reanudó su ciclicidad reproductiva.
Discusión
La yegua del presente caso clínico fue recibida a consulta con un diagnóstico presuntivo de tumor de células de la granulosa, de conformidad con la historia reproductiva que habían observado los colegas que tenían a cargo el caso. Sin embargo, a pesar de no haber podido medir las concentraciones de inhibina, la ausencia de concentraciones elevadas de testosterona permitió descartar la ocurrencia de dicho tumor; mientras que, las bajas concentraciones de estradiol y progesterona que coincidían con un perfil hormonal típico de una yegua en anestro (McCue et al., 2006), sugerían que la yegua presentaba inactividad ovárica al momento del examen, hallazgo que coincide con un folículo hemorrágico anovulatorio, en cuyo caso se supone que no hubo concentraciones endógenas de LH suficientes para permitir una adecuado desarrollo folicular, la ovulación y la luteinización subsiguiente del folículo ovulado. A pesar de no haber realizado otras mediciones hormonales, la elevada condición corporal de la yegua, posiblemente como consecuencia de una alteración del balance nutricional (Vick et al., 2006) de conformidad con los requerimientos para su estado por fuera de las competencias de pista, estaría relacionada con alteraciones en la producción de LH.
La aplicación de la terapia neural segmental, mediante la inyección del ganglio de Frankenhausser o “plexo útero-vaginal” denominada “Técnica del FK” estimula el ganglio impar, el cual regula la información simpática y parasimpática para el sistema genito-urinario (Dosch, 1985). El principio de la terapia neural segmental se basa en que los órganos enfermos regularmente producen reacciones y cambios en ciertas zonas cutáneas y subcutáneas claramente definidas (Head y Mckenzie, 2001). En la terapia neural se conocen tres posibles formas de producir un efecto segmental: a) la inyección directa en el sitio doloroso, como las inyecciones de procaína o lidocaína sin epinefrina, las que aplicadas con precisión son efectivas en el tratamiento de desórdenes dolorosos en músculos, huesos, tendones, ligamentos, articulaciones y nervios, contusiones, abrasiones, hematomas, cicatrices dolorosas y todas las formas de daño traumático (puntos gatillo o terapia de Quaddle) (Dosch, 1985); b) la aplicación directa de procaína o lidocaína en el segmento relevante de las áreas dolorosas tratadas efectivamente con inyecciones paravertebrales (Dosch, 1985); y c) el tratamiento con procaína o lidocaína de la cadena simpática y sus ganglios, la cadena simpática lumbar y abdominal, los ganglios ciliar, de Gasser, esfeno-palatino y estrellado, y los ganglios cervicales superior y medio (Head y Mckenzie, 2001).
En equinos, la terapia neural segmental se ha propuesto como un método para controlar o corregir el dolor u otros síntomas inducidos por un campo interferente ubicado en cualquier parte del cuerpo y en cualquier órgano; el problema puede ocurrir en el mismo lado o en lado opuesto al campo interferente. Hasta ahora, la única forma de confirmar si un determinado campo de interferencia es la causa de una dolencia específica, consiste en inyectar anestesia local en la cicatriz o en el segmento afectado y esperar si se presenta el signo clásico que muestra si existe relación o no. Si ocurre el “fenómeno secundario” (fenómeno en segundos), prueba la relación entre ambos. La parte más importante de la terapia neural es encontrar la cicatriz relevante o el campo interferente. El uso de la técnica del FK aun no está descrito en medicina veterinaria y ha sido desarrollado de acuerdo con lo descrito en la aplicación de terapia neural para mujeres, con las adaptaciones técnicas ya descritas.
La terapia con medicamentos homeopáticos antihomotóxicos consiste en generar estímulos que se sitúan por debajo o mínimamente por encima del umbral fisiológico, los que se producen mediante la administración adicional de una toxina similar a la homotoxina contra la que se encuentran “combatiendo” los mecanismos de defensa del organismo. Este agente tóxico adicional, dada la elevada dilución a la que se administra, no representa ninguna carga tóxica adicional para el organismo (Heel, 2006). Para comprender el concepto de enfermedad característico de la homotoxicología se deben tener en cuenta las siguientes reflexiones: 1) el organismo puede considerarse como “un sistema de flujo controlado cibernéticamente”; 2) las sustancias tóxicas (toxinas endógenas y exógenas) que ingresan en el sistema activan sus mecanismos de defensa, con la finalidad de restablecer el equilibrio de flujo alterado; y 3) las enfermedades son las manifestaciones de los mecanismos de defensa (Heel, 2006). Por lo tanto, en el concepto de enfermedad de la homotoxicología se engloban las afecciones producidas por sustancias tóxicas (homotoxinas) y todos los procesos de defensa antitóxica subsiguientes, los cuales tratan de restablecer la salud.
Respecto de la falla fisiológica en la ovulación, los períodos de transición otoño–primavera en los países estacionales, están caracterizados por ondas de desarrollo y regresión folicular, sin ovulación. La transición a primavera o fase de resurgencia puede durar de 2 a 3 meses y los folículos dominantes de una onda folicular pueden alcanzar tamaño preovulatorio (es decir, >35 mm de diámetro) tarde en el período de transición a la primavera y sufrir la regresión sin alcanzar la ovulación. La ovulación de un folículo dominante marca el final del período transicional a la primavera (Donadeu and Watson, 2007) y la mayoría de las yeguas ovulan a intervalos de 21 días aproximadamente. En otoño, las yeguas pueden exhibir ondas de crecimiento folicular y regresión por varias semanas, después de la última ovulación del año, la actividad folicular disminuye gradualmente en asocio con la disminución del estímulo del fotoperíodo y los ovarios de la mayoría de las yeguas se inactivan durante los meses de invierno (Collins et al., 2007; Irvine et al., 2000).
Durante el período de transición del otoño se pueden formar folículos anovulatorios grandes, los cuales han sido descritos comúnmente como “folículos otoñales”. Estos folículos han sido descritos clásicamente como hemorrágicos, con un líquido de apariencia gelatinosa y se conocen también como folículos hemorrágicos anovulatorios (Ginther et al., 2007). Las yeguas durante el posparto también pueden presentar falla ovulatoria fisiológica; la mayoría de yeguas que no ciclan después del parto son yeguas que parieron temprano en el año, pero puede ser difícil diferenciar entre anestro postparto debido a un corto fotoperíodo respecto del anestro debido a efectos lactacionales (Vanderwall et al., 1993). En Colombia sólo hay un estudio reportado sobre el comportamiento ovárico en condiciones tropicales a lo largo del año, en donde fueron halladas variaciones en la actividad ovárica relacionadas con los niveles de luminosidad de cada temporada climática (época lluviosa y época seca) característica del país para la época del estudio (Otálvaro , 1996).
La falla en la ovulación ocurre ocasionalmente durante la temporada reproductiva fisiológica. Los folículos anovulatorios pueden ser grandes (5-15 cm de diámetro), persistir hasta por dos meses y terminar en período prolongado de comportamiento de anestro y un largo intervalo interovulatorio. Las causas específicas de falla en la ovulación no son conocidas, pero se ha sugerido una insuficiente estimulación gonadotrópica pituitaria para inducir este evento (Pycock and Newcombe, 1996; Van Niekerk and Van Niekerk, 1997; Williams et al., 2007), fallas en los mecanismos locales de regulación intraovárica (Gastal et al., 2004; Ginther et al., 2008), una producción insuficiente de estrógenos desde el mismo folículo (Ginther et al., 2003), o alteraciones vasculares (Acosta et al., 2004) que comprometen el tejido formado en el lumen del folículo preovulatorio (Ginther et al., 2007). Las yeguas pueden desarrollar folículos anovulatorios sin una previa exposición a hormonas exógenas.
Durante la fase folicular de la yegua es difícil determinar si un folículo dominante en una yegua en estro fallará en ovular; la formación de un folículo anovulatorio usualmente está precedida del desarrollo de pliegues endometriales normales o edema (Gastal et al., 2004). Los patrones de crecimiento inicial de los folículos destinados a ser anovulatorios están usualmente dentro de los límites normales y el primer indicativo de problemas es la observación de partículas ecogénicas dentro del fluido folicular durante el examen ultrasonográfico. Los folículos anovulatorios pueden contener sangre y consecuentemente, han sido llamados folículos hemorrágicos anovulatorios (Ginther et al., 2007).
La yegua del presente caso había tenido alguna actividad cíclica no regular en las semanas previas al diagnóstico de la estructura anormal en el ovario y no se pudo realizar un seguimiento sistemático que pudiera dar una idea del mecanismo responsable de la formación de la estructura anecoica. Sin embargo, es particular la respuesta rápida que mostró al tratamiento con la hCG, como se evidenció en la ecografía por la formación de una estructura ecográfica de aspecto lúteo y la producción de concentraciones de progesterona típicas del diestro. Algunos estudios han reportado que el uso repetitivo de hCG durante una temporada reproductiva disminuyó la utilidad de la administración de hCG para inducir una ovulación programada en una estación reproductiva subsiguiente (McCue, 2007). Sin embargo, en la yegua del presente caso sólo se hicieron tres administraciones con intervalo de 24 horas, tiempo que podría ser insuficiente para la generación de anticuerpos contra la hCG; además, la respuesta de la yegua en la formación del CL y la producción de progesterona, indican que la hormona actuó de manera apropiada para el efecto buscado. Lo anterior sugiere además que la estructura anormal presente en el ovario de la yegua era un folículo hemorrágico anovulatorio.
El TCG es el tumor ovárico más común en la yegua, casi siempre es unilateral, presenta crecimiento lento y es de naturaleza benigna. La evaluación ultrasonográfica del ovario afectado casi siempre revela una estructura multiquística o en aspecto de panal de abejas, pero el tumor también puede estar presente como una masa sólida o un gran quiste único. El ovario contralateral usualmente está pequeño e inactivo, aunque se han reportado algunas yeguas con tumor de células de la granulosa y de ovario funcional contralateral. Las normalidades de comportamiento tales como anestro prolongado, comportamiento agresivo o como de semental y estro persistente o ninfomanía se pueden expresar en las yeguas afectadas (Bailey et al., 2002; Maurice, 2005; McCue et al., 2006). Los TCG son hormonalmente activos, y las pruebas clínicas diagnósticas para su detección incluyen la medición de inhibina, testosterona y pregesterona.
La inhibina está elevada en aproximadamente el 90% de las yeguas con TCG, es responsable de la inactividad del ovario contralateral mediante la supresión de la liberación de la hormona FSH (Bailey et al., 2002). La testosterona puede estar elevada en aproximadamente el 50-60% de las yeguas afectadas, si un componente significativo de las células de la teca está presente en el tumor (es decir, un tumor de células de la teca-granulosa) (Bailey MT et al., 2002) y usualmente está relacionada con un comportamiento de tipo androgénico. La progesterona casi siempre está por debajo de 1 ng/ml, debido a la ausencia de ovulación y formación del cuerpo lúteo. Por lo tanto, las concentraciones de inhibina mayores de 0.7 ng/ml (Maurice, 2005), de testosterona mayores de 50-100 pg/ml, y de progesterona menores de 1 ng/ml, son sugestivos de un TCG en una yegua no gestante (McCue, 2007).
El tratamiento convencional utilizado en casos de falla ovulatoria está fundamentado en la utilización de hCG, hormona cuya aplicación en yeguas en estro que tengan edema uterino leve a moderado y un folículo ≥ 35 mm de diámetro, inducirá la ovulación en 36 ± 4 horas (McCue, 2007). El tratamiento con hCG es muy efectivo en yeguas jóvenes que no han recibido la hormona previamente y en yeguas adultas que reciben la hormona por primera vez en la temporada reproductiva. La hCG es usada además como fuente exógena de LH en programas de biotecnología reproductiva equina (Allen, 2002).
Otra alternativa terapéutica hormonal diferente a la hCG para inducir la ovulación en las yeguas, es la deslorelina, una hormona peptídica pequeña de 9 aminoácidos, que estimula una liberación prolongada de LH desde la glándula pituitaria de la yegua. La maduración folicular y la ovulación son inducidas por la LH endógena. El mecanismo de acción de la deslorelina es, por lo tanto, diferente al de la hCG, la cual tiene actividad inherente LH. La remoción del implante es recomendada una vez es detectada la ovulación, para prevenir la ocurrencia de una refractariedad pituitaria y un retardo en el retorno al estro (Pycock and Newcombe, 1996).
Debido a que el uso de hormonas exógenas para el tratamiento de alteraciones del ciclo estral en hembras puede afectar la futura vida reproductiva a causa de bloqueos del eje hipotalámico – hipofisiario – gonadal (McCue, 2007), o por efecto de reacciones de tipo inmune (McCue, 2007; McCue, 1998), como las ya conocidas por el uso de GnRH o HCG sintéticas (McCue, 2007), es posible utilizar tratamientos no convencionales de las medicinas alternas, con los cuales se busca trabajar sobre el tejido base del sistema alterado, para estimular respuestas naturales fisiológicas que no conlleven efectos colaterales indeseados. Durante años, la acupuntura, la terapia neural, la homeopatía, etc, han ofrecido la posibilidad de tratamiento a múltiples patologías orgánicas, apoyados en el estímulo que se logra en las células de los tejidos afectados, buscando restablecer el equilibrio energético celular perdido (Heel, 2006). Al parecer, el equilibrio energético celular fue restablecido mediante la aplicación del FK y el protocolo homeopático antihomotóxico, y posteriormente, se utilizó un protocolo hormonal convencional, buscando obtener una rápida respuesta en la yegua tratada.
Conclusión
Desde la perspectiva de la medicina alternativa, lo ideal para el tratamiento de la yegua del caso habría sido terminar todo el tratamiento con refuerzos celulares energéticos con terapia neural y homeopatía, pero ante la urgencia que se tenía de lograr una preñez en esta yegua, se optó por hacer uso de terapias convencionales hormonales, teniendo en cuenta que el sistema útero–ovárico estaba presentando signos de estabilización, lo que se tradujo en una rápida luteinización del folículo hemorrágico anovulatorio con la administración de hCG y su posterior luteolisis mediante la aplicación de la PgF2α. De conformidad con la literatura disponible a nuestro alcance, no se conocen reportes de casos similares al utilizado en este caso.
Agradecimientos
Los autores agradecen al Criadero El Edén (Sopetrán, Colombia), por todo el apoyo, la paciencia y la credibilidad puesta en los variados y múltiples usos de las terapias alternas para el manejo y tratamiento de diferentes tipos de patologías, incluido el caso descrito en el presente artículo.
Referencias
Acosta TJ, Beg MA, Ginther OJ. Aberrant blood flow area and plasma gonadotropin concentrations during the development of dominant-sized transitional anovulatory follicles in mares. Biol Reprod 2004; 71:637-642. [ Links ]
Allen WR. The development and application of the modern reproductive technologies to horse breeding. Reprod Domest Anim 2005; 40:310-329. [ Links ]
Bailey MT, Troedsson MH, Wheato JE. Inhibin concentrations in mares with granulosa cell tumors. Theriogenology 2002; 57:1885-1895. [ Links ]
Bergfelt D. Estrous synchronization. En: Samper JC (ed). Equine breeding management and artificial insemination. Philadelphia: Saunders; 2000. p.166-167. [ Links ]
Caldas MCS, Perdigão de Oliveira FRA, Rosa e Silva AAM. Chronobiological characterization of the first estrous cycle in Brasileiro de Hipismo mares during the postpartum period. Theriogenology 1994; 42:803-813. [ Links ]
Chen FJ, Day W, Evans G, Evans JW, Peterson KD. Follicular, estrus, gonadotropin and ovulation responses in anestrous mares treated with a GnRH analogue (CH 690030). J Equ Vet Sci 1993; 13:636-642. [ Links ]
Collins SM, Zieba DA, Williams GL. Continuous administration of low-dose GnRH in mares II. Pituitary and ovarian responses to uninterrupted treatment beginning near the autumnal equinox and continuing throughout the anovulatory season. Theriogenology 2007; 68:673-681. [ Links ]
Donadeu FX, Watson ED. Seasonal changes in ovarian activity: lessons learn from the horse. Anim Reprod Sci 2007; 100:225-242. [ Links ]
Dosch M. Illustrated Atlas of the techniques of neural therapy with local anesthetics. Heidelberg: Haug; 1985. p.11-15, 116-118. [ Links ]
Gastal EL, Gastal MO, Beg MA, Ginther OJ. Interrelationships among follicles during the common-growth phase of a follicular wave and capacity of individual follicles for dominance in mares. Reproduction 2004; 128:417-422. [ Links ]
Ginther OJ, Beg MA, Gastal EL, Gastal MO, Baerwald AR, et al. Systemic concentrations of hormones during the development of follicular waves in mares and women: a comparative study. Reproduction 2005; 130:379-388. [ Links ]
Ginther OJ, Gastal EL, Gastal MO, Beg MA. Incidence, endocrinology, vascularity, and morphology of hemorrhagic anovulatory follicles in mares. J Equ Vet Sci 2007; 27:130-139. [ Links ]
Ginther OJ, Gastal EL, Gastal MO, Beg MA. Intrafollicular effect of IGF1 on development of follicle dominance in mares. Anim Reprod Sci 2008; 105:417-423. [ Links ]
Ginther OJ, Woods BG, Meira C, Beg MA, Bergfelt DR. Hormonal mechanism of follicle deviation as indicated by major versus minor follicular waves during the transition into the anovulatory season in mares. Reproduction 2003; 126:653-660. [ Links ]
Head y Mckenzie, Terapia neural. Mexico, 2001. p. 250-254 [ Links ]
Heel. Ordinatio antihomotoxica et materia medica. Madrid: Edigrafos; 2006. p.330-332, 335-336, 363-364, 404-406; [ Links ]
Hinrichs K, Hunt PR. Ultrasound as an aid to diagnosis of granulosa cell tumour in the mare. Equine Vet J 1990; 22:99-103 [ Links ]
Irvine CH, Alexander SL, McKinnon AO. Reproductive hormone profiles in mares during the autumn transition as determined by collection of jugular blood at 6 h intervals throughout ovulatory and anovulatory cycles. J Reprod Fertil 2000; 118:101-109. [ Links ]
Maurice KT. Diagnosis and surgical removal of a granulosatheca cell tumor in a mare. Can Vet J 2005; 46:644-646. [ Links ]
McCue P. Ovarian abnormalities. Capítulo 13. En: Samper JC, Pycock JF, McKinnon AO. Current therapy in equine reproduction. Missouri: Saunders, 2007; p. 90-91. [ Links ]
McCue P. Review of ovarian abnormalities in the mare. En: Proceedings of the 44th annual convention of the American Association of Equine Practitioners. AAEP, Baltimore, 1998; p.126-128, 131. [ Links ]
McCue PM, Roser JF, Munro CJ, Liu IK, Lasley BL. Granulosa cell tumors of the equine ovary. Vet Clin North Am Equine Pract 2006; 22:799-817. [ Links ]
McCue PM. Ovulation failure. Capítulo 12. En: Samper JC, Pycock JF, McKinnon AO. Current therapy in equine reproduction. Missouri: Saunders; 2007. p. 83-86. [ Links ]
Otálvaro J. Evaluación de un programa de inseminación artificial con semen fresco en equinos. Trabajo de grado. Medicina Veterinaria, Facultad de Medicina Veterinaria y de Zootecnia, Universidad de Antioquia. 1996. 164p. [ Links ]
Pycock JF, Newcombe JR. The effect of the gonadotrophinreleasing hormone analog, buserelin, administered in diestrus on pregnancy rates and pregnancy failure in mares. Theriogenology 1996; 46:1097-1101. [ Links ]
Van Niekerk FE, Van Niekerk CH. The effect of dietary protein on reproduction in the mare. IV. Serum progestagen, FSH, LH and melatonin concentrations during the anovulatory, transitional and ovulatory periods in the non-pregnant mare. J S Afr Vet Assoc 1997; 68:114-120. [ Links ]
Van Niekerk FE, Van Niekerk CH. The effect of dietary protein on reproduction in the mare. III. Ovarian and uterine changes during the anovulatory, transitional and ovulatory periods in the non-pregnant mare. J S Afr Vet Assoc 1997; 68:86-92. [ Links ]
Van Niekerk FE, Van Niekerk CH. The effect of dietary protein on reproduction in the mare. II. Growth of foals, body mass of mares and serum protein concentration of mares during the anovulatory, transitional and pregnant periods. J S Afr Vet Assoc 1997; 68:81-85. [ Links ]
Vanderwall DK, Woods GL, Freeman DA, Weber JA, Rock RW, et al. Ovarian follicles, ovulations and progesterone concentrations in aged versus young mares. Theriogenology 1993; 40:21-32. [ Links ]
Vick MM, Sessions DR, Murphy BA, Kennedy EL, Reedy SE, et al. Obesity is associated with altered metabolic and reproductive activity in the mare: effects of metformin on insulin sensitivity and reproductive cyclicity. Reprod Fertil Dev 2006; 18:609-617. [ Links ]
Williams GL, Amstalden M, Blodgett GP, Ward JE, Unnerstall DA, et al. Continuous administration of low-dose GnRH in mares I. Control of persistent anovulation during the ovulatory season. Theriogenology 2007; 68:67-75. [ Links ]