Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.22 no.4 Medellín Oct./Dec. 2009
Selecciones
Perspectivas para el control del Virus de la Diarrea Viral Bovina (BVDV)¤
Perspectives to control Bovine Viral Diarrhea Virus (BVDV)
Perspectivas para o controle do vírus da diarréia viral Bovina (BVDV)
Diana S Vargas1,2*, MV; Jairo Jaime2, MV, MSc, PhD; Víctor J Vera2, MV, MSc, PhD;
1Estudiante de Maestría, Facultad de Medicina Veterinaria y de Zootecnia Universidad Nacional de Colombia, Sede Bogotá 2Grupo de investigación en Microbiología y Epidemiología. Universidad Nacional de Colombia, Sede Bogotá
(Recibido: 29 enero, 2009; aceptado: 28 julio, 2009)
Resumen
El virus de la diarrea viral bovina (VDVB) es uno de los agentes infecciosos más importantes del ganado bovino. Este patógeno tiene una distribución mundial y es endémico en la mayoría de las poblaciones bovinas donde alcanza un nivel de seropositividad del 40 al 80%. Así mismo, ocasiona pérdidas económicas principalmente de origen reproductivo. Una de las características más importantes de este virus es su alta frecuencia de mutación y la tendencia a la recombinación, lo que ha llevado a que tenga una gran diversidad genética y antigénica; problema que se ve reflejado en las múltiples manifestaciones clínicas observadas en los animales afectados y en el difícil control de la enfermedad. Los programas de control utilizados por algunos países se fundamentan en gran medida en la eliminación de la principal fuente de infección: los animales persistentemente infectados (PI), así como en mejorar la respuesta inmune mediante el empleo de vacunas. La inmunización con vacunas inactivadas y virus vivo modificado contra VDVB se ha empleado por décadas sin evidencia de una reducción significativa de la prevalencia de la enfermedad o un control de la infección, por lo cual se han empezado a desarrollar otras estrategias experimentales como las vacunas recombinantes, donde se seleccionan genes específicos del BVDV con el fin de inmunizar al ganado buscando superar los inconvenientes de las vacunas convencionales.
Palabras clave: programas de control, vacunas experimentales, vacunas tradicionales.
Summary
Bovine Viral Diarrhea Virus (BVDV) is one of the most important infectious agents in cattle population. BVDV is widespread throughout the world and it is endemic disease in most of the cattle population where 40 to 80% are seropositive. It causes economic losses mainly in breeding cattle. BVDV genetic and antigenic diversity is due to the virus high mutation and recombination frequency, which is reflected in many clinical manifestations and the difficult control of the disease. Control and prevention measures implemented by some countries are based on the elimination of the main source of infection: the persistently infected animals (PI animals), as well as the improvement of the immune response through the use of vaccines. Immunization with inactivated and modified-live vaccines has been used for decades without any significant improvement. New experimental strategies are being developed: recombinant vaccines where BVDV specific genes are selected in order to immunize cattle and thus overcome the shortcomings of conventional vaccines.
Key words: control programs, conventional vaccines, experimental vaccines.
Resumo
O vírus da diarréia viral bovina (VDVB) é um dos agentes mais importantes do gado bovino. Este patogénio tem uma distribuição mundial e é endêmico na maioria das populações bovinas onde alcança um nível de seropositividade do 40 ao 80%. Também ocasiona perdas econômicas, principalmente de origem reprodutivo. Uma das características mais importantes do vírus é sua alta freqüência de mutação e tendência à recombinação, o que tem ocasionado uma grande diversidade genética e antigênica; problema que ocasiona múltiples manifestações clinicas observadas nos animais afetados e no difícil controle da doença. Os programas de controle utilizados por alguns países que fundamentam em grande medida a eliminação da principal fonte de infecção: os animais persistentemente infectados (PI). Assim como melhorar a resposta imune mediante o uso de vacinas. A imunização com vacinas inativas e vírus vivo modificado contra o VDVB tem-se utilizado por décadas sim evidencia de uma redução significativa da prevalência da doença o um controle da infecção, pelo qual se utilizam estratégias experimentais como vacinas recombinantes, onde se selecionam genes específicos do BVDV com o propósito de imunizar o gado buscando superar os inconvenientes das vacinas convencionais.
Palavras chave: programas de controle, vacinas experimentais, vacinas tradicionais.
Introducción
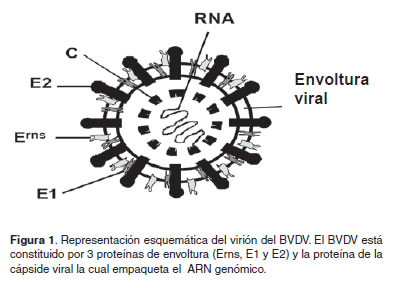
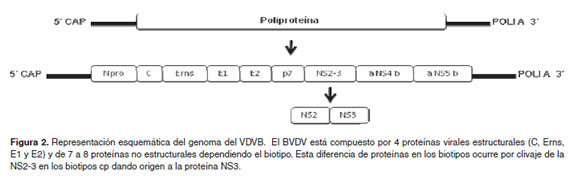
El Virus de la Diarrea Viral Bovina (BVDV) es un miembro del género pestivirus de la familia Flaviviridae, junto con los virus de la peste porcina clásica y la enfermedad de las fronteras en las ovejas (Muphy et al., 1999). El BVDV presenta forma esférica con un diámetro entre 40 a 60nm y está constituido por una cápside icosahédrica, rodeado de una envoltura lipóproteica proveniente de la membrana celular (Mettenleiter y Sobrino, 2008) (Figura 1). El genoma del VDVB es un RNA de polaridad positiva de 12.5 Kb, posee sólo un marco abierto de lectura (ORF) y en cada uno de sus extremos presenta regiones sin traducir o UTR (Untraslated región). El extremo 5’ UTR presenta una secuencia de nucleótidos que imita la estructura CAP, de los mRNAs con función de sitio de entrada ribosomal interno (IRES) que media la transducción de la poliproteína viral (Hellen y Breyne, 2007).
El ORF codifica para una poliproteína de aproximadamente 4000 aminoácidos, la cual es posteriormente clivada por enzimas virales y celulares (endoproteasas) en los diferentes polipéptidos (proteínas estructurales y no estructurales) (Agapov et al., 2004; Lectora, 2007) (Figura 2). Entre las proteínas estructurales más importantes se encuentra la glicoproteína (gp) E2, anticuerpos neutralizantes generados posterior a una que posee los epítopes que inducen la producción de infección y a la vacunación (Liang et al., 2006).
Historia y diversidad del BVDV
Este virus fue reconocido por primera vez en los Estados Unidos por Olafson en 1946, al detectar en hatos un síndrome agudo caracterizado por fiebre, diarrea, anorexia y tos (Baker, 1987). Ramsay y Chivers en 1953, describieron una enfermedad esporádica caracterizada por diarrea profusa, emaciación, ulceraciones en la mucosa del tracto alimenticio y una mortalidad del 100%. Luego, se determinó que el mismo virus era el responsable de los dos síndromes (Baker, 1987). A finales de los 60´s se describieron dos biotipos del virus: el citopático (cp) y el no citopático (ncp), caracterizados por su habilidad para causar efecto citopático y muerte celular en cultivos celulares in vitro. El biotipo cp induce destrucción masiva celular mediante la formación de vacuolas citoplasmáticas llevando a la muerte de las células pocos días después de la infección, a diferencia del biotipo ncp que no induce ningún efecto aparente en cultivo (Birk et al., 2008).
Los avances en secuenciación genética a finales de los ochenta permitieron establecer dos genotipos: el 1 y 2, caracterizados por diferencias en la región 5´ UTR y en la región que codifica para la proteína E2 principalmente. El genotipo 2, el cual surgió en Norte América y Canadá se correlaciona con sintomatología hemorrágica y alta mortalidad (Ridpath et al., 2006). De esta manera, en la naturaleza existen 2 biotipos y 2 genotipos. Adicionalmente, cada genotipo presenta subgenotipos los cuales muestran una homología entre sí del 80 al 85%. En la actualidad se han reportado en la literatura 11 subgenotipos de BVDV tipo 1 (a-j) y 2 subgenotipos del BVDV- 2 (a y b) (Ridpath, 2005). Esta diversidad genética del BVDV está asociada con la propensión de los virus RNA a modificaciones genómicas como mutaciones y recombinaciones (Bolin y Grooms, 2004).
En Colombia, los primeros reportes de la enfermedad datan de 1975, tras el ingreso al país de terneros enfermos importados desde Holanda. Los hallazgos a la necropsia y las pruebas serológicas de estos animales mostraron como diagnóstico la presencia de la “Enfermedad de las Mucosas (EM) “(Borda, 1975). Se han realizado diferentes estudios en el país, que comprueban su presencia. Entre estos están el estudio de Mogollón et al. (1990), donde se reporta por primera vez en el país un caso de EM, con aislamiento e identificación de los dos biotipos: ncp y cp (Vera et al., 2003). En 1994, se reportó una seropositividad del 89% al VDVB en 101 animales en fincas de la Sabana de Bogotá mediante la seroneutralización viral y se identificaron coinfecciones con otras entidades como IBR, leucosis y leptospira (Parra, 1994). Para la fecha se desconoce completamente si hay presencia del genotipo 2 en el país, pero este se ha aislado en Argentina y Brasil (Flores et al., 2002).
Presentación clínica
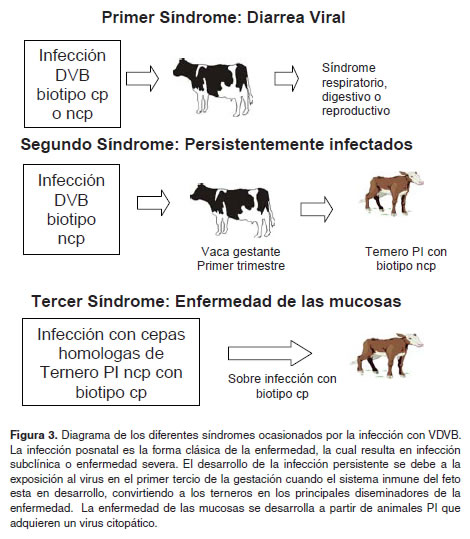
La infección del ganado con el VDVB puede resultar en uno de tres síndromes (Figura 3): Diarrea viral bovina (o infección postnatal primaria), la infección persistente y la enfermedad de las mucosas desarrollar una infección respiratoria, digestiva o (Potgieter, 1997). En la Infección postnatal, el reproductiva con sintomatología subclínica o severa animal se puede infectar con un biotipo cp o ncp y con alta mortalidad (Walz et al., 2001).
La enfermedad respiratoria puede ser una de las principales manifestaciones de la infección generalizada por BVDV. Existe evidencia epidemiológica y experimental de que BVDV está directamente asociado con el “complejo respiratorio bovino (CRB)” (Potgieter, 1997; Ridpath et al., 2007). La infección reproductiva o infección fetal está asociada con la diseminación transplacentaria del virus dependiendo del momento de la infección durante la gestación, provocando muerte embrionaria, aborto, inmunotolerancia, defectos congénitos, nacimiento de terneros débiles; aunque también pueden nacer terneros normales con anticuerpos neutralizantes precalostrales para BVDV (Grooms, 2004).
La Infección persistente ocurre en animales infectados entre los 35 a 125 días de la gestación con biotipos ncp. En este período, el sistema inmunológico fetal reconoce al virus como propio y no genera respuesta inmune contra este; por lo cual, estos animales nacen seronegativos y se convierten en los principales diseminadores o reservorios asintomáticos de la enfermedad (Campbell, 2004).
La enfermedad de las mucosas se desarrolla a partir de animales persistentemente infectados que adquieren un virus citopático. El desarrollo de este síndrome es dependiente de diferencias antigénicas o similitudes entre los dos biotipos del virus, por lo tanto, no todas las combinaciones de biotipos no citopáticos y citopáticos resultan en enfermedad de las mucosas. Es indispensable cierta homología entre las cepas para desarrollar esta forma de presentación (Baker, 1987). En este cuadro, la sintomatología cursa con pirexia, anorexia, diarrea aguda, úlceras en cavidad bucal. Presenta baja morbilidad y alta mortalidad que puede llegar al 100% (Campbell, 2004).
Otro síndrome reportado como el Síndrome hemorrágico, se comenzó a presentar en algunos hatos de USA y Canadá a mediados de los noventa, aunque ya se ha evidenciado en países de Europa y Sur América como Alemania y Brasil respectivamente (Ridpath et al., 2006; Vilcek et al., 2005). Su nombre se debe a la presentación de diarrea con sangre, epistaxis, congestión en conjuntiva y mucosas, hemorragias petequiales y equimóticas en mucosas, pirexia, leucopenia, linfopenia y neutropenia. Este síndrome se ha asociado a cepas del genotipo 2, aunque no todas las cepas son altamente virulentas (Chul et al., 2005; Ridpath et al., 2006).
La naturaleza insidiosa del virus ha llevado a grandes pérdidas económicas principalmente de origen reproductivo, reflejadas en las producciones de leche y carne. Estas pérdidas se relacionan con el aumento en el número de días abiertos, abortos, disminución en la calidad de semen, así como en los costos de tratamiento en animales enfermos y en las pérdidas en producción (Houe, 1999; Valle et al., 2005). La cuantificación de pérdidas económicas frente a la infección con BVDV en hatos lecheros en Europa se ha calculado entre 13-160 € por vaca al año dependiendo del tipo de presentación de la enfermedad (Fourichon et al., 2005). Las pérdidas se pueden incrementar cuando el BVDV se combina con otros patógenos como los del complejo respiratorio (Gunn et al., 2005).
En Colombia, no se han calculado las pérdidas económicas específicas para el BVDV, pero sí se han determinado las pérdidas económicas generales para todas las enfermedades reproductivas en 44.000 millones de pesos anuales, donde se infiere que la BVDV juega un papel importante debido a la alta prevalencia de la enfermedad (50-58%) en los hatos colombianos (Castañeda, 2004).
Control y prevención
La utilización de pruebas diagnosticas en los programas de control permiten: la vigilancia o monitoreo de la prevalencia a nivel del hato así como también a nivel regional; establecer el estatus del hato frente a la enfermedad, e identificar animales PI para su posterior eliminación (Sandvik, 2005). Entre las metodologías diagnósticas se tienen: la detección de antígeno, la detección de anticuerpos y la detección del genoma viral (Houe, 2006).
La detección del antígeno mediante el aislamiento viral se facilita debido a que el virus crece rápidamente en muchas líneas celulares. Sin embargo, esta prueba es de alto costo, su ejecución es laboriosa y se requieren varios días para obtener resultados (Saliki y Dubovi, 2004; Sandvik, 2005). Es importante resaltar que una limitante mayor para el aislamiento es la posibilidad de una contaminación de los cultivos celulares con virus adventicio de DVB proveniente del suero utilizado como suplemento, por tal motivo la interpretación de resultados se debe realizar cautelosamente (Ramírez, 1993). El aislamiento se realiza a partir de suero o sangre, tejidos fetales, secreciones corporales como fluido nasal, secreción vaginal, semen entre otros (Saliki y Dubovi, 2004). Los antígenos también se detectan en tejidos o improntas, mediante la utilización de las técnicas inmunohistoquímicas. Estas técnicas emplean anticuerpos (Acs) monoclonales o policlonales marcados, los cuales se visualizan con fluorescencia (IF) o peroxidasa (IP). Esta metodología es útil para confirmar el aislamiento, debido a que la replicación del VDVB en las células puede o no inducir un efecto citopático (Brodersen, 2004). Otra técnica de detección de antígeno es el ELISA de captura, la cual emplea anticuerpos monoclonales (MAbs) para inmovilizar un antígeno en particular como la proteína NS2-3 o la Erns (Sandvik, 2005).
La detección de Acs específicos se realiza mediante pruebas serológicas las cuales miden los títulos de anticuerpos tales como la seroneutralización o el ELISA indirecto y competitivo. Los resultados de estas pruebas varían de laboratorio a laboratorio, por la diversidad antigénica entre los diferentes aislamientos del VDVB (Saliki y Dubovi, 2004).
Los métodos de detección de genoma a través de la PCR se fundamentan en la capacidad de oligonucleótidos específicos de DNA para unirse a blancos de secuencias específicas como la región 5´del genoma. La RT-PCR ha tenido amplia distribución como método de diagnóstico; así como también para la genotipificación de cepas virales, permitiendo distinguir entre los diferentes virus dentro del género Pestivirus (Saliki y Dubovi, 2004).
Para la realización de esta prueba se emplean muestras de leche, órganos homogenizados o suero, posteriormente el RNA viral se purifica y se transcribe a DNA complementario (cDNA), mediante la enzima transcriptasa reversa. La aplicación de RT-PCR para propósitos diagnósticos puede verse limitada por la contaminación con RNAsas o proteínas, generando falsos negativos (Rossmanith et al., 2001).
El diagnóstico de los animales PI es de gran importancia debido a que ellos constituyen los principales diseminadores de la enfermedad representando entre el 1 al 2% de la población bovina afectada (Houe, 2006). Estos animales son inmunotolerantes, lo que indica que eliminan altas cantidades de virus sin presentar anticuerpos dificultando su diagnóstico cuando se emplean métodos serológicos. Por lo anterior, el diagnóstico de estos animales se debe basar en la detección del antígeno o del genoma viral. Entre los métodos disponibles se encuentra la RT-PCR; para animales mayores de 3 meses se puede realizar ELISA de captura de antígeno (Ag) o aislamiento viral, igualmente, la inmunohistoquímica en biopsia de piel (oreja) (Brodersen, 2004; Rossmanith et al., 2001). En nuestro país, ha sido usada la técnica de cultivo de linfocitos para detectar animales persistentemente infectados con el VDVB (Jaime J, 1996).
Programas de erradicación
En cuanto a la erradicación de la enfermedad, algunos países han instaurado programas basados en el control sistemático sin vacunación y el control sistemático con vacunación (Houe, 2006; Lindberg y Alenius, 1999).
El primero, el control sistemático sin vacunación, consiste en la identificación y eliminación de animales PI, seguido de un monitoreo continuo del hato, mediante la realización de pruebas diagnósticas para confirmar su estatus libre o para detectar nuevas infecciones (Lindberg et al., 2006). En este programa también se implementan medidas de bioseguridad como el control en el desplazamiento de animales entre fincas, la realización de cuarentenas para animales nuevos que ingresen a las fincas, uso de semen certifi cado libre de la enfermedad, control en el ingreso del personal al hato, entre otras (Lindberg et al., 2006). Este esquema se comenzó a implementar desde la década de los noventa en los países de la región escandinava (Dinamarca, Finlandia, Noruega, Suecia) donde en su mayoría hay declaración de erradicación de la enfermedad (Gunn et al., 2005; Valle et al., 2005). Posteriormente, las islas Shetland implementaron este programa donde también se declaró la erradicación del BVDV (Sandvik, 2004; Synge et al., 1999). Las pruebas diagnosticas realizadas bajo esta estrategia de erradicación se basan en serologías al azar o muestras del tanque de la leche para medir los títulos de anticuerpos, así como también la realización de RT-PCR (Houe, 2006).
El Control sistémico con vacunación, consiste en la implementación de esquemas de vacunación destinados a la erradicación. Este programa se ha desarrollado en países donde el control mediante la eliminación de PI y la implementación de medidas de bioseguridad no han sido suficientes, como es el caso de Alemania (Makoschey et al., 2001). En este país se implementó la vacunación con el fin de prevenir la reintroducción de la enfermedad y la reintroducción de animales PI. Con el empleo de vacunas se espera que se reduzcan los signos clínicos asociados con la infección con el BVDV y que estas provean un mejoramiento reproductivo al reducir las tasas de abortos, muertes embrionarias y el nacimiento de terneros PI.
Para un control eficiente de la enfermedad es importante que la vacunación confiera altos niveles de protección para la madre y para el feto; así mismo, que la vacuna proteja contra los dos genotipos de VBVB (Kelling, 2004). Entre los protocolos vacunales empleados se ha sugerido una primo-vacunación con una vacuna inactivada y 4 semanas después una revacunación con una vacuna a virus modificado; esto con el fin de generar una eficiente inmunidad humoral y celular, así como también desarrollar protección fetal (Moennig et al., 2005). En otros países como Colombia, los métodos de control para BVDV se basan sólo en el empleo de vacunas desconociendo el estatus libre del hato frente a la infección viral, de igual manera no se realiza la detección de animales PI y no se implementan medidas de bioseguridad, este tipo de programa es conocido como control no sistemático (Lindberg y Alenius, 1999; Lindberg et al., 2006).
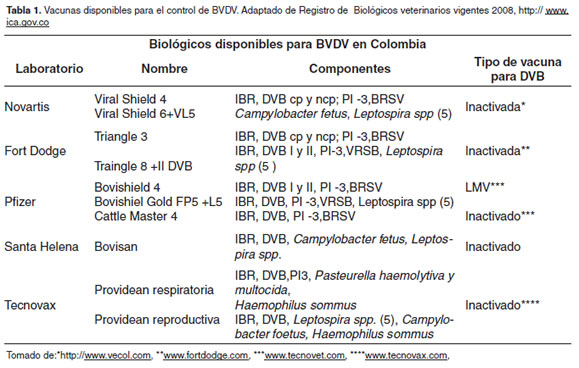
Entre las vacunas disponibles actualmente en el mercado nacional e internacional se encuentran las vacunas inactivadas y las de virus vivo modificado (VLM). En su mayoría, estas vacunas vienen en presentación polivalente junto con otros antígenos virales tales como: IBR (Rinotraqueitis Bovina Infecciosa), PI-3 (Parainfluenza Bovina), BRSV (Virus Sincitial Respiratorio Bovino); así como algunos antígenos bacterianos (Pasteurella spp, Moraxella spp, entre otros) (Tabla 1). Actualmente se vienen desarrollando vacunas con vectores recombinantes basadas en DNA plasmídico o vectores virales, las cuales todavía están en etapa de experimentación (Nobiron et al., 2003).
Vacunas Inactivadas. Son vacunas en las que los virus pierden su capacidad infectiva y replicativa mediante la inactivación con químicos como la Etilamina Binaria (BEI), la Beta propiolactona, entre otros. Este tipo de vacunas se deben administrar con adyuvantes para alcanzar una mejor respuesta inmune (Oirschot et al., 1999). Son vacunas muy seguras y se pueden administrar en cualquier momento de la gestación; pero requieren de una inmunización cada 6 meses para mantener los niveles de anticuerpos vacunales (Oirschot et al., 1999). Estas vacunas no inducen inmunidad celular y pueden retener una infectividad residual si la inactivación no fue realizada correctamente (Young et al., 2005). Así mismo, pueden inducir reacciones inflamatorias localizadas, y adicionalmente requieren altos costos en su producción (Makoschey et al., 2004).
Vacunas a virus vivo modificados (LMV). Estas vacunas contienen cepas atenuadas del VBDV capaces de replicarse en el huésped. La atenuación se realiza mediante pasajes en serie en los cultivos celulares (Oirschot et al., 1999). La inducción de la respuesta inmune es rápida pudiéndose detectar Acs dentro de las 4 semanas posvacunales y manteniéndose estos altos por más de un año. Entre las desventajas en el empleo de estas vacunas están la presentación de efectos colaterales por la capacidad de atravesar la barrera placentaria e infectar el feto, así como la generación de inmunosupresión predisponiendo al animal a infecciones con otros patógenos (Houe, 2006). La LMV ha mostrado seguridad cuando se administra al ganado 4 semanas pre-inseminación (Moennig et al., 2005). Estas vacunas también pueden presentar alta frecuencia de recombinación genética con cepas de campo y mala respuesta inmune por fallas en el almacenamiento o manejo (Kovács et al., 2003).
Muchas de las vacunas LMV e inactivadas que se encuentran comercialmente contienen el genotipo 1 y no proveen protección cruzada contra el genotipo 2, esto indica que la exposición a uno de estos genotipos no asegura la protección contra el otro. Se ha establecido una mayor protección cuando los animales se exponen al mismo genotipo con el cual han sido vacunados, que cuando se exponen a un genotipo diferente (Paton et al., 1999; Ridpath, 2005). Para mayor protección, algunas casas comerciales han introducido los dos genotipos en sus vacunas (Ridpath et al., 2007) (Tabla 1).
Vacunas en Experimentación
Con el advenimiento de la terapia génica se ha venido trabajando en el tratamiento de desórdenes genéticos, en la terapia contra el cáncer y en el desarrollo de vacunas (Polo y Dubensky, 2002). Este último constituye uno de los más importantes desarrollos en la historia de la vacunación, con el que se han logrado algunos avances en enfermedades para la salud pública como las ocasionadas por el Virus de Inmunodeficiencia humana (VIH), Hepatitis, malaria; y en enfermedades animales BVDV e IBR, entre otras (Leitner et al., 2000; Souza et al., 2005).
Entre las metodologías biotecnológicas más usadas para la generación de vacunas se encuentran el empleo de DNA plasmídico y los vectores virales. Estas técnicas se fundamentan en el uso de un vector que permite una eficiente expresión de un transgen (generalmente un antígeno viral) y su correcta presentación generando una potente inmunidad humoral y celular (Harpin et al., 1999; Liu y Murwe, 2003). Los vectores empleados en terapia génica se clasifican en dos categorías: virales y no virales (Bostock, 1990). Para incrementar su eficiencia cuando son empleados como vacunas recombinantes, se introducen elementos o secuencias dentro de los vectores que maximicen la expresión de las proteínas virales. Estos elementos son promotores, intrones, señales de poli-adenilación, entre otros (Leitner, W et al., 2000; Liang et al., 2006).
En el caso del BVDV, el transgen más empleado es el que codifica para la proteína viral más inmunogénica: la glicoproteína (gp) E2 de la envoltura. La secuencia de esta proteína se ha clonado de forma completa, truncada o quimérica (unida a proteínas del vector). Esto se debe a que cada una de estas formas modifica la expresión de la glicoproteína en la superficie celular y por consiguiente su presentación y respuesta inmune (Donofrio et al., 2006; Lian y Babiuk, 2007).
El empleo de la proteína incompleta se debe a que la proteína completa es retenida dentro de la célula ya que su extremo C-terminal funciona como dominio de anclaje de membrana; de igual manera, contiene una señal de localización intracelular la cual es responsable de su retención en el retículo endoplásmico. Esta retención hace que genere una menor respuesta inmune al no ser detectada por el sistema inmune, a diferencia de la proteína truncada o con deleción del dominio de anclaje en membrana, la cual alcanza la superficie celular y por lo tanto genera una mayor respuesta inmune (Donofrio et al., 2006).
Así mismo, la construcción de proteínas quiméricas unida a secuencias señales como la gp D del Herpesvirus o el factor activador plasminógeno t-Pas o unida a proteínas virales como la proteína G del VSV, facilitan la expresión de la proteína E2 en la superficie celular (Lian y Babiuk, 2007; Wang et al., 2003). Esta proteína ha sido la única detectada tanto en lisados como en sobrenadantes de cultivos de células Cos-7 transfectadas (Lian y Babiuk, 2007). Es importante resaltar, que no solo la versión completa o truncada de la proteína E2 afecta la respuesta inmune en el organismo, esta respuesta también está asociada con el tipo de vector en que se transporte la proteína. Igualmente con la presencia de promotores en el vector que faciliten la expresión del transgen.
En el mismo estudio de Liang et al (Lian R and Babiuk L, 2007), el plásmido DNA con la proteína E2 truncada unida a una secuencia señal fue la única capaz de inducir títulos neutralizantes posteriores a la inmunización de ratones. Estos resultados difieren de los realizados por Medhy et al. (Mehdy et al., 1999), donde la proteína E2 completa insertada en un vector adenoviral fue capaz de inducir títulos neutralizantes. En la construcción de plásmidos policistrónicos para el BVDV que codifiquen la proteína E2 de los dos genotipos, la expresión e inmunogenicidad se puede ver alterada por cambios conformacionales, esto se relaciona con la posición de las secuencias ya sea en el extremo C terminal o N terminal del plásmido. Se ha determinado que los plásmidos con las secuencias en el extremo N-terminal presentan una mayor expresión de la proteína transgénica (Lian y Babiuk, 2007; Mehdy et al., 1999).
La secuencia que codifica el gen de la proteína E2 es hipervariable, es decir, no se conserva entre los diferentes genotipos del virus (Stokstad et al., 2004), lo cual ha llevado al desarrollo de estudios con proteínas más conservadas entre los pestivirus, como la proteína C de la cápside, la proteína no estructural NS3, etc., (Elahi et al., 1999; Nobiron et al., 2000). Al trabajar con los genes de estas zonas conservadas se inducen anticuerpos contra desafíos homólogos y heterólogos; sin embargo, la protección luego de la vacunación con vectores que expresen estas proteínas es desconocida y la respuesta inmune sigue siendo mayor para desafíos con virus homólogos. Esto fue demostrado por Elahi et al (Elahi et al., 1999), al inocular ratones con vectores adenovirales que expresaban la NS3 del BVDV encontrando inmunidad celular mayor para el desafío con el genotipo 1 comparado con el genotipo 2 (Elahi et al., 1999; Young et al., 2005).Varios estudios con flavivirus han mostrado que las proteínas como la NS-3 son fuertes estimuladores de la inmunidad celular y que las proteínas de la envoltura son relativamente débiles (Elahi et al., 1999).
Las proteínas inmunogénicas del BVDV se han expresado a través de varios plásmidos DNA y en diferentes vectores virales. Entre los vectores virales vacunales usados para el BVDV y otros virus animales se encuentran: los herpesvirus, adenovirus, baculovirus, poxvirus, togavirus y retrovirus. Para poder ser empleados como vectores, a estos virus se les realiza deleción de genes involucrados en el proceso replicativo lo que disminuye su infectividad; en estos sitios de deleción se introduce el gen o genes de interés (transgen) (Bostock, 1990).
En algunos vectores virales se han realizado deleciones completas del genoma dejando sólo sus extremos para incrementar la capacidad de clonaje. En otros vectores se han realizado deleciones de secuencias para proteínas involucradas en la respuesta inmune del huésped para disminuir la citotoxicidad (Liu y Murwe, 2003). Entre las desventajas que presentan estas vacunas están la corta expresión del transgen, ya sea por la respuesta inmune generada contra las proteínas del vector viral o por la presencia de anticuerpos pre-existentes contra el virus que sirve como vector vacunal. Para solucionar este problema se utilizan serotipos virales que infectan otras especies contra los cuales no hay inmunidad preexistente (Jooss y Chimule, 2003). Otras de las desventajas potenciales son el riesgo de generar mutaciones por integración del vector viral en el genoma de la célula huésped (retrovirus), perdida de la atenuación y/o diseminación de una infección inadvertida (Leitner, et al., 2000).
En el caso de las vacunas de DNA plasmídico las cuales usan los plásmidos como vector, se puede expresar una (plásmidos monocistrónicos) o varias proteínas virales de interés (plásmidos policistrónicos) (Leitner et al., 2000; Lian y Babiuk, 2007). La respuesta inmune celular generada por estas vacunas ha mostrado ser mayor a la respuesta alcanzada por las vacunas vivas atenuadas; sin embargo, la respuesta inmune humoral se ha visto limitada probablemente debido a la cantidad de antígeno administrado intradermal o intramuscular ya sea mediante agujas hipodérmicas o mediante el uso de pistolas liberadoras de genes (Nobiron et al., 2000). Los plásmidos se pueden administrar de forma desnuda (N-DNA) o unidos a liposomas cationicos (L-DNA); estas dos formas inducen una respuesta inmune; sin embargo, estudios realizados por Harpin et al (Harpin et al.,1999), han mostrado luego del desafío con BVDV una mejor respuesta o mayor protección contra la enfermedad con el DNA desnudo que con el L-DNA (Harpin et al., 1999). Para lograr una mayor respuesta tanto humoral como celular se ha comenzado a introducir dentro del DNA plasmídico genes que codifiquen Interleuquinas, tales como la IL-2, IL4, IL12, entre otras; las cuales estimulan las células Th1 y Th2 (Kowalczyk y Erti, 1999; Liang et al., 2006).
Al igual que las vacunas convencionales, los factores que afectan la inmunogenicidad empleando vectores, son la ruta de administración y el número de inmunizaciones requeridas (Leitner et al., 2000). Adicionalmente, se debe tener en cuenta la estructura del vector (presencia de secuencias estimuladoras como promotores), cantidad del vector liberado y los niveles de expresión del antígeno (Leitner et al., 2000).
Como en otros virus RNA, el BVDV es un virus que presenta alta variabilidad genética, lo que se ve reflejado en las múltiples manifestaciones clínicas, en el difícil diagnóstico y control de la enfermedad. Los programas de control utilizados por algunos países se basan en la eliminación de animales PI, ya que estos constituyen los reservorios asintomáticos de la enfermedad, así como en mejorar la respuesta inmune mediante el empleo de vacunas. Independientemente del método de control utilizado, lo que se busca es prevenir la entrada del virus al hato no infectado, eliminar la circulación del virus en hatos infectados y disminuir las pérdidas económicas.
Para ejecutar un programa de control exitoso en cualquier hato se requiere conocer el estatus de la enfermedad, detectar la presencia de animales PI, determinar las características del hato (abierto o cerrado, número de animales, tipo de producción, entre otras) para implementar el siguiente paso: la eliminación paulatina de animales PI, la vacunación y el empleo de medidas de bioseguridad.
La mayor ventaja que se obtendría con la aplicación de vacunas en experimentación como las vacunas recombinantes, es que permiten trabajar con solo una fracción del genoma viral, particularmente con las proteínas más inmunogénicas contra las cuales están dirigidos la mayor parte de anticuerpos neutralizantes. Estas vacunas constituyen una alternativa promisoria para el desarrollo de vacunas seguras y efectivas en el control del VDVB. Aunque los estudios realizados han mostrado protección limitada, conviene seguir adelantando estudios para aumentar su inmunogenicidad.
El desarrollo de nuevas tecnologías para la generación de vacunas es una herramienta para el tratamiento de enfermedades de alto impacto para la salud humana y animal. Es importante resaltar que estas vacunas no buscan reemplazar las ya existentes; sin embargo, son una alternativa en enfermedades donde los biológicos tradicionales no han logrado buenos resultados como en el caso de BVDV. De igual manera, esta tecnología permite desarrollar biológicos a partir de cepas propias de una región para proteger las explotaciones ganaderas contra las cepas actuantes en el medio.
Referencias
Agapov E, Murray C, Frolov I, Qu L, Myers T. Uncleaved NS2-3 is required for production of infectious bovine viral diarrhea viral. J virol 2004; 78: 2414-2425. [ Links ]
Baker JC. Bovine viral diarrhea virus: a review. J Am Vet Med Assoc 1987; 190: 1449-58. [ Links ]
Birk A, Dubovi E, Cohen-Gould L, Donis R, Szeto H. Cytoplasmic vacuolization responses to cytopathic bovine viral diarrhea virus. Virus Research 2008; 132: 76-85. [ Links ]
Bolin S, Grooms D. Origination and consequences of bovine viral diarrhea virus diversity. Vet Clin Food Anim 2004; 20: 51-86. [ Links ]
Borda A. Diarrea viral bovina en terneros y terneras procedentes de Holanda. Tesis de pregrado, Facultad de Medicina Veterinaria, Universidad Nacional de Colombia, Bogotá, 1975. [ Links ]
Bostock CJ. Virus as vectors. Vet microbiology 1990; 23: 55-62. [ Links ]
Brodersen B. Immunohistochemistry used as a screening method for persistent bovine viral diarrhea virus infection. Vet Clin Food Anim 2004; 20: 85-93. [ Links ]
Campbell J. Effect of bovine viral diarrhea virus in the feedlot. Vet Clin Food Anim 2004; 20: 39-50. [ Links ]
Castañeda V. Implementación de la técnica de inmunohistoquímica para la detección del VDVB utilizando Acs monoclonales 15c5 en tejidos fijados con formol. Tesis de pregrado, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia, Bogotá ,2004. [ Links ]
Chul B, Walz P, Kennedy G, Kapil S. Biotype, genotype and clinical presentation associated with bovine viral diarrhea virus isolates from cattle. Intern J Appl Res Vet Med 2005; 3: 319-25. [ Links ]
Donofrio G, Bottarrelli E, Sandro C, Filippo C. Expression of Bovine Viral Diarrhea Virus Glycoprotein E2 as a soluble form in a Mammalian cell line. Clinical and vaccine immunology 2006; 13: 698-701. [ Links ]
Elahi SM, Shen SH, Harpin S, Talbot BG, Elazhary Y. Investigation of the inmunological properties of the bovine viral diarrea virus protein NS3 expressed by an adenovirus vector in mice. Arch Virol 1999; 144:1057-1070. [ Links ]
Elahi SM, Shen SH, Talbot BG, Massie B, Harpin S, Elazhary Y. Induction of humoral and cellular immune responses against the nucleocapsid of bovine viral diarrhea virus by adenovirus vector with an inducible promoter. Virology 1999; 261: 1-7. [ Links ]
Flores E, Ridpath J, Weiblen R, Vogel F, Gil L. Phylogenetic analysis of Brazilian Bovine Viral Diarrhea Virus type 2 (BVDV-2) isolates: Evidence for a a subgenotype within BVDV-2. Virus Research 2002; 87: 51-60. [ Links ]
Fourichon C, Beaudeau F, Bareille N, Seegers H. Quantification of economic losses consecutive to infection of a dairy herd with Bovine Viral Diarrhea Virus. Prev Vet Med 2005; 72: 177-81. [ Links ]
Grooms D. Reproductive consequences of infection with bovine viral diarrhea virus. Vet Clin North Am 2004; 20:5-19. [ Links ]
Gunn G, Saatkamp H, Humphry R, Stot A. 2005. Assesing economic and social pressure for the control of BVDV. Prev Vet Med 2005; 72: 149-162. [ Links ]
Harpin S, Hurley D, Mbikay M, Talbot B, Elazhary Y. Vaccination of cattle with a DNA plasmid encoding the Bovine Viral Diarrhea Virus major glycoprotein E2. Journal of general Virology 1999; 80: 3137-44. [ Links ]
Hellen C, Breyne S. A distinct group of Hepacivirus/Pestiviru_ like Internal Ribosomal Entry Sites (IRES) in members of Diverse Picornavirus genera: Evidence for Modular Exchange of Functional Noncoding RNA elements by Recombination. Journal of Virology 2007; 81: 5850-5863. [ Links ]
Houe H, Lindberg A, Moennig V. Test strategies in Bovine Viral Diarrhea Virus control and eradication campaigns in Europe. J Vet Diagn Invest 2006; 18: 427-36. [ Links ]
Houe H. Epidemiological features and economical importance of Bovine Viral Diarrhea Virus. Vet Microbiology 1999; 64: 89-107. [ Links ]
Jaime J. Infección persistente con el virus DVB en hatos lecheros de la Sabana de Bogotá. Tesis de Maestría, Facultad de Medicina Veterinaria, Universidad Nacional de Colombia, Bogotá, 1996. [ Links ]
Jooss K, Chimule N. Immunity Adenovirus and Adenovirus associated virus for gene therapy. Gene therapy 2003; 10: 955-63. [ Links ]
Kelling C. Evolution of bovine viral diarrhea virus vaccines. Vet Clin Food Anim 2004; 20: 115-129. [ Links ]
Kovács F, Magyar T, Rinehart C, Elbers K, Ohnesorge WC. The live attenuate bovine viral diarrhea virus components of a multi-valent vaccine confer protection against fetal infection. Vet Microbiol 2003; 96: 117-131 [ Links ]
Kowalczyk D, Erti H. Immune responses to DNA vaccines. Cell Mole Life Sci 1999; 55: 751-770. [ Links ]
Lectora W. Diarrea viral bovina: Actualización. Rev Vet 2003; 14: 1-17. [ Links ]
Leitner, W., Ying, H., Restifo, N. DNA and RNA-based vaccines: principles progress and prospects. Vaccine 2000; 18: 765-77. [ Links ]
Lian R, Babiuk L. Compatibiility of plasmid encoding bovine viral diarrhea virus type 1 and type 2 E2 in a single DNA vaccine formulation. Vaccine 2007; 25: 5994-6006. [ Links ]
Liang R, Hurk J, Babiuk L, Hurk F. Priming with DNA encoding E2 and boosting with E2 protein formulated with CpG oligodeoxinucleotid induces strong immune response and protection from BVDV in cattle. Journal of general Virology 2006; 87: 2971-82. [ Links ]
Lindberg A, Alenius S. Principles for eradication of bovine viral diarrhea virus (BVDV) infectious in cattle populations. Vet Microbiol 1999; 64: 197-222. [ Links ]
Lindberg A, Browlie J, Gunn G, Houe H, Moennig V. The control of bovine viral diarrhea virus in Europe: today and in the future. Rev sci tech off int Epiz 2006; 25:961-979. [ Links ]
Liu Q, Murwe Da. Molecular basis of the inflammatory response to Adenovirus vectors. Gene therapy 2003; 10: 935-940. [ Links ]
Makoschey B, Becher P, Orlich M, Thiel HJ, Lutticken D. Bovine viral diarrhea virus with deletions in the 5´-nontranslated region: reduction of replication in calves and induction of protective immunity. Vaccine 2004; 22:3285-3294. [ Links ]
Makoschey B, Janssen MG, Vrijenhoek MP, Korsten JHM. An inactivated bovine virus diarrhoea virus (BVDV) type 1 vaccine affords clinical protection against BVDV type 2. Vaccine 2001; 19:3261-3268. [ Links ]
Mehdy S, Shen S, Talbot B, Massie B, Harpin S, Elazhary Y. Recombinant adenoviruses expressing the E2 protein of Bovine Viral Diarrhea virus induce humoral and cellular responses. Microbiology Letters 1999; 177: 159-165. [ Links ]
Mettenleiter T, Sobrino F, editors. Animal Viruses: Molecular Biology. Madrid: Caister Academic Press; 2008. [ Links ]
Moennig V, Eicken K, Flebbe U, Frey HR, Grummer B. Implementation of two-step vaccination in the control of bovine viral diarrhea (BVD). Prev Vet Med 2005; 72:109-114. [ Links ]
Muphy F, Fauquet C, Bishop D, Ghabrial S, Jarvis A, editors. Virus taxonomy: Sixth Report of the International Commitee on Taxonomy of virus. Vienna and New YorK: Spinger-verlag; 1999. [ Links ]
Nobiron I, Thompson I, Browlie J, Collins M. DNA vaccination against Bovine Viral Diarrhea Virus induces humoral and cellular responses in cattle with evidence for protection against viral challenge. Vaccine 2003; 21: 2082-92. [ Links ]
Nobiron I, Thompson I, Brownlie J, Collins M. Coadministration of IL-2 enhances antigen-specifi c immune responses following vaccination with DNA encoding the glycoprotein E2 of bovine viral diarrhea virus. Vet microbiol 2000; 76:129-142. [ Links ]
Oirschot J, Brruschke C, Rijn P. Vaccination of cattle against Bovine Viral Diarrhea Virus. Vet Microbiol 1999; 64: 169-83. [ Links ]
Parra J. Influencia de la infección por el virus de la diarrea viral bovina (DVB) y de la coinfección con el virus de leucosis bovina, leptospira y rinotraqueitis bovina infecciosa (IBR) sobre la producción en ganado de leche. Universidad Nacional de Colombia 1994. [ Links ]
Paton D, Sharp G, Ibata G. Fetal cross-protection experiments between type 1 and type 2 BVDV in pregnant ewes. Vet Microbiol 1999; 64: 185-196. [ Links ]
Polo JM, Dubensky TW. Virus-based vectors for human vaccine applications. Research focus 2002; 7: 719-728. [ Links ]
Potgieter L, Bovine Respiratory Tract Disease caused by Bovine Viral Diarrhea virus. Vet Clin North Am 1997; 13:471-481. [ Links ]
Ramírez MC. Evaluación de cultivos celulares y SFB con PEI en el estudio del virus DVB. Trabajo de investigación. Facultad de Medicina veterinaria, Universidad Nacional de Colombia, Bogotá 1993. [ Links ]
Ridpath J. Practical significance of heterogeneity among BVDV strains: Impact of biotype and genotype on U.S. Control program. Prev Vet Med 2005; 72: 17-30. [ Links ]
Ridpath J, Neill J, Peterhans E. Impact of variation in acute virulence of BVDV 1 strain on design of better vaccine efficacy challenge models. Vaccine 2007; 25: 8058-66. [ Links ]
Ridpath J, Neill J, Vilcek S, Dubovi E, Carman S. Multiple outbreaks of severe acute BVDV in North America occurring between 1993 and 1995 linked to the same BVDV2 strain. Vet Microbiology 2006; 114: 196-204. [ Links ]
Rossmanith W, Vilcek S, Wenzl H, Rossmanith E, Loitsch A, et al. Improved antigen and nucleic acid detection in a Bovine Viral Diarrhea Virus eradication program. Vet microbial 2001; 81: 207-218. [ Links ]
Saliki J, Dubovi E. Laboratory diagnosis of bovine viral diarrhea virus infections. Vet Clin Food Anim 2004; 20: 69-83. [ Links ]
Sandvik T. Selection and use laboratory diagnostic assays in BVD control programmers. Prev Vet Medicine 2005; 72: 3-16. [ Links ]
Sandvik T. Progress of control and prevention programs for Bovine Viral Diarrhea Virus in Europe. Vet Clin Food Anim 2004; 20: 151-169. [ Links ]
Souza A. Haut L, Reyes A., Pinto A. Recombinant viruses as vaccines against viral diseases 2005. Brazilian Journal of Medical and Biological research 38: 509-22. [ Links ]
Stokstad M, Brownlie J, Collins M. Analysis of variation BVDV E2 sequence following transplacental infection in cattle. Vet Microbiol 2004; 102: 141-45. [ Links ]
Synge B, Clark A, Moar J, Nicolson T, Nettleton P, et al. Control of Bovine Viral Diarrhea Virus In Shetland. Vet Microbiol 1999: 64: 223-229. [ Links ]
Valle P, Skjerve E, Wayne S, Larsen R, Nyberg O. Ten years of BVDV control in Norway: A cost benefits analysis. Prev Vet Med 2005; 72: 189. [ Links ]
Vera V, Ramirez G, Villamil L, Jaime J. Biología molecular, epidemiología y control de IBR y BVDV. ed. Universidad Nacional de Colombia, Bogotá 2003. [ Links ]
Vilcek S, Durkovic B, Kolesarova M, Paton D. Genetic diversity of BVDV: Consequences for classification and molecular epidemiology. Prev Vet Med 2005; 72: 31-35. [ Links ]
Walz P, Bell T, Wells J, Grooms D, Kaiser L, et al. Relationship between degree of viremia and disease manifestations in calves with experimentally induced bovine viral diarrhea virus infection. Am J Vet Res 2001; 62: 1095-1103. [ Links ]
Wang L, Whitbeck C, Lawrence W, Volgin D, Bello L. Expression of the genomic form of the BVDV E2 ORF in a Bovine Herpesvirus-1 Vector. Virus genes 2003; 27:83-91. [ Links ]
Young N, Thomas C, Thompson I, Collins M, Brownlie J. Immune responses to non-strcutural protein 3 (NS3) of BVDV in NS3 DNA vaccinated and naturally infected cattle. Prev Vet Med 2005; 72: 115-120. [ Links ]