Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Ciencias Pecuarias
versión impresa ISSN 0120-0690versión On-line ISSN 2256-2958
Rev Colom Cienc Pecua v.23 n.1 Medellín ene./mar. 2010
Comparación de la activación y la cinética de la plasmina bufalina con la humana¤
Comparative activation and kinetic of plasmin bufaline with the human one
Ativação e cinética comparativa da plasmina bufalina e a humana
Omaira Cañas Bermúdez1, BSc; Alfonso Quijano Parra2, BsC,PhD; Luis FArbeláez Ramírez1*, MD, PhD.
1Grupo de Investigación en Biomoléculas, 2Grupo de Investigación en Química, Departamento de Química, Facultad de Ciencias Básicas, Universidad de Pamplona. Km 1 vía Bucaramanga. Pamplona-Colombia.
(Recibido: 14 febrero, 2008; aceptado: 26 enero, 2010)
Resumen
El plasminógeno es el zimógeno de la plasmina, enzima activada a nivel fisiológico por el activador tisular del plasminógeno y la urokinasa, la plasmina es la enzima encargada de disolver el coágulo sanguíneo. En este estudio se compararon la plasmina humana con la bufalina en su forma de activación de zimógeno a enzima y en la afinidad hacia el sustrato cromogénico. Los plasminógenos fueron purificados por el mismo método de cromatografías de afinidad y cambio iónico. De igual manera las activaciones se hicieron utilizando urokinasa humana en ambos casos. La plasmina bufalina demostró mayor activación y afinidad (1.35mM) que la plasmina humana (2.16 mM), siendo la bufalina 1.5 veces mas afin al sustrato cromogénico que la humana. Este estudio demuestra que el método de purificación de los plasminógenos puede ser el mismo para muchas especies, se demuestra una vez más que las plasminas animales al parecer son más eficientes en la disolución del coágulo o degradación de sustratos, que la plasmina humana. Este estudio indica que la plasmina bufalina puede ser utilizada en los parámetros que se determinan clínicamente en pacientes con problemas cardiovasculares, reduciendo el tiempo de determinación de estos parámetros fibrinolíticos, que pueden dar al médico un margen de tiempo superior para actuar.
Palabras clave: cinética, fibrinólisis, glu-plasminógeno, plasmina, urokinasa.
¤ Para citar este artículo: Cañas O, Quijano A, Arbeláez LF. Comparación de la activación y la cinética de la plasmina bufalina con la humana. Rev Colomb Cienc Pecu 2010; 23:47-54
* Autor para correspondencia: Luis Fernando Arbeláez Ramírez. Facultad de Ciencias Básicas, Universidad de Pamplona. Km 1 vía Bucaramanga. Pamplona-Colombia. Correo electrónico: luifer@unipamplona.edu.co
Summary
The Plasminogen is the zymogene of the Plasmin, enzyme which physiologically is activated by two different enzymes, the tissue plasminogen activator and the urokinase, the plasmin is the enzyme that dissolves blood clots. In this study the human plasmin was compared to the bufaline plasmin, in the activation from the zymogene to the enzyme form as well as in the affinity to the chromogenic substrate. The two plasminogens were purified by the same chromatographies methods: affinity and ion-exchange. Furthermore, both plasminogens were activated by human urokinase. The bufaline plasmin showed more activation and affinity (1.35 mM) that the human plasmin (2.16 mM), in addition, the bufaline plasmin demonstrated a 1.5 times more affinity to the chromogenic substrate that the human plasmin. This study demonstrated that the plasminogens of several species can be purified by this method. Besides, one more time the animal’s plasmins probably to be more efficient in the dissolution of blood clots or degradation of substrates than the human plasmin. More over this study indicated that the bufaline plasmin can be used in clinical determinations of patients with cardiovascular diseases. This also reduces the determination time of fibrinolytic parameters that physicians can give, having more time to take appropriate treatment.
Key words: fibrinolysis, glu-plasminogen, kinetics, plasmin, urokinase.
Resumo
O plasminogênio é o zymogen da plasmina, enzima ativada a nivel fisiológico pelo ativador tissular do plasminogênio e uroquinase, plasmina é a enzima responsável de dissolver o coágulo de sanguíneo. neste estudo foi comparada a plasmina humana com a plasmina búbalina em seu modo de ativação de zymogen a enzima e na afinidade substrato cromogênico. Os plasminogênio foram purificados como mesmo método de cromatografia de afinidade e de troca iônica, e as ativações foram feitas usando uroquinase humana nos dois casos. A Búfalo plasmina mostrou maior ativação e afinidade (1.35 mM) que a plasmina humana (2.16 mM), sendo a bufalina 1.5 vezes mais afim ao substrato Cromogênico que a humana. Este estudo mostrou que o método de purificação do plasminogênios pode ser o mesmo para muitas espécies, alem disso, que as plasminas animais são mais eficientes na dissolução do coágulo o degradação de substratos que a plasmina humana. Este estudo indicou que a plasmina búfalo pode ser utilizada nos parâmetros determinados clínicamente em pacientes com problemas cardiovasculares, diminuindo o tempo de determinação destes parâmetros fibrinolíticos, que podem dar ao médico um intervalo de maior tempo para atuar.
Palavras chave: fibrinólise, glu-plasminogênio, plasmina, uroquinase.
Introducción
El sistema de coagulación comprende cuatro eventos básicos, adhesión, activación, agregación plaquetaría y formación de la fibrina, que interactúan con las paredes de los vasos sanguíneos, en casos patológicos pueden obstruir la circulación (Spronk et al., 2004).
La coagulación inicia por la exposición del factor tisular, formando complejo con los factores VIIa y Xactivado (a), generando pequeñas cantidades de trombina la cual convierte el fi brinógeno en fibrina. Dentro de los anticoagulantes que regulan la coagulación están las proteínas C y S, que degradan el factor Va, el cual en complejo con el factor Xa potencian la producción de trombina. El trombo sirve además en el desarrollo del mecanismo fibrinolítico que activa el plasminógeno (Plg) a plasmina (Pli) esta última degrada la acumulación de fibrina, formando los productos de degradación de la fibrina y facilitando el correcto fl ujo sanguíneo (Walsh y Ahmad, 2002).
El Plg, está en la circulación sanguínea, su concentración plasmática es 2 μM (Wallen, 1980). La conversión del Plg a Pli involucra un corte proteolítico del enlace Arg561-Val562, el cual es mediado por los activadores, tisular del Plasminógeno (t-PA) y el tipo Urokinasa (u-PA). Estos activadores en la circulación son regulados por los Inhibidores de los activadores del Plg tipo 1 y 2 (PAI-1 y PAI 2), la Pli por la α2-antiplasmina (α2AP) y la α2-macroglobulina (Hernández y Marrero, 2005; Hyldgaard et al., 1 993).
La pro-uroquinasa tiene 54 kDa su activación ocurre por la acción de la Pli que hidroliza el enlace Lis158-Ile159 formando cadenas polipeptídicas de 20 y 34 kDa unidas por un puente disulfuro. (Bajaj y Castellino, 1977; Hernández y Marrero, 2005).
El complejo formado entre enzima-sustrato y la cinético fue propuesto por Michaelis-Menten (Michaelis y Menten, 1913), ha sido estudiada en otros Plgs de otras especies por Cañas et al. (Cañas et al., 2006; Cañas et al., 2007), Plg bovino (Schaller et al., 1985), Equino (Marcum et al., 1982), Canino (Leytus et al., 1981), Ovino (Paoni et al., 1977), porcino (Brunisholz y Rickli, 1981), algunas de estas especies comparadas con el humano por varios autores (Wolh et al., 1983), pero hasta la fecha la literatura no ha reportado evidencia sobre el estudio del Plg bufalino.
En este estudio se compara la activación y cinética de la Pli bufalina con la humana, lo que ampliara los conocimientos sobre el sistema fibrinolítico de especies mamíferas que contribuirá a un mejor entendimiento y manejo de los problemas cardiovasculares que agobian sobre todo al ser humano.
Materiales y métodos
Reactivos
Fenilmetilsulfonilfluoruro (PMSF), ε-amino acido caprioico (ε-ACA) y ácido clorhídrico de (Fabroquim), cloruro de sodio (NaCl), dimetilsulfoxido (DMSO) y acetato de sodio anhidro de (Riedel-de-Haën), N,N´-Metilen-bisacrilamida, persulfato de amonio, β-mercaptoetanol, sodio dodecyl sulfato (SDS), di-hidrógeno fosfato de sodio dihidratado de (Merck), lisina-sefarosa-4B de (Amersham Biosciences), ácido acético concentrado de (Baker), sustrato cromogénico para Pli Spectrozyme y u-PA (110.000 UI/ml) de (Amdiag).
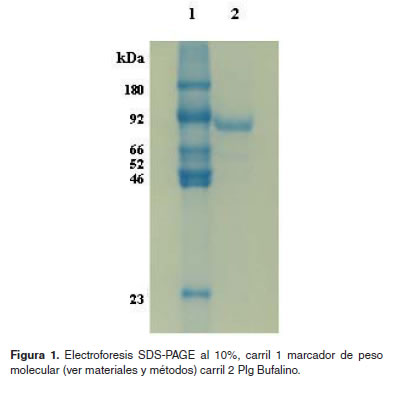
El volumen utilizado de sustrato fue el mismo para todas las pruebas (60 μl) a una concentración de 0.3 mM, el estándar de peso molecular usado fue: 180 KDa (α2-macroglobulina), 92 KDa (Glu-Plg), 66 KDa (cadena-α, fibrinσgeno humano), 52 KDa (cadena-β, fibrinσgeno humano), 46 KDa (cadena-γ, fibrinσgeno humano), 23.8 KDa (Tripsina), y el agua tipo 3, ambos de los laboratorios de Investigación en Biomoléculas (Universidad de Pamplona).
Toma y procesamiento de las muestras
La muestra del plasma humano fue suministrada por el Hospital Erasmo Meoz de la ciudad de Cúcuta-Colombia, analizado y certificado libre de antígenos como hepatitis, VIH, Chagas y otras enfermedades infecciosas.
La muestra del plasma bufalino fue tomada con la autorización del comité de ética de la Universidad de Pamplona, aprobada el 13 de julio de 2004. Dicha muestra se tomó bajo la supervisión de un médico veterinario, siguiendo las recomendaciones contempladas en el título V del decreto 08430, en la Granja experimental Villa Marina, propiedad de la Universidad de Pamplona, utilizando bolsas para extracción sanguínea con solución anticoagulante de citrato, fosfato, dextrosa y adenina (CPDA-1) de (BAXTER). A la sangre obtenida, se le añadió PMSF disuelto en DMSO, a una concentración final de 1 mM, con el fin de inhibir la actividad de las serino proteasas. Las muestras se mantuvieron refrigeradas y el plasma separado por centrifugación a 7.000 r.p.m. durante 15 min. a 4 ºC.
Purificación de los Plasminógenos
Los Plgs de las dos especies mamíferas fueron purificados por cromatografía de afinidad en Lisina-sefarosa, en un cromatógrafo Biologic LP (Biorad Laboratories, Hercules) según el método de Deutsch and Mertz (Deutsch y Mertz, 1970), la concentración fue determinada utilizando el coeficiente absorción de (ε1%)1cm = 1.6 (Appel et al., 1994), los Plgs fueron concentrados en una celda Amicon (Millipore, Bedford) utilizando membranas de celulosa regenerada de 10 kDa, hasta aproximadamente 1 mg/ml, luego se dializaron toda la noche a 4ºC con buffer 0.06M Tris, 0.06M NaCl, 0.02M HCl pH 8.5. Buffer (A) en una manguera de diálisis de 25 mm (Fisherbrand).
Posteriormente los Plgs obtenidos, fueron separados por cromatografía de cambio iónico según el método de Cañas (Cañas et al, 2006), la concentración del Plg fue determinada y las muestras fueron concentradas como se realizó en la cromatografía de afinidad y almacenadas a -80 ºC hasta su posterior uso.
Análisis electroforético
Las electroforesis SDS-PAGE se realizaron de acuerdo al método de Laemmli (Laemmli, 1970). Las muestras de Plgs de 5 μg fueron mezcladas con el buffer de muestra en un volumen 1:1 (vol/vol), fueron tratadas térmicamente por cinco minutos a 100 ºC y fueron visualizadas por tinción de Azul brillante de Coomassie. El marcador de peso molecular que se utilizo se describe en materiales y métodos.
Activación de los Plasminógenos
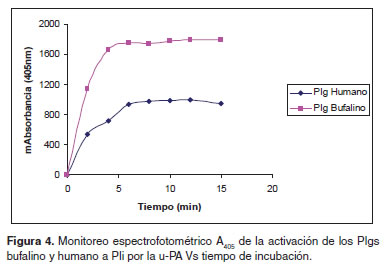
Se utilizó 1 mg para cada uno de los Plgs a una concentración de 1mg/ml y a una temperatura constante de 37 ºC, a los cuáles se les adicionó 6.72 μl de u-PA para una concentración final de 739.2 UI/ml “Solución activada”. Se monitoreó espectrofotométricamente A405 así: se tomaron ocho tubos con 60 μl de sustrato equivalentes a los diferentes tiempos de incubación (0, 2, 4, 6, 8, 10, 12 y 15 minutos) a los cuales se les adicionaron 3 μl de la “solución activada”, se dejaron reaccionar por 12 segundos, deteniendo la reacción con la adición de 10 μl de buffer acetato (BA) 4 M pH 3.8.
Al minuto 15, la activación de los Plgs se detuvo adicionando a las soluciones del “Plg activado”, 323 μl de glicerol al 100%, de tal manera que la concentración de glicerol final fue de 25%. La muestra activada, se homogenizó y se marcó con el número de lote correspondiente. Posteriormente, se porcionó y se almacenó a -20 ºC.
Adicionalmente, se determinó la absorbancia A405 de las ocho incubaciones, y se gráfico la A405 Vs. el tiempo de incubación.
Determinación de la concentración de Plasmina
De acuerdo al proveedor del sustrato cromogénico, la hidrolización con 10 (mA405) a 37 ºC corresponde a 1nM de Plis (Vinazzer, 1988).
A los tubos con sustrato, se les agregó 3 μl de la solución final activada y se incubaron por 0, 1 y 2 minutos respectivamente, la reacción se detuvo adicionando 10 μl de BA. La A405 se determinó para cada tubo y se convirtió en mA405/min.
Cinética de la Pli
Se estudió la cinética de las dos especies de Pli partiendo de una concentración común para ambas Plis de 2.7 μM, a una temperatura de 37 ºC y un pH 7.3. Su actividad se determinó por la velocidad de transformación del sustrato espectrofotométricamente a 405 nm utilizando las siguientes concentraciones de sustrato: 0.05, 0.08, 0.10, 0.13, 0.18, 0.25, 0.30 mM, a los cuales se les adiciono 3 μl de cada Pli. La reacción se detuvo con 10 μl de BA.
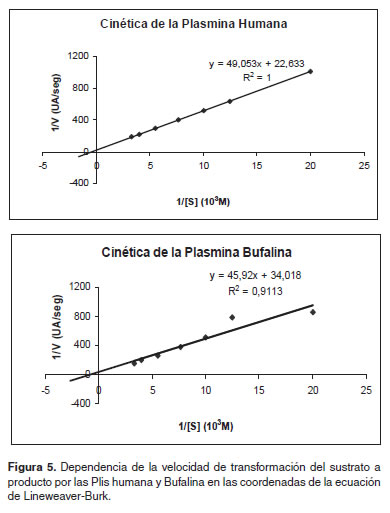
La absorbancia se determinó y se gráfi co según la ecuación de Lineweaver-Burk (Lineweaver y Burk, 1934).
Transferencia directa de los Plgs humano y bufalino a una membrana de (PVDF)
Para determinar la secuencia del N-terminal de los dos Plgs se realizó el método de transferencia como sigue: Se tomaron 2 μl de la proteína y se diluyó en 500 μl de ácido acético (CH3CH2OH), en agua desionizada tipo I al 0.1 % en un tubo para microcentrifuga. A continuación se tomaron varios trozos de membrana PVDF de un tamaño no mayor a 3 X 3 mm, y se humedecieron con metanol al 99% durante 15 segundos. A la solución proteica diluida se añadió un trozo de membrana PVDF totalmente húmeda con metanol, se agitó suavemente durante tres minutos y se mantuvo a una temperatura de 5 - 8 ºC agitando de igual manera cada 8-12 horas, luego de 2 días, se secó, se lavó 2 veces con metanol en agua tipo I al 20%. A la proteína se le determinó la secuencia del N-terminal según el método de Edman (Edman, 1970), por el doctor Per-Invarg Ohlsson de la Universidad de Umeå (Suecia).
Análisis densitométrico
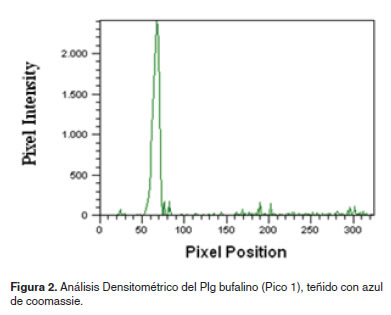
El análisis densitométrico de la banda del Plg bufalino se realizó en un escáner (Image Quant TL, Healthcare, Buckinghamshire-inglaterra) y se verificó el grado de pureza usando el software Image análisis software v 2003.
Resultados
Análisis electroforético
La pureza del Plg bufalino se determino mayor al 95% (Figura 1, carril 2), esta banda migra aproximadamente a la misma altura que el Plg humano utilizado en el marcador de peso molecular carril 1 banda 2 de 92 kDa.
Análisis densitométrico
El análisis densitométrico de la banda del Plg bufalino (Figura 2), estableció un pico de 98%, con un 1.46% de impurezas, confirmando la alta pureza de esta proteína.
Activación de los Plasminógenos
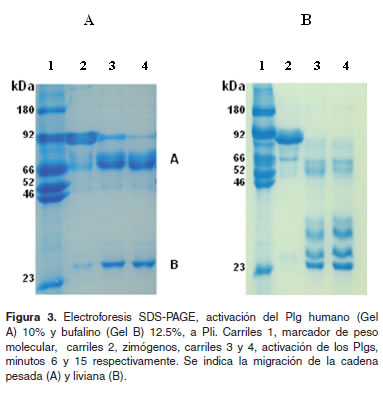
Se demostró la clásica forma de activación del Plg humano a Pli, formando las típicas bandas, pesada (A) y liviana (B) a los 6 y 15 minutos de incubación, carriles 3 y 4 respectivamente, donde se señaló a los 6 minutos que aún queda Plg por activar e inclusive a los 15 minutos no se ha activado a un 100%, al comparar con el carril 2 del cimógeno (Figura 3A).
Al hacer el mismo análisis al Plg bufalino (Figura 3B) se observó que al minuto 6 carril 3, ya no hay Plg para activar, además la cadena pesada A, mostró una degradación severa que al compararla con el Plg humano tiende a desaparecer y formar una serie de bandas de degradación (Figura 3B, carriles 3 y 4) y (Figura 3A, carriles 3 y 4).
La conversión de los Plgs bufalino y humano a Pli por activación con u-PA fue monitoreada por la hidrólisis del sustrato que se detectó espectrofotométricamente a 405 nm (Figura 4).
Cinética de la Plasmina
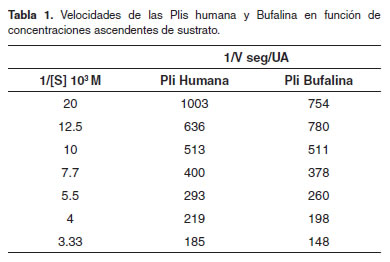
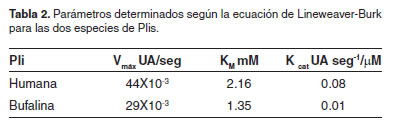
Los parámetros cinéticos para la Pli bufalina fueron determinados de acuerdo al método de Michaelis-Menten, en las coordenadas de Lineweaver-Burk (Figura 5), donde se observó el comportamiento de esta Pli. La velocidad de hidrólisis del sustrato por la Pli fue estudiada a una concentración de enzima constante y concentraciones ascendentes de sustrato. Los resultados de los parámetros cinéticos de los Plgs humano y bufalino se comparan y resumen en la tabla 1, columnas 2 y 3, respectivamente. Los parámetros de importancia cinética de las dos especies de Plis se determinan y se comparan en la tabla 2.
Secuenciamiento del N-terminal de los Plasminógenos humano y bufalino
El N-terminal de los Plgs, se determinaron, las letras en negrilla, son los aminoácidos (a.a.), que difieren al comparar las secuencias (Tabla 3).
Discusión
El Plg de búfalo, fue purificado, por el método de Cañas et al., demostrando una vez más, que este método puede ser utilizado para el aislamiento de esta molécula en muchas especies (Cañas et al., 2006; Cañas et al., 2007), contribuyendo así a la unificación del método de purifi cación, que facilitara el estudio homogéneo de esta molécula en muchas especies. Los parámetros cinéticos del Plg bufalino, fueron determinados por primera vez, ampliando los conocimientos de esta molécula en diferentes especies mamíferas, lo que permitirá la comparación de la misma entre especies, así mismo de los sistemas de coagulación y fibrinólisis en estos mamíferos. Conocimientos científicos que comparados con las dietas de las diferentes especies nos pueden dilucidar alguno de los motivos por los cuales el ser humano es aparentemente el más propenso a sufrir problemas cardiovasculares.
El Plg bufalino alcanza su máxima actividad antes del minuto tres, superando las demás especies estudiadas hasta ahora (Cañas et al., 2006; Cañas et al. 2007). A partir de este minuto se observó una clara tendencia a estabilizarse evidenciándose en la electroforesis realizada a los minutos 6 y 15 que mostró una clara degradación sobre todo de la cadena pesada (A), al compararla con la humana y las otras especies antes estudiadas donde no se distinguió la degradación a estos tiempos de incubación (Cañas et al., 2006; Cañas et al., 2007).
La Pli bufalina manifestó notablemente una mayor afinidad por el sustrato con una Km de 1.35 mM superando la del humano de 2.16 mM. Podría afirmarse que los riesgos de problemas cardiovasculares por formación de trombos en el bufalino serían muy inferiores a los del humano y otras especies estudiadas por Cañas (Cañas et al., 2006). Los resultados obtenidos en este estudio, indicaron que el Plg bufalino hidrolizó eficientemente el sustrato humano, hecho que facilitaría la utilización de éste para determinar los parámetros relacionados con problemas cardiovasculares (t-PA, PAI-1, PAI-2, α2-AP entre otros) (Topol, 2000).
La importancia de este estudio radica en que la alta afinidad que presentaron las Plis animales por el sustrato sintético utilizado, se puede interpretar en la misma forma, accionando sobre sustratos naturales que componen el trombo como la fibrina, lo que indicaría que estas Plis animales y sobre todo la bufalina, identificarían y degradarían la formación de los trombos de una manera más temprana y eficiente que la Pli humana, lo que traería como beneficio la rápida degradación del trombo. Esto facilitaría además las determinaciones en el diagnóstico clínico, en los laboratorios donde se determinan estos parámetros relacionados con problemas cardiovasculares, reduciendo el tiempo de determinación que puede ser vital para la toma de medidas por parte del médico. De otro lado, el secuenciamiento del N-terminal del Plg humano y bufalino difiere en dos a.a., datos que se asemejan a resultados obtenidos anteriormente (Brunisholz y Rickli, 1981; Schaller et al., 1985; Wiman, 1973), en los cuales las especies estudiadas tenían una diferencia exactamente en estos mismos a.a. Estos datos, fundamentan aún más la importancia que posee la identificación plena de la composición de a.a. de los diferentes Plgs y sus diferentes degradaciones a nivel fisiológico para su posterior uso clínico y terapéutico.
Agradecimientos
Los autores agradecen a la Dra. Esperanza Paredes rectora de la Universidad de Pamplona por su apoyo económico, al Dr. Torgny Stigbrand de la Universidad de Umeå por el soporte económico para la determinación de la secuencia del N-terminal de los Plasminógenos Humano y Bufalino, realizado muy amablemente por el Dr. Per-Ingvar Olhson en esta misma universidad. Por último agradecen la donación del plasma humano al hospital universitario Erasmo Meoz de Cúcuta, Colombia.
Referencias
Appel RD, Bairoch A, Hochstrasser DF. A new generation of information retrieval tools for biologist. Biochem Sci 1994; 19:258-260. [ Links ]
Bajaj AP, Castellino FJ. Activation of human Plasminogen by equimolar levels of streptokinase. J Biol Chem 1977; 252:492-498. [ Links ]
Brunisholz RA, Rickli EE. Primary Structure of Porcine Plasminogen Isolation and Characterization of CNBr-Fragments and Their Alignment within the Polypeptide Chain. Eur J Biochem 1981; 119:15-22. [ Links ]
Cañas O, Quijano A, Arbeláez LF. Activación y cinética comparativa de dos especies de plasminógenos: Humano y Bovino. Rev Bistua 2006; 4:3-12. [ Links ]
Cañas O, Quijano A, Arbeláez LF. Activación y comparación cinética del Plasminógeno Equino con el plasminógeno humano. Rev Bistua 2007; 5:43-52. [ Links ]
Deutsch DG, Mertz ET. Plasminogen purification from human plasma by affinity chromatography. Science 1970; 962:10951096. [ Links ]
Edman P. Sequence Determination Review. Mol Biol Biochem Biophys 1970; 8:211-255. [ Links ]
Hernández L, Marrero MA. Estreptoquinasa: a propósito de un agente trombolítico patentado en cuba. Biotecnología aplicada 2005; 22:182-190. [ Links ]
Hyldgaard JPE, Hagglof EM, Arbeláez LF, Stigbrand T, Shanbhag VP. Comparison of conformational changes of pregnancy zone protein and human α2-macroglobulin, a study using hydrophobic affinity partitioning. Biochim Biophys Acta 1993; 1164:152-158. [ Links ]
Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970; 227:680-685. [ Links ]
Leytus SP, Bowvles LK, Konisky J, Mangel WF. Activation of plasminogen to plasmin by a protease associated with the outer membrane of Escherichia coli. Proc Natl Acad Sci 1981; 78:1485-1489. [ Links ]
Lineweaver H, Burk D. The determination of enzyme dissociation constants J Amer Chem Soc 1934; 56:658-666. [ Links ]
Marcum JA, Highsmith RF, Kline DL. Streptokinase-dependent delayed activation of horse plasminogen. Biochim Biophys Acta 1982; 79:19-27. [ Links ]
Michaelis L, Menten ML. Kinetik der Invertinwirkung. Biochem 1913; Z 49:333-369. [ Links ]
Paoni NF, Violand BN, Castellino FJ. Isolation and characterization of native and lower molecular weight forms of sheep Plasminogen. The journal of biol chem 1977; 252:77257732. [ Links ]
Schaller J, Moser PW, Dannegger Muller GA Rosselet SJ, Kampfer U, Rickli. Complete amino acid sequence of bovine plasminogen, comparison with human plasminogen. Eur J Biochem 1985; 149:267-278. [ Links ]
Spronk MHH, Van der Voort D and Ten CH. Review Blood coagulation and the risk of atherothrombosis: a complex relationship. Tromb J 2004; 2:1-10. [ Links ]
Topol JE. Coronary disease, Acute myocardial infartaction thrombolysis. Heart 2000; 83:122-126. [ Links ]
Vinazzer H. Basic and practice in evaluating plasminogen. Haem 1988; 1:41-45. [ Links ]
Walsh PN, Ahmad SS. Proteases in blood clotting. Essays Biochem 2002; 38:95-111. [ Links ]
Wallen P. In: Biochemistry of Plasminogen. Fibrinolysis. eds Kline, D. L. And Reddy; 1980. p.2-25. [ Links ]
Wiman B. Human Plasminogen, Studies on its properties and mechanism of activation. University of Umeå. Medical disertation No 13 1973; 1-22. [ Links ]
Wolh RC, Sinio l, Summaria L, Robbins KC. Comparative activation kinetics of mammalian plasminogens. Biochim Biophys Acta 1983; 745 :20-31. [ Links ]