Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.23 no.3 Medellín July/Sept. 2010
Evaluación del crecimiento y sobrevivencia de larvas de bagre rayado Pseudoplatystoma fasciatum (Linneaus, 1766) alimentadas con alimento vivo natural y enriquecido con ácidos grasos¤
Growth and survivability of bagre rayado (Pseudoplatystoma fasciatum; Linneaus, 1766) larvae fed live feed enriched with fatty acids
Avaliação do crescimento e a sobrevivência de larvas de bagre rayado Pseudoplatystoma fasciatum (Linneaus, 1766) alimentadas com alimento vivo natural ou enriquecido com ácidos graxos
Lili J Marciales-Caro1,2*, Biol; John J Díaz-Olarte1,2, Biol; Víctor M Medina- Robles1,2, MVZ, MSc; Pablo E Cruz-Casallas1,2, MVZ, PhD.
1 Grupo de Investigación sobre Reproducción y Toxicología de Organismos Acuáticos GRITOX; 2 Instituto de Acuicultura, Universidad de los Llanos.
(Recibido: 20 abril. 2009; aceptado: 25 mayo, 2010)
Resumen
La producción de silúridos en etapas larvales implica un suministro adecuado de alimento, el cual debe suplir las necesidades nutricionales en cada especie. El uso de zooplancton nativo como alimento vivo y su sometimiento a procesos de enriquecimiento con ácidos grasos vegetales han permitido en parte alcanzar este objetivo, no obstante, su evaluación en cada una de las especies aún es necesaria. Por lo anterior, el objetivo del presente trabajo fue evaluar el crecimiento y sobrevivencia de larvas de bagre rayado Pseudoplatystoma fasciatum alimentadas con alimento vivo enriquecido con ácidos grasos. Para esto, fueron utilizadas larvas de 3 dpe obtenidas por reproducción artificial, las cuales fueron alimentadas 4 veces al día, durante 15 d con nauplios de Artemia y zooplancton nativo (Diaphanosoma sp. y Moina sp.) no enriquecidos y enriquecidos con una emulsión a base de 20% de Aceite de Canola, 7% de Lecitina de Soya y 73% de agua destilada, para suministrar 4 tratamientos: T1: Artemia Natural; T2: Artemia Enriquecida; T3: Cladóceros Natural; T4 Cladóceros Enriquecidos). Como resultados, el tratamiento que presentó la mayor ganancia de peso y talla fue el de larvas alimentadas con Artemia (91.9 ± 13.6 mg y 17.3 ± 1.1 mm, respectivamente), y la menor el tratamiento correspondiente a cladóceros enriquecidos con ácidos grasos (20.3 ± 2.5 mg y 9.9 ± 0.5 mm, respectivamente), sin embargo, las tasas más altas de sobrevivencia fueron observadas en los tratamientos de larvas alimentadas con cladóceros enriquecidos y no enriquecidos (58.8 ± 3.2 y 63.1 ± 6.4%, respectivamente), cuando comparadas con los tratamientos alimentados con artemia y artemia enriquecida (42.1 ± 9.3 y 49.8 ± 5.2%, respectivamente). En conclusión se observó que los procedimientos de enriquecimiento de zooplancton nativo aumentan la sobrevivencia larval en la especie, aun cuando las tasas de crecimiento son menores a las obtenidas con Artemia.
Palabras clave: enriquecimiento, primera alimentación, Pseudoplatystoma fasciatum, sobrevivencia, zooplancton.
Summary
The larval stages of Catfish require an adequate provision of feed to meet its nutritional requirements. Native zooplankton enriched with fatty acids has been used as live feed to achieve this objective. However, this feed should be evaluated for each particular species. Therefore, this study evaluated growth and survival of Bagre rayado (Pseudoplatystoma fasciatum) larvae fed live feed enriched with fatty acids. Bagre rayado larvae were obtained by artificial reproduction. Larvae were fed four times per day during 15 days. Live feed consisted of Artemia nauplii and native zooplankton (Diaphanosoma sp. and Moina sp.) non-enriched or enriched with a mixture containing 20% canola oil emulsion, 7% soya lecithin, and 73% distilled water. Dietary treatments were: T1 (non-enriched Artemia), T2 (enriched Artemia), T3 (non-enriched cladocerans), and T4 (enriched cladocerans). The highest weight gain and size were observed for T1 (91.9 ± 13.6 mg and 17.3 ± 1.1 mm, respectively), while the lowest were for T4 (20.3 ± 2.5 mg and 9.9 ± 0.5 mm, respectively). Nevertheless, the highest survival rates were observed for larvae fed enriched and non-enriched cladocerans (58.8 ± 3.2 and 63.1 ± 6.4%, respectively) in comparison with Artemia and enriched Artemia (42.1 ± 9.3 and 49.8 ± 5.2%, respectively). In conclusion, native zooplankton increased larval survival, although growth rates were lower than those obtained with Artemia.
Key words: enrichment, first feeding, Pseudoplatystoma fasciatum, survival, zooplankton.
Resumo
Para a produção de silurídeos, durante a fase larval é necessario o fornecimento de alimento que satisfaga as necessidades nutricionais da espécie. O uso de zooplâncton nativo natural ou submetido a enriquecimento com ácidos graxos de origem vegetal tem permitido, em parte, atingir esse objetivo; No entanto, sua avaliação em cada uma das espécies é mesmo necessária. Por tanto, o objetivo deste trabalho foi avaliar o crescimento e a sobrevivência de larvas do Bagre Rayado (Pseudoplatystoma fasciatum) alimentadas com zooplâncton vivo, enriquecido ou não com ácidos graxos. Para tal propósito, foram utilizadas larvas de 3 dias de idade, obtidas mediante reprodução artificial, as quais foram alimentadas 4 vezes ao dia, durante 15 d, com nauplios de Artemia ou zooplâncton nativo (cladóceras dos gêneros Diaphanosoma sp e Moina sp.) enriquecidas ou não com uma emulsão composta de 20% de óleo de canola, 7% de lecitina de soja e 73% de água destilada, para obter 4 tratamentos: T1, Artemia; T2, Artemia enriquecida; T3, Cladóceras; T4 Cladóceras enriquecidas. Os resultados revelaram que as larvas alimentadas com Artemia apresentaram ou maior ganho de peso e cumprimento corporal (91.9 ± 13.6 de mg e 17.3 ± 1.1 mm, respectivamente), em tanto que as larvas alimentadas com cladóceras enriquecidas com ácidos graxos foram as mais pequenas (20.3 ± 2.5 mg e 9.9 ± 0.5 mm, respectivamente); contudo, as maiores taxas de sobrevivência foram obtidas nos tratamentos de larvas alimentadas com cladóceras enriquecidas e não enriquecidas (58.8 ± 3.2 e 63.1 ± 6.4%, respectivamente), quando comparadas com os tratamentos baseados em Artemia natural e enriquecida (42.1 ± 9.3 e 49.8 ± 5.2%, respectivamente). Em conclusão, o estudo revelou que o enriquecimento do zooplâncton nativo aumenta a sobrevivência das larvas, porem as taxas de crescimento podem ser menores ás obtidas com Artemia.
Palavras chave: enriquecimento, primeira alimentação, Pseudoplatystoma fasciatum, sobrevivência, zooplâncton.
¤ Para citar este artículo:Marciales-Caro L, Díaz-Olarte J, Medina-Robles V, Cruz-Casallas P. Evaluación del crecimiento y sobrevivencia de larvas de bagre rayado Pseudoplatystoma fasciatum (Linneaus, 1766) alimentadas con alimento vivo natural y enriquecido con ácidos grasos.Rev Colomb Cienc Pecu 2010; 23:308-316.
* Autor para correspondencia: Lili J Marciales Caro. Instituto de Acuicultura, Universidad de los Llanos, Km 4 Vía Puerto López, Vereda Barcelona. Villavicencio, Meta, Colombia. E-mail: lilimarciales@gmail.com. Telefax: (8) 6616807 ext. 105.
Introducción
Actualmente, las investigaciones colombianas relacionadas con acuicultura buscan desarrollar paquetes tecnológicos para incorporar especies de silúridos a la piscicultura nacional. Estos procesos comenzaron con protocolos de reproducción, evaluados particularmente en especies como rayado (P. fasciatum) y yaque (L. marmoratus), obteniendo resultados positivos (Mira et al., 2007; 2008; Nuñez et al., 2008). En la larvicultura, el principal problema observado ha sido la alta tasa de mortalidad, siendo las causas más relevantes: a) Canibalismo, comportamiento derivado de sus hábitos piscívoros; b) Inadecuadas condiciones ambientales y c) Poco conocimiento de su hábitat y hábitos alimenticios en sistemas naturales (Atencio-Garcia y Zaniboni-Filho, 2006; Kestemont et al., 2003).
El cultivo en cautiverio de silúridos se dificulta por su exigencia en las condiciones de calidad de agua y su estricta dieta alimenticia (Link de Rosso, 2006; Lopes et al., 2006; Segura et al., 2004). Uno de los factores más importantes en la optimización del cultivo de silúridos es el suministro adecuado de alimento, el cual debe cumplir con el nivel de calidad nutricional que permita un equilibrio en el crecimiento, la sobrevivencia y conversión alimenticia para obtener un adecuado desempeño productivo (Hung, 2002; Kestemont, 2003).
En nuestro contexto, el alimento tradicional en larvicultura conocido como Artemia tiene como desventaja su alto costo, ya que no es producido nacionalmente y el proceso de eclosión en agua con salinidad cercana a las 33 ppt hace difícil su uso en larvas de peces de agua dulce. Para contrarrestar estos altos costos se ha propuesto reemplazar este producto de manera parcial o total por alimento natural. Diversos ensayos usando zooplancton han mostrado que, si bien la aceptación del alimento natural es idónea, no lo es la tasa de crecimiento, la cual es significativamente menor que la alcanzada por las larvas alimentadas con Artemia (Evangelista, 2005; Falanghe, 2003). Sin embargo, es posible mejorar la calidad del alimento vivo natural, suministrado a la etapa de larvicultura, para que su calidad nutricional sea equiparable a la ofrecida por la Artemia, realizando procedimientos de enriquecimiento de este alimento utilizando técnicas de incorporación de nutrientes o biocompuestos, tales como ácidos grasos, vitaminas, probióticos, antibióticos y fosfolípidos (Coutteau y Sorgeloos, 1997; Kim y Lee, 2005; Legendre et al., 1995).
Por lo anterior, el objetivo del presente trabajo fue evaluar el desempeño y sobrevivencia de larvas de bagre rayado, Pseudoplatystoma fasciatum, proporcionando como alimento Artemia y zooplancton de origen nativo, después de un proceso de enriquecimiento con ácidos grasos de origen vegetal (Canola y Soya).
Materiales y métodos
Producción de Alimento vivo
Para los experimentos de enriquecimiento de zooplancton nativo, cladóceros de los géneros Moina sp. y Diaphanosoma sp. fueron cultivados en piletas de concreto, siguiendo la metodología propuesta por Sipauba-Tavares y Rocha (2003) (Sipaúba-Tavares y Rocha, 2003), a partir de medios de cultivo orgánicos. Los cladóceros fueron cosechados con una malla de plancton de 60 μm, aproximadamente 24 horas antes de ser suministrados como alimento vivo a las larvas. Para el caso de la Artemia, esta fue sometida a proceso de eclosión bajo las condiciones descritas por Sorgeloos et al. (1986). Después de 8 horas post – eclosión, se procedió a realizar el enriquecimiento con ácidos grasos. Tanto los cladóceros como la Artemia, en cada uno de los tratamientos, fueron lavados brevemente con agua destilada, antes de ser suministrados a las larvas.
Preparación de emulsión de ácidos grasos y enriquecimiento de alimento vivo
Se preparó una emulsión de ácidos grasos, a base de canola y soya, en una proporción de 20% de Aceite de Canola, 7% de Lecitina de Soya y 73% de agua destilada, según el protocolo propuesto por Prieto-Guevara (2003). Los ingredientes se mantuvieron a temperatura constante (80 °C), mezclando primero el aceite de canola y la lecitina de soya hasta obtener una mezcla homogénea, la cual posteriormente fue añadida lentamente al agua, agitando constantemente hasta obtener una emulsión homogénea sin grumos o gránulos. Para el enriquecimiento de los cladóceros y la artemia, se adicionó directamente al medio de cultivo la emulsión de ácidos grasos, a razón de 10 ml/L, sometiendo durante 24 horas cada grupo de organismos a la emulsión, la cual es suministrada en una sola dosis al inicio del proceso, Posterior a esto, se procedió a cosechar los organismos, con una malla de 60 μm. Antes de ser suministrado como alimento, el zooplancton enriquecido fue lavado con agua destilada, para retirar excesos de emulsión y prevenir el deterioro de la calidad del agua.
Obtención de larvas y diseño experimental
Las larvas de bagre rayado (P. fasciatum) fueron obtenidas por reproducción artificial, usando Extracto de Hipófisis de Carpa, siguiendo los protocolos evaluados satisfactoriamente para esta especie (Mira et al., 2007; Nuñez et al., 2008; Varón et al., 2007). La eclosión ocurrió 18 – 24 h post fertilización. Tres días post-eclosión (dpe) las larvas fueron transportadas y distribuidas en 40 acuarios plásticos con capacidad de 4 L. cada uno. Se seleccionaron al azar 1040 larvas (longitud total de 5.28 ± 0.21 mm y peso de 1.29 ± 0.12 mg), las cuales fueron alojadas en cada acuario plástico, a una densidad de 10 larvas por litro, con aireación leve y constante. Durante el ensayo, se manejaron 3 L de volumen efectivo, para un total de 30 larvas por réplica. Antes de comenzar el experimento se permitió un día de adaptación a las condiciones experimentales y las larvas muertas fueron remplazadas con larvas del mismo desove para mantener la densidad de 10 larvas por litro. Los tratamientos fueron Artemia (A), Artemia enriquecida (AE), cladóceros (C) y, cladóceros enriquecidos (CE), y se realizaron en total 10 réplicas por cada tratamiento. La ración diaria fue dividida en 4 suministros (7:00, 11:00, 15:00, 19:00 h), a razón de 500 organismos por litro de alimento disponible por día hasta el día sexto, y 1000 organismos por litro disponible diario hasta el final del ensayo (15 d).
Calidad del agua
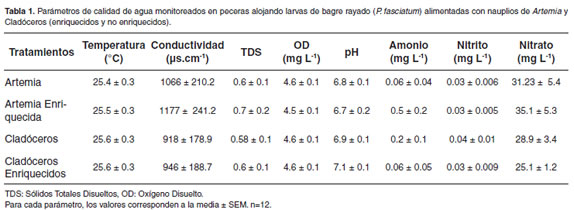
Para el mantenimiento de la calidad del agua, los acuarios fueron sifoneados diariamente realizando un recambio de 30% del volumen total de agua antes de la primera alimentación del día, con agua previamente madurada (ajustada a pH 7). El agua en los acuarios se mantuvo con una salinidad de 1 ppt, con el objeto de reducir el estrés en las larvas y prevenir infestaciones parasitarias. Para monitorear la calidad del agua, se determinaron diariamente las variables temperatura (°C), oxígeno disuelto (mg.L-1), conductividad (μs.cm-1), sólidos totales disueltos (gr.L-1) y pH, usando una sonda multiparamétrica (YSI professional plus, USA). Las variables Amonio (NH4), Nitritos (NO2) y Nitratos (NO3) fueron monitoreadas cada tres días usando un kit colorimétrico de aguas (Aquamerck, Alemania).
Determinación del crecimiento y sobrevivencia larval
Al final del ensayo, de cada réplica con 30 larvas /L, fueron tomadas al azar 5 larvas por acuario (20% aproximado de larvas por tratamiento) para obtener medidas de longitud y peso. La longitud total fue medida usando un calibrador (precisión de 0.01 mm) y el peso de cada larva fue determinado usando una balanza analítica (Ohaus, USA, 0.01 mg de sensibilidad) y un beaker con agua destilada para optimizar el procedimiento del pesaje larval. El número de individuos muertos fue registrado diariamente, y la tasa de sobrevivencia estimada al fi nal del experimento, con base en el número de individuos vivos por acuario al final del ensayo.
Análisis estadístico
Los datos fueron descritos como media ± error estándar de la media (SEM). Posteriormente, para analizar los efectos de los tratamientos se realizó un análisis de varianza (ANOVA) de dos vías tipo MLG, verificando previamente los supuestos de normalidad (prueba de Kolmogorov-Smirnov) y homogeneidad de varianzas (prueba de Levene). Los datos de crecimiento en longitud y peso fueron transformados en logaritmo natural (Ln) y los de sobrevivencia, transformados con la raíz del arco-seno. Adicionalmente, se utilizó la prueba de Duncan para comparar las medias entre los diferentes tratamientos. El criterio de significancia fue p<0,05. Los análisis estadísticos fueron realizados usando el programa SPSS.
Resultados
Calidad del agua
Los parámetros de calidad de agua, determinados a lo largo del ensayo se presentan en la tabla 1. La temperatura, oxígeno disuelto y pH fueron uniformes en todos los tratamientos a lo largo del muestreo; La conductividad presentó valores cercanos a los 1000 μs.cm-1, refl;ejando la salinidad mantenida en 1 ppt durante la fase experimental. Dentro de los compuestos nitrogenados no se observaron variaciones entre tratamientos, a excepción del amonio, el cual fue evidentemente más alto para los tratamientos que involucraron Artemia (A, AE) y el tratamiento con cladóceros sometidos a enriquecimiento con ácidos grasos. Aún cuando se realizó un lavado previo a la alimentación, los restos de emulsión de ácidos grasos afectaron la calidad de agua, lo que se refl;ejó en los valores de concentración de amonio; adicionalmente, la Artemia muere y se descompone después de 2 horas de ser proporcionada como alimento, lo cual afectó también la calidad del agua.
Crecimiento y sobrevivencia de larvas
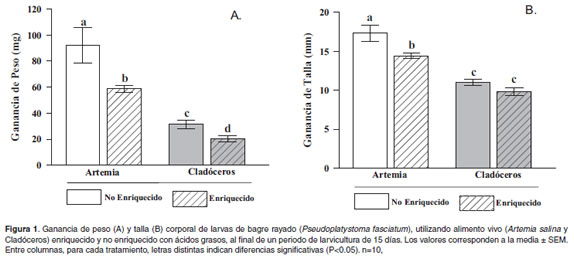
Se observaron diferencias significativas en las medias de longitud total (p<0.01) y peso corporal (p<0.01) de las larvas de P. fasciatum sometidas a los diferentes tratamientos durante 15 d (Figura 1). El crecimiento fue menor en las larvas alimentadas con cladóceros, en especial cladóceros enriquecidos (21.6 ± 2.5 mg y 15.1 ± 0.4 mm). El tratamiento que presentó la mayor ganancia de peso y talla fue el de larvas alimentadas con Artemia (91.9 ± 13.6 mg y 17.3 ± 1.1 mm, respectivamente) y la menor, el tratamiento de larvas alimentadas con cladóceros enriquecidos con ácidos grasos (20.3 ± 2.5 mg y 9.9 ± 0.5 mm, respectivamente). Dentro de los tratamientos alimentados con cladóceros, se observó un mejor rendimiento en cuanto a la ganancia de peso y talla en las larvas alimentadas con cladóceros sin enriquecer (31.4 ± 3.3 mg y 11.0 ± 0.4 mm, respectivamente).
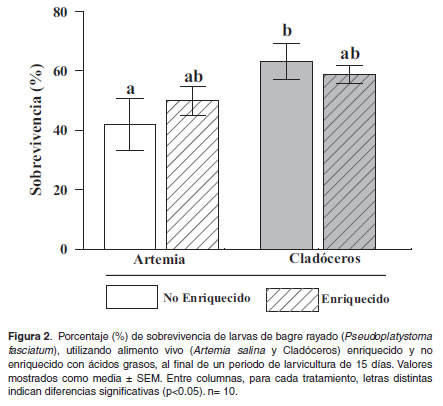
En cuanto al porcentaje de sobrevivencia el comportamiento fue diferente, se observó diferencia significativa (p<0.01) entre los tratamientos de Artemia y cladóceros no enriquecidos (Figura 2), siendo las tasas más altas de sobrevivencia las observadas en los tratamientos de larvas alimentadas con cladóceros enriquecidos y no enriquecidos (58.8 ± 3.2 y 63.1 ± 6.4%, respectivamente); en el caso de los tratamientos alimentados con Artemia y Artemia enriquecida las bajas tasas de sobrevivencia (42.1 ± 9.3 y 49.8 ± 5.2%, respectivamente) se deben principalmente a las conductas caníbales de las larvas, comportamiento evidenciado en mayor medida en estos tratamientos, y al rápido deterioro en la calidad del agua debido a la rápida descomposición de la Artemia en cada réplica.
Discusión
En el presente estudio se hace evidente que una de las principales ventajas al momento de usar organismos zooplanctónicos de origen natural como primera alimentación son las altas tasas de sobrevivencia, con respecto a las observadas en los tratamientos alimentados con Artemia, en donde la mortalidad se debió principalmente a comportamientos de canibalismo. El impacto del canibalismo depende directamente de la disponibilidad y la calidad de los recursos alimenticios, ya que cualquier restricción en este aspecto puede iniciar o aumentar este comportamiento (Baras y Jobling, 2002; Qin y Fast, 1996); existen reportes de reducción de la incidencia del canibalismo cuando están disponibles en el medio algunas presas alternativas.
El zooplancton nativo presenta en este aspecto una ventaja sobre la Artemia: permanece vivo y es disponible una mayor cantidad de tiempo. En el caso de la larvicultura de peces de agua dulce, el suministro de Artemia (de origen marino) implica un cambio en la salinidad, que ocasiona mortalidad después de efectuada la alimentación. Por tanto, la disponibilidad de alimento en los periodos presentados entre cada alimentación es menor en el caso de la Artemia, lo cual aumenta el canibalismo intraespecífico, disminuyendo la sobrevivencia.
Nuñez et al. (2008) reportan que larvas de P. fasciatum alimentadas con zooplancton natural y Artemia, presentaron tasas de sobrevivencia superiores al 60% en todos los casos, hasta los 15 días post-eclosión (dpe); posterior a este periodo de tiempo, decrecen considerablemente en los tratamientos alimentados con zooplancton natural, debido a que el zooplancton tiene baja digestibilidad de nutrientes y contenido de energía, así que los peces que persisten en forrajear estos individuos pueden tener una desventaja excesiva en el crecimiento con respecto a los que se vuelven caníbales (Baras y Jobling, 2002; Baras et al., 2003).
En ensayos de primera alimentación realizados con bagre asiático Clarias macrocephalus, la sobrevivencia se mantuvo durante 28 dpe por encima de 60%; sin embargo, la sobrevivencia fue mayor en el caso de las larvas alimentadas con Moina sp. que aquellas alimentadas con Artemia (Evangelista et al., 2005). Hung et al. (2002) reporta que para el bagre asiático Pangasius bocourti, la tasa de sobrevivencia en larvas alimentadas con Moina sp. fue más alta que en larvas alimentadas con Artemia y Tubifex, observando adicionalmente que las tasas más bajas de canibalismo se presentaron en las unidades experimentales alimentadas con Moina sp (Hung et al., 2002).
Aún cuando la sobrevivencia fue mayor en los tratamientos con larvas alimentadas con zooplancton de origen natural, el rendimiento en el crecimiento, tanto en talla como en peso siguen siendo menor cuando comparamos con tratamientos a base de Artemia, tal y como se evidenció en el presente estudio. En el caso del bagre asiático Clarias macrocephalus, se ha demostrado que aún cuando es posible reemplazar completamente la Artemia por zooplancton natural en la cría de las larvas, el crecimiento es menor en cuanto a ganancia de talla y peso, comparando con el alcanzado con larvas alimentadas con Artemia y con otros recursos de alimentación, como el Tubifex (Evangelista et al., 2005; Fermin y Bolivar, 1991). Resultados similares se han observado en los procesos de larvicultura de otros bagres como Heterobranchus longifilis (Ajah, 1997; Kerdchuen y Legendre, 1994) y el bagre asiático Pangasius bocourti (Hung et al., 2002).
El uso de cladóceros como alternativa alimenticia en la larvicultura de silúridos es posible; algunos estudios muestran un aumento significativo en el crecimiento de larvas alimentadas con Moina sp., como es el caso del bagre africano Clarias gariepinus y Heterobranchus bidorsalis (Adeyemo et al., 1994).
Estas diferencias en los proceso de larvicultura que involucran zooplancton natural como primera alimentación se deben principalmente a las diferentes condiciones de cultivo de zooplancton, que incide directamente en la calidad nutricional del mismo (Evangelista et al., 2005). Adicionalmente, es de gran importancia tener en cuenta otros factores que pueden afectar en gran medida los procesos de larvicultura, tales como la calidad de agua, densidades de siembra y la técnica de cultivo como tal (Lopes et al., 2001; Segura et al., 2004).
En el caso de las larvas alimentadas con cladóceros y Artemia enriquecidos, no se obtuvieron los resultados esperados, ya que el crecimiento definido como ganancia de talla y peso en las larvas fue menor que en sus homólogos sin enriquecer.
La gran cantidad de ácidos grasos esenciales requeridos durante los estadios larvales y postlarvales, difícilmente son obtenidos únicamente por síntesis endógena, por lo cual el défi cit debe ser suministrado adicionalmente junto con la dieta, enriqueciéndola a conveniencia (Prieto y Atencio, 2008). Sin embargo, el enriquecimiento de la dieta no implica necesariamente un aumento en la talla y peso de las larvas, ya que estas variables pueden verse infl;uenciadas por factores ambientales como la temperatura, el fotoperiodo, intensidad de la luz y factores relacionados con la alimentación, tales como la densidad de siembra, disponibilidad y composición de alimento en lo que puede definirse como una descompensación en el crecimiento, que consiste en un incremento en la heterogeneidad en la talla a lo largo del tiempo (Kestemont et al., 2003).
En conclusión, el presente estudio aporta una práctica de alimentación alternativa como herramienta para la disminución de costos de producción de larvas en bagre rayado, mostrando una optimización en la sobrevivencia larval lo cual ha sido uno de los principales inconvenientes en la especie. De igual forma, se recomienda evaluar otros procesos de enriquecimiento y fuentes de ácidos grasos con el objetivo de lograr aumentar la tasa de crecimiento durante esta fase y consolidar el proceso de larvicultura de esta especie.
Agradecimientos
El presente trabajo fue realizado en el marco del convenio 00325, suscrito entre el Servicio Nacional de Aprendizaje SENA y la Universidad de los Llanos, como parte del proyecto “Producción de alimento vivo nativo a partir de comunidades zooplanctónicas nativas para su utilización como primera alimentación en silúridos”. Los Autores agradecen al grupo de investigación GRITOX del Instituto de Acuicultura de la Universidad de los Llanos por su activa colaboración en el desarrollo del proyecto, y a los estudiantes de Licenciatura en Producción Agropecuaria Fabián Lugo Laverde y Jimmy Alexander Parra, por su excelente desempeño y apoyo en los ensayos de laboratorio.
Referencias
1. Adeyemo A, Oladosu G, Ayinla A. Growth and survival of fry of African catfish species, Clarias gariepinus Burchell, Heterobranchus bidorsalis Geoffery and Heteroclarias reared on Moina dubia in comparison with other first feed sources. Aquaculture 1994; 119:41-45. [ Links ]
2. Ajah P. Effects of live foods, artificial feedand their combination on growth and survival of African Clariid Catfish (Heterobranchus longiifilis Valenciennes,1840) larvae. Isr J Aquacult 1997; 49:205-213. [ Links ]
3. Atencio-García V, Zaniboni-Filho E. El canibalismo en la larvicultura de peces. Rev MVZ Córdoba 2006; 11:9-16. [ Links ]
4. Baras E, Jobling M. Dynamics of intracohort cannibalism in cultures fish. Aquacult Res 2002; 33:461-479. [ Links ]
5. Baras E, Kestemont P, Melard C. Effect of stocking density on the dynamics of cannibalism in sibling larvae of Perca fl;uviatilis under controlled conditions. Aquaculture 2003; 219:241-255. [ Links ]
6. Coutteau P, Sorgeloos P. Manipulation of dietary lipids, fatty acids and vitamins in zooplankton culture. Freshw Biol 1997; 38:501-512. [ Links ]
7. Evangelista A, Fortes N, Santiago C. Comparision of some live organism and artificial diet as feed for asian catfi sh Clarias macrocephalus (Günther) larvae. J Appl Ichthyol 2005; 21:437, 443. [ Links ]
8. Falanghe P, Mikos J, Schorer M, Campagnoli P, Bendhack F. Live and formulated diet evaluation through initial growth and survival of Jundiá larvae, Rhamdia quelen. Scientia Agricola 2003; 60:615-619. [ Links ]
9. Fermin A, Bolívar M. Larval rearing of the Philippine freshwater catfish, Clarias macrocephalus. Isr J Aquacult-Bamidgeh 1991; 43:87-94. [ Links ]
10. Hung L, Tuan N, Cacot P, Lazard J. Larval rearing of the Asian Catfish, Pangasius bocourti (Siluroidei, Pangasiidae): alternative feeds and weaning time. Aquaculture 2002; 212:115, 127. [ Links ]
11. Kerdchuen N, Legendre M. Larval rearing of an African catfish, Heterobranchus longifilis (Teleostei, Clariidae): a comparison between natural and artificial diet. Aquat Living Resour 1994; 7:247-253. [ Links ]
12. Kestemont P, Jourdan S, Houbart M, Melard C. Size heterogeneity, cannibalism and competition in cultured predatory fish larvae: biotic and abiotic infl; uences. Acuaculture 2003; 227:333-356. [ Links ]
13. Kim L, Lee S. Effects of the dietary protein and lipid levels on growth and body composition of bagrid catfish, Pseudobagrus fulvidraco. Aquaculture 2005; 243:323-329. [ Links ]
14. Legendre M, Kerdchuen N, Corraze G, Bergot P. Larval rearing of an African catfish Heterobranchus longifl;is (Teleostei, Clariidae): effect of dietary lipids on growth, survival and fatty acid composition of fry. Aquat Living Resour 1995; 8:355-363. [ Links ]
15. Link de Rosso F, Bolner K, Baldisserotto B. Ion fl;uxes in silver catfi sh (Rhamdia quelen) juveniles exposed to different dissolved oxygen levels. Neotrop Ichthyol 2006; 4:435-440. [ Links ]
16. Lopes J, Silva L, Baldisserotto B. Survival and growth of silver catfish larvae exposed to different water pH. Aquac Int 2001; 9:73-80. [ Links ]
17. Mira T, Castro S, Medina V, Murillo R, Otero A, Ramírez J, Zapata B, Velasco Y, Cruz P. Ensayos preliminares de reproducción inducida de bagre rayado Pseudoplatystoma fasciatum con extracto de hipófisis de carpa. Memorias de la XIII Jornada de Acuicultura Unillanos 2007; VIII: 65-67. [ Links ]
18. Mira T, Murillo R, Ramírez J, Otero A, Berruecos B, Medina V, Cruz P. Ensayos preliminares de reproducción inducida de yaque Leiarius marmoratus con extracto de hipófisis de carpa. En memorias del IV congreso colombiano de acuicultura, Carmen de Víboral, Antioquia. Rev Colomb Cienc Pecu 2008; 21: 517. [ Links ]
19. Nuñez J, Duque R, Corcuy-Arana N, Duponchelle F, Renno J, Raynaud T. Induced breeding and larval rearing of Surubí, Pseudoplatystoma fasciatum (Linneaus, 1766), from the bolivian Amazon. Aquac Res 2008; 39:764-776. [ Links ]
20. Prieto M. Enriquecimiento de Zooplâncton com óleo de peixe na larvicultura de Pacú, Piaractus mesopotamicus e Curimbatá, Prochilodus lineatus. Tesis de Maestria, Facultad de Zootecnia, Universidade Federal de Lavras, Minas Gerais, Brasil, 2003; 106 p. [ Links ]
21. Prieto M, Atencio V. Zooplancton en la larvicultura de Peces Neotropicales. MVZ de Córdoba 2008; 13:1415-1425. [ Links ]
22. Qin J, Fast A. Size and feed dependent cannibalism with juvenile snakehead Channa striatus. Aquaculture 1996; 144:313-320. [ Links ]
23. Segura L, Hayashi C, de Souza S, Soares C. Canibalismo entre larvas de pintado, Pseudoplatystoma corruscans, cultivadas sob diferentes densidades de estocagem. Acta Sci Biol Sci 2004; 26:299-302. [ Links ]
24. Sipaúba-Tavares L, Rocha O. Produção de Plâncton (fitoplâncton e Zooplâncton) para alimentação de Organismos Aquáticos. 1ra ed. São Carlos (BRA). RiMa; 2003. [ Links ]
25. Sorgeloos P, Lavens P, Leger P, Tackaert W, Versichele D. Manual for the culture and use of brine shrimp Artemia in aquaculture. Belgium: University of Ghent; 1986. [ Links ]
26. Varón D, Urueña F, Solano M. Evaluación comparativa del efecto del extracto pituitario de carpa (EPC) y gonadotropina coriónica humana (HCG) en las características seminales del bagre Rayado (Pseudoplatystoma fasciatum). Memorias del III congreso Internacional de Acuicultura. Rev Med Vet Zoot 2007; 54:245. [ Links ]