Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Ciencias Pecuarias
versão impressa ISSN 0120-0690versão On-line ISSN 2256-2958
Rev Colom Cienc Pecua v.23 n.3 Medellín jul./set. 2010
Caracterización de algunos parámetros de coagulación en el caballo criollo colombiano en el Valle de Aburrá-Antioquia¤
Characterization of coagulation parameters in Colombian creole horses from Valle de Aburrá (Antioquia province)
Caracterização de alguns parâmetros de coagulação do cavalo crioulo colombiano no Valle de Aburrá-Antioquia
Jhon D Ruíz1*, MV, MS, cPhD; Diego A Zuluaga1, MV; Paula Palomino1, MVZ; Felipe A Gómez1 MVZ; Juliana Loaiza1 MV.
1Grupo de Investigación en Ciencias de los Animales INCA-CES. Facultad de Medicina Veterinaria y Zootecnia. Universidad CES, Medellín, Colombia.
(Recibido: 19 marzo, 2009; aceptado: 22 junio, 2010)
Resumen
Actualmente no existen en el medio, parámetros de coagulación sanguínea que sean confiables para el desarrollo de la medicina y cirugía equina, lo que dificulta el pronóstico, diagnóstico y tratamiento de enfermedades importantes que alteran el sistema de coagulación en esta especie. El principal objetivo de este trabajo fue caracterizar los parámetros de coagulación sanguínea en el caballo criollo Colombiano (CCC) en el Valle de Aburrá, mediante la utilización de pruebas de coagulación de campo como Tiempo de Coagulación (TP) Tiempo de Sangría (TS) y pruebas de laboratorio como Tiempo de Protrombina (TP), Tiempo Parcial de Tromboplastina (TPT) y Recuento de Plaquetas (RP). Para calcular el tamaño muestral, se realizó una prueba piloto con siete ejemplares criollos colombianos; los resultados estadísticos indicaron que el tamaño de muestra necesario era de 162 animales para recuento de plaquetas y al menos 43 animales para las demás pruebas. Los animales fueron divididos en 6 grupos que dependieron de la etapa reproductiva en que se encontraban. El promedio de los resultados de las pruebas de coagulación normales para el CCC del Valle de Aburrá fueron TP: 11.46 ± 0.085 seg; TPT: 37.26 ± 1.83 seg; TS: 2.08 ± 0.11 min; TC: 8.44 ± 0.39 min y RP: 333.998 ± 33.778 plaq/μl; no tubo diferencias estadísticamente significativas entre los grupos diferentes grupos reproductivos.
Palabras clave: coagulación, equinos, hemorragias, sangrado.
Summary
There is a lack of reliable information on blood clotting parameters for Colombian Creole horses, which compromises the diagnosis, treatment and prognosis of those diseases that affect coagulation in this species. The main objective of this study was to characterize blood clotting parameters in Colombian Creole horses from Valle de Aburrá, through the use of field and lab tests such as Coagulation Time (CT), Bleeding Time (BT), Prothrombin Time (PT), Thromboplastin Partial Time (TPT), and Platelet Count (PC). Sample size was calculated by conducting a pre-test using seven horses. The sample size required was 162 animals for the platelet count and at least 43 animals for the other tests. Animals were divided into 6 groups according to their reproductive stage. Results for normal blood clotting parameters were PT: 11.46 ± 0.085 sec; PTT: 37.26 ± 1.83 sec; BT: 2.08 ± 0.11 min, CT: 8.44 ± 0.39 min, PC: 333.998 ± 33.778 plat/ μl. There were no statistical differences among reproductive stages.
Key words: bleeding, coagulation, equine, hemorrhages.
Resumo
Atualmente não existem no meio, parâmetros de coagulação sanguínea que sejam confiáveis para o desenvolvimento da medicina e cirurgia eqüina, o que dificulta o prognóstico, diagnóstico e tratamento de doenças importantes que alteram o sistema de coagulação na espécie. O principal objetivo do trabalho foi caracterizar os parâmetros de coagulação sanguínea no Cavalo Crioulo Colombiano (CCC) no Valle de Aburrá, mediante a utilização de testes de coagulação em campo como no Tempo de Coagulação (TC) , tempo de sangria no Valle de Aburrá e testes de laboratório como o tempo de Protrombina (TP), Tempo Parcial de Tromboplastina (TPT) e Reconto de Plaquetas (RP). Para calcular o tamanho amostral foi realizada um teste piloto com sete exemplares CCC; Os resultados estadísticos indicaram que o tamanho de amostral necessário era de 162 animais para reconto de plaquetas e ao menos 43 animais para os outros testes. Os animais foram divididos em seis grupos que dependeram da etapa reprodutiva. A media dos resultados dos testes de coagulação normais para CCC do Valle de Aburrá furam: TP: 11.46 ± 0.085 seg; TPT: 37.26 ± 1.83 seg; TS: 2.08 ± 0.11 min; TC: 8.44 ± 0.39 min y RP: 333.998 ± 33.778 plaq/μl; não existiram diferenças estatísticas significativas para os grupos reprodutivos.
Palavras chave: coagulação, eqüinos, hemorragias, sangrado.
¤ Para citar este artículo:. Ruíz JD, Zuluaga DA, Palomino P, Gómez FA. Caracterización de algunos parámetros de coagulación en el caballo criollo colombiano en el Valle de Aburrá-Antioquia.Rev Colomb Cienc Pecu 2010; 23:359-367.
* Autor para correspondencia: Jhon Didier Ruíz. Facultad de Medicina Veterinaria y Zootecnia. Universidad CES. Calle 10ª No 22-04. Medellín Colombia. E-mail: didieruiz@hotmail.com.
Introducción
Las especies animales tienen un sistema especializado para mantener la sangre dentro del sistema vascular, en forma líquida y sin coágulos; sin embargo, permite la formación rápida de un tapón sólido de sangre (coágulo) para obturar las lesiones de los vasos sanguíneos, este proceso se conoce como hemostasia normal (Feldman et al., 2000; Richard, 1999; Thrall et al., 2004). El cese de una hemorragia es fruto de la participación coordinada de múltiples mecanismos. La integridad de la pared vascular y la turgencia de los tejidos que los rodea impiden la salida de sangre del lecho vascular (García, 1995). Los vasos sanguíneos afectados se contraen por mecanismos neurógenos reflejos, haciendo más difícil el derrame de sangre (Fox, 2003; García, 1995; Guyton and Hall, 2006). Las células endoteliales al ser injuriadas exponen el colágeno subendotelial altamente trombogénico al que se adhieren las plaquetas y se sella el punto de fuga en el vaso (Richard and Mitchell, 1999). Finalmente por un mecanismo bioquímico, se forma un coágulo sanguíneo que lleva a la oclusión completa de la abertura existente impidiendo la pérdida adicional de sangre. Esta función fisiológica se ejerce varias veces al día por la ruptura de vasos de pequeño calibre por traumatismos o variaciones de la presión sanguínea. La rapidez en la detección de la hemorragia evita que el individuo tenga conciencia de estos pequeños accidentes (García, 1995; Greer et al., 2004).
El proceso hemostático, se puede dividir en tres fases: fase vascular, fase plaquetaria y fase plasmática; las fases vascular y plaquetaria constituyen la hemostasia primaria, que concluye con la formación de un trombo hemostático como resultado de la agregación plaquetaria; la fase plasmática comprende la coagulación y esta precede a la fibrinólisis, proceso en el que se disipan los residuos fibrosos producto de la hemostasia (Beutler et al., 1990; Smith et al., 2005; Pelagalli et al., 2003).
La activación de la coagulación se divide en una vía extrínseca y una vía intrínseca, que se unen en el punto en el cual se activa el factor X (García, 1995; Richard, 1999; Guyton and Hall, 2006). La vía intrínseca de la coagulación se inicia por la activación por contacto del plasma con estructuras subendoteliales con carga negativa, tales como el colágeno o la membrana basal de la pared vascular, desencadenando una serie de reacciones. El factor XIIa activa al factor XI, con precalicreina y cininógeno de alto peso molecular. Cuando el factor XI se activa, activa al factor IX. El XIa forma un complejo con el factor VIIIa (que se activa cuando se separa del factor Von Willerbrand), y junto con fosfolípidos e iones de calcio, activan al factor X (Fox, 2003, García, 1995, Tresguerres et al., 2005). La vía extrínseca se activa cuando la sangre abandona los vasos sanguíneos y establece contacto con la tromboplastina tisular. El factor III (tromboplastina tisular), activa al factor VII, que al quedar activado (VIIa) y junto con el factor III, activan a los factores IX y X (Richard, 1999; Tresguerres et al., 2005).
La vía intrínseca y la extrínseca se unen con la activación del factor X (Guyton and Hall, 2006; Richard, 1999; Tresguerres et al., 2005). Luego de la activación del factor X, en presencia de calcio, y el factor V, el factor Xa cataliza la conversión de protrombina en trombina, la trombina activada, activa al fibrinógeno y el fibrinógeno al activarse se convierte en fibrina (García, 1995; Mishke, 2000; Tresguerres et al., 2005).
El proceso de coagulación es regulado por la fase de fibrinólisis, que se pone en marcha cuando ha terminado la hemostasia. Este proceso representa un sistema antagonista de la coagulación. El plasminógeno, componente normal del coágulo, se activa en plasmina por medio de activadores de la plasmina, sustancias liberadas por las células endoteliales y los fibroblastos, utilizando como cofactor la fibrina (García, 1995; Guyton and Hall, 2006; Richard, 1999). La plasmina es una enzima proteolítica, cuya función es degradar las cadenas de fibrina, y tiene actividad catalítica sobre el fibrinógeno, la protrombina y los factores V, VII y XII (Landoni, 2002).
Pruebas de coagulación
La finalidad de la coagulación es la formación de fibrina. Los procesos reactivos para llegar a este fin pueden seguir diferentes rutas, que dependen del factor desen cadenante. Es así que para evaluar cada vía se utiliza una prueba diferente y existen múltiples pruebas para evaluar la integridad del sistema de coagulación (Brooks, 2008), sin embargo se describirán las que están al alcance de los veterinarios de nuestro medio.
El Tiempo de Protrombina (TP), mide el tiempo requerido para la transformación del fibrinógeno en un coágulo de fibrina (Dallap, 2004; Taylor and Hillyer, 1997; Thrall et al., 2004), posterior a la adición de tromboplastina a una muestra de plasma fresco citratado. En equinos se considera normal un valor inferior a 15 segundos (Feldman et al., 2000; Mussman and Rave, 1978; Thrall et al., 2004).
El TP mide la integridad de la vía extrínseca, y detecta una deficiencia de uno o más de los factores específicos de la coagulación, II, V, VII, X y fibrinógeno (Ángel, 1993; Dallap, 2004; Mishke, 2000).
El Tiempo Parcial de Tromboplastina (TPT), mide el tiempo requerido para la formación de un coágulo de fibrina (Dallap, 2004; Mishke, 2000; Thrall et al., 2004), posterior a la adición de un activador de contacto in vitro a una muestra de plasma fresco citratado. Su valor se encuentra aumentado en cifras superiores a 45 segundos (Feldman et al., 2000; Thrall et al., 2004). Comprueba la integridad de la vía intrínseca de la sangre entera y detecta deficiencias de los factores II, VIII, IX, X, XI, XII y fibrinógeno (Dallap, 2004; Taylor and Hillyer, 1997).
El recuento de plaquetas determina el número de plaquetas en la sangre circulante (Mishke, 2000; Taylor and Hillyer, 1997; Thrall et al., 2004).
El Recuento de Plaquetas (RP), en caballos es típicamente el más bajo que las demás especies y cifras inferiores a 100.000 plaquetas/μl señalan trombocitopenia (Dallap, 2004; Thrall et al., 2004).
Los productos de degradación de fibrina permiten determinar el grado de fibrinólisis. Para su ejecución son utilizados anticuerpos monoclonales específi cos para cada especie. (Mishke, 2000; Thrall et al., 2004) No existen este tipo de anticuerpos sintéticos para equinos en nuestro medio, por esto no es posible realizar esta prueba.
En cuanto a las pruebas de campo y aunque menos exactas que las de laboratorio, son una primera aproximación al estado de coagulación de un equino. El Tiempo de Sangrado (TS), mide el tiempo requerido para controlar la pérdida de sangre producida por una incisión en la piel y se consideran normales valores por debajo de 5 minutos y su alteración permite evaluar el número o funcionalidad de las plaquetas, un defecto en la pared de los vasos, falla hepática grave y deficiencia de vitamina K (Taylor and Hillyer, 1997; Thrall et al., 2004). Otra prueba de campo es el Tiempo de Coagulación (TC) y mide el tiempo de una muestra de sangre entera sin ningún conservante. El tiempo varía si se realiza en un tubo de vidrio o de plástico. En los tubos de plástico se activan rápidamente los factores XII y XI y se reduce la acción de los trombocitos. El TC normal en equinos es inferior a 14 minutos y su alteración indica un evidente trastorno del sistema intrínseco o una marcada trombocitopenia (Mishke, 2000; Thrall et al., 2004).
El objetivo de este trabajo fue caracterizar algunos parámetros de coagulación sanguínea (TP, TPT, TS y TC), en el caballo criollo Colombiano del Valle de Aburrá-Antioquia, en diferentes estados reproductivos.
Materiales y métodos
Consideraciones éticas
El procedimiento que se le realizó a los animales cumple con las condiciones del capítulo VI de la ley 84 de 1989, además con el título III, capítulo 6 de la ley 576 del año 2000 y cuenta con el aval responsabilidad ética otorgado en el comité operativo de investigaciones de la facultad de Medicina Veterinaria y Zootecnia de la Universidad CES, acta 007 de 2009.
Tipo de estudio
Este es un estudio descriptivo de algunas variables de coagulación en el Caballo Criollo Colombiano (CCC) del Valle de Aburrá-Antioquia.
Tamaño de muestra
Para definir el tamaño de la muestra se desarrolló una prueba piloto en la que se incluyeron siete caballos criollos, ubicados en el área metropolitana del Valle de Aburrá, a los que se les desarrolló toda la metodología que se describe en técnica de muestreo. Según los resultados estadísticos obtenidos con esta prueba, las variables de TP, TPT, TC, TS y RP se distribuyen de manera normal, el número de animales necesarios para estandarizar las diferentes pruebas tomando como referencia el coefi ciente de variación y asumiendo que la población de caballos criollos en el área metropolitana del Valle de Aburrá es de aproximadamente 10.000 animales y con un error de muestreo menor del 5% se debe trabajar: con 43 muestras para TS, por haber obtenido un 13% de coeficiente de variación, 162 para RP por haber obtenido un coeficiente de variación de 26%, 5 pruebas para TP y TPT por tener un 3.7 y 0.87 de coeficiente de variación respectivamente y 23 pruebas para TC por tener un CV de 9.68.
Se tomó como tamaño de muestra 96 equinos para las pruebas de TP, TPT, TC, TS (para estas pruebas es indispensable realizar pruebas hepáticas) y 162 animales incluidos los 96 anteriores, para la prueba RP (para esta variable no es indispensable realizar a todos los animales las pruebas hepáticas) y fueron divididos en los 6 grupos de acuerdo al estado reproductivo. Los grupos reproductivos fueron: hembras preñadas, hembras paridas (tiene cría, está lactando y no esta en gestación), potros de 1 a 3 años, potrancas de 1 a 3 años, reproductores (machos no castrados mayores de 3 años), machos castrados.
Los animales fueron escogidos de los diez municipios del área metropolitana del Valle de Aburrá, departamento de Antioquia, Colombia (Barbosa, Girardota, Copacabana, Bello, Medellín, Envigado, Itaguí, Sabaneta, La Estrella y Caldas), con una altura sobre el nivel del mar entre 1.300 y 2.000 metros, y una temperatura que varía entre 15 y 32 oC y una humedad relativa promedio del 70%. Se localizaron las pesebreras que quisieron participar en el muestreo y a los equinos se les aplicaron los criterios de inclusión y de exclusión.
En este trabajo incluyeron animales clínicamente sanos, con pruebas hepáticas GGT y AST (algunos de los animales del conteo de plaquetas no se les realizaron estas pruebas) dentro de los parámetros normales. Se excluyeron del trabajo los animales que presentaban o que hubieran presentado cualquier entidad clínica y recibido cualquier tipo de tratamiento médico previo, por un mínimo de 45 días.
Técnica de muestreo
Previo al muestreo los animales se dejaron reposar y se les realizó un examen clínico general y se descartaron aquellos que presentaban algún tipo de alteración. Se escribieron los antecedentes de cada animal: raza, sexo, edad (determinada por cronometría dentaria), peso y cualquier otra información importante relacionada con tratamientos previos.
Una vez realizado el examen clínico se procedió a determinar el TS, para lo cual se produjo una pequeña incisión en la oreja, previa desinfección con una gasa impregnada con clorhexidina solución, con una cuchilla de bisturí estéril # 24 y se tomó el tiempo utilizando un cronómetro, desde que aparece la primera gota de sangre hasta que dejó de sangrar, retirando las gotas que se acumulaban con un papel filtro cada 30 segundos. Luego se obtuvieron tres muestras de sangre por venopunción en la vena yugular con aguja calibre 21. Para la recolección de la sangre se utilizaron tubos al vacío (Vacutainer ® Becton Dickinson Co, Argentina). En un tubo tapa roja se sacó 1 ml de sangre por animal para medir la variable TC de sangre fresca o Lee-White. Para esta prueba se puso 1 ml de sangre venosa en un tubo de vidrio de 1 cm de diámetro y se puso en un baño maría a 37 oC. Luego de 3 minutos se inclinó ligeramente el tubo cada 30 segundos. El periodo de coagulación empieza desde que se introduce la sangre en el tubo, y termina cuando al inclinar el tubo la sangre formó un coágulo firme.
En otro tubo tapa roja se sacó la sangre necesaria para la realización de las pruebas hepáticas AST (Aspartatoamino Transferasa) y GGT (Gama Glutamil Transpeptidasa).
En tubo de tapa azul (con citrato de sodio) se sacaron 7 ml de sangre; se dejó reposar la muestra durante 15 minutos para disminuir gradualmente su temperatura, después fue refrigerada en una nevera de icopor con hielo y papel para ser enviada en un tiempo menor a dos horas (desde la toma de la muestra) al laboratorio clínico veterinario AGROLAB para ser analizadas para el RP, TP y TPT.
Análisis estadístico
Se realizó un análisis de tipo descriptivo con el fin de obtener los promedios de las variables TP, TPT, TS, TC y RP en el caballo criollo Colombiano en el Valle de Aburrá Antioquia, con sus respectivos límites de confianza al 95%. De acá se propondrán unas estandarizaciones iniciales, por medio de simulaciones Mantel-Markov que permitan una calibración inicial confrontable con el tiempo, en caso de poder hacer más replicaciones de este experimento. Se realizaron análisis de varianza para determinar diferencias estadísticamente significativas de las variables entre los diferentes grupos reproductivos analizados.
Resultados
La población muestreada para las pruebas TP, TPT, TC, TS fue de un total de 98 animales (se les realizaron pruebas hepáticas), dentro de estos animales se muestrearon los diferentes grupos reproductivos para un total de 16 hembras preñadas, 19 hembras vacías, 12 machos castrados, 20 machos enteros, 13 potros y 18 potrancas. Para la prueba RP se muestrearon 162 animales (64 de los cuales no se les realizaron pruebas hepáticas), de los diferentes municipios con una distribución en los grupos de edades así: 28 hembras preñadas, 31 hembras vacías, 24 machos castrados, 29 machos enteros, 22 potros y 28 potrancas.
Los resultados de las pruebas hepáticas AST y GGT, para los 98 animales a los que se les realizó, tuvieron un valor promedio de 306.05 ± 83.41 UI y 16.25 ± 9.72 UI respectivamente, y ninguno de los animales tuvo valores por fuera de los considerados normales para los equinos. Estos resultados junto con los de la evaluación clínica sugieren que los animales estaban clínicamente sanos, criterio indispensable para ser incluidos en el estudio.
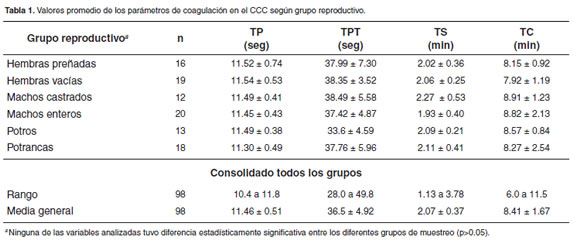
El valor promedio del TP para todos los animales evaluados fue de 11.46 ± 0.51 seg. Cuando el valor del TP se analizó por categorías de muestreo se obtuvo un valor promedio de 11.52 ± 0.74 seg para las hembras preñadas, de 11.54 ± 0.53 seg para las hembras vacías, de 11.49 ± 0.41 seg para los machos castrados, de 11.45 ± 0.43 seg para los machos enteros, de 11.49 ± 0.38 seg para los potros y de 11.30 ± 0.49 seg para las potrancas, véase tabla 1. El análisis de varianza para el TP de acuerdo a las categorías de muestreo encontró que no hubo diferencias estadísticamente significativas entre los diferentes grupos (p>0.05). Lo que indica que el TP no está afectado por el estado reproductivo.
El valor promedio del TPT para todos los animales evaluados fue de 36.5 ± 4.92 seg. Cuando el valor del TPT se analizó por categorías de muestreo se obtuvo un valor promedio de 37.99 ± 7.30 seg para las hembras preñadas, de 38.35 ± 3.52 seg para las hembras vacías, de 38.49 ± 5.58 seg para los machos castrados, de 37.42 ± 4.87 seg para los machos enteros, de 33.6 ± 4.59 para los potros y de 37.76 ± 5.96 seg para las potrancas (Tabla 1). El análisis de varianza para el TPT de acuerdo a las categorías de muestreo encontró que no hubo diferencias estadísticamente significativas entre los diferentes grupos (p>0.05). Esto indica que el TPT no está influenciado por el estado reproductivo.
El valor promedio del TS para todos los animales evaluados fue de 2.071 ± 0.37 min. Cuando el valor del TS se analizó por categorías de muestreo se obtuvo un valor promedio de 2.02 ± 0.36 min para las hembras preñadas, de 2.06 ± 0.25 min para las hembras vacías, de 2.27 ± 0.53 min para los machos castrados, de 1.93 ± 0.40 min para los machos enteros, de 2.09 ± 0.21 min para los potros y de 2.11 ± 0.41 min para las potrancas (Tabla 1). El análisis de varianza para el TS de acuerdo a las categorías de muestreo encontró que no hubo diferencias estadísticamente significativas entre los diferentes grupos (p>0.05). Estos resultados indican que el TS no está afectado por el estado reproductivo.
El valor promedio del TC para todos los animales evaluados fue de 8.41 ± 1.67 min. Cuando el valor del TC se analizó por categorías de muestreo se obtuvo un valor promedio de 8.15± 0.92 min para las hembras preñadas, de 7.92 ± 1.19 min para las hembras vacías, de 8.91 ± 1.23 min para los machos castrados, de 8.82 ± 2.13 min para los machos enteros, de 8.57 ± 0.84 min para los potros y de 8.27 ± 2.54 min para las potrancas,(Tabla 1). El análisis de varianza para el TC de acuerdo a las categorías de muestreo encontró que no hubo diferencias estadísticamente significativas entre los diferentes grupos (p>0.05). Estos hallazgos indican que el TC no varía por la etapa reproductiva.
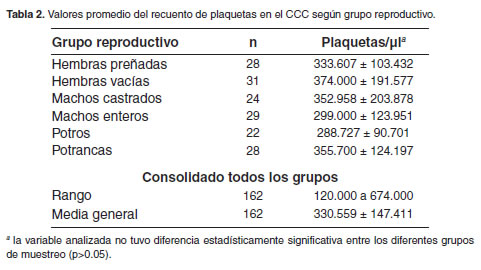
El valor promedio del RP para todos los animales evaluados fue de 330.559 ± 147.411 plaquetas/μl. Cuando el valor del RP se analizó por categorías de muestreo se obtuvo un valor promedio de 333.607 ± 103.432 plaquetas/μl para las hembras preñadas, de 374.000 ± 191.577 plaquetas/μl para las hembras vacías, de 352.958 ± 203.878 plaquetas/μl para los machos castrados, de 299.000 ± 123.951 plaquetas/ μl para los machos enteros, de 288.727 ± 90.701 plaquetas/μl para los potros y de 355.700 ± 124.197 plaquetas/μl para las potrancas (Tabla 2). El análisis de varianza para el RP de acuerdo a las categorías de muestreo encontró que no hubo diferencias estadísticamente significativas entre los diferentes grupos (p>0.05). Estos resultados indican que no existen diferencias en el RP atribuibles al estado reproductivo en el CCC.
Discusión
La literatura reporta para TP un tiempo de 9 a 15 seg (Feldman et al., 2000; Mussman and Rave, 1978; Thrall et al., 2004), el promedio en todos los grupos en el CCC fue de 11.46 seg (rango 10.4 a 11.8 seg), lo que concuerda con los valores encontrados en la literatura. El TP se aumenta en casos de déficit de vitamina K, falla hepática crónica y concentraciones de fi brinógeno reducidas (Mishke, 2000; Taylor and Hillyer, 1997) y en los equinos estudiados los problemas hepáticos no estuvieron presentes ya que las pruebas hepáticas debían estar normales para ser incluidos en el estudio y ninguno de los animales fueron tratados para problemas de laminitis que es la entidad donde se indican los anticoagulantes, por lo tanto los resultados son compatibles con el estado clínico de los pacientes.
Para el TPT la literatura reporta un máximo de 45 seg (Feldman et al., 2000; Thrall et al., 2004), el valor promedio entre los grupos evaluados fue de 36.5 seg (rango 28.0 a 49.8 seg), que se encuentra dentro de los límites reportados. Un valor prolongado de TPT indica un déficit de los factores de la vía intrínseca (VIII, IX, XI, XII). El TPT no se afecta por el bajo número de plaquetas (Ángel, 1993; Mishke, 2000,).
Para el TS la literatura reporta un tiempo máximo de 5 min (Taylor and Hillyer, 1997; Thrall et al., 2004) y el encontrado en el CCC fue en promedio de 2.07 min (rango 1.13 a 3.78 min), que se encuentra dentro del rango de los reportes de literatura. Un tiempo de sangrado superior a 5 minutos señala alteración en el número o funcionalidad de las plaquetas, un defecto en la pared de los vasos, falla hepática grave o deficiencia de vitamina K (Ángel, 1993; Taylor and Hillyer, 1997; Thrall et al., 2004).
El TC encontrado en la literatura reporta un máximo de 14 min (Mishke, 2000, Thrall et al., 2004) y en el CCC se encontró un tiempo promedio de 8.41 min (rango 6.0 a 11.5). El TC aumentado indica un evidente trastorno de del sistema intrínseco o una marcada trombocitopenia (Mishke, 2000). Los datos del TC de este estudio se consideran normales para la especie estudiada. Otro estudio realizado por este mismo grupo de investigación, encontró que el TC realizado por el método de Lee-White con tres tubos de sangre de prueba, mostró que los TC estuvieron en un rango de 7.67 a 14.5 min y no se afectaron ni por el tiempo de muestreo (mañana o tarde), ni por el estado reproductivo (Ruiz et al., 2009). Datos que concuerdan con los de este estudio.
El RP del CCC se encontró en promedio 330.559 plaquetas/μl (rango 120.000 a 674.000), y la literatura reporta que no debe ser menor a 100.000 plaquetas/μl (Cunningham, 2003; Feldman et al., 2000; Thrall et al., 2004), por lo que se puede afirmar que los valores obtenidos estuvieron dentro del rango considerado normal en la especie equina. Una de las utilidades más importantes de esta prueba es la identificación de pacientes con coagulación intravascular diseminada (CID) subclínico (Dallap, 2004; Mishke, 2000), y en el caso de los pacientes estudiados ninguno presentó enfermedad alguna que permitiera suponer una CID.
La causa más común de sangrado en el equino es la injuria vascular, sin embargo las coagulopatías deben ser consideradas como diagnósticos diferenciales (Brooks, 2008; Taylor and Hillyer, 1997). Las coagulopatías como consecuencia de trastornos vasculares, se caracterizan por petequias de las membranas mucosas, edema, letargia y, en ocasiones, fiebre (Landoni, 2002; Taylor and Hillyer, 1997). Las causas habituales son agentes infecciosos, y una respuesta vascular inflamatoria (vasculitis) de origen inmunológico. Las patologías que potencialmente producen trastornos vasculares son: púrpura hemorrágico, arteritis viral equina, anemia infecciosa equina (Taylor and Hillyer, 1997). Otra de las causas de coaguloaptías en equinos es la CID, esta puede ser secundaria a diferentes enfermedades que favorecen diferentes estados de hipercoagulación. Menos frecuente en caballos adultos son la hepatitis que presentan coagulopatías debido a que todos los factores de la coagulación, se producen en el hígado excepto los III, IV y VIII (Taylor and Hillyer, 1997). Las trombocitopenias son poco frecuentes en el caballo y suele ir asociado a un gasto excesivo de plaquetas por los procesos de CID (Brooks, 2008; Landoni, 2002; Taylor and Hillyer, 1997) o más raramente, asociado a la infiltración neoplásica de la medula ósea. Otras causas suelen ser la destrucción inmunógena de plaquetas por parte del sistema fagocitario mononuclear, la etiología exacta se desconoce, y con frecuencia se habla de trombocitopenia idiopática; también se asocia con el uso de fármacos como salicilatos y lidocaína que alteran la función de las plaquetas (Landoni, 2002).
Dentro de las alteraciones iatrogénicas de la coagulación existen las producidas por fármacos como anticoagulantes como warfarinas, heparina y antiinflamatorios esteroideos y no esteroideos. Los antiinflamatorios no esteroideos (AINES) bloquean la ciclooxigenasa evitando la formación de prostaglandinas para controlar el dolor, pero igualmente bloquean los tromboxanos evitando así la agregación plaquetaria que genera riesgo de sufrir hemorragias (Cunningham, 2003), los antiinflamatorios esteroideos (AIES) bloquean la cascada de la coagulación a partir de la fosfolipasa evitando que se forme el ácido araquidónico y A2, finalmente ev itará la formación de tromboxanos y al igual que con los AINES existe riesgo de que se produzcan hemorragias (García, 1995; Landoni, 2002). Con todas estas posibles alteraciones del sistema de coagulación equino es importante conocer los parámetros normales de nuestros pacientes en nuestro medio, para poder diagnosticar y tratar con precisión las enfermedades que afectan al sistema hemostático del caballo criollo Colombiano.
En este estudio no se hallaron variaciones de los parámetros de coagulación evaluados (TP, TPT, TS, TC y RP), que estuvieran relacionados con el estado reproductivo, de igual manera ninguna de las referencias consultadas reportan variaciones en los parámetros de coagulación atribuibles a factores como la edad, el sexo o el estado reproductivo (Cunningham, 2003; Taylor and Hillyer, 1997; Thrall et al., 2004).
Se puede concluir que los datos de las pruebas de coagulación evaluadas, que aparecen en las tablas 1 y 2, pueden servir como referencia para el caballo criollo colombiano del Valle de Aburrá. Según los resultados obtenidos no existió diferencia estadísticamente significativa entre los diferentes estados reproductivos evaluados, en las pruebas realizadas, por esto se puede decir que no es necesario separar los parámetros de coagulación de los caballos criollos colombianos por grupo reproductivo.
Referencias
1. Ángel GM. Interpretación clínica del laboratorio. 4ta ed. Bogotá: Panamericana; 1993. [ Links ]
2. Beutler E, Lichtman MA, Coller BS, Kipps JT. Williams Hematology. 5ta ed. New York: McGraw Hill- Interamericana; 1990. [ Links ]
3. Brooks MB. Equine coagulopathies. Vet Clin North Am Equine Pract 2008; 24:335-55. [ Links ]
4. Cunningham JG. Fisiología Veterinaria. 3ra ed. Madrid: Elsevier Saunders; 2003. [ Links ]
5. Dallap BL. Coagulopathy in the equine critical care patient. Vet Clin Equine 2004; 20: 231-251. [ Links ]
6. Feldman B, Zinkl JG, Jain NC. Schalm´s Veterinary Hematology. 5ta ed. Philadelphia. Lippincott. Williams and Wilkins; 2000. [ Links ]
7. Fox SI. Fisiología Humana. 7a ed. España. McGraw Hill-Interamericana; 2003. [ Links ]
8. García LA. Hemostasia. En: García Sacristán A, Castejón. F, de la Cruz LF, Gonzales J, Murillo MD. Fisiología Veterinaria. España: McGraw Hill- Interamericana; 1995. p.274-286. [ Links ]
9. Greer JP, Foerster J, Lukens JN, Rodgers GM, Paraskevas FI, Glader B. Wintrobe`s Clinical Hematology. 11ª ed. Philadelphia: Lippncott Williiams & Wilkins; 2004. [ Links ]
10. Guyton AC, Hall JE. Hemostasis and blood coagulation. In: Medical Physiology. 11ª ed. Filadelfia: Elsevier Saunders; 2006. p.457-468. [ Links ]
11. Landoni MF. Fármacos que actúan en la sangre. En: Botana LM, Landoni F, Jiménez TM. Farmacología y terapéutica veterinaria. España: McGraw Hill-Interamericana; 2002. p.263-271. [ Links ]
12. Mishke R. Hemostasis. En: Kraft W, Dûrr UM. Diagnóstico de Laboratorio Clínico en Veterinaria. 3ª ed. Alemania: Acribia; 2000. p.92-111. [ Links ]
13. Mussman H, Rave G. Patología Clínica Veterinaria. ICA. Subgerencia investigación. Programa de Patología Animal. 1978. [ Links ]
14. Pelagalli A, Belisario MA, Tafuri S, Lombardi P, d`Angelo D, Avallone L, Staiano N. Adhesive properties of platelets from differen animal species. J Comp Path 2003; 128: 127-131. [ Links ]
15. Mitchell RN. Hemoyinamic Disorders, Thromboembolic disease, and shock. In: Kumar, Abbas, Fausto. Robbins and Cotran pathologic basis of disease. 7ª ed. Filadelfi a: Elsevier Saunders; 1999. p.119-144. [ Links ]
16. Ruiz JD, Zuluaga D, Tobón R. Evaluación del tiempo de coagulación Lee- White a diferentes temperaturas ambientales de muestreo y estados reproductivos en el caballo criollo colombiano en el Valle de Aburrá, Antioquia. Rev CES Med Vet Zoot 2009; 4: 20-27. [ Links ]
17. Smith JW, Day TK, Mackin A. Diagnosing bleeding disorders. Comp Cont Educ Pract Vet 2005; 27: 828-844. [ Links ]
18. Taylor FGR, Hillyer MH. Técnicas diagnósticas en medicina equina. España: Acribia; 1997. [ Links ]
19. Thrall MA, Backer DC, Campbell W, Denicola D, Fettman MJ, Lassen ED, Weiser G. Veterinary hematology and clinical chemistry. Philadelphia: Lippincott Williams and Wilkins; 2004. [ Links ]
20. Tresguerres JA, Arinavanneta C, Cachofeiro V, Cardinali DP, Escrich E, Gil P, Lahera V, Mora F, Romano M, Tamargo J. Fisiología Humana. 3ª ed. España: McGraw Hill-Interamericana; 2005. [ Links ]