Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.24 no.2 Medellín Apr./June 2011
Alleles of the BoLA DRB3.2 gene are associated with mastitis in dairy cows¤
Alelos del gen BoLA DRB3.2 están asociados con mastitis en vacas lecheras
Alelos BOLA DRB3.2 estão associados à mastite em vacas leiteiras
Juan C Zambrano1, 4, Qco, MS, PhD(c); Julián Echeverri2, 4, Zoot, MS, PhD(c); Albeiro López-Herrera3, 4*, Zoot, MV, MS, PhD.
1 Estudiante de doctorado Universidad Nacional de Colombia. 2Profesor Auxiliar. Universidad Nacional de Colombia, Sede Medellín, Facultad de Ciencias Agropecuarias, Departamento de Producción Animal. 3Profesor Asociado. Universidad Nacional de Colombia, Sede Medellín, Facultad de Ciencias Agropecuarias, Departamento de Producción Animal. 4 Grupo de Investigación Biodiversidad y Genética Molecular "BIOGEM" (Recibido: 16 febrero, 2010; aceptado: 11 abril, 2011) ¤ Para citar este artículo: Zambrano JC, Echeverri J, López-Herrera A. Alelos del gen BoLA DRB3.2 están asociados con mastitis en vacas lecheras. Rev Colomb Cienc Pecu 2011; 24:145-156 * Autor para correspondencia: Albeiro López-Herrera. Universidad Nacional de Colombia, Calle 59A No 63-20 - Núcleo El Volador, Bloque 50 oficina 310, Medellín - Colombia. E-mail: alherrera@unal.edu.co.
Summary
The Mayor Histocompatibility Complex (MHC) is a pool of genes which regulate both processing and recognition of antigens. The MHC is the main genetic component of the resistance or susceptibility to infectious diseases. In bovines, MHC is known as Bovine Leukocyte Antigen (BoLA), and some of its alleles have been associated with udder health issues. This study evaluated exon-2 polymorphisms of BoLA DRB3 gene in 91 cows of a dairy farm. A total of 66 Holstein and 25 cross breed BON x Holstein (BxH) cows were evaluated. Twenty seven alleles were identified by PCR-RFLP and PCR-SBT. Allelic frequencies varied from 0.8 to 15.9% for the Holstein, and from 2 to 20% for BxH cows. The BoLA DRB3.2*23 was the most frequent allele in both groups. A prospective study was also conducted for cows in production (n=47) during one lactation to determine subclinical mastitis incidence using the California Mastitis Test (CMT). A 38.69% frequency of positive cases was observed. Additionally, a retrospective study was conducted for all the cows (n=91), finding 9.2% incidence of clinical mastitis per year. Possible associations were established using a statistical model to determine the effect of genetic substitution, in which BoLA DRB3.2*24 was used as the substitution allele. Alleles associated with susceptibility to subclinical mastitis were DRB3.2*8 (p<0.10) and DRB3.2*14 (p< 0.01). Allele DRB3.2*33 was associated with resistance to subclinical mastitis (p<0.01). No significant associations were found for clinical mastitis.
Key words: bovine, CMT, immune response, major histocompatibility complex.
Resumen
El complejo mayor de histocompatibilidad (CMH) es un conglomerado de genes que regulan el procesamiento y reconocimiento de antígenos extraños, siendo el principal componente genético de resistencia o susceptibilidad a enfermedades infecciosas. En bovinos el CMH es conocido como antígeno leucocitario bovino (BoLA) y algunos alelos de este han sido asociados con problemas de salud de la ubre. En este estudio se evaluaron polimorfismos del exón 2 del gen BoLA DRB3 en 91 animales, 66 vacas de raza Holstein y 25 vacas del cruce de razas BON x Holstein (BxH) del Hato Paysandú de la Universidad Nacional de Colombia. Fueron identificados 27 alelos mediante PCR-RFLP y confirmados por PCR-SBT, encontrando frecuencias alélicas desde 0.8 hasta 15.9% en la raza Holstein y desde 2 hasta 20% en BxH. El alelo más frecuente en los dos grupos fue el alelo BoLA DRB3.2*23. Para determinar la frecuencia de mastitis subclínica, se realizó un estudio prospectivo con animales en producción (n = 47) durante un periodo de una lactancia, empleando la prueba CMT (California Mastitis Test) y se determinó una frecuencia de 38.69% de casos positivos (reacciones positivas: una, dos y tres cruces) en promedio. Para mastitis clínica se realizó un estudio retrospectivo en toda la población (n=91), a partir de los registros clínicos y se determinó una incidencia anual de 9.2%. Adicionalmente se establecieron asociaciones potenciales utilizando un modelo estadístico para determinar el efecto de sustitución genética en el cual se empleó el alelo BoLA DRB3.2*24 como alelo de sustitución. Los alelos asociados con susceptibilidad a mastitis subclínica fueron DRB3.2*8 (p<0.10) y el *14 (p< 0.01), de otro lado el alelo *33 fue asociado con resistencia a esta misma enfermedad (p< 0.01). Para mastitis clínica no se encontraron asociaciones significativas.
Palabras clave: bovino, complejo mayor histocompatibilidad, CMT, respuesta inmune.
Resumo
O complexo principal de histocompatibilidade (CMH) é um conjunto de genes que regulam o processamento e reconhecimento de antígenos estranhos, o principal componente genético da resistência ou suscetibilidade a doenças infecciosas. Em bovinos, o CMH é conhecida como antígeno leucocitário bovino (BoLA) e alguns alelos têm sido associados a problemas de saúde do úbere. Neste estudo, os polimorfismos do éxon 2 do gene BoLA DRB3 em 91 animais, 66 vacas e 25 vacas da raça Holandesa no cruzamento BON x Holandês (BXH) do rebanho Paysandú, da Universidade Nacional da Colômbia. Foram identificados 27 alelos foram identificados por PCR-RFLP e confirmados por PCR-SBT, encontrando frequências alélicas de 0.8 - 15.9% para a raça Holandesa e 2 - 20% em BXH. O alelo mais frequente nos dois grupos foi BoLA DRB3.2*23. Para determinar a frequência de mastite subclínica, um estudo prospectivo foi realizado com animais de produção (n=47) durante o período de lactação, utilizando o CMT (Califórnia Mastite Teste) e foi determinada uma frequência de 38,69% de casos positivos (reacções positivas: uma, duas e três cruzes) em média. Para a mastite clínica foi feito um estudo retrospectivo em toda a população (n=91), a partir de casos clínicos e foi encontrada uma incidência anual de 9.2%. Além disso, foram estabelecidas potenciais associações, utilizando um modelo estatístico para determinar o efeito da substituição genética do alelo DRB3.2*24. Os alelos associados à susceptibilidade à mastite foram DRB3.2 * 8 (p<0.10) e o * 14 (p<0.01), o alelo * 33 esteve associado com a resistência à mesma doença (p<0.01). Para a mastite clínica não foram encontradas associações significativas.
Palavras-chave: a resposta imune, bovinos, complexo maior de histocompatibilidade, CMT.
Introducción
El mejoramiento genético tradicional en lechería se ha dirigido la selección de animales para incrementar principalmente la producción, lo que ha aumentado los problemas de la salud de la ubre, principalmente de mastitis (Van Dorp et al., 1999). La mastitis es considerada la enfermedad de mayor impacto económico en lechería especializada (Rodríguez, 2006; Rainard y Riollet, 2006). Las vacas en producción pueden sufrir mastitis clínica o subclínica, siendo más frecuente la subclínica y las pérdidas económicas son atribuibles principalmente a esta enfermedad. En la lechería antioqueña se estiman pérdidas de producción por mastitis en más del 12% por año (Lorbacher, 1982; Cerón et al., 2007), de ahí la importancia de realizar investigaciones para mejorar la salud de la ubre en regiones como la cuenca lechera del norte de Antioquia que es la segunda de mayor importancia en producción de leche en el país después de la sabana cundiboyacence.
La susceptibilidad a enfermedades, por su carácter multifactorial, tiene una alta incidencia del ambiente, lo que dificulta el éxito de la genética clásica, por esto es importante que el mejoramiento genético tradicional se apoye en herramientas moleculares que permitan la identificación de marcadores genéticos asociados con salud de la ubre y de otras afecciones de importancia económica.
En el complejo mayor de histocompatibilidad (CMH), conocido en bovinos como bovine leukocyte antigen (BoLA), ubicado en el cromosoma 23, se han identificado varios marcadores moleculares asociados a mastitis (Lewin, 1989; Rupp y Boichard, 2007). Uno de estos marcadores es el gen DRB3, expresado en células del sistema inmune como macrófagos, células dendríticas y linfocitos B que procesan y presentan antígenos a los linfocitos T ayudadores, para desencadenar la respuesta inmune contra patógenos infecciosos (Banchereau y Steinman, 1998; Schaschl et al., 2006).
El gen DRB3 tiene un alto polimorfismo principalmente en el exón 2 (Rostchild et al., 2000). De este exón, han sido identificados 121 alelos diferentes (Davies et al., 1992; Russell et al., 2004; Takeshima y Aida, 2006), algunos de los cuales han sido asociados con susceptibilidad a mastitis (Rupp y Boichard, 2003; Abdel et al., 2006).
Los objetivos de este trabajo fueron: determinar las variantes alélicas del gen BoLA DRB3.2 mediante la técnica PCR-RFLP, determinar las frecuencias de mastitis clínica y subclínica y asociar los alelos BoLA DRB3.2 con susceptibilidad a mastitis, en vacas de raza Holstein y del cruce de razas BON x Holstein (BxH) en un hato lechero de Antioquia.
Materiales y métodos
Población
El trabajo se realizó en el hato Paysandú de propiedad de la Universidad Nacional de Colombia sede Medellín, ubicado en el Departamento de Antioquia, corregimiento de Santa Elena, a 16 km al oriente de Medellín en zona de bosque muy húmedo montano bajo (bmh-MB) con una temperatura media de 14 °C y a una altura de 2500 msnm. Para el gen BoLA DRB3.2 se genotipificaron 91 vacas, de las cuales 66 fueron de raza Holstein y 25 del cruce BON x Holstein (BxH). El análisis de asociación con mastitis clínica fue realizado con el total de la población (91 vacas), con base en la información histórica del hato y la recopilada durante la ejecución de la investigación. Para mastitis subclínica el análisis se realizó con base en 47 vacas (35 Holstein y 12 BxH), las cuales fueron evaluadas mediante la prueba de California Mastitis Test (CMT) durante el periodo de ejecución; estas cumplían el requisito de estar entre 60 y 240 días de lactancia, lo que permite evitar los falsos positivos del inicio y finalización de la lactancia en la prueba CMT.
Diagnóstico de mastitis subclínica
Cada 15 días durante un período de 6 meses a cada vaca se le realizaron pruebas de CMT según las recomendaciones del fabricante del reactivo, en los ordeños de la tarde. En total, durante todo el desarrollo del proyecto, fueron analizados 2140 cuartos cuyos resultados de CMT fueron clasificados en cinco categorías: negativo (N), trazas (T), una cruz (+), dos cruces (++) y tres cruces (+++). Se consideraron cuartos mamarios no afectados los que presentaron las categorías N y T; y cuartos mamarios con mastitis subclínica, los que presentaron una, dos o tres cruces.
Diagnóstico de mastitis clínica
Se evaluaron los registros clínicos de las 91 vacas para el año 2008, 84 vacas para el año 2007 y de 66 vacas para el 2006. Los registros históricos permitieron clasificar la población en dos grupos: animales con diagnóstico de mastitis clínica (animales afectados) y sin diagnóstico de mastitis clínica (no afectados). Los animales que presentaron sintomatologías clínicas como inflamación de la ubre, dolor de la ubre a la palpación y en algunos casos tratamiento de la enfermedad con antibióticos intramamarios u otros medicamentos conformaron el grupo de los afectados que fueron 12/91, 4/84 y 6/66 en los años respectivos.
Extracción de ADN
Para cada uno de los 91 individuos se colectaron 5 ml de sangre periférica en tubos al vacío con EDTA como anticoagulante y almacenadas a 4 °C hasta su procesamiento. El ADN fue extraído empleando el método de salting out descrito por Miller et al., (1988). La concentración de DNA fue ajustada entre de 50 a 100 ng/mL.
Amplificación del gen BoLA DRB3.2
El exón 2 del gen BoLA DRB3 fue genotipificado empleando la metodología desarrollada por Van Eijk et al., (1992), con algunas modificaciones descritas a continuación. Los cebadores utilizados fueron: HL030 (5´-ATCCTCTCTCTGCAGCAC ATTTCC-3´), HL031 (5´- TTTAAATTCGCGCTCACCTCGCCGCT-3´) y HL032 (5´TCGC CGCTGCACAGTGAAACTCTC -3). La primera ronda de amplificación se realizó en un volumen de reacción de 25 μl que contenía: 0.4 mM de cada dNTP, 0.5 μM de primer HLO30 y HLO31, 2.5 μl de 10X buffer termofílico libre de magnesio [500 mM KCl, 100 mM Tris-HCl (pH 9.0), 1% Tritón X-100], 2.5 μl of 25 mM MgCl2, 12.8 μl de agua ultrapura, 1U de Taq ADN polimerasa (Fermentas, California, U.S.A) y 50 a 100 ng de ADN genómico.
La mezcla de reacción se llevó a cabo en un termociclador (Biometra, Göttingen Germany con el siguiente programa de temperaturas: Desnaturalización inicial a 94 °C por 240 seg, seguido de 10 ciclos desnaturalización a 94 °C por 60 seg, alineación a 60 °C por 120 seg, extensión a 72 °C por 60 seg y una extensión final a 72 °C por 300 seg.
La segunda ronda de PCR se llevó a cabo en un volumen de reacción de 60 μl que contenía: 0.4 mM de cada dNTP, 0.6 μM de cada primer HLO30 y HLO32, 6 μl de 10X magnesium-free thermophilic buffer, 6 μl de 25 mM MgCl2, 36.9 μl de agua ultra pura, 1U de Taq ADN polimerasa (Fermentas, California, U.S.A) y 2,5 μl de ADN amplificado en la primer ronda de PCR. El programa de amplificación fue el siguiente: Desnaturalización inicial a 94 °C por 240 seg, seguida de 25 ciclos desnaturalización a 94 °C por 60 seg, alineación a 67 °C por 120 seg, extensión a 72 ºC por 60 seg, seguido por una extensión final de 72 °C por 300 seg. Como control negativo se hicieron reacciones en ausencia de ADN.
El producto de PCR fue resuelto en geles de agarosa al 1.5% y visualizado bajo luz ultravioleta en un equipo de fotodocumentación de geles (Biometra, Göttingen Germany).
Digestión con enzimas de restricción
El amplificado obtenido en la segunda ronda de PCR fue digerido con tres enzimas de restricción RsaI, BstYI (New England BioLabs, Ontario Canadá) y HaeIII (Fermentas, California, USA). La digestión se llevó a cabo en un volumen final de 20 μl para cada enzima, que contenía 10 μl del producto de PCR, 5 UI de enzima y 2 μl de buffer de la enzima. La incubación para las enzimas RsaI y HaeIII se realizó a 37 °C y para la enzima BstYI a 60 °C por un tiempo de 1.5 horas. Para evitar la presencia de falsos heterocigóticos, se utilizó exceso de enzima de restricción.
Las muestras digeridas fueron resueltas en geles de agarosa al 4%, teñidas con bromuro de etídio 10 μg/ml como describe Gilliespie et al. (1999). El marcador de peso molecular utilizado fue Gene Ruler ADN Ladder, Low Range (Fermentas, California U.S.A) de 25 pb. Las muestras fueron corridas durante 3 horas a 100 voltios y luego visualizadas bajo luz ultravioleta. La identificación de los alelos del gen BoLA DRB3.2 se realizó por combinación de los diferentes patrones de restricción obtenidos en el siguiente orden RsaI, BstYI, HaeIII para cada muestra de acuerdo con la nomenclatura reportada por Van Eijk et al. (1992); Gelhaus et al. (1995) y Maillard et al. (1999).
Tipificación basada en secuenciación
La genotipificación también fue realizada por secuenciación utilizando la técnica SBT (Sequence Based Typing). Las muestras amplificadas en la segunda ronda de PCR fueron purificadas con el kit QIAquick (Qiagen, Valencia, ca, U.S.A) y enviadas a la empresa Macrogene Inc. en Seúl Corea para el análisis de secuenciación. Una vez obtenidos los resultados, se procedió a alinear las secuencias con el programa BioEdit Sequence Alignment Editor (Hall, 1999), empleando la secuencia referencia, BoLA DRB3.2*1A que correspondiente al alelo 24 la cual fue obtenida por Sigurdardóttir et al., (1991). Con el mismo software fueron identificados los sitios de restricción de cada secuencia para las enzimas RsaI, HaeIII y BstYI, con el fin de confirmar los alelos obtenidos por PCR-RFLP.
Análisis estadístico
Frecuencia de mastitis subclínica y clínica. Se calculó como el porcentaje de animales afectados sobre el total de la población evaluada.
Frecuencias alélicas. La frecuencia de los diferentes alelos se realizó determinando la proporción de cada forma del gen entre el número de copias totales de la población en estudio. Se identificaron los homocigotos (dos copias del mismo alelo) y los heterocigotos (una copia de cada alelo) con el método descrito por Hartl (2000).
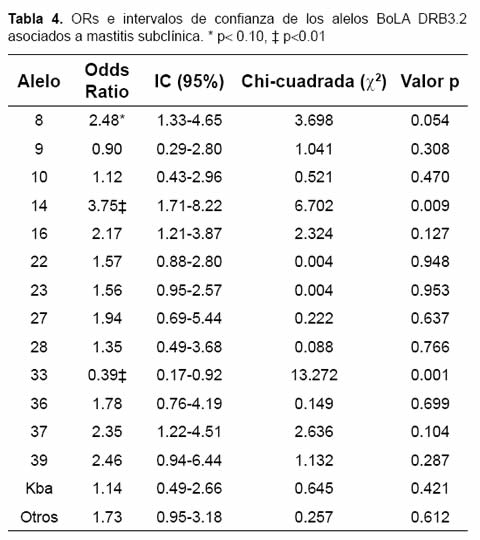
Asociación de la frecuencia de mastitis clínica y subclínica con las variantes alélicas del gen BoLA DRB3.2. Para la determinar la asociación de cada alelo BoLA DRB3.2 con la presencia o ausencia de la enfermedad (mastitis clínica y mastitis subclínica) se utilizó la metodología de sustitución genética mediante el procedimiento LOGISTIC de SAS (SAS, 1998) con el modelo estadístico: Yijkl = μ + Ri + P + ΣkbKBoLAijk + eijkl , donde Yijkl, es la variable dependiente, en este caso Log(P/1-P), donde P es la probabilidad de afección de la enfermedad (mastitis clínica o mastitis subclínica); μ es la media de la población; Ri es el efecto fijo del i-ésimo grupo genético, siendo: 1 Holstein y 2 BxH; Pj es el efecto fijo del j-ésimo número de partos, siendo 1 vacas de primero y segundo parto y 2: vacas de 3 o más partos; bK es el coeficiente de regresión del número de copias del k-ésimo alelo BoLA, BoLAijkes el número de copias (0,1 y 2) del alelo k BoLA (k = 1…15) presente en la vaca ijkl (Los alelos con frecuencias menores a 2% fueron agrupados en una categoría denominada otros); Eijkl es error experimental (Batra et al.,, 1989; Sharif et al., 1998; Trujillo et al., 2005).
El Odds Ratio (OR) o razón de posibilidades y su intervalo de confianza fue calculado según Lemeshow y Hosmer, (1984). Si el OR es mayor que 1, el factor es considerado como de alto riesgo según sea la variable analizada, presencia de la enfermedad con respecto al alelo de sustitución (alelo BoLA DRB3.2*24). Si OR es menor que 1, el factor puede interpretarse sin efecto sobre la enfermedad, ausencia de la enfermedad en comparación con el alelo de sustitución. Para determinar la significancia estadística de los OR se empleó la prueba Chi-cuadrado (μ2).
Resultados
Frecuencia de mastitis subclínica
De los 2140 cuartos analizados, 443 resultaron positivos al CMT (una, dos o tres cruces), discriminadas de la siguiente forma: una cruz, 10.56%, dos cruces, 5.75% y tres cruces, 4.39%, con un promedio de 20.70% de casos positivos al CMT (Tabla 1).
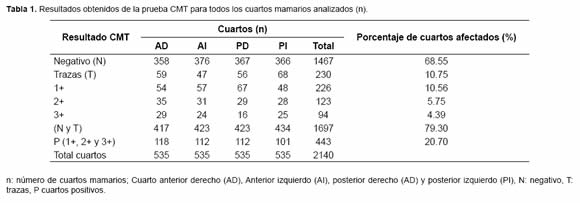
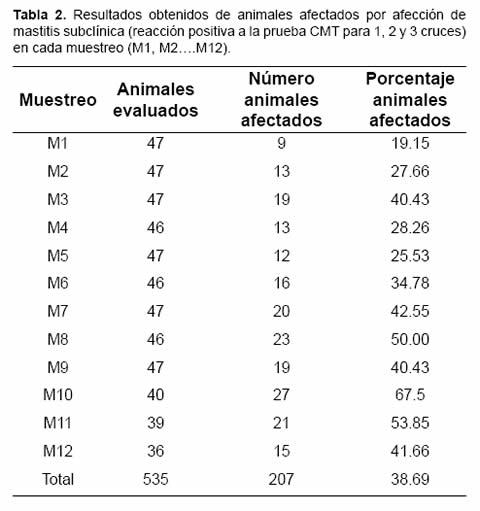
Considerando un animal afectado por mastitis subclínica el que presentó una, dos o tres cruces en cualquiera de los cuatro cuartos, se determinó el porcentaje de animales afectados. Los resultados fueron muy variable entre cada muestreo realizado, en el primer muestreo determinó la menor frecuencia de un valor de 19.15% y la de mayor frecuencia, en el muestreo 10 con un valor de 67.5%. El promedio general de afección de mastitis fue de 38.69% por cada muestreo (Tabla 2).
Frecuencia de mastitis clínica
La frecuencia de mastitis clínica medida con respecto al número de vacas afectadas fue de 9.09, 4.76 y 13.19% para los años 2006, 2007 y 2008 respectivamente, indicando un efecto directo de las condiciones ambientales y de manejo presentes en los diferentes niveles de esta fuente de variación. Esta fuente de variación no fue incluida en el modelo estadístico debido al desbalance de los datos para este efecto.
Frecuencias alélicas del gen BoLA DRB 3.2
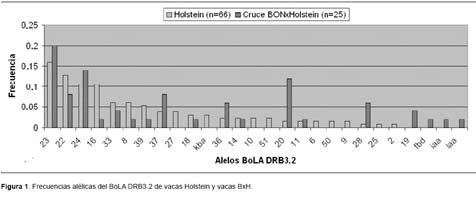
Fueron identificados, por PCR-RFLP y confirmados por SBT 23 alelos en la raza Holstein y 18 alelos en el cruce BxH, para un total de 27 variantes alélicas del BoLA DRB3.2. Las frecuencias alélicas para la raza Holstein se ubicaron entre 0.8 y 15.9% (barras gris claro Figura 1), siendo los alelos más frecuentes el 22, 23 y 24 con frecuencias de 12.9, 15.9 y 10.6% respectivamente. En BxH las frecuencias alélicas estuvieron entre 2 y 20% (barras oscuras Figura 1), siendo los alelos más frecuentes el 23, 24 y 20 con frecuencias de 20, 14 y 12% respectivamente. En la raza Holstein se determinó que el 79% de las vacas fueron heterocigóticas y el 21% homocigóticas, para BxH se obtuvo un resultado muy similar, 80% de heterocigóticos y 20% homocigóticos para el gen BoLA DRB3.2.
Asociación de la frecuencia de mastitis clínica y subclínica con las variantes alélicas del gen BoLA DRB3.2
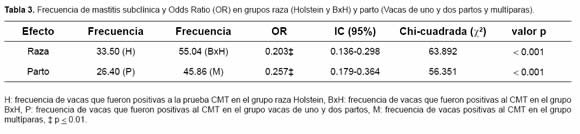
Efecto de la raza y el número de partos sobre la frecuencia de mastitis subclínica. Para la mastitis subclínica los efectos raza y parto tuvieron diferencias estadísticas altamente significativas (p<0.01). Para el efecto raza el grupo más afectado por mastitis subclínica según las pruebas de CMT realizadas es BxH con una frecuencia de 55.04% y en cuanto al número de partos las más afectadas fueron las multíparas con una frecuencia de 45.86%. El OR calculado para el efecto raza fue de 0.203 IC95% (0.136-0.298) indicando que las vacas Holstein presentan menos afección por mastitis subclínica. Para el efecto parto el OR fue 0.257 IC95% (0.179-0.364), mostrando que las vacas primíparas son menos susceptibles a mastitis subclínica comparadas con vacas multíparas en el hato Paysandú (Tabla 3).
Asociación del polimorfismo del gen BoLA DRB3.2 con mastitis subclínica. Se determinaron asociaciones significativas de los alelos BoLA DRB3.2 con riesgo de sufrir afección por mastitis subclínica. El alelo BoLA DRB3.2*8 OR= 2.48 IC95% (1.33-4.65), fue asociado (p<0.10) con 95% susceptibilidad a mastitis subclínica comparado con el alelo de sustitución (alelo BoLA DRB3.2*24), lo que significa que las vacas que portan el alelo 8 tienen 2.48 veces más riesgo de sufrir la enfermedad que las que portan el alelo 24; el alelo BoLA DRB3.2*14 OR= 3.75 IC95% (1.71-8.22) fue asociado significativamente con susceptibilidad a mastitis subclínica pero con mayor nivel de significancia (p<0.01). De otro lado, el alelo BoLA DRB3.2*33 OR= 0.39 IC 95% (0.17-0.92) fue asociado (p<0.01) con resistencia a mastitis subclínica comparado con el alelo de sustitución (Tabla 4).
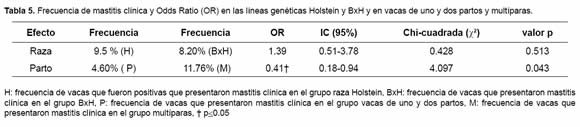
Efecto de la raza y el número de partos sobre la frecuencia de mastitis clínica. Los animales de la raza Holstein tuvieron una frecuencia de mastitis clínica mayor que los individuos cruzados, 9.5% y 8.20%, respectivamente. Esta diferencia no fue estadísticamente signifi cativa (p>0.05). En cuanto al grupo parto se encontró un efecto signifi cativo (p<0.1) sobre la frecuencia de mastitis clínica, las frecuencias encontradas de la enfermedad fueron 4.6% y 11.76% para las vacas de uno y dos partos y multíparas, respectivamente. El OR calculado para el efecto parto, fue de 0.41, IC95%, (0.18-
0.94), indicando que las vacas de uno y dos partos presentaron menor afección por mastitis clínica comparado con vacas multíparas (Tabla 5).
Asociación de los Alelos BoLA DRB3.2 con Mastitis Clínica. Para los alelos BoLA DRB3.2 no se encontraron asociaciones significativas con alto o bajo riesgo de sufrir mastitis clínica comparado con el alelo de sustitución (alelo BoLA DRB3.2*24)
Discusión
Frecuencia de mastitis clínica y subclínica
El porcentaje de animales afectados por mastitis subclínica, para la población evaluada con la prueba CMT y considerando un animal afectado el que presentó una, dos o tres cruces, fue de 38.69%. Este valor es acorde a los valores obtenidos por Starkenburg et al. (1997), quienes determinaron valores de incidencia de mastitis subclínica mediante el RCS, valores entre 26.4% y 45.86%, con un promedio de incidencia de 30%.
Para mastitis clínica, la frecuencia anual para el hato fue de 9.2% teniendo en cuenta los registros clínicos del hato y el seguimiento realizado durante la ejecución del proyecto. Sharif et al. (1998), encontraron resultados similares a los de esta investigación, determinado un valor de 9.3%, para mastitis severa (caracterizada por signos sistémicos y locales tales como inflamación de la ubre, leche anormal, fiebre y anorexia). Estos estudios realizados indican que las ganadería lecheras son más afectadas por mastitis subclínica y que en una parte de estos animales la enfermedad progresa hasta un nivel clínico.
Frecuencias alélicas para el gen BoLA DRB3.2
En el Hato Paysandú se identificaron 27 alelos BoLA DRB3.2 diferentes en las razas Holstein y BxH, siendo indicativo de un alto polimorfismo. En la raza Holstein se encontraron 23 alelos BoLA DRB3.2 y los 10 alelos más frecuentes son: 23, 22, 24, 16, 33, 8, 39, 37, 27 y 18 los cuales tienen una frecuencia acumulada de 78.1%; seis de estos alelos: 8, 16, 22, 23, 24, y 27, fueron también reportados dentro de los 10 más frecuentes (Dietz et al., 1997a; Dietz et al., 1997b; Starkenburg et al., 1997; Kelm et al., 1997 y Nassiry et al., 2008). De igual forma, Sharif et al. (1998) y Rupp et al. (2007), reportaron 5 alelos: 8, 16, 22, 23 y 24 que están dentro de los 10 más frecuentes en sus estudios. Nassiry et al. (2005); reportaron 6 alelos dentro de los 10 más frecuentes (8, 16, 22, 23, 24 y 18), mientras que Ledwige et al. (2001); reportaron 4 alelos dentro de los 10 más frecuentes: 8, 16, 22 y 23.
Para BxH se identificaron 18 alelos diferentes de los cuales 11 fueron reportados por Martínez et al. (2005) para la raza BON. Las frecuencias alélicas son diferentes en las vacas BxH de esta investigación, comparadas con la raza BON en el estudio realizado por Martínez et al (2005); esta diferencia se debe posiblemente al cruce de razas y el perfil alélico tiende a parecerse a la raza Holstein ya que 5 alelos de los 10 más frecuentes: 23, 24, 22, 33, 37, 16 están dentro de los 10 más frecuentes en la raza Holstein identificados en este estudio y para el cruce BxH solo dos alelos: 16 y 18 fueron encontrados de los 10 más frecuentes identificados por Martínez et al. (2005); en la raza BON.
Asociación de los alelos BoLA DRB3.2 con mastitis subclínica y mastitis clínica
En el presente estudio fue analizada la asociación de las variables independientes (parto, raza) con ocurrencia de mastitis subclínica y clínica. Para mastitis subclínica, el efecto parto fue significativo (p<0.01), determinando una frecuencia de 26.4% en vacas de uno y dos partos y 45.86% en vacas multíparas. En el estudio realizado por Starkenburg et al., (1997), se determinó una incidencia de mastitis subclínica mediante el RCS de 25% para vacas de primer parto, 35% en vacas de segundo parto y 29% en vacas de tercer parto en un periodo de una lactancia; lo cual confirma la alta incidencia de la enfermedad en los hatos lechería especializada como el de este estudio.
La frecuencia de mastitis subclínica en vacas de uno y dos partos en nuestro estudio fue similar que la reportada por Starkenburg et al., (1997), ya que para este mismo grupo en el estudio de Starkenburg et al., (1997), el promedio de incidencia fue de 30%. Para el grupo de vacas multíparas en nuestro caso fue mayor la frecuencia de mastitis subclínica, porque incluyó vacas hasta de 11 partos, cuyas glándulas mamarias están más distendidas y con los esfínteres del pezón más abiertos, por eso este resultado fue mayor al grupo de tercer parto del estudio de Starkenburg et al., (1997).
El efecto del número de partos fue altamente significativo (p<0.01) sobre la frecuencia de mastitis subclínica, lo cual coincide con los estudios realizados por Linn (1998). Wolfová et al., (2006), quienes determinaron que las vacas de tres partos en adelante son más afectadas por mastitis subclínica que vacas de 1 y 2 partos. Estos resultados pueden ser producto el desgaste de las vacas multíparas por sus múltiples lactancias lo cual se asocia a conteos de células somáticas mayores.
El efecto parto también fue significativo para mastitis clínica (p<0.05), se encontró una frecuencia por año de 11.76% en vacas multíparas y 4.60% en vacas de uno y dos partos. El efecto raza no fue significativo para mastitis clínica, sin embargo las vacas (BxH) tienden a ser más resistentes que las vacas Holstein, la frecuencia para BxH fue de 8.20%, mientras que en Holstein la frecuencia fue de 9.50%. Esta leve tendencia de la resistencia a enfermedades en vacas BxH puede ser favorecida posiblemente por la resistencia natural a enfermedades que han heredado de la raza BON, la cual lleva más de cinco siglos de adaptación en áreas tropicales de nuestro país (Múnevar, 1989; López et al., 2001).
En cuanto a la asociación de los alelos BoLA DRB3.2 con la frecuencia a mastitis, en esta investigación se determinó una asociación significativa (p<0.10) del alelo 8 con mayor riesgo de adquirir mastitis subclínica, comparado con el alelo de sustitución y este resultado es consistente con los obtenidos por Starkenburg et al. (1997) quienes encontraron asociación significativa del alelo 8 con un incremento agudo elevado del RCS en vacas Holstein de segundo parto; igualmente Dietz et al. (1997a); reportó una asociación significativa con un aumento agudo en el RCS de vacas Holstein de primer parto, Rupp et al. (2007) definen que vacas con un bajo promedio del RCS exhiben una baja inflamación de la glándula mamaria y pueden considerarse resistentes a mastitis. En el estudio realizado por Pashmi et al. (2009), igualmente encontraron una asociación del alelo 8 con incremento en el RCS, indicando una alta probabilidad de ocurrencia a mastitis subclínica.
En general el alelo 8 está involucrado con susceptibilidad a mastitis o con problemas de salud de la ubre. Kelm et al. (1997); encontraron una asociación significativa con un alto valor de cría estimado para mastitis clínica en vacas Holstein, igualmente Sharif et al. (2000) y Rupp et al. (2007); encontraron una asociación significativa del alelo 8 con alto riesgo de mastitis clínica para la raza Holstein; en este estudio el alelo 8 no fue asociado con riesgo de adquirir mastitis clínica. Por estudios de polimorfismos del intrón 2 el gen BoLA DRB3, se identificó el alelo 207 mediante microsatélites (Barryere et al. 1994) que estudios de linaje corresponde al alelo BoLA DRB3.2*8 (Davies et al., 1994). Este alelo fue asociado con susceptibilidad a mastitis causada por S. aureus en vacas Holstein canadiense, este resultado es coherente con los obtenidos en esta investigación.
Otros alelos en los cuales han sido encontradas asociaciones significativas con mastitis subclínica en varios estudios realizados son: 16, 22, 23 y 24. En este estudio el alelo 16 no se encontró asociación con susceptibilidad a mastitis subclínica. Kelm et al. (1997); encontraron una asociación significativa del alelo 16 con riesgo de incremento agudo del RCS en vacas Holstein de primer parto y Dietz et al. (1997ª); también determinaron que el alelo 16 está asociado como factor de riesgo para el incremento agudo y crónico en el RCS en vacas Holstein de segundo parto, sin embargo Starkenburg et al. (1997); reportaron una asociación significativa, con disminución en el RCS crónico y agudo durante la segunda lactancia para las líneas de control y de selección combinadas y fue posteriormente confirmado por Sharif et al. (1998), quienes determinaron una asociación significativa del alelo 16 con bajo RCS.
En el estudio que realizaron Rupp et al. (2007); no determinaron asociaciones significativas para el alelo 16 con mastitis subclínica. Según lo anterior nuestros resultados están de acuerdo con los trabajos de Kelm et al. (1997) y Dietz et al. (1997a) y son contrarios a los de Sharif et al. (1998). Estas discrepancias entre los cuatro resultados respecto al alelo 16 se pueden deber a la prevalencia de distintos patógenos entre los estudios y al escaso número de observaciones que impiden resultados satisfactorios.
Una explicación para estos resultados contradictorios es que cada población de estudio tiene diferente linaje del gen BoLA DRB3 y de otros genes que influyen en la respuesta inmune, otra posibilidad es que diferentes patógenos pueden estar presentes en el medio ambiente de cada hato y el mismo alelo puede responder de manera diferente para cada patógeno (Starkenburg et al., 1997). Se puede considerar también que esta diferencia de resultados sea debido no sólo a factores genéticos, sino también a factores ambientales que involucran manejo, estado sanitario y alimentación del hato. Los resultados obtenidos en esta investigación son similares a los encontrados por Starkenburg et al. (1997) y Sharif et al. (1998).
Otro alelo, que ha sido asociado a problemas de salud de la ubre es el alelo 22, que tiene más riesgo de adquirir mastitis. Según Starkenburg et al. (1997); el alelo está asociado con susceptibilidad a mastitis subclínica, ya que determinaron un incremento significativo del RCS crónico durante la primera lactancia para las dos líneas combinadas (la línea de control y la línea de selección), igualmente Rupp et al. (2007) encontraron una asociación significativa del alelo 22 con aumento del RCS. Castro et al. (2006), determinaron en vacas de la raza sintética Lucerna una asociación significativa con alto RCS del alelo 191 identificado por microsatélites en el segundo intrón del gen DRB3 (Davies et al., 1994), que corresponde por estudios de linaje al alelo BoLA DRB3.2*22. Sin embargo Dietz et al. (1997a); encontraron una asociación del alelo 22 con bajo RCS en vacas Holstein de segundo parto. En el presente estudio el alelo 22 no fue asociado con mastitis.
Rupp et al. (2007), encontraron que el alelo 23 está asociado con alto RCS, igualmente Sharif et al. (1998), determinaron una asociación del alelo 23 con probabilidad de ocurrencia de mastitis severa y mastitis media en ganado de raza Holstein. Ledwige (2003), determinó que el alelo 23 presenta una asociación desfavorable con incremento de incidencia de mastitis subclínica causada por patógenos bacterianos. En esta investigación no se encontró asociación del alelo 23 con susceptibilidad a mastitis.
El alelo 14 fue asociado con susceptibilidad a mastitis subclínica (p<0.01) y no se encontraron reportes de este alelo por otros autores, siendo un reporte nuevo de este estudio, al igual que para el alelo 33 el cual presentó asociación altamente significativa con resistencia a mastitis subclínica (p<0.01) y la importancia es que es un alelo nuevo de resistencia a la enfermedad y no ha sido reportado antes en la raza Holstein, aunque ha sido reportado en la raza Gyr (Mota et al., 2002).
Agradecimientos
Este artículo fue parte del proyecto: Correlación entre mastitis clínica y subclínica con las variantes genotípicas del gen BoLA DRB3.2, presentes en las vacas y novillas de primer parto del hato lechero de la hacienda Paysandú de La Universidad Nacional de Colombia, código QUIPU 20101006713, financiado por la Dirección de Investigación de la Universidad Nacional de Colombia sede Medellín y hace parte del trabajo de grado de Maestría en Biotecnología de Juan Carlos Zambrano Arteaga y de Doctorado en Ciencias Animales de José Julián Echeverri Zuluaga.
Referencias
1. Abdel KG, Sender G, Mayntz M. Major histocompatibility complex polymorphism y mastitis resistance - a review. Anim Sc Pap Rep 2006; 24:11-25.
[ Links ]2. Banchereau R, Steinman RM. Dendritic cell and de control of immunity. Nature 1998; 392:245-252.
[ Links ]3. Barryere TG, Muggli-Cockett N, Robbins JW, Schmutz SM. Molecular studies of DRB relative to Sthaphylococcus aureus mastitis. Proceeding of the 5th World Congress on Genetics Applied to livestock Productions, Guelph, Canadá, 1994; 21:187-90.
[ Links ]4. Batra TR, Lee AJ, Gavora JS, Stear MJ. Class I alleles of the bovine major histocompatibility system and their association with economic traits. J Dairy Sci 1989; 72:2115-2124.
[ Links ]5. Castro S, Trujillo E, Durán CV. Polimorfismos de BoLA-DRB3 en el bovino sintético colombiana Lucerna y asociación con conteo de células somáticas y mastitis. Rev Col Cienc Pecu 2006; 19:270-278.
[ Links ]6. Cerón MF, Agudelo EJ, Maldonado JG. Relación entre el recuento de células somáticas individual o en tanque de leche y la prueba CMT en dos fincas leches del Departamento de Antioquia (Colombia). Rev Colomb Cienc Pecu 2007; 20:472-483.
[ Links ]7. Davies CJ, Joosten I, Andersson L, Arriens M, Bernoco D. Polymorphims of bovine MHC class II genes. Joint report of the fifth international bovine lymphocyte antigen (BoLA) Worshop, Interlaken, Switzerland, 1 august 1992. Eur J immunogenet 1994; 21:259-289.
[ Links ]8. Davies CJ, Joosten I, Andersson L, Arriens MA, Bernoco D, Byrns G, Bissumbhar B, van Eijk MJT, Kristensen B, Lewin HA, Mikko S, Morgan ALG, Muggli-Cockett NE, Nilsson PhR, Oliver RA, Park CA, van der Piel JJ, Polli M, Spooner RL and Stewart JA. Polymorphism of bovine MHC class II genes. 1992, [fecha de acceso 30 de septiembre de 2009]. URL: http://www. projects.roslin.ac.uk/bola/wk92b.html
[ Links ]9. Dietz AB, Cohen ND, Timms L, Kehrli ME. Bovine lymphocyte antigen class II alleles as risk factors for high somatic cell counts in milk of lactating dairy cows. J Dairy Sci 1997a; 80:406-412.
[ Links ]10. Dietz AB, Detilleux JC, Freeman AE, Kelley DH, Stabe JR. Genetic association of bovine lymphocyte antigen DRB3 alleles with immunological traits of Holstein cattle. J Dairy Sci 1997b; 80:400-405.
[ Links ]11. Gelhaus A, Schnittger L, Mehlitz D, Horstmann R, Meyer C. Sequence and PCR-RFLP analysis of 14 novel BoLA-DRB3 alleles. Anim Genet 1995; 26:147-153.
[ Links ]12. Gillespie BE, Jayarao BM, Dowlen HH, Oliver SP. Analysis and frequency of bovine lymphocyte antigen DRB3.2 alleles in Jersey cow. J Dairy sci 1999; 82:2049-2053.
[ Links ]13. Hall TA, BIOEDIT: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucleic Acids Symp Ser 1999; 41:95-98.
[ Links ]14. Hartl DL. A primer of populations Genetics. 3th. Sinauer Associates, Inc. Publishiers. Sunderland, Mássachussets. U.S.A 2000; p. 26-31.
[ Links ]15. Kelm SC, Dettilleux JC, Freeman AE, Kehrli JR, Dietz AB, Fox LK, Butler JE, Kasckovics I, Kelley DH. Genetic association between parameters of inmate immunity and measures of mastitis in periparturient Holstein cattle. J Dairy Sci 1997; 80:1767-1775.
[ Links ]16. Ledwige SA, Mallard BA, Gibson JP, Jansen GB, Jialing ZH. Multi-primer target PCR for rapid identification of bovine DRB3 alleles. Anim Genet 2001; 32:219-221.
[ Links ]17. Ledwige SA. Associations between specific bovine leukocyte antigen DRB3 alleles and mastitis in Canadian Holstein. Ms. Thesis. University of Guelph Ontario Canadá. NIH-2101. 2003.
[ Links ]18. Lemehow S, Hosmer DW. Estimating odds ratio with categorically scaled covariates in multiple logistic regression analysis. Am J Epidemiol 1984; 119:147-151.
[ Links ]19. Lewin HA. Disease resistance and immune response genes in cattle: Strategies for their detection and evidence of their existence. J. Dairy Sci 1989; 72:1334-1348.
[ Links ]20. Linn D. Como mantener las células somáticas bajas y las producciones de leche altas. En: Hoard's Dairyman en español 1998; 484-485.
[ Links ]21. López A, Saldarriaga OA, Arango AE, Rugeles MT, Zuluaga FN, Olivera M, Bermúdez N, Bedoya G, Ossa JE. Ganado Blanco Orejinegro (BON): Una alternativa para la producción en Colombia. Rev Colomb Cienc Pecu 2001; 14:2.
[ Links ]22. Lorbacher H. La mastitis bovina. Universidad de Antioquia, Departamento de Salud Pública, Folleto marzo 1982; p. 5-62.
[ Links ]23. Maillard J, Renard C, Chardon P, Chantal I, Bensaid A. Characterization of 18 new BoLA-DRB3 alleles. Anim Genet 1999; 30:200-203.
[ Links ]24. Martínez R, Toro R, Montoya F, Burbano M, Tobón J, Gallego J, Ariza F. Caracterización del locus BoLA-DRB3 en ganado criollo colombiano y asociación con resistencia a enfermedades. Arch zoot 2005; 54:349-356.
[ Links ]25. Miller SA, Dykes DD, Polesky HF. A simple salting out procedure for extracting ADN from human nucleated cells. Nucleic Acids Res 1988; 16:1215.
[ Links ]26. Mota AF, Gabriel JE, Martinez ML, Coutinho LL. Distribution of bovine lymphocyte antigen (BoLA-DRB3) alleles in Brazilian dairy Gir cattle (Bos indicus) Eur J Immunogenet 2002; 29:223-227.
[ Links ]27. Munévar MG. Creer en lo criollo. Carta Ganadera 1989; 26:26.
[ Links ]28. Nassiry MR, Eftekhar SF, Mosafer J, Mohammadi A, Manshad E, Ghazanfari S, Mohammad Abadi MR, Sulimova GE. Analysis and frequency of bovine lymphocyte antigen (BoLA DRB3) alleles in Iranian Holstein cattle. Russian J Genet 2005; 41:664-668.
[ Links ]29. Nassiry MR, Sadeghi B, Tohidi R, Afshari JT, Khosravi M. Comparison of bovine lymphocyte antigen DRB3.2 allele frequencies between two subpopulations of Iranian Holstein cattle. African J Biotech 2008; 7:2671-2675.
[ Links ]30. Pashmi M, Qanbari S, Ghorashi SA, SharifiAR, Simianer H. Analysis of relationship between bovine lymphocyte antigen DRB3.2 alleles, somatic cell count and milk traits in Iranian Holstein population. J Anim Breed Genet 2009; 126:296-303.
[ Links ]31. Rainard P, Riollet C. Innate immunity of the bovine mammary gland - Review article. Vet Res 2006; 37:369-400.
[ Links ]32. Rodríguez G. Comportamiento de la mastitis bovina y su impacto económico en algunos hatos de la sabana de Bogotá, Colombia. Rev Med Vet 2006; 12:35-55.
[ Links ]33. Rothschild MF, Skow L, Lamont SJ. The major histocompatibility complex and its role in disease resistance and immune responsiveness. En: Breeding for disease resistance in farm animals. 2nd edition. Ed Axford RFE, Bishop SC, Nichols FW Owen JB. CABI publishing 2000; p. 73.
[ Links ]34. Rupp R, Boichard D. Genetics of udder health in dairy ruminants. EAAP meeting, Dublin, 26-29 August 2007- Session 34.
[ Links ]35. Rupp R, Boichard D. Genetics of resistance to mastitis in dairy cattle. Vet Res 2003; 34:671-688.
[ Links ]36. Rupp R, Hernández A, Mallard BA. Association of bovine leukocyte antigen (BoLA) DRB3.2 with immune response, mastitis and production and type traits in Canadian Holsteins. J Dairy Sci 2007; 90:1029-1038.
[ Links ]37. Russell GS, Smith JA, Oliver RA. Structure of the BoLA-DRB3 gene and promoter. Eur J Immunogenet 2004; 31:145-151.
[ Links ]38. SAS Institute. SAS/STAT User's Guide: Statistics. Version 8. 4th ed. Cary. North Carolina, Inc 1998.
[ Links ]39. Schaschl H, Wandeler P, Suchentrunk F, Obexer-Ruff G and Goodman S. Selection and recombination drive the evolution of MHC class II DRB diversity in ungulates. Heredity 2006; 97:427-437.
[ Links ]40. Sharif S, Mallard BA, Sargeant JM. Presence of glutamine at position 74 of pocket 4 in the BoLA-DR antigen binding groove is associated with occurrence of clinical mastitis caused by Staphylococcus species. Vet Immunol Immunopathol 2000; 76:231-238.
[ Links ]41. Sharif S, Mallard BA, Wilkie BN, Sargeant JM, Scott HM, Dekkers JCM, Leslie KE. Associations of the bovine major histocompatibility complex DRB3 (BoLA-DRB3) alleles with occurrence of disease and milk somatic cell score in Canadian dairy cattle. Anim Genet 1998; 29:185-193.
[ Links ]42. Sigurdardóttir S, Borsch C, Gustafsson K, Andersson L. Cloning and sequence-analysis of 14 DRB alleles of the bovine major histocompatibility complex by using the polymerase chain reaction. Anim Genet 1991; 22:199-209.
[ Links ]43. Starkenburg RJ, Hansen LB, Kehrli JR, Chester-Jones H. Frequencies and Effects of Aternative DRB3.2 Allels of bovine lymphocyte antigen for Holstein in milk selection and control lines. J Dairy Sci 1997; 80:3411-3419.
[ Links ]44. Takeshima SN, Aida Y. Structure, Function and disease susceptibility of the bovine major histocompatibility complex. Anim Sci Journal 2006; 77:138-150.
[ Links ]45. Trujillo E, Rodríquez P, Cerón M. Caracterización y análisis de asociación de BoLA DRB3 con el conteo de células somáticas, en la raza Holstein en Antioquia Colombia. Acta Biol Colomb 2005; 27:171-178.
[ Links ]46. Van Dorp RT, Martin SW, Shoukri MM, Noordhuizen JP, Dekkers JC. Cananadian. An Epidemiologic study of disease in 32 registered Holstein Dairy Herds in British Columbia. J Vet Res 1999; 63:185-192.
[ Links ]47. Van Eijk MJT, Stewart-Haynes JA, Lewin HA. Extensive polymorphism of the BoLA-DRB3 gene distinguished by PCRRFLP. Anim Genet 1992; 23:483.
[ Links ]48. Wolfová M, Stípkova M, Wolf J. Incidence and economics of clinical mastitis in five Holstein herds in the Czech Republic. Prev Vet Med 2006; 77:48-64.
[ Links ]













