Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.25 no.1 Medellín Jan./Mar. 2012
Artículos originales
Glutathione Peroxidase and Superoxide Dismutase activities inblood and seminal plasma in colombian stallions¤
Actividad de la Glutatión Peroxidasa y la Superóxido Dismutasa en sangre y plasma seminal en caballos colombianos
Atividade das enzimas antioxidantes: glutationa peroxidase e superóxido dismutase no sangue e plasma em cavalos colombiano
Néstor A Villa1*, MVZ, MSc; Daniel Castaño1, MVZ; Paulo C Duque1, MVZ; Alejandro Ceballos1, MVZ, MSc, PhD.
1 Instituto de Biotecnología Agropecuaria. Grupo de investigación Biotecnología Agraria, Universidad de Caldas. A.A.275. Manizales, Colombia.
(Recibido: 28 julio, 2010; aceptado: 4 agosto, 2011)
Summary
Objective: to measure the activity of the antioxidant enzymes Glutathione Peroxidase (GSH-Px; EC 1.11.1.9) and Superoxide Dismutase (SOD; EC 1.15.1.1) in blood and seminal plasma of Colombian Stallions from four farms and to relate them to changes in semen quality. Methods: semen was collected from 25 horses using an artificial vagina. Blood was collected in EDTA vacutaniers by yugular venipuncture. Basic semen analysis included individual and mass motility, morphology, and sperm concentration. A sub sample was centrifuged to obtain seminal plasma for the evaluating GSH and SOD. Results: mean GSH- Px activity was 514.8 ± 22.4 U/g Hb and 0.55 ± 0.05 U/mL in blood and seminal plasma, respectively. Mean SOD activity was 1877 ± 188 U/g Hb in blood, and 86 ± 7.1 U/mL in seminal plasma. No correlation was found between the enzyme activities in seminal plasma and blood. However, seminal plasma GSH- Px activity was correlated with sperm concentration. Similarly, GSH-Px activity in blood was correlated to the proportion of sperm cells with progressive motility and morphologically normal. Conclusions: the absence of correlation found between enzymatic activity in blood and seminal plasma suggests that both antioxidant systems are independent.
Key words: antioxidant enzymes, spermatozoa, stallions.
Resumen
Objetivo: determinar la actividad de las enzimas antioxidantes Glutatión Peroxidasa (GSH-Px; EC 1.11.1.9) y Superóxido Dismutasa (SOD; EC 1.15.1.1) en sangre y plasma seminal de 25 caballos reproductores criollos colombianos, clínicamente sanos, pertenecientes a cuatro criaderos y alimentados con concentrado comercial. Métodos: a cada caballo se le tomó un eyaculado mediante vagina artificial. Previa centrifugación del semen para obtener el plasma seminal, se evaluaron las características seminales (volumen, motilidad masal, motilidad individual, concentración espermática). Resultados: el promedio para GSH-Px fue 514.8 ± 22.4 U/g Hb y 0.55 ± 0.05 U/mL en sangre y plasma seminal, respectivamente. La actividad de SOD fue 1877 ± 188 U/g Hb en sangre y 86 ± 7.1 U/mL en plasma seminal. No se encontró correlación entre la actividad de las enzimas estudiadas en el plasma seminal con la actividad sanguínea. Sin embargo la actividad de GSH-Px en plasma seminal se correlacionó significativamente con la concentración espermática. Así mismo GSH-Px en sangre se correlacionó con el porcentaje de espermatozoides con movimiento individual progresivo y con el porcentaje de espermatozoides normales. La SOD no tuvo ninguna correlación con las variables espermáticas analizadas. Conclusiones: La falta de correlación entre la actividad enzimática en ambos sistemas sugiere que serían sistemas antioxidantes independientes.
Palabras clave: caballos, enzimas antioxidantes, espermatozoide.
Resumo
Objetive: o objetivo deste estudo foi determinar a atividade de enzimas antioxidantes glutationa peroxidase (GSH-Px, EC 1.11.1.9) e superóxido dismutase (SOD, EC 1.15.1.1) no sangue e plasma seminal de 25 cavalos reprodutores crioulo colombiano, clinicamente saudáveis , provenientes de quatro fazendas e alimentados com ração comercial. Métodos: cada cavalo foi levado por ejaculado vagina artificial. Após a centrifugação do sêmen para a obtenção do plasma seminal, foram avaliados as características seminais (volume, turbilhonamento, motilidade individual, a concentração de espermatozóides). Resultados: a média de GSH-Px foi de 514.8 ± 22.4 U / g Hb e 0.55 ± 0.05 U / mL no plasma sanguíneo e seminal, respectivamente. Atividade da SOD foi 1877 ± 188 U / g Hb no sangue e 86 ± 7.1 U / mL no plasma seminal. Não houve correlação entre a atividade das enzimas estudadas no plasma seminal para a atividade de sangue. No entanto, a atividade de GSH-Px no plasma seminal se correlacionaram significativamente com a concentração de espermatozoides. Também a GSH-Px no sangue foi correlacionada com a percentagemde espermatozoides com movimento individual progressiva e o percentual de espermatozoides normais. SOD não teve correlação com variáveis analisadas no esperma. Conclusões: A falta de correlação entre a atividade da enzima em ambos os sistemas sugere que os sistemas antioxidantes são independentes.
Palavras chave: cavalos, enzimas antioxidantes, espermatozoides.
¤ Para citar este artículo: Villa NA, Castaño D, Duque PC, Ceballos A. Actividad de Glutatión Peroxidasa y Superóxido Dismutasa en sangre y plasma seminal en caballos colombianos. Rev Colomb Cienc Pecu 2012; 25:64-70.
* Autor para correspondencia: Néstor Alonso Villa. Departamento de Sistemas de Producción. Grupo de investigación Biotecnología Agraria, Universidad de Caldas. A.A. 275. Manizales, Colombia, E-mail: navilla@ucaldas.edu.co.
Introducción
El macho reproductor juega un papel relevante en las explotaciones equinas bien sea que se utilice para monta directa o inseminación artificial, pues es responsable, en gran medida del mejoramiento genético y la fertilidad. En los equinos, como en las demás especies aerobias, existe equilibrio entre la producción de Especies Reactivas de Oxígeno (ERO) y la capacidad antioxidante, cuando se rompe ese equilibrio se genera estrés oxidativo, que puede ocasionar daño celular (Aitken, 1994). Las células sexuales masculinas también sufren daño oxidativo; pero, en ocasiones el papel de las ERO es paradójico, ya que en cantidades bajas son necesarios para que el espermatozoide desarrolle sus procesos fisiológicos, como capacitación e hiperactivación espermática (Aitken, 1994; Man'kovs'ka y Serebrovs'ka, 1998).
La membrana espermática posee gran cantidad de Ácidos Grasos Poliinsaturados (AGPI) necesarios para la fluidez de la membrana plasmática durante la fusión de membranas, evento necesario para la reacción del acrosoma y la interacción con la membrana del ovocito (Aitken et al., 1993). Los AGPI son susceptibles a la peroxidación, lo que hace altamente vulnerable al espermatozoide al estrés oxidativo (Aitken, 1994; Aitken et al., 1993).
La acción de las ERO es contrarrestada por el sistema antioxidante, que puede ser enzimático o no enzimático. La enzima antioxidante Glutatión Peroxidasa (GSH-Px; EC 1.11.1.9) actúa fundamentalmente contra el peróxido de hidrógeno y otros peróxidos orgánicos, y la Superóxido Dismutasa (SOD; EC 1.15.1.1) contra el anión superóxido; ambas se encuentran entre los principales antioxidantes del plasma seminal (Griveau et al., 1995). Además, debe considerarse que durante la espermatogénesis se pierde gran proporción del citoplasma, haciendo al espermatozoide más susceptible al daño de las ERO, ya que ambas enzimas, son citoplasmáticas (Aitken, 1994).
En el hombre se ha indicado que la deficiencia de antioxidantes en plasma seminal deja al espermatozoide desprotegido, especialmente cuando es retirado mediante métodos de selección espermática. Dentro de los trastornos observados se describen alteraciones en la motilidad, en la reacción del acrosoma y disminución de la capacidad fecundante (Aitken y Fisher, 1994). De otra parte, las ERO alteran la integridad del DNA (Kodama etal., 1997; Lopes etal., 1998); además, el daño oxidativo sobre el DNA del espermatozoide puede inducir mutaciones (Comhaire et al., 1999). Así, la caracterización de la actividad enzimática antioxidante en plasma seminal y sangre, tendría un alto potencial para definir una estrategia terapéutica y de control cuando las alteraciones de la fertilidad masculina sean de este origen (Sanches, 1997).
En equinos también se han descrito alteraciones en la morfología y concentración espermática, señalándose que la deficiencia de selenio ha sido asociada con la disminución del número de células espermáticas, incremento en la mortalidad y aumento de defectos de la cabeza y cola del espermatozoide (Hansen y Deguchi, 1996).
En consideración a lo anterior, el objetivo de este estudio fue evaluar la capacidad antioxidante en sangre y plasma seminal en equinos mediante la determinación de la actividad de Glutatión Peroxidasa y Superóxido Dismutasa; además, establecer la eventual relación entre la actividad enzimática en sangre y plasma seminal.
Materiales y métodos
Animales
Se seleccionaron 25 caballos criollos Colombianos en el municipio de Manizales, Caldas (4-6º LN y 75-76º LO). Con una edad promedio de 7 años, clínicamente sanos, en actividad reproductiva y con reposo sexual previo al estudio de tres días. Los caballos recibían una ración diaria de 3 kg de alimento balanceado comercial con una proteína que varío entre el 14 y 16%, pasto imperial (Axonopusscoparius) o heno a voluntad.
Muestras
A cada caballo se le tomó una muestra de semen mediante una vagina artificial tipo Hannover y una yegua en celo según la metodología descrita por Blanchard et al., (2003). Inicialmente se evaluaron las características espermáticas: volumen, motilidad masal, motilidad individual y concentración espermática mediante un densímetro modelo 534B Mod-1. Otra parte del semen se centrifugó durante 15 minutos a 3000 rpm para separar el plasma seminal. También se tomó una muestra de sangre con EDTA mediante venopunción yugular empleando el sistema de tubos al vacío de 10 mL; la sangre, previa determinación de la concentración de hemoglobina utilizando el método de cianometahemoglobina (Van Kampen y Zijlstra, 1961), fue hemolizada separando los eritrocitos contenidos en 500 μL de sangre, mediante centrifugaciones sucesivas a 3000 rpm por 10 minutos en agua destilada a 4 ºC y posteriormente se hizo una dilución de 1:50 con diluyente Ransod; el hemolizado y el plasma seminal se conservaron congelados a –20 ºC hasta su posterior análisis.
La actividad de GSH-Px en el plasma seminal y en sangre se determinó mediante un método cinético NADPH-dependiente, empleando reactivos comerciales (Ransel®, Randox Laboratories, Crumlin, UK). Para plasma seminal se tomaron 10 µL de la muestra diluyéndolos directamente en el reactivo, continuándose según las instrucciones. La actividad de SOD en plasma seminal y en sangre se determinó mediante un método colorimétrico, empleando reactivos comerciales (Ransod®, Randox Laboratories, Crumlin, UK). Para el manejo y el análisis de la muestra de plasma seminal se siguieron las modificaciones de la técnica reportadas por Gavella et al., (1996). La actividad de las enzimas en sangre se expresa en unidades por gramo de hemoglobina (U/g Hb) y en el plasma seminal en unidades por mililitro (U/mL).
Análisis estadístico
Mediante el PROC UNIVARIATE de SAS (SAS Inst. Cary, NC) se calcularon los valores de sesgo y apuntamiento para la distribución de las variables GSH–Px y SOD y así evaluar su ajuste a una distribución normal hipotética; Los datos se analizaron mediante análisis de varianza usando el PROC GLM de SAS para evaluar el efecto de compartimiento (sangre o plasma seminal) sobre GSH–Px y SOD. Así mismo, se evaluó el efecto de GSH–Px y SOD sobre las características espermáticas analizadas. Los resultados se expresan como medias de mínimos cuadrados ± error estándar y los límites del intervalo de confianza al 95%.
Resultados
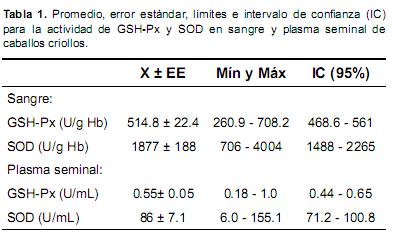
En la Tabla 1 se describe el promedio, error estándar, valor mínimo y máximo e intervalo de confianza al 95% para la actividad enzimática de GSH-Px y SOD en sangre y plasma seminal de los caballos criollos de Manizales Colombia.
Al calcular los valores de sesgo y apuntamiento para la distribución de las variables GSH–Px y SOD no hubo evidencia para rechazar la hipótesis nula que la distribución era en efecto normal (p=0.47 y p=0.9 para sesgo y apuntamiento, respectivamente); se obtuvieron correlaciones entre la actividad de ambas enzimas en sangre y plasma seminal usando el PROC CORR de SAS.
Por lo tanto, no se observó correlación entre la actividad de GSH-Px en sangre y en plasma seminal; sin embargo, la GSH-Px en sangre estaba correlacionada con el porcentaje de espermatozoides con movimiento individual progresivo (r=0.43; p<0.05 y con el porcentaje de espermatozoides normales (r=0.44; p<0.05). Igualmente, se observó que la actividad de GSH- Px en plasma seminal estaba correlacionada significativamente con la concentración espermática (r=0.42; p<0.05).
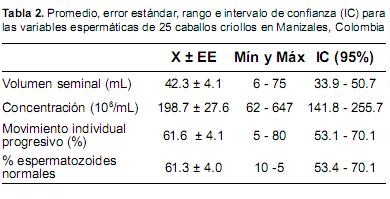
Con respecto a la SOD en sangre y plasma seminal se observó una amplia variación, 706 - 4004 U/g Hb y 6.0 - 155.1 U/mL, respectivamente. No se encontró correlación entre los niveles de esta enzima en sangre y plasma seminal como tampoco con las características seminales. Las características seminales observadas en los animales objeto de estudio se describen en la Tabla 2.
Discusión
La actividad sanguínea promedio de GSH-Px en los equinos estudiados se encontró por encima de 60 U/g Hb, valor que ha sido considerado como indicador de una deficiencia de selenio en animales (Ceballos y Wittwer, 1996; Wichtel, 2007). La actividad de GSH-Px en sangre es dependiente del consumo de selenio en la dieta, observándose que frente a un mayor consumo, se produce un incremento en la actividad de la enzima (Mahan y Parrett, 1996). Pese a lo anterior, la actividad de la enzima alcanza una meseta cuando el consumo de selenio es superior a 0.1 ppm. De otra parte, en un estudio realizado en Polonia con yeguas gestantes y usando la misma técnica analítica, Górecka et al. (2002), encontraron concentraciones inferiores a 60 U/g Hb, indicando poca actividad de la enzima por un consumo inadecuado de Se. Sin embargo, De Moffarts et al. (2005), también encontraron concentraciones de esta enzima inferiores a los hallados en este estudio, 228 ± 38.2 U/g Hb. Por lo anterior y de acuerdo a los antecedentes de literatura, los valores obtenidos para la actividad de la enzima GSH-Px serían compatibles con un consumo adecuado de selenio, si bien la determinación de selenio como tal no fue objeto del presente estudio.
En el laboratorio de la Universidad de Caldas se han realizado estudios en otras especies de interés zootécnico; se ha encontrado en toros Brahman y Normando una actividad promedio de GSH- Px en plasma seminal superior a la observada en caballos (Villa et al., 1999; Villa et al., 2008). Igualmente, estudios realizados en cerdos y suplementados con selenio (0.5 mg/kg de ración), los valores obtenidos para la actividad de GSH-Px en el plasma seminal fueron inferiores (Kolodziej y Jacyno, 2004) a los observados en los caballos de este estudio. Lo anterior sugiere que el estado pro oxidativo en los caballos se encontraría asociado a la actividad celular y al consumo de oxígeno propio de la especie y que podría diferir de dicha actividad en otras especies, lo que sugiere una demanda antioxidante mayor por el esfuerzo físico al que están sometidos constantemente los equinos, indicando un mayor consumo de antioxidantes por parte de los espermatozoides. Por lo tanto, se sugiere la realización de estudios complementarios donde se consideren caballos con problemas de fertilidad y la evaluación del contenido de selenio tanto en la dieta como en sangre y plasma seminal.
No se observó correlación entre la actividad de GSH-Px en sangre y en plasma seminal, lo que sugeriría una independencia entre ambos compartimientos en la síntesis de la enzima. Resultados similares a los descritos por Lasota et al., (2004), quienes señalan que los mecanismos que controlan el contenido de selenio y la actividad de GSH-Px en la sangre son independientes a los observados en el semen.
Pese a lo anterior, en diferentes especies domésticas se ha indicado que los espermatozoides son ricos en selenio (aproximadamente 30 µg/g) y se encuentra localizado en la mitocondria, incorporándose tempranamente durante la espermatogénesis (Hansen y Deguchi, 1996). Así, se ha visto que el tejido testicular tiene una alta capacidad de retención del mineral, observándose un detrimento, por ejemplo, en la actividad reproductiva del cerdo frente a dietas deficitarias en este mineral (Marín-Guzmán et al., 1997). Por lo anterior, es de esperar que frente a un mayor consumo de selenio en la dieta, habría una mayor disponibilidad de este mineral para los procesos antioxidativos en el semen del equino.
La correlación observada de GSH-Px en sangre con las características seminales, movimiento individual progresivo y porcentaje de normalidades espermáticas, no tienen una explicación biológica aparente y no se encontraron antecedentes de literatura que la pudieran explicar. Sin embargo es importante realizar otros estudios para profundizar los conocimientos en esta área.
Con respecto a la SOD, los valores promedio obtenidos son similares a los observados para otras especies. En bovinos y utilizando la misma técnica analítica se observó un promedio para esta enzima en sangre de 1390 ± 1299 U/g Hb (Jaramillo et al., 2005). En toros Brahman y Normando se ha observado una actividad en sangre de 1196 ± 645 y 940 ± 374 U/g Hb, respectivamente y en plasma seminal una actividad enzimática, en estas mismas especies de 5.7 ± 4.0 y 5.1 ± 2.6 U/mL, respectivamente (Villa et al., 1999; Villa et al., 2008). En plasma seminal humano, se encontraron valores para SOD que fluctuaron entre 6 y 31 U/mL (Vallejos et al., 2003); igualmente, ha descrito un promedio de 6.9 ± 2.8 U/mL en plasma seminal humano (Gavella et al., 1996).
La mayor actividad de esta enzima en el plasma seminal de los equinos puede deberse a una suficiente cantidad de sustrato (e.g. cobre, zinc y manganeso) para la síntesis de la misma. Igualmente, la síntesis de la enzima podría estar aumentada a nivel de las glándulas sexuales accesorias y en el testículo en comparación con otras especies estudiadas. También, podría presentarse una menor participación de la enzima en la defensa antioxidante a nivel del plasma seminal del equino, lo que se podría traducir en una mayor actividad de la enzima por menor consumo.
Lo anterior, también podría indicar que la actividad de SOD tendría una menor participación en la prevención del daño oxidativo en el semen, entonces los espermatozoides obtendrían su defensa antioxidante a partir de otros sistemas (ej. vitaminas). Pese a ello, la SOD es la mayor enzima protectora contra la toxicidad del oxígeno en términos generales (Álvarez et al., 1987). Al agregar diferentes antioxidantes a un medio con espermatozoides recuperados mediante separación en gradiente de Percoll e incubados con xantina y xantina oxidasa, encontrando que la catalasa y la SOD evitaron el daño producido por las ERO sobre los ácidos grasos de la membrana espermática (Griveau et al., 1995).
Con respecto al semen, éste se encontraba dentro de los valores de referencia para volumen (33.7-65 mL), concentración (164-335 x 106/mL) movimiento individual progresivo (52-68%) y porcentaje de espermatozoides normales (47-67%) señalados por Juhász et al., (2000) para la especie. Se observó una correlación significativa entre la concentración espermática y la actividad de GSH-Px en plasma seminal. En humanos, se ha encontrado una correlación inversa entre ERO y el volumen seminal y motilidad espermática (Iwasaki y Gagnon, 1992). De otra parte, en semen equino la mayor fuente de radicales libres es el peróxido de hidrógeno, el que es neutralizado por la SOD; sin embargo no se han encontraron asociaciones entre la calidad seminal y esta enzima (Baumber et al., 2000).
Bajo las condiciones de este estudio se puede señalar que la actividad de GSH-Px en sangre es superior a la hallada en otros estudios. La falta de más antecedentes en la literatura y la evaluación del estado antioxidante en sangre y plasma seminal en equinos, hizo necesaria la comparación con lo observado en otras especies, no dejando de considerar las diferencias nutricionales y metabólicas que existen. Habiéndose utilizado la determinación de la actividad de GSH-Px como un indicador indirecto del balance nutricional de selenio (Ashton et al., 2009), una actividad superior a la referencia estaría indicando que el consumo de selenio en la dieta sería adecuado. Otro aspecto a considerar es que no necesariamente una mayor actividad de GSH- Px significa una mayor defensa antioxidante o un mayor consumo de selenio, no necesariamente se ve reflejado en una mayor actividad de la enzima, lo que limita el uso de este indicador para evaluar en forma efectiva el estado antioxidante en un compartimiento determinado del organismo.
Igualmente, la actividad de SOD ha sido usada como un indicador indirecto del aporte de otros minerales antioxidantes, indicando que el aporte ha sido suficiente para lograr esta función biológica. No obstante, la alta variación observada en la actividad de esta enzima estaría indicando las diferencias en el consumo de minerales propias de un manejo nutricional diferente en los criaderos. Además, no hay correlación entre la actividad sanguínea de las enzimas analizadas con su actividad en el plasma seminal, lo que sugiere que la sangre y el tracto reproductivo tendrían un sistema de defensa antioxidante independiente.
Agradecimientos
Los autores agradecen a la Vicerrectoría de Investigaciones y Postgrados de la Universidad de Caldas y a los propietarios de los caballos que facilitaron los animales para esta investigación.
Referencias
1. Aitken RJ. A free radical theory of male infertility. Reproduction, Fertility and Development 1994; 6:19-23. [ Links ]
2. Aitken RJ, Buckingham D, Harkiss D. Use of a xanthine oxidase oxidant generating system to investigate the cytotoxic effects of reactive oxygen species on human spermatozoa. J Reprod Fertil 1993; 97:441-50. [ Links ]
3. Aitken RJ, Fisher H. Reactive oxygen species generation and human spermatozoa: The balance of benefit and risk. BioEssays 1994; 16:259-67. [ Links ]
4. Álvarez JG, Touchstone JC, Blasc L, Storey BT. Spontaneous lipid peroxidation and production of hydrogen peroxide and superoxide in human spermatozoa. Superoxide dismutase as major enzyme protectant against oxygen toxicity. J Androl 1987; 8:338-48. [ Links ]
5. Ashton K, Hooper L, Harvey LJ, Hurst R, Casgrain A, Fairweather-Tait SJ. Methods of assessment of selenium status in humans: a systematic review. Am J Clin Nutr 2009; 89:2025S-39S. [ Links ]
6. Baumber J, Ball BA, Gravance CG, Medina V, Davies-Morel MC. The effect of reactive oxygen species on equine sperm motility, viability, acrosomal integrity, mitochondrial membrane potential, and membrane lipid peroxidation. J Androl 2000; 21:895-902. [ Links ]
7. Blanchard TL, Varner DD, Love CC, Brinsko SP, Rigby SL, Schumacher J. Manual of Equine Reproduction. 2nd Ed. St. Louis (MO): Mosby; 2003. [ Links ]
8. Ceballos A, Wittwer FG. Metabolismo del Se en rumiantes. Arch Med Vet 1996; 28: 5-18. [ Links ]
9. Comhaire F, Mahmoud A, Depuydt C, Zalata A, Christophe A. Mechanisms and effects of male genital tract infection on sperm quality and fertilizing potential: the andrologist's viewpoint. Hum Reprod 1999; 5:393-98. [ Links ]
10. De Moffarts B, Kirschvink N, Art T, Pincemail J, Lekeux P. Effect of oral antioxidant supplementation on blood antioxidant status in trained thoroughbred horses. Vet J 2005; 169:65-74. [ Links ]
11. Gavella M, Lipovac V, Vucic M, Rocic B. Superoxide anion scavenging capacity of human seminal plasma. International Journal of Andrology 1996; 19:82-90. [ Links ]
12. Górecka R, Kleczkowski M, Kluciñski WR, Kasztelan R, Sitarska E. Changes in antioxidant components in blood of mares during pregnancy and after foaling. Bull Vet Inst Pulawy 2002; 46:301-06. [ Links ]
13. Griveau JF, Dumont E, Callegari D, Lannou LE. Reactive oxygen species, lipid peroxidation and enzymatic defence system in human spermatozoa. J Reprod Fértil 1995; 103:17-26. [ Links ]
14. Hansen JC, Deguchi Y. Selenium and fertility in animals and man: a review. Acta Vet Scand 1996; 37:19-30. [ Links ]
15. Iwasaki A, Gagnon C. Formation of reactive oxygen species in spermatozoa of infertile patients. Fertil Steril 1992; 57:409-16. [ Links ]
16. Jaramillo S, Villa NA, Pineda AF, Gallego AB, Tabares P, Ceballos A. Actividad sanguínea de superóxido dismutasa y glutatión peroxidasa en novillas a pastoreo. Pesquisa Agropecuária Brasileira 2005; 40:1115-21. [ Links ]
17. Juhász J, Nagy P, Kulcsár M, Huszenicza GY. Methods for semen and endocrinological evaluation of the stallion: A review. Acta Vet Brno 2000; 69:247-59. [ Links ]
18. Kodama H, Yamaguchi R, Fukuda J, Kasai H, Tanaka T. Increased oxidative deoxyribonucleic acid damage in the spermatozoa of infertile male patients. Fertil Steril 1997; 68:519-24. [ Links ]
19. Kolodziej A and Jacyno E. Effect of dietary selenium and vitamin E supplementation on reproductive performance of young boars. Electronic Journal of Polish Agricultural Universities 2004; [fecha de acceso 8/10/10] http://www.ejpau. media.pl/articles/volume7/issue1/animal/art-04.pdf: [ Links ]
20. Lasota B, Blaszczyk B, Seremak B, Udala J. Selenium status and GSH -Px activity in semen and blood of boars at different ages used for artificial insemination. Reprod Domest Anim 2004; 39:309-14. [ Links ]
21. Lopes S, Jurisicova A, Sun JG, Casper RF. Reactive oxygen species: potential cause for DNA fragmentation in human spermatozoa. Hum Reprod 1998; 13:896-900. [ Links ]
22. Mahan DC, Parrett NA. Evaluating the efficacy of selenium- enriched yeast and sodium selenite on tissue selenium retention and serum glutathione peroxidase activity in grower and finisher swine. Journal of Animal Science 1996; 74:2967-74. [ Links ]
23. Man'kovs'ka IM and Serebrovs'ka ZO. The role of oxygen radicals in the physiology and pathology of human sperm. Fiziol Zh 1998; 44:118-25. [ Links ]
24. Marín-Guzmán J, Mahan DC, Chung YK, Pate JL, Pope WF. Effects of dietary selenium and vitamin E on boar performance and tissue responses, semen quality, and subsequent fertilization rates in mature gilts. Journal of Animal Science 1997; 75: 2994-3003. [ Links ]
25. Sanches RG. Estrés oxidativo y fertilidad. En: estrés oxidativo y antioxidantes en la Salud y Nutrición AnimalConference.Curso- seminario. Valdivia Universidad Austral de Chile 1997; p.4-7 [ Links ]
26. Vallejos S, López C, Schulz M, Villegas M. Valores de referencia para superóxido dismutasa, glutatión peroxidasa y estado antioxidante total en sangre y plasma seminal humano. II Reunión anual sociedad de andrología y gametología de Chile: IV Jornadas internacionales de medicina reproductiva y biología de la reproducción. Int J Morphol 2003; 21:167-75. [ Links ]
27. Van Kampen EJ, Zijlstra WG. Standardization of hemoglobinometry II. The hemiglobincyanide method. Clin Chim Acta 1961; 6:538-44. [ Links ]
28. Villa NA, Ceballos A, Correa S, Lopez E, Salazar J. Evaluación del estado antioxidante en plasma seminal en toros Brahman (Bos indicus) en pastoreo y suplementados. Revista Colombiana de Ciencias Pecuarias 1999; 12:187. [ Links ]
29. Villa NA, Moreno W, Ceballos A. Actividad de glutatión peroxidasa y superóxido dismutasa en sangre, plasma sanguíneo y plasma seminal en toros Normando. Rev Col Cienc Pec 2008; 21:537-45. [ Links ]
30. Wichtel J. Se and vitamin E in diary cattle nutrition: review and recent develolopmensConference.VI Seminario internacional de reproduction y metabolismo en bovinos. Manizales, Colombia Universidad de Caldas 2007; p.10-19 [ Links ]