Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.25 no.2 Medellín Apr./June 2012
REVISIONES DE LITERATURA
Endocrine disruption in fish¤
Disrupción endocrina en peces
Disrupção endócrina em peixes
Diego A Aranzazu Taborda1,2*, MV, Esp, MSc (c); Berardo de J Rodríguez2, MV, Esp, PhD, Biviana A Duque Agudelo3, Ing.
* Autor para correspondencia: Diego Alfonso Aranzazu Taborda. Carrera 75 No. 65–87 Escuela de Medicina Veterinaria (Medellín, Antioquia, Colombia). E–mail: daranta7@gmail.com
1,2 Docente Facultad de Ciencias Agrarias, Universidad de Antioquia. Escuela de Medicina Veterinaria. Grupo de Investigación en Patobiología, Quirón.
3 Ingeniera Ambiental; Estudiante Medicina Veterinaria, Facultad de Medicina Veterinaria, Universidad de Antioquia.
(Recibido: 1 febrero, 2012; aceptado: 24 abril, 2012)
Summary
The exposure of living creatures to endocrine disruptors is universal, as they are scattered throughout the world as a result of its widespread use. The variety of endocrine disruptors is very broad and growing every day, including chemicals synthesized by humans, additionally to substances found naturally in the environment. The endocrine disruptors constitute a threat not only to animal health and reproduction, but possibly to humans as well. Biomarkers are used as risk indicators for endocrine disruption. Considered amongst them are plasma steroids levels, induction of vitellogenin and zone radiate protein, and, histology and immunohistochemistry of the liver, gonads and other organs. The appropriate and combined use of biomarkers has allowed significant advances to understand fish reproductive toxicology in both field and laboratory studies. Given that few reports have been published in Colombia on this area, and considering its global importance, this article scrutinizes the state of the art on problems caused by the DE and points out the need of doing more research on this issue.
Key words: ecotoxicology, estrogens, fish, vitellogenin.
Resumen
La exposición de los seres vivos a los disruptores endocrinos (DE) es global, ya que se encuentran dispersos por todo el mundo como consecuencia de su empleo generalizado. El catálogo de DE es muy amplio y crece día a día, comprendiendo desde productos químicos sintetizados por el hombre, hasta sustancias que se encuentran de manera natural en el medio ambiente. Los DE constituyen una amenaza, no solo para la salud general y reproductiva de los animales, sino posiblemente para la salud humana. Los biomarcadores son utilizados como indicadores de riesgo de la disrupción endocrina y entre ellos se incluyen de manera relevante la determinación de los esteroides en plasma, la inducción de Vitelogenina (Vtg) y proteínas de la zona radiada (Zrp) del oocito, junto con la histología e inmunohistoquímica hepática, gonadal y de otros órganos. El uso integrado y adecuado de estos biomarcadores ha permitido avanzar en el conocimiento y la comprensión de la toxicología reproductiva de peces, tanto en estudios de campo como de laboratorio. Debido a que en Colombia se ha realizado escasas publicaciones sobre este tema de importancia mundial, se elaboró este artículo con el objetivo de hacer un escrutinio del estado del arte sobre los problemas causados por los DE, e identificar necesidades de investigación sobre este tema en Colombia.
Palabras clave: ecotoxicología, estrógenos, peces, vitelogenina.
Resumo
A exposição dos seres vivos aos disruptores endócrinos (DE) é global, devido a que se encontram dispersos por todo o planeta como consequência do seu emprego generalizado. O catálogo de DE é muito amplo e cresce dia após dia, compreendendo desde produtos químicos sintetizados pelo homem até substâncias que se encontram de maneira natural no meio ambiente. Os DE constituem uma ameaça, não só para a saúde geral e reprodutiva dos animais, mas também possivelmente para a saúde humana. Os biomarcadores são utilizados como indicadores de risco da disrupção endócrina, dentre eles estão à determinação de esteroides no plasma, a indução de Vitelogenina (Vtg) e as proteínas da zona radiata (Zrp) do oócito, junto com a histologia e a inmunoistoquímica hepática, gonadal e de outros órgãos. O uso integrado destes biomarcadores tem permitido avançar no conhecimento e na compreensão da toxicologia reprodutiva de peixes, tanto em estudos de campo como de laboratório. Devido a que na Colômbia existem escassas publicações sobre este tema de importância mundial, este artigo foi escrito com o objetivo de fazer um escrutínio do estado da arte sobre os problemas causados pelos DE e identificar as necessidades de pesquisa.
Palavras chave: ecotoxicologia, estrogénios, peixes, vitelogenina.
Introducción
Cada vez son mayores las evidencias referentes a que los cuerpos de agua reciben cantidades tanto de químicos sintéticos (xenobióticos) como de químicos naturales que actúan como DE, constituyéndose en una amenaza, no solo para la salud general y reproductiva de los animales, sino para la salud humana (Harrison, 2001; Waring y Harris, 2005).
Los DE alteran el equilibrio hormonal, actúan a dosis muy bajas y utilizan mecanismos de acción variables. Como resultado de lo anterior, se producen trastornos de tipo reproductivo, en el desarrollo de órganos y tejidos, así como alteraciones en los procesos metabólicos (Arukwe y Gokoyr, 2003).
Las fuentes de DE incluyen las descargas de alcantarillados municipales y de algunos efluentes industriales como se han reportado principalmente en Norteamérica, Europa y Japón (Hutchinson et al., 2006); Centroamérica (Vega et al., 2007) y Suramérica (Suárez et al., 2011). Estos contaminantes constituyen un problema global y por esta razón, desde la década de los 90's se han realizado investigaciones con el fin de determinar el impacto que los DE producen en la salud de poblaciones humanas y animales (Waring y Harris, 2005).
No obstante, el gran interés que los DE han generado en la comunidad internacional, en Colombia se han realizado escasos estudios (Gallo, 2006) para identificar el impacto sobre los ecosistemas nativos y, sobre la salud pública y animal; por esta razón se realizó esta revisión de literatura que tiene como objetivo hacer un escrutinio del estado del arte sobre los problemas causados por los DE, e identificar necesidades de investigación sobre este tema en Colombia. Para tal efecto, se revisaron aspectos relacionados con los mecanismos causantes de disrupción endocrina, las fuentes de exposición, los DE comunes en el agua, los efectos sobre los peces, los biomarcadores de disrupción endocrina. Adicionalmente en este artículo se discute la necesidad de realizar investigaciones en las que se determine el efecto de los agroquímicos de mayor uso en Colombia, que puedan servir para comprender la dimensión de este problema en el país, con miras a establecer bases para la biorremediación ecológica.
Definición de disruptor endocrino
El término DE, define un conjunto diverso y heterogéneo de compuestos químicos, tanto naturales como producidos por el hombre, capaces de alterar el equilibrio hormonal, pudiendo interferir con las glándulas endocrinas y sus hormonas, así como con los órganos donde estas actúan (Breithaupt, 2004). Los términos estrógenos ambientales, xenoestrógenos y fitoestrógenos son considerados como sinónimos de los DE (Arukwe y Gokoyr, 2003).
Mecanismos de disrupción endocrina
Los mecanismos de acción de los DE estudiados hasta la fecha incluyen: 1) mimetizar la acción de las hormonas ocupando su lugar, 2) antagonizar la acción de las hormonas, 3) alterar el patrón de síntesis y metabolismo hormonal, y 4) modular el número de receptores correspondientes (Escudero, 2010).
Formas y efectos de exposición a DE
La exposición de los organismos a los DE es masiva y universal. Los DE no persistentes pueden actuar durante cortos períodos de tiempo, en momentos críticos del desarrollo desapareciendo del organismo con facilidad. Los DE persistentes se acumulan en el organismo y pueden actuar a pesar de que la exposición no haya tenido lugar en el momento crítico; a lo anterior contribuye su baja biodegradabilidad, el transporte a otros lugares por el aire y el agua, así como la bioacumulación en la cadena trófica (Hutchinson, 2006).
En hábitats acuáticos, los DE son fácilmente biodisponibles para los peces a través de una variedad de rutas, incluyendo la respiración, la osmoregulación, y la transferencia materna de contaminantes al embrión vía lípidos del vitelo. El contacto dérmico con sedimentos contaminados o la ingestión de alimentos contaminados también son rutas probables de exposición (Mills y Chichester, 2005).
Aunque los efectos de los DE varían de una especie a otra y son específicos de cada sustancia química, pueden formularse cuatro enunciados según (Mills y Chichester 2005): 1) los efectos de los contaminantes pueden ser distintos sobre el embrión, el feto, el organismo perinatal o el adulto, 2) los efectos se manifiestan con mayor frecuencia en la progenie que en el progenitor expuesto, 3) el momento en que se expone el organismo en desarrollo es decisivo para determinar el carácter, la gravedad y la evolución del efecto; y por último y 4) aunque la exposición crítica tenga lugar durante el desarrollo embrionario, las manifestaciones pueden no ser evidentes hasta la madurez del individuo.
DE y fuentes de exposición
Actualmente se conoce un gran número de sustancias químicas artificiales, que vertidas al medio ambiente tienen el potencial para perturbar el sistema endocrino de los organismos. Entre ellas se encuentran sustancias persistentes, bioacumulativas y organohalógenas como algunos plaguicidas (fungicidas, herbicidas e insecticidas), sustancias químicas industriales, productos sintéticos y metales pesados (Bridges y Bridges, 2004; Mastandrea et al., 2005).
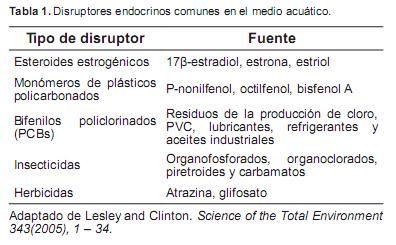
Entre los DE encontrados en el medio acuático están los esteroides estrogénicos como: 17β–estradiol, estrona, estriol, los cuales se han encontrado en efluentes de alcantarillados en concentraciones bajas (Hyndman et al., 2010). Los xenoestrógenos al ser su estructura muy similar a los estrógenos endógenos se unen a los receptores estrogénicos α o β y así ejercerse su efecto aún a concentraciones bajas (Larsson y Adolffsson, 2002).
Productos de la biodegradación de los detergentes alquil–poliethoxilatos como el nonilfenol y octilfenol, se encuentran en efluentes de alcantarillados y aguas de desecho de sistemas sépticos. Algunos alquilfenoles han mostrado su unión a receptores estrogénicos y estimulan una respuesta biológica similar a 17β–estradiol, aunque se requieren investigaciones adicionales para determinar los niveles en el ambiente acuático que pueden tener efecto estrogénico. (White et al., 1994)
El Bisfenol A, usado en resinas epóxicas, plásticos policarbonados y sellantes dentales, tienen actividad estrogénica tanto en pruebas de proliferación celular in vitro como con células de cáncer de mama (LaPensee et al., 2010). Este compuesto se ha detectado en efluentes de alcantarillado y aguas de desecho de sistemas sépticos a bajas concentraciones (Korner, 2000; Wei et al., 2011). Algunos contaminantes ambientales persistentes tales como bifenilos policlorinados (PCBs) (Storelli et al., 2009) y pesticidas (DDT y sus metabolitos) también se han considerado DE (Ssebugere et al., 2009).
Otros DE interactúan con receptores de andrógenos, más que con receptores de estrógenos; entre estos se encuentran algunos agentes terapéuticos como hidroxitamoxifen, flutamide y el fungicida vinclozolin. Compuestos como bisfenol A, butil–benzil–ftalato. y o,p'–DDT son también antiandrógenos (Olea et al., 2002), demostrando que un DE químico puede tener actividad hormonal múltiple. En efecto, los receptores de hormonas esteroides se han denominado como ''promiscuos'' en relación a su unión al ligando; lo anterior, debido a que muchos químicos considerado DE se unen con más de un tipo de receptor de esteroides (Mills y Chichester, 2005).
Los DE tienen una de las siguientes características: están presentes en el medio ambiente a altas concentraciones, son persistentes y bioacumulables o están ingresando constantemente al medio ambiente (Mills y Chichester, 2005). Los DE resistentes a biodegradación y lipofílicos, como pesticidas organoclorados, PCBs y alquifenoles se encuentran en el medio acuático y pueden bioacumularse en los organismos expuestos. El Bisfenol A y el 17β– estradiol no se bioacumulan pero están ingresando continuamente al medio ambiente acuático (Mills y Chichester, 2005).
DE como el tributyltin (TBT) se sospecha que actúa por mecanismos distintos a la interacción con los receptores hormonales. Las evidencias sugieren que el TBT ejerce sus efectos por interferencia con la enzima aromatasa en la biosíntesis normal de hormonas esteroides, más que mediante la interacción con los receptores de dichas hormonas (Matthiessen y Gibbs, 1998; McAllister y Kime, 2003).
DE comunes en el medio acuático
Se ha reconocido una gama amplia de compuestos químicos encontrados en el ambiente acuático que comprometen la capacidad reproductiva y el desarrollo sexual de numerosas especies. Los siguientes son DE comunes en el medio acuático (Tabla 1).
Estimación de los riesgos de los DE
Según Mills y Chichester (2005) se plantean las siguientes consideraciones sobre la estimación de riesgo por DE: 1) los DE no presentan una relación unívoca dosis–respuesta. Por el contrario, pueden presentar varias respuestas a una misma causa, además, estas pueden ocurrir tras períodos de latencia de varios años, 2) ningún organismo esta expuesto a una sola sustancia a la vez. Por el contrario, están expuestos a mezclas y, de hecho, cada organismo puede estar contaminado con cientos de sustancias químicas sintéticas y cabe la posibilidad de que puedan interactuar entre si, ya sea inhibiendo sus efectos, sumándolos o potenciándolos, 3) la acción hormonal derivada de la exposición a DE depende de la presencia de la cantidad adecuada de hormonas en el momento preciso, variando los efectos según la edad y el sexo, 4) la capacidad de los contaminantes de ser transportados por el aire, el agua o los alimentos y de depositarse en zonas localizadas a miles de kilómetros de sus lugares de origen, ha convertido el problema de contaminación en un problema de exposición global y 5) el hecho de que muchos de los DE sean bioacumulativos dificulta la determinación del período de exposición.
Efecto de los DE en peces
En general, la fisiología reproductiva de vertebrados tanto mamíferos como no mamíferos es similar en estructura y función. De igual manera las vías biosintéticas para las hormonas esteroideas por sí mismas también están bien conservadas en vertebrados mamíferos y no mamíferos. (Mills y Chichester, 2005).
Sin embargo, los peces tienen algunos aspectos de la fisiología reproductiva que puede causar que estos respondan de una manera diferente a los DE, por ejemplo, en peces, la secreción de GnRH normalmente cambia en respuesta a señales del ambiente (Mills y Chichester, 2005). En el mismo sentido, se ha demostrado en especies de peces que durante una etapa de diferenciación sexual, la expresión de genes es regulada por factores epigenéticos como la temperatura y otros factores ambientales, repercutiendo en la diferenciación gonadal y de estructuras sexuales secundarias (Méndez et al., 2008). Hay especies de peces que pueden ser dioicas (sexos separados) o hermafroditas (gónadas de macho y hembra en un individuo). Contrario a los mamíferos, los genes que determinan el sexo en peces no se han descrito aún, aunque se han propuesto algunos candidatos para especies en particular como el salmón del atlántico (Manolakou et al., 2006)
En hembras de especies de peces ovíparos la producción de vitelogenina (Vtg), precursor proteico del vitelo, es un proceso crítico para su éxito reproductivo. Normalmente, las hembras maduras producen estrógenos suficientes para inducir la vitelogénesis, pero la exposición a químicos estrogénicos en el ambiente, provocan respuestas negativas en machos de peces adultos y jóvenes (Mills y Chichester, 2005).
En 1993 se publicó, por primera vez, la observación experimental relativa a los desórdenes de expresión del fenotipo sexual en peces. En efecto, los peces machos capturados en las cercanías de plantas de tratamiento de aguas residuales presentaron características sexuales masculinas y femeninas. Se observó también la producción de Vtg en el hígado de los peces macho, una proteína sintetizada normalmente por las hembras como respuesta a una señal estrogénica. Varias sustancias químicas, especialmente alquifenoles encontrados en detergentes y plásticos se identificaron como responsables de estos efectos (Jobling et al., 1996).
Estudios de laboratorio han permitido evaluar el impacto de la exposición a tóxicos en peces y sus efectos en el desarrollo ovárico. Se ha observado efectos como inhibición en el desarrollo y maduración de oocitos, incremento de atresia folicular, depósito anormal y formación de yema en los oocitos, alta mortalidad, machos con ovotestis, intersexos, disminución en el crecimiento del testículo, reducción del índice gonadosomal, histología gonadal alterada y maduración y producción anormal de huevos (Mills y Chichester, 2005).
Wester et al., (1988), observaron el desarrollo de ovotestes en machos y la inducción de vitelogénesis en peces Medaka (Oryzias latipes) expuestos a β– hexachlorocyclohexano (β–HCH), demostrando los efectos estrogénicos de este compuesto (Liang et al., 1990). En estudios más recientes se han observado respuestas similares cuando estos peces son expuestos a 4–nonilfenol y Bisfenol A (Mills y Chichester, 2005).
La alteración de la función tiroidea, la disminución de la fertilidad, la disminución del éxito en la incubación, alteraciones morfológicas, anormalidades metabólicas y feminización, son las consecuencias que como efecto de disrupción endocrina, se han presentado en peces en estudios tanto de poblaciones en afluentes, estuarios y en trabajos experimentales de laboratorio (Mills y Chichester, 2005).
En general, los datos experimentales de laboratorio apoyan la hipótesis de que los DE en el medio ambiente acuático pueden impactar la salud reproductiva de varias especies de peces. Sin embargo, se necesitan más estudios que determinen si las poblaciones de peces rutinariamente expuestas a DE en su hábitat están expresando cambios en la estructura de la población (Mills y Chichester, 2005). La relación, disrupción endocrina y deterioro reproductivo con un impacto ecológicamente relevante sobre la sostenibilidad de peces, permanece, con pocas excepciones, como un desafío de investigación (Bridges y Bridges, 2004; Ôrn et al., 2003).
Métodos para la identificación de DEs. Biomarcadores de disfunción endocrina en peces
Los biomarcadores son indicadores de cambios en un organismo a nivel molecular, celular, histopatológico debidos a la exposición a xenobióticos (Arukwe y Gokoyr, 2003; Fossi et al., 2002).
De acuerdo a la Organización Mundial de la Salud, los biomarcadores pueden subdividirse en tres clases: 1) Biomarcadores de Exposición: estos incluyen la detección y la medición de una sustancia exógena o sus metabolitos o el producto de una interacción entre un agente xenobiótico y alguna molécula blanco o célula, los cuales se miden en un compartimiento dentro de un organismo, 2) Biomarcadores de Efecto: incluyen las mediciones bioquímicas, fisiológicas u otras alteraciones dentro de los tejidos o líquidos corporales de un organismo, que pueden reconocerse como asociados con el deterioro de la salud o enfermedad, y 3) Biomarcadores de Susceptibilidad: indican la habilidad hereditaria o adquirida de un organismo para responder al desafío de la exposición a un xenobiótico específico, incluyendo factores genéticos y cambios en los receptores los cuales pueden alterar la susceptibilidad de un organismo a la exposición.
La exposición a un contaminante ambiental y la determinación de sus efectos en peces en ecosistemas acuáticos, puede examinarse utilizando biomarcadores como: enzimas de biotransformación como la citocromo P–450; parámetros de estrés oxidativo a partir de la medición de la actividad de enzimas como glutatión peroxidasa y catalasa; parámetros hematológicos; inmunológicos; reproductivos y endocrinos. Así como, parámetros genotóxicos, neuromusculares, e histomorfológicos (Van der Ven et al., 2003).
Los biomarcadores tienen diferente potencial dependiendo de la característica del estudio que se realice. En este artículo trataremos de manera particular la relevancia de las proteínas oogénicas, de la histopatología e inmunohistoquímica (IHQ) en los estudios de ecotoxicidad. El uso integrado de estos biomarcadores ha permitido avanzar en el conocimiento y la comprensión de la toxicología reproductiva de peces tanto en estudios de campo como en los de laboratorio; además de proporcionar los mecanismos de ''alerta'' para el estudio de otras poblaciones acuáticas, que pueden compartir sistemas reproductivos hormonales similares (Hutchinson et al., 2006; Van der Oost et al., 2003).
Se asume generalmente que los biomarcadores indican el estado de salud en general del pez siendo el reflejo de los efectos debidos a la exposición a xenobióticos. Los cambios agudos se observan cuando los niveles de un contaminante son lo suficientemente altos, mientras que se requiere la exposición crónica a agentes contaminantes para determinar los aspectos subletales de los cambios observados (Rajeswary y Ramudu, 2005).
En las dos últimas décadas se ha producido información relevante sobre estos aspectos histopatológicos debidos a tóxicos o sus mezclas, lo que permite su aplicación en estudios integrados de campo (Mills y Chichester, 2005).
En algunos casos cuando se evalúa la histología gonadal, es posible que las observaciones microscópicas puedan sugerir diferentes efectos adversos significativos, por ejemplo, si un pez expuesto a una sustancia no tiene células de Sertoli, como consecuencia de disrupción endocrina durante las primeras etapas de su desarrollo será infértil. De igual manera, si los peces expuestos a xenobióticos no desarrollan su conducto gonadal, los gametos no podrán ser transportados al exterior y por ende serán infértiles. Por otro lado, si los peces fueron expuestos a un DE durante la diferenciación sexual, puede que estos tengan reversión sexual; la histología gonadal puede no mostrar un impacto adverso en el individuo, pero este efecto individual podría significar o alertar sobre la existencia de un efecto adverso en la población (Arukwe y Gokoyr, 2003; Hutchinson, 2006).
Dependiendo de los tejidos u órgano blanco a evaluar, se ha desarrollado una amplia variedad de pruebas para medir la expresión de proteínas oogénicas en peces. Estas incluyen radioinmunoensayo (RIA), ELISA e IHQ utilizando anticuerpos monoclonales y policlonales (Nilsen et al., 2004). En los últimos años, se ha incrementado el uso de RT–PCR (Reacción de la Cadena de Polimerasa en Transcripción Reversa), constituyéndose en una herramienta de trabajo valiosa en la evaluación de la expresión génica, por ejemplo, del mARN de Vtg (Nilsen et al., 2004). En las muestras en plasma, las pruebas varían en sensibilidad, pero algunas como el RT–PCR tienen la capacidad de detectar muy bajos niveles de expresión génica (por debajo de 1 ng/mL). Las pruebas para la detección de Vtg que utilizan solo anticuerpos policlonales, se restringen para el uso con especies homólogas; es importante destacar que algunos anticuerpos presentan reacción cruzada contra Vtg de otras especies (Hashimoto et al., 2003; Hutchinson et al., 2006; Aranzazu et al., 2011).
La localización celular de la síntesis de proteínas oogénicas hepáticas por IHQ ha permitido constatar, utilizando anticuerpos específicos, el efecto que tienen los xenobióticos (Van der Ven et al., 2003). La IHQ ha sido una herramienta valiosa para evaluar la inducción de la síntesis hepática de Vtg (Aranzazu et al., 2009), así como de proteínas de la corona radiada (Zrp) (Van der Ven et al., 2003). Dicha herramienta es especialmente útil en situaciones en donde las muestras de sangre son difíciles de recolectar como sucede con las especies de tamaño muy pequeño. Aunque esta técnica demanda tiempo de trabajo, la localización de la Vtg en los cortes de hígado y otros órganos puede proporcionar conocimientos relevantes de los mecanismos patogénicos provocados por los DE (Arukwe y Gokoyr, 2003).
En estudios de ecotoxicidad tanto en peces como en otros organismos es importante utilizar biomarcadores que permitan constatar el potencial tóxico o disruptor. Por lo tanto, en peces y otros vertebrados ovíparos con frecuencia se utiliza como biomarcador la inducción de Vtg (Aranzazu et al., 2009; Aranzazu et al., 2011) y de la proteína de la zona radiada (Zrp) (Fossi et al., 2002).
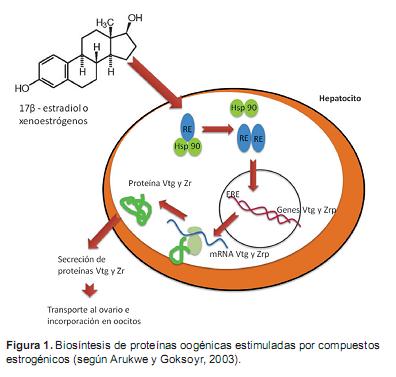
La vitelogenina y zona radiada como biomarcadores de toxicidad
En peces los principales componentes del huevo, como la yema (Vtg) y las proteínas de la cáscara del huevo como la (Zrp), son sintetizados en el hígado de hembras bajo regulación endocrina y trasportados a la sangre para la toma posterior por el oocito (Figura 1). Tanto machos y hembras tienen receptores hepáticos para estrógenos, pero solo los hígados de peces hembras están expuestos normalmente a los estrógenos. Por lo tanto, la producción de estas proteínas en peces macho o peces inmaduros proporciona un indicador útil para detectar la presencia de DE con actividad estrogénica (Arukwe et al., 1997, Arukwe et al., 2003).
La característica útil de la inducción de Vtg como biomarcador es su especificidad para los estrógenos, la sensibilidad y la magnitud de la respuesta posible de tal manera que la concentración de Vtg puede incrementarse hasta un millón de veces en plasma (Davis et al., 2009; Kashiwada et al., 2002; Tyler y Sumpter, 1990). Las pruebas para Vtg se han desarrollado para un amplio rango de especies de peces y en el momento se encuentran disponibles en el mercado algunas de estas (Fossi et al., 2002; Inui et al., 2003; Solé et al., 2002; Arukwe et al., 1999).
La medición del mARN de Vtg también se ha utilizado recientemente y su evaluación ha demostrado ser igualmente efectiva a la obtenida con la medición de la proteína Vtg (Gelbke et al., 2004; Inui et al., 2003; Larkin et al., 2003). La longitud parcial o total de cADNs en longitud parcial o total de la Vtg se han clonado en 20 especies diferentes de peces, convirtiéndose en una herramienta diagnóstica potencial. El transcripto de mARN de Vtg es inducido rápidamente pocas horas después de la exposición a estrógenos, lo cual constituye la RT–PCR como una herramienta de valor potencial para utilizarse como prueba de valoración de la expresión de Vtg en períodos muy cortos (Thomas et al., 2003).
El establecimiento de las relaciones entre la inducción de Vtg y los efectos adversos en la salud en los peces son limitadas. Algunos autores plantean que los niveles muy altos de síntesis de Vtg en peces adultos pueden inducir falla renal y causar alteraciones en la dinámica sanguínea (Scholz y Gutzeit, 2000). El impacto de la inducción de bajos niveles de Vtg, no está bien definido; sin embargo, hay planteamientos teóricos con relación a que la síntesis de Vtg en forma precoz, ocasionada por la exposición a estrógenos, podría reducir la capacidad de supervivencia de peces que se encuentran en estadios de la vida donde la provisión de energía es muy crítica (Lânge y Hutchinson, 2001).
Estudios de campo en ciprínidos en ríos del Reino Unido han demostrado un incremento en el contenido plasmático de Vtg en peces que presentan intersexo (Jobling et al., 1998) y que existe una correlación, no necesariamente de naturaleza causal, entre los niveles elevados de Vtg y la presencia de gónadas con intersexo (Arukwe y Gokoyr, 2003).
La aplicación de la Vtg como biomarcador para la exposición a estrógenos y los efectos potenciales de estos para la salud son complicados de determinar debido a que algunas especies de peces tienen isoformas de la Vtg (Desantis et al., 2005; Diniz et al., 2005; Hutchinson et al., 2006; Solé et al., 2002). En el pez zebra (Brachydanio rerio) se han identificado nueve mARN para la Vtg (Örn et al., 2003) y en los Medakas se han identificado dos subtipos de Vtg –1 y 2– (Inui et al, 2003). De esta manera pueden encontrarse diferentes sensibilidades para la detección de la Vtg según la característica del xenobiótico comprometido (Hiramatsu et al., 2005).
En trabajos realizados con salmones juveniles del Atlántico y utilizando diferentes dosis de 4–nonilfenol (NP), se observó que el tratamiento elevó significativamente los niveles plasmáticos de Zrp y de Vtg durante las dos semanas del estudio in vivo, mostrando la Zrp un incremento mayor en respuesta a xenoestrógenos (Arukwe et al., 1997). También se encontró un mayor aumento de la Zrp cuando se comparó con Vtg utilizando una técnica de ELISA en salmones juveniles del Atlántico tratados con E2 (Celius y Walther, 1998). En ambos estudios, los niveles de inducción de Zrp fueron más altos a menor dosis del DE, mientras que la Vtg se indujo a altas dosis del DE. Sin embargo, podría pensarse que las diferencias en la sensibilidad de la técnica ELISA para la detección de Zrp y Vtg puede deberse a diferencias en las afinidades de los anticuerpos usados en las pruebas para ligarse a éstas proteínas, asunto que los investigadores tratan de resolver mediante el desarrollo de pruebas cuantitativas para los dos grupos de proteínas y sus mARNs (Hiramatsu et al., 2005).
Estudios in vivo realizados en tilapias (Oreochromis mossambicus) (Davis et al., 2009), han demostrado la inducción de Vtg en machos utilizando dietas comerciales para truchas; esto sugiere la presencia de compuestos estrogénicos en esas dietas y la consecuente inducción de Vtg. De igual manera la Vtg se ha utilizado como indicador de contaminación en tilapias macho en la República Africana de Benin (Okoumassoun et al., 2002); en ese trabajo se encontraron cantidades significativas de Vtg en tejido hepático lo que se relacionó con los niveles de pesticidas organoclorados en tejidos.
Clorpirifos y su impacto en los ecosistemas acuáticos
Entre los productos químicos más utilizados y considerados como disruptores endocrinos en mamíferos, peces e insectos, están los pesticidas organofosforados. Los organofosforados inhiben la enzima acetilcolinesterasa al producir su fosforilación, lo cual causa acumulación del neurotransmisor acetilcolina en las sinapsis mediadas por éste, con la consecuente aparición de un cuadro colinérgico (Córdoba, 2008).
El mayor uso de estos compuestos está asociado a la actividad agrícola, principalmente en los países del tercer mundo, ya que son capaces de combatir plagas que otros insecticidas no han logrado, lo anterior hace predecir su permanencia prolongada en el mercado mundial. Estos plaguicidas son poco persistentes, lo que implica que sea necesario aplicarlos con mayor frecuencia para lograr una acción eficiente (Córdoba, 2008).
El clorpirifos es un insecticida organofosforado de amplio espectro que se utiliza desde 1970 en agricultura, clínica veterinaria y a nivel doméstico; además es utilizado para controlar la aparición de mosquitos en lagos y estanques (Giesy et al., 1999). La sensibilidad de las diversas especies acuáticas frente al clorpirifos es muy variable, probablemente debido a diferencias en el comportamiento, los hábitos alimenticios, la sensibilidad de los receptores y la farmacocinética (Giesy et al., 1999). El clorpirifos es absorbido, metabolizado y eliminado por los peces y otros organismos acuáticos, con tiempos de eliminación medios comprendidos entre 0.5 a 5 días (Montañes et al., 1995).
En Colombia, en el año 1999 fueron vendidos alrededor de unos 2.100.000 litros y 1.6 toneladas de clorpirifos, cifras similares a las comercializadas hasta el año 2007; siendo éste el organofosforado de mayor uso porcentual respecto al total de ventas de este grupo de insecticidas en este país (ICA, 2001).
La acción erosiva sobre el suelo, tanto de origen pluvial como atribuible a la irrigación, es potencialmente responsable del transporte de clorpirifos aplicado en áreas agrícolas hacia las aguas superficiales. Sin embargo, no se conoce hasta el momento datos sobre niveles de clorpirifos en aguas para Colombia.
Son pocos los trabajos realizados para determinar la toxicidad del clorpirifos y sus metabolitos en el medio acuático. Sin embargo, algunos trabajos de diferentes países e institutos han confirmado que es altamente tóxico para los peces y para los invertebrados acuáticos (De Silva y Samayawardhena, 2005).
Estudios experimentales de toxicidad aguda realizados en estadios tempranos del guppy (Poecilia reticulata) revelaron que aún a bajas concentraciones de clorpirifos hubo toxicidad en los peces juveniles, con una concentración letal 50 (CL50) de 7.17 μg/L a las 96 h a 26 °C. Las concentraciones bajas de este xenobiótico fueron responsables de algunos cambios en el comportamiento de nado; de igual manera se encontraron malformaciones en la aleta caudal en todos los grupos tratados, incrementándose estas malformaciones a mayor tiempo de exposición. También fueron frecuentes hemorragias en las aletas, en el opérculo, así como un considerable número de alteraciones en las branquias, a saber: acortamiento y fusión de lamelas e incremento en la vacuolización del tejido branquial, entre otras (De Silva y Samayawardhena, 2002).
Por otro lado, se han determinado alteraciones en el rendimiento reproductivo de guppy utilizando de igual manera dosis bajas de clorpirifos entre (0.002 μg/L–2 μg/L). Con estas concentraciones se encontraron efectos en el comportamiento de apareamiento, disminución en la descendencia y tasas bajas de supervivencia (De Silva y Samayawardhena, 2005).
En otro trabajo realizado en el guppy, con dosis de 1.47 a 2.10 mg/L, se presentaron cambios en el comportamiento como una forma de neurotoxicidad; los peces se observaron menos activos que el grupo control, presentando pérdida del equilibrio, nado errático, y permanencia en el nivel medio de la columna de agua por periodos prolongados de tiempo (Mahmut et al., 2005).
Por último, trabajos realizados con clorpirifos en larvas de tilapia (Oreochromis niloticus) demostraron su efecto tóxico; los peces tuvieron cambios en el comportamiento a concentraciones muy bajas (1.3, 1.5 y 1.7 μg/L). Las larvas nadaban alrededor de su eje, con movimientos lentos y no respondían a estímulos externos; adicionalmente se observó la pérdida del equilibrio en los peces (Gul, 2005).
Son escasos los reportes en peces de lesiones asociadas al clorpirifos en ecosistemas acuáticos. Concretamente para el caso de la tilapia, los trabajos se orientan al efecto de inhibición de la enzima acetilcolinesterasa y las manifestaciones clínicas asociadas. Si bien hay algunos reportes que puntualizan lesiones en branquias, hígado y cerebro en Oreochromis niloticus con períodos de una semana de exposición a concentraciones subletales entre el 30 y el 90% de la CL50 (Rajeswary y Ramudu, 2005), en la actualidad no hay evidencia publicada de los efectos sobre la salud de esta especie a concentraciones subletales inferiores a las antes descritas por períodos más prolongados de exposición, así como durante su etapa de madurez. Lo anterior es importante debido a que las concentraciones de clorpirifos verificadas en algunos ecosistemas acuáticos tanto norteamericanos como europeos, alcanzan aproximadamente entre el 4 y el 10% de la CL50.
Conclusiones
Aunque es evidente que en las últimas dos décadas se generó mucha información sobre los DE, también es cierto que resultan necesarias más investigaciones que permitan responder a las múltiples inquietudes que todavía se plantean por la comunidad científica. Se conoce un número creciente de una amplia variedad de químicos y sus productos de degradación; sin embargo, en Colombia son muy escasos los estudios que evalúan el compromiso de los ecosistemas acuáticos con sustancias químicas que puedan determinar efectos de disrupción endocrina en las poblaciones de peces.
De esta manera, es importante realizar estudios sistemáticos con biomarcadores que permitan determinar el riesgo potencial de exposición de las poblaciones de peces más vulnerables a estos efectos, y de igual manera su estimación como factor de riesgo para la población humana.
Un caso concreto de aplicación de lo anterior en la investigación toxicológica en Colombia sería, la determinación de las concentraciones de clorpirifos en ecosistemas acuáticos y la valoración de su impacto. Por lo tanto, es relevante conocer en los sistemas de producción agropecuaria colombianos y en las diferentes cuencas hidrográficas, los efectos de la utilización de xenobióticos como el clorpirifos que contaminan los recursos hídricos por desagüe, sobre la salud de los peces y su posible efecto DE. Para este cumplir este propósito será importante la implementación de técnicas que utilicen biomarcadores histopatológicos e inmunohistoquímicos como son la Vtg y proteínas de la zona radiada. Estos biomarcadores proporcionaran evidencia del impacto de tales xenobióticos en las especies piscícolas, lo cual es de gran importancia para comprender la dimensión de este problema en el país y a nivel mundial, con miras a establecer bases para la biorremediación ecológica.
Agradecimientos
Las actividades del Grupo de Investigación en Patobiología, Quirón, son posibles gracias a los aportes de la Convocatoria CODI de Menor Cuantía, Universidad de Antioquia 2008. Proyecto 20092027.
Referencias
1. Aranzazu D, Vieco B, Balvín DI, Duque BA, Restrepo LF, Rodríguez B. Evaluación inmunocitoquímica de peces nativos colombianos candidatos para centinelas en estudios de ecotoxicidad. Rev Colomb Cienc Pecu 2011; 24:530–531. [ Links ]
2. Aranzazu D, Rodríguez B, Arboleda L, Restrepo LF, Vieco B. Efecto del 0,0 dietil 0–(3, 5, 6–tricloro–2–piridil fosforotioato) en machos adultos de tilapia (Oreochromis spp). Rev Colomb Cienc Pecu 2009; 22:556–557. [ Links ]
3. Arukwe A, Gokoyr A. Eggshell and egg yolk proteins in fish: hepatic proteins for the next generation: oogenetic, population, and evolutionary implications of endocrine disruption. Comp Hepatol 2003; 4:1–21. [ Links ]
4. Arukwe A, Nilsen BM, Berg K. Immunohistochemical analysis of the vitellogenin response in the liver of Atlantic salmon exposed to environmental estrogens. Biomarkers 1999; 4:373– 380. [ Links ]
5. Arukwe A, Knudsen FR, Goksoyr A. Fish zone radiate (eggshell) protein: A sensitive biomarker for environmental estrogens. Environ Health Perspect 1997; 105:418–422. [ Links ]
6. Breithaupt H. A cause without a disease. EMBO reports 2004; 5:16–18. [ Links ]
7. Bridges JW, Bridges O. Integrated risk assessment and endocrine disrupters. Toxicology 2004; 205:11–15. [ Links ]
8. Celius T, Walther BT. Oogenesis in Atlantic salmon (Salmo salar L.) occurs by zonagenesis preceding vitellogenesis in vivo and in vitro. J Endocrinol 1998; 158:259–266. [ Links ]
9. Córdoba D. Toxicología. 5a. Edicion. México: Manual Moderno; 2008. [ Links ]
10. Davis LK, Bradley K. Fox, Chhorn Lim, Naoshi Hiramatsu, Craig V. Sullivan, Tetsuya Hirano, E. Gordon Grau. Induction of vitellogenin production in male tilapia (Oreochromis mossambicus) by commercial fish diets. Comp Biochem Physiol 2009; 154:249–254. [ Links ]
11. Desantis S, Corriero A , Cirillo F. Immunohistochemical localization of CYP1A, vitellogenin and zone radiate proteins in the liver of swordfish (Xiphias gladius L) taken from the Mediterranean Sea, South Atlantic, South Western Indian and Central North Pacific Oceans. Aquat Toxicol 2005; 17:1–12. [ Links ]
12. De Silva PMCS, Samayawardhena. Effects of clorpirifos on reproductive performances of guppy (Poecilia reticulata). Chemosphere 2005; 58:1293–1299. [ Links ]
13. De Silva PMCS, Samayawardhena. Low concentrations of Lorsban in water result in far reaching behavioral and histological effects in early life stages in guppy. Ecotoxicol Environ Saf 2002; 53:248–254. [ Links ]
14. Diniz MS, Peres I, Pihan JC. Comparative study of the estrogens responses of mirror carp (Cyprinus carpio) exposed to treated municipal sewage effluent (Lisbon) during two periods in different seasons. Sci Total Environ 2005; 349:129–139. [ Links ]
15. Escudero M. Sensibilidad Química Múltiple, Enfermedad Ambiental Emergente. Rev enferm CyL 2010; 2:26–40. [ Links ]
16. Fossi MC , Casini S, Marsili L, Neri G, Mori G, Ancora S, Moscatelli A, Ausili A, Notarbartolo–di–Sciara G. Biomarkers for endocrine disruptors in three species of mediterranean large pelagic fish. Mar Environ Res 2002; 54:667–671. [ Links ]
17. Gallo SM, Palacio JA, Gutiérrez PD. Efectos del insecticida Clorpirifos sobre la tasa de crecimiento y la metamorfosis de Smilisca phaeota (Cope, 1862) (Anura: hylidae). Actual Biol 2006; 28: 51–58. [ Links ]
18. Gelbke HP, Kayser M, Poole A. OECD test strategies and methods for endocrine disruptors. Toxicology 2004; 205:17–25. [ Links ]
19. Giesy, JP, Solomon KR, Coats JR, Dixon KR, Giddings JM, Kenaga EE. Chlorpyrifos: Ecological Risk Assessment in North American Aquatic Environments. Rev Environ Contam Toxicol 1999; 160:1–129. [ Links ]
20. Gul A. Investigation of acute toxicity of clorpirifos–metyl on Nile tilapia (Oreochromis niloticus L.) larvae. Chemosphere 2005; 59:163–166. [ Links ]
21. Harrison PT. Endocrine disrupters and human health. BMJ 2001; 223:1317–1318. [ Links ]
22. Hashimoto S, Kurihara R, Strûssmann CA. Gonadal histology and serum vitellogenin of bigeye tuna Thunnus obesus from Northern Pacific Ocean–absence of endocrine disruption bioindicators. Mar Pollut Bull 2003; 46:459–465. [ Links ]
23. Hiramatsu N , Cheek AO, Sullivan CV, Matsubara T, Hara A. Vitellogenesis and endocrine disruption. Biochem Mol Biol 2005; 6:431–471. [ Links ]
24. Hutchinson TH, Ankley GT, Segner H, Tyler C. Screening and testing for endocrine disruption in fish–biomarkers as ''signpost'', not ''traffic lights'', in risk assessment. Environ Health Perspect 2006; 114:106–114. [ Links ]
25. Hyndman KM, Biales A, Bartell SE, Schoenfuss HL. Assessing the effects of exposure timing on biomarker expression using 17beta–estradiol. Aquat Toxicol 2010; 96:264–272. [ Links ]
26. Inui MA, Takenaka S, Nakasawa M, Ueda M, Watanabe H, Mori C, Iguchi T, Miyatake K. Effects of UV screens and preservatives on Vtg and choriogenina production in male medaka. Toxicology 2003; 194:43–50. [ Links ]
27. Jobling S, Nolan M, Tyler CR. Widespread sexual disruption in wild fish. Environ Sci Technol 1998; 32:2498–2506. [ Links ]
28. Jobling S, Sheahan D, Osborne JA, Matthiessen P, Sumpter JP. Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals. Environ Toxicol Chem 1996; 15:194–202. [ Links ]
29. Kashiwada S, Ishikawa H, Miyamoto N, Ohnishi Y, Magara Y. Fish test for endocrine–disruption and estimation of water quality of Japanese rivers. Water Res 2002; 36:2161–2166. [ Links ]
30. Korner W. Input/output balance of estrogenic active compounds in a major municipal sewage plant in Germany. Chemosphere 2000; 40:1131–1142. [ Links ]
31. Lânge R, Hutchinson TH. Effects of the synthetic estrogen 17 ά– ethinylestradiol on the life cycle of the fathead minnow (Pimephales promelas). Environ Toxicol Chem 2001; 20:1216– 1227. [ Links ]
32. LaPensee EW, LaPensee CR, Fox S, Schwemberger S, Afton S, Ben–Jonathan N. Bisphenol A and estradiol are equipotent in antagonizing cisplatin–induced cytotoxicity in breast cancer cells. Cancer Lett 2010; 28:167–173. [ Links ]
33. Larkin P, Knoebl I, Denslow ND. Differential gene expression analysis in fish exposed to endocrine disrupting compounds. Comp Biochem Physiol B Biochem Mol Biol 2003; 136:149– 161. [ Links ]
34. Larsson DGJ, Adolffsson EM. Ethinylestradiol–an undesired fish contraceptive? Aquat Toxicol 2002; 45:91–97. [ Links ]
35. Liang IF, Chamow SM, Dean J. Oocyte–specific expression of mouse ZP–2– developmental regulation of the zone–pellucid genes. Mol Cell Biol 1990; 10:1507–1515. [ Links ]
36. Mahmut S, Sarikaya R, Erkoc F, Kocak O. Investigation of acute toxicity of clorpirifos–metyl on guppy Poecilia reticulata. Chemosphere 2005; 60:93–96. [ Links ]
37. Manolakou P, Lavranos G, Angelopoulou R. Molecular patterns of sex determination in the animal kingdom: a comparative study of the biology of reproduction. Reprod Biol Endocrinol 2006; 4:1–23. [ Links ]
38. Mastandrea C, Chichizola C, Ludueña B, Sánchez H, Álvarez H, Gutiérrez Andrea. Hidrocarburos aromáticos policíclicos. Riesgos para la salud y marcadores biológicos. Acta bioquím clín latinoam 2005; 39:27–36. [ Links ]
39. Matthiessen P, Gibbs PE. Critical appraisal of the evidence for Tributylin–mediated endocrine disruption in mollusks. Environ Toxicol Chem 1998; 1:37–43. [ Links ]
40. McAllister BG, Kime DE. Early life exposure to environmental levels of the aromatasa inhibitor Tributylin causes masculinisation and irreversible sperm damage in Zebrafish (Danio rerio). Aquat Toxicol 2003; 65:309–316. [ Links ]
41. Méndez AS, Méndez F, Aguirre G, Serrano H. Disrupción endocrina de la diferenciación sexual. ContactoS 2008; 70:43– 49. [ Links ]
42. Mills LJ, Chichester C. Review of evidence: Are endocrinedisrupting chemicals in the aquatic environment impacting fish populations?. Sci Total Environ 2005; 343:1–34. [ Links ]
43. Ministerio de Agricultura y Desarrollo Rural. Instituto Colombiano Agropecuario, División de Insumos Agrícolas. Comercialización de plaguicidas 1999. Bogotá. 2001. 108p. [ Links ]
44. Montañes, JF, Van Hattum B, Deneer J. Bioconcentration of Chlorpyrifos by the freshwater isop Asellus aquaticus (L.) in outdoor experimental ditches. Environ Pollut 1995; 88:137–146. [ Links ]
45. Nilsen BM, Berg K, Eidem JK, Kristiansen SI, Brion F, Porcher JM, Goksøyr A. Development of quantitative vitellogenin ELISAs for fish test species used in endocrine disruptors screening. Anal Bioanal Chem 2004; 378:621–633. [ Links ]
46. Okoumassoun LE, Brochu C, Deblois C, Akponan S, Marion M, Averill–Bates D, Denizeau F. Vitellogenin in tilapia male fishes exposed to organochlorine pesticides in Ouémé River in Republic of Benin. Sci Total Environ 2002; 299:163–172. [ Links ]
47. Olea N, Fernández MF, Araque P, Olea F. Perspectivas en disrupción endocrina. Gac Sanit 2002; 16:650–656. [ Links ]
48. Ôrn S, Holbech H, Madsen TH, Norrgren L, Petersen GI. Gonad development and vitellogenin production in Zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterona. Aquat Toxicol 2003; 65:397–411. [ Links ]
49. Rajeswary S, Ramudu K. Studies on toxicological effects of Chlorpyrifos in the brain of freashwater fish, Oreochromis mossambicus (Peters) under subletal exposure. Environmental crisis and Security in the new millennium. 2005, 241 - 248. [ Links ]
50. Scholz S, Gutzeit HO. 17 ά–ethinylestradiol affects reproduction, sexual differenciation, and aromatasa gen expression of the medaka (Oryzias latipes). Aquat Toxicol 2000; 50:363–373. [ Links ]
51. Solé M, Barcelo D, Porte C. Seasonal variation of plamatic and hepatic vitellogenin and EROD activity in carp, Cyprinus carpio, in relation to sewage treatment plants. Acuat Toxicol 2002; 60:233–248. [ Links ]
52. Ssebugere P, Kiremire BT, Kishimba M, Wandiga SO, Nyanzi SA, Wasswa J. DDT and metabolites in fish from Lake Edward, Uganda. Chemosphere 2009; 76:212–215. [ Links ]
53. Storelli MM, Losada S, Marcotrigiano GO, Roosens L, Barone G, Neels H, Covaci A. Polychlorinated biphenyl and organochlorine pesticide contamination signatures in deep–sea fish from the Mediterranean Sea. Environ Res 2009; 109:851– 856. [ Links ]
54. Suares P, Bernecker C, Strecker R, Fiorillo C, Martins ML, Storch V, Hollert H, Braunbeck T. Sediment–contact fish embryo toxicity assay with Danio rerio to assess particlebound pollutants in the Tiete River Basin (Sao Paulo, Brazil). Ecotoxicol Environ Saf 2011; 74:1951–1959. [ Links ]
55. Thomas JE, Thorpe K, Harrison N, Thomas G. Dynamics of estrogen biomarker responses in rainbow trout exposed to 17 β–estradiol and 17 α–ethinylestradiol. Environ Toxicol Chem 2003; 22:3001–3008. [ Links ]
56. Tyler CR, Sumpter JP. The dynamics of oocyte growth during vitellogenesis in the rainbow trout Salmo gairdneri. Biol Reprod 1990; 43:202–209. [ Links ]
57. Van der Oost R, Beyer J, Vermeulen NPE. Fish bioaccumulation and biomarkers in environmental risk assessment: a review. Environ Toxicol Pharmacol 2003; 13:57–149. [ Links ]
58. Van der Ven LTM, Holbech H, Fenske M. Vitellogenin expresión in zebra fish Danio rerio: evaluation by histochemistry, immunohistochemestry, and in situ mARN hybridization. Aquat Toxicol 2003; 65:1–11. [ Links ]
59. Vega A, Martínez L, Domínguez ML, García E, Ramón E, García A. Vitellogenin induction in the endangered goodeid fish Girardinichthys viviparus: vitellogenin characterization and estrogenic effects of polychlorinated biphenyls. Comp Biochem Physiol C Toxicol Pharmacol 2006; 142:356–364. [ Links ]
60. Waring RH, Harris RM. Endocrine disrupters: A human risk?. Mol Cell Endocrinol 2005; 244:2–9. [ Links ]
61. Wei X, Huang Y, Wong MH, Giesy JP y Wong CK. Assessment of risk to humans of bisphenol A in marine and freshwater fish from Pearl River Delta, China. Chemosphere 2011; 85:122–128. [ Links ]
62. Wester PW, Canton JH, Dormans JAMA. Pathological effects in freshwater fish Poecilia reticulata (guppy) and Oryzias latipes (medaka) following methyl bromide and sodium bromide exposure. Aquat Toxicol 1988; 12:323–343. [ Links ]
63. White R, Jobling S, Hoare SA, Sumpter JP, Parker MG. Environmentally persistent alkylphenolic compounds are estrogenic. Endocrinology 1994; 135:175–182. [ Links ]
Notas
¤ Para citar este artículo: Aranzazu DA, Rodríguez B de J, Duque BA. Disrupción endocrina en peces. Rev Colomb Cienc Pecu 2012; 25:312–323.