Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.25 no.3 Medellín July/Sept. 2012
ARTÍCULOS ORIGINALES
Production of ''Chame'' (Dormitator latifrons, Pisces: Eleotridae) larvae using GnRHa and LHRHa¤
Producción de larvas de Chame (Dormitator latifrons, Pisces: Eleotridae) usando GnRHa and LHRHa
Produção de larvas de Chame (Dormitator latifrons, Pisces: Eleotridae) usando GnRHa e LHRHa
Gustavo A Rodríguez-Montes de Oca1*, PhD; Eva A Medina-Hernández1, BA; Jeniffer Velázquez-Sandoval1, Biol; Vanesa V López-López1, BA; José Cristóbal Román-Reyes1, PhD; Konrad Dabrowski2, PhD, Maria C Haws3, PhD.
* Autor para correspondencia: Gustavo A Rodríguez-Montes de Oca. Facultad de Ciencias del Mar, Universidad Autónoma de Sinaloa, Mazatlán, México. E-mail: grodriguez@uas.edu.mx
1Facultad de Ciencias del Mar, Universidad Autónoma de Sinaloa, Mazatlán, México.
2School of Environment and Natural Resources, Ohio State University, Columbus OH.
3Pacific Aquaculture and Coastal Resources Center, University of Hawaii at Hilo, Hilo, Hawaii, USA.
(Recibido:29 junio, 2011 ; aceptado: 3 octubre, 2011)
Summary
The Pacific fat sleeper is a potential species for aquaculture in Latin American countries. Nevertheless, production depends on wildcaught juveniles, thus needing hatchery produced larvae. Objective: the purpose of this study was to determine the ideal conditions for viable gamete release and larvae laboratory production. Methods: a total of 16 mature male and 16 female fish were allocated to one of four groups (n=4) that were injected with either saline solution, Desgly10-Ala6 LHRHa, salmon GnRHa + domperidone, or implanted with salmon GnRHa. Results: spermiation was observed in all treatments. Spawning rates were 100% at 24 and 48 h for the GnRHa implanted group, 25% for the LHRHa group, and 0% for the salmon GnRHa + domperidone group (48-72 h post injection). Conclusion: GnRHa and LHRHa are a succesful tool for chame induced reproduction. A gross morphological description of oocytes, sperm quality, and first stages of larval development is included.
Key words: chame fish, gamete release, pacific fat sleeper, spawning, spermiation.
Resumen
El chame es una especie con potencial para la acuicultura en Latinoamérica. Sin embargo, su producción depende de la utilización de individuos juveniles capturados en el medio silvestre, siendo necesaria la reproducción en cautiverio. Objetivo: determinar las condiciones ideales para la obtención de gametos viables y larvas en laboratorio. Métodos: un total de 16 machos y 16 hembras adultos se asignaron a cuatro grupos (n=4) y fueron inyectados con solución salina, Desgly10-Ala6 LHRHa, GnRHa de salmón+domperidone, o con implantes de GnRHa de salmón. Resultados: se logró exitosamente la liberación de esperma para todos los tratamientos. La inducción al desove fue del 100% a las 24 y 48 h para el grupo implantado con GnRHa, 25% para el grupo con LHRHa, y 0% para el grupo GnRHa de salmón+domperidone (48-72 h post-inyección). Conclusiones: el uso de GnRHa y LHRHa es una herramienta útil en la reproducción inducida del chame. Se incluye una descripción morfológica de los oocitos, calidad de esperma y primeros estadio del desarrollo larvario. Se discuten también las condiciones óptimas de salinidad para la fertilización e incubación de huevos fertilizados.
Palabras clave: chame, desove, espermiación, liberación de gametos.
Resumo
O chame é uma espécie com potencial para a aquicultura na América Latina. Porém, toda a produção depende da captura de juvenis selvagens. Objetivo: determinar as condições ideais para a obtenção de gametas viáveis e larvas no laboratório. Métodos: um total de 16 machos e 16 fêmeas adultos foram divididos em quatro grupos (n=4) e foram tratados com injeção de Desgly10Ala6, LHRHa, GnRHa de Salmon+domperidone ou implante de GnRHa de salmão. Resultados: foi possível induzir exitosamente a liberação de esperma com todos os tratamentos. A indução de desove foi do 100% às 24 e 48 h para o grupo implantado com GnRHa, 25% para o tratamento com LHRHa e 0% para o grupo injetado com GnRHa de Salmon+domperidone (48-72 h após-injeção). Conclusões: o uso de GnRHa e LHRHa é uma ferramenta útil na reprodução induzida do chame. Neste trabalho está incluída a descrição dos oócitos, qualidade do esperma e dos estágios iniciais de desenvolvimento larval. Também são abordados os valores ótimos de salinidade, tanto para a fertilização como para a incubação dos ovos fertilizados.
Palavras chave: chame, desova, espermiação, liberação de gametas.
Introducción
El Chame (Dormitator latifrons) también denominado fat sleeper, puyeque, popoyote o chalaco, en un pez cuya distribución natural va desde California, Estados Unidos de Norte América, hasta las costas de Perú, es cultivado a mediana escala en Ecuador y existe interés en México y Nicaragua para desarrollar su producción por acuicultura. Como antecedente relevante, en Ecuador la producción total en cultivo esta reportada en el orden de 2000 toneladas hasta 1993, decayendo hasta 50 toneladas en 1997 con un leve repunte en años recientes hasta cerca de 800-1000 toneladas por año (FAO, 2011). En México se reporta una captura anual por pesquerías del orden de 450 toneladas por año (CONAPESCA, 2009), con algunos intentos de cultivo en México (Castro- Rivera et al., 2005). Sin embargo, los juveniles que son sembrados en los estanques de cultivo en Ecuador son capturados del medio natural en un 100% (EcoCostas, 2006) dando como resultado una dependencia total de organismos silvestres para cultivo. Existe un reporte de un ensayo enfocado a lograr la reproducción y producción de crías en cautiverio de la especie (Bonifaz et al., 1985) al igual que varios reportes sin publicar, siendo poca la información al respecto, además de otros trabajos en el mismo tema de especies similares Dormitator maculatus (Gaudé et al., 2010). Este trabajo de investigación se enfocó en los siguientes aspectos: establecer en una etapa preliminar la viabilidad del uso análogos sintéticos de hormonas liberadoras de gonadotropinas (GnRHa y LHRHa) como inductores al desove con diversas vías de administración de una forma similar a otros peces (Duncan et al., 2003), liberación espermática (Rodriguez M de O, 2001) y determinar las condiciones de salinidad óptimas para la activación espermática, incluyendo una descripción de las larvas producidas.
Materiales y métodos
Peces reproductores con una talla mínima de 10 cm de longitud y 100 g de peso individual fueron colectados en un radio de 100 km de Mazatlán, Sinaloa México, durante los meses de junio a agosto de 2009-2010, para luego ser transportados a las instalaciones de la Facultad de Ciencias del Mar de la Universidad Autónoma de Sinaloa (23°12'57'' N; 106°25'31'' O).
Los organismos fueron alimentados con una combinación de 60/40% de alimento extruido para tilapia con 32-8 y 25-6% proteína/lípidos ad libitum dos veces por día (9:00 am y 4:00 pm). Una vez identificados los organismos de ambos sexos y que presentaron signos evidentes de maduración sexual tales como cambio de color en la papila genital y abdomen, crecimiento significativo de la cabeza en machos, al igual que un abultamiento abdominal significativo en hembras (Bonifaz et al., 1985), fueron sedados utilizando una solución de 0.7 ml/L de 2-fenoxi-etanol diluido en agua dulce por 2-3 minutos. Posteriormente, se procedió a identificarlos individualmente utilizando marcas de radio frecuencia (PIT-Tags, Passive Integrated Transponder tags), para ser monitoreados individualmente.
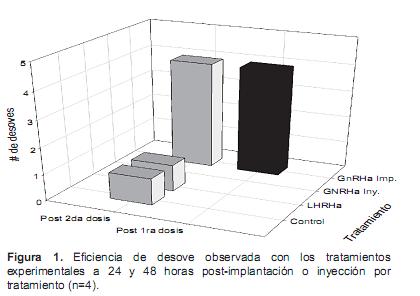
Para fines experimentales, se seleccionaron un total de 16 hembras y 16 machos, los cuales fueron divididos en los siguientes grupos (cuatro peces por tratamiento por sexo): para las hembras dos inyecciones de 0.5 ml/kg de solución salina como grupo Control, una inyección inicial de 40 µg/kg y una dosis final de 80 µg/kg de la hormona Desgly10- Ala6 LHRHa, dos inyecciones consecutivas a 0.5 ml/kg de GnRHa de salmón+domperidone (inhibidor de dopamina) en 48 horas o un solo implante de 75 µg de GnRHa de salmón. Cabe señalar que no fue posible colectar muestras de ovocitos por canulación previo a los tratamientos hormonales, dado el reducido tamaño del poro genital. Las variables evaluadas fueron: número de desoves a 24 y 48 h de la aplicación de cada uno de los tratamientos, número de ovocitos por gramo de desove (fecundidad relativa) y diámetro de los ovocitos obtenidos (Rodriguez, 2001).
Para los machos, los cuales fueron seleccionados al presentar liberación de esperma después una ligera presión abdominal; se seleccionó un grupo de 16 ejemplares, con cuatro peces por tratamiento, donde los grupos experimentales fueron los siguientes: una sola inyección de 0.5 ml/kg de solución salina como grupo Control, una inyección de 40 µg/kg de LHRHa, una aplicación de 0.5 ml/kg de GnRHa de salmón+domperidone o un implante de 75 µg por pez. Las muestras de esperma fueron colectadas en viales de plástico de 1.5 ml, evitando la contaminación de las muestras con orina; para posterior evaluación de la calidad del esperma en cuanto a porcentaje de motilidad (% de células con desplazamiento rectilíneo), tiempo de activación y concentración espermática por espécimen dentro de cada tratamiento experimental (Rodriguez, 2001).
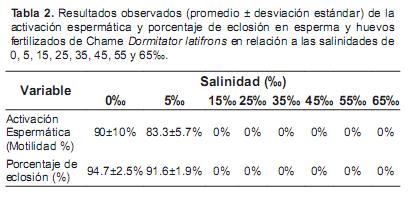
Una vez obtenidos los gametos se procedió a establecer el intervalo óptimo de salinidades para la activación espermática e incubación de huevos de la siguiente forma: muestras de esperma (100 µl) fueron pre-diluidas en solución de Ringer (NaCl 0.85 g; KCl 0.04 g; CaCl2.H2O 0.034 g en 100 ml de agua destilada) en diluciones de 1:10 a 1:40; dado que la alta viscosidad del semen impedía una activación directa con agua filtrada a 10 µm y esterilizada con luz UV; posteriormente las muestras de esperma prediluidas en solución de Ringer fueron activadas a salinidades de 0, 5, 15, 25, 35, 45, 55 y 65‰ utilizando 100 µl de la muestra prediluida en Ringer y 900 µl de agua a cada salinidad (igualmente filtrada a 10 µm y esterilizada con luz UV) por triplicado. La estimación de porcentaje de motilidad y tiempo de activación se realizó con observaciones a 400X en un microscopio óptico y los conteos espermáticos con una cámara Neubauer a una dilución de 1:300-1:500. Posteriormente, una vez que se obtuvieron los desoves se utilizaron las mismas salinidades mencionadas arriba para incubar huevos fertilizados en agua dulce (0‰) a una densidad de 1000 a 1500 huevos en envases de plástico transparente con 1 L de agua a cada salinidad, con aireación constante, con tres replicas por salinidad, estableciendo supervivencia (%) por cada una de las salinidades. Se determinaron algunas características morfológicas de las larvas obtenidas post-eclosión durante los siguientes 5-6 días post eclosión utilizando análisis digital de imágenes obtenidas con un cámara para ocular de 5 MP, en un microscopio estereoscópico a magnificaciones de 7 a 40X con un software de análisis digital de imágenes.
Los datos obtenidos de la inducción de desove y efecto de la salinidad son descriptivos; los datos de calidad de esperma fueron analizados con pruebas estadísticas de análisis de varianza de 1 vía para tiempo de actividad y concentración espermática (datos paramétricos) y los datos de porcentaje de motilidad (datos no paramétricos) fueron sometidos a una prueba de Kruskal-Wallis, todos a un valor de significancia de α=0.05, utilizando el programa estadístico MINITAB versión 16.1.0.
Resultados
En este estudio, se observaron desoves en un 100% de las hembras (n=4) post-implantación de GnRHa de salmón (75 µg) tanto a 24 como a 48 h después del tratamiento hormonal. El resto de los tratamientos experimentales, a 24 horas de la segunda dosis, sólo una hembra en el grupo de LHRHa liberó ovocitos, al igual que una hembra del grupo control, sin observar ningún desove en el grupo inyectado con GnRHa de salmón + domperidome (Figura 1).
De los resultados obtenidos se establece que las características de los ovocitos son las siguientes: el diámetro promedio de la célula es de alrededor de 300 µm, y que la fecundidad relativa está en el orden de 50.000 a 80.000 células por gramo de desove (Tabla 1).
En relación a la inducción hormonal en machos, se observó una respuesta positiva en cuanto a la liberación de esperma en los cuatro grupos experimentales, sin que se observaran cambios significativos (p>0.05) en las variables evaluadas, tales como porcentaje de motilidad, duración de la activación y concentración espermática (Tabla 1). Las únicas variables que presentaron algunos cambios observables fueron la de número de machos liberando esperma y el volumen del mismo (Tabla 1), dado que en los tratamientos de implante y GnRHa de salmón+domperidone se observó una alta presencia de fluido seminal transparente mezclado con el esperma colectado. En general se establece que el tiempo de motilidad de los espermatoziodes está en el valor de los 4 minutos y la concentración espermática en el intervalo de 1 a 2X109 células por mililitro, con o sin inducción hormonal (Tabla 1).
En cuanto a la evaluación del esperma se refiere, los mejores resultados fueron observados al prediluir el esperma a una tasa 1:10 en solución de Ringer, para continuar con la activación y evaluación de las variables antes mencionadas. En cuanto a la salinidad, tanto de activación como de incubación, fue posible establecer que no hay activación espermática ni fertilización a salinidades por arriba de 5 ‰; así como no se observó eclosión por arriba de 15‰ (Tabla 2).
El desarrollo temprano de las larvas de Chame D. latifrons puede ser descrito de la siguiente forma: los huevos son demersales y presentan una capa adherente. Son de forma esférica y son transparentes. Presentan un diámetro promedio de 300 µm (Figura 2a). Después de 17 horas de incubación a una temperatura de 26 °C eclosionan larvas con una longitud promedio 1288.2 ± 137.2 µm. El saco vitelino tiene un diámetro promedio de 171.2 ± 10.6 µm y se observa una gota de aceite. Las larvas recién eclosionadas no presentan ojos ni boca y no nadan activamente (Figura 2b). Las larvas a 1 día post-eclosión (dpe) presentan un saco vitelino con un diámetro promedio de 137.1 ± 8.3 µm. Se hacen visibles los ojos, sin embargo no están pigmentados y se empieza a observar el tracto digestivo (Figura 2c).
La abertura de la boca se da a 2 dpe, cuando los ojos ya están pigmentados y se pueden observar algunas estructuras internas como el tracto digestivo. En este periodo el saco vitelino disminuye significativamente hasta un diámetro promedio de 93.8±10.7 µm (Figura 2d). El saco vitelino desaparece al 3 dpe, cuando la larva presenta movimientos bucales, el tracto digestivo inicia el proceso de circunvolución y presenta pigmentación (Figura 2e). El ano se abre al 4 dpe, cuando son visibles algunas estructuras internas de las larvas y éstas presentan una mayor pigmentación.
Discusión
El uso de hormonas exógenas para la inducción al desove es una técnica confiable para la reproducción de muchas especies de peces en condiciones de laboratorio. En nuestras observaciones, el uso de análogos sintéticos de factores liberadores de gonadotropinas (LHRHa y GNRHa) aplicados por inyección o implantación, permitieron la liberación de gametos viables tanto en machos y hembras de Chame, tal como lo descrito en machos de botete diana Sphoeroides annulatus (Rodríguez, 2001) y en hembras (Duncan et al., 2003), varios salmónidos (Zohar y Mylonas, 2001), barramundi Lates calcarifer (García, 1989) y lobina de mar rayada Dicentrarchus labrax (Fornies et al., 2001), por mencionar algunos. Los implantes presentan una serie de ventajas tales como una liberación lenta y prolongada de las hormonas contenidas en el mismo, dado que se libera cerca del 50% dentro de las primeras 2-3 horas y el resto por un periodo de 8-10 horas (Crim et al., 1988) factor evidentemente favorable para la reproducción inducida del Chame.
El producto utilizado que contiene GnRHa de salmón+domperidone (inhibidor de la dopamina) es igualmente una herramienta útil para la reproducción inducida en un gran número de peces tales como bagres (Sahoo et al., 2007) y peces ornamentales (Yanong et al., 2009), considerando que las dosis utilizadas en otros peces están en el orden de 0.3-0.7 ml/kg para inducir desoves en el pez cabeza de serpiente Channa punctatus y el bagre Heteropneustes fossilis (Kather-Haniffa y Sridhar, 2002). Sin embargo, sólo se observó un efecto en los machos de Chame al incrementar la cantidad de semen liberado pero sin ayudar al desove en hembras de la especie, siendo nuestros resultados similares a lo descrito por Harris et al., (2011) donde de igual forma no se observaron desoves en Gobiomorus dormitor un pez de la misma familia taxonómica que el Chame (Eleotridae).
Las gonadotropinas purificadas como la HCG, no fueron consideradas inicialmente para este estudio debido a una serie de comunicaciones personales y reportes no publicados de investigadores de Ecuador donde mencionan el uso de dosis muy altas, hasta 10.000 UI por pez de esta hormona, cuando por lo general las dosis requeridas son menores, tal como está reportado para la cabrilla Mycteroperca rosasea, donde es posible utilizar dosis de sólo 1000 UI (Gracia López et al, 2004) aunado a posibles problemas de inmunoreactividad en los peces que reduce o elimina la efectividad del tratamiento (Patiño, 1997). Por lo que consideramos que el uso de LHRHa o GnRHa por inyección o implante es el tratamiento más adecuado para asegurar la reproducción en cautiverio del Chame.
Es común observar una mínima liberación de esperma en peces en cautiverio, lo cual no es aparente en machos de Chame recién colectados del medio natural; aun así el uso de LHRHa o GnRHa por inyección o implante, incrementa significativamente la cantidad de semen colectado manteniendo sus características de calidad tales como porcentaje de activación, tiempo de motilidad y concentración espermática, tal como ha sido descrito para varias especies de peces (Zohay y Mylonas, 2001), en particular a la dosis de 40 µg/kg, tal como ha sido descrito para aplicaciones repetidas en machos del botete diana S. annulatus, manteniendo una liberación constante de esperma por hasta tres meses en inyecciones mensuales de cantidades similares del mismo análogo sintético de LHRHa (Rodríguez, 2001). El principal punto a destacar es que la viabilidad del uso de estas hormonas en machos de la especie es información no descrita anteriormente y que además elimina la necesidad de utilizar testículos macerados para llevar a cabo la fertilización artificial en Chame y otros peces de esta familia taxonómica, tal como lo descrito por Harris et al., (2011) donde se utilizó este procedimiento para fertilizar los ovocitos obtenidos en Gobiomorus dormitor.
La pre-dilución de esperma en solución de Ringer es una de las técnicas más utilizadas para trabajar con este tipo de fluido, en particular para criopreservación (Hara et al., 1982) además de ser altamente efectivo para favorecer la activación y capacidad de fertilización en Chame, tal como se observó en este estudio. Originalmente se había considerado establecer el valor de espermatocrito en las muestras obtenidas, esto no fue posible dada la alta viscosidad del semen, razón por la cual se consideró la predilución del esperma.
La biología del Chame es muy interesante, considerando que la salinidad del agua juega un papel relevante en su reproducción. Nuestros resultados indican que hay una baja tolerancia a la salinidad para la activación espermática (0-5 ‰) y por ende la fertilización y a pesar de la relación de estos factores con la eclosión de los huevos, esta puede ocurrir a valores de salinidad más altos pero por debajo de 15 ‰ de salinidad. Inicialmente la salinidad no fue considerada como un factor relevante ya que existen reportes que describen la presencia de larvas de Chame tanto en ambientes salobres (Navarro-Rodríguez et al., 2006) y marinos (Franco-Gordo et al., 2002), por lo que se puede establecer que la reproducción del Chame ocurre principalmente en agua dulce. Esta descrito con cierta frecuencia este tipo de comportamiento reproductivo en peces que son encontrados en ambientes estuarinos, donde la fertilización es más eficiente a bajas salinidades, pero la eclosión no es afectada por un gradiente o cambio de salinidad en el agua, tal es el caso del fúndolo Fundulus heteroclitus donde se presenta una mayor fertilización en valores por debajo de 15 ‰ y mejor porcentaje de eclosión a 10-30 ‰ de salinidad (Bush y Weis, 1983). De igual manera, peces de ambientes predominantemente marinos requieren de bajas salinidades para su reproducción y desarrollo ontogénico temprano, dado que el pez globo Takifugu obscures presenta una mayor tasa de eclosión en salinidades de 0-8‰ (Yang y Cheng, 2006) por lo que lo observado en Chame es un fenómeno similar a lo descrito para otras especies.
Asimismo, la salinidad de incubación puede reducir significativamente la viabilidad de las larvas e incrementar la presencia de deformaciones en las mismas como se ha descrito en la anguila Anguilla japonica (Okamoto et al., 2009), al igual que posibles diferencias en las tallas de eclosión y tamaño del saco vitelino dado lo descrito en el pargo Pagrus auratus (Fielder et al., 2005) y el jurel Caranx mate (Santerre, 1973) donde en ambos estudios se observaron menores tallas de eclosión y diferencias en la utilización del saco vitelino. Para este estudio las larvas obtenidas después de una incubación en agua a 0-5‰ presentan una talla mayor a la descrita por Todd (1975) de sólo 0.8 a 0.9 mm para la misma especie y siendo los valores más cercanos a lo descrito por Gaudé et al., (2010) en el orden de 1.13 ± 0.01 mm para Dormitator maculatus; aunque cabe mencionar que ambos estudios fueron llevados a cabo a temperaturas de 13 (Todd, 1975) a 23 °C (Gaudé et al., 2010), mientras que los resultados presentados en este trabajo fueron obtenidos con larvas mantenidas a 26 ± 2 °C. Por lo que consideramos importante establecer los valores óptimos de salinidad para la incubación de huevos fertilizados de Chame.
En conclusión, los resultados obtenidos en el presente trabajo permiten determinar de forma preliminar la viabilidad del uso de análogos sintéticos de hormonas liberadoras de gonadotropinas como agentes de inducción a la liberación de gametos viables en Chame; además de establecer las condiciones de fertilización e incubación adecuadas para la obtención de larvas de este pez. Como alcances futuros, se seguirá desarrollando investigación relacionada con el inicio de la alimentación exógena para lograr la supervivencia de este pez en condiciones de cultivo.
Agradecimientos
Este proyecto fue financiado en parte por The AquaFish CRSP bajo USAIDCA/LWA No. EPP-A-00-06-00012-00 y por las instituciones participantes en EUA y países sedes, tales como el proyecto DGIP-UAS PROFAPI 2009/117 de la Universidad Autónoma de Sinaloa, México otorgado al primer autor. El número de archivo AquaFish CRSP es el 1378. Las opiniones aquí expresadas por los autores, no reflejan necesariamente los puntos de vista de AquaFish CRSP o de USAID.
Referencias
1. Bonifaz N, Campos M, Castelo R. El Chame, una nueva fuente de alimentación e ingresos. Fundación Ciencia. Ecuador; 1985. [ Links ]
2. Bush CP, Weis JS. Effect of salinity on fertilization success in two populations of Fundulus heteroclitus. Biol Bull 1983; 164:406-417. [ Links ]
3. Castro-Rivera R, Aguilar-Benítez G, Hernández-Girón JP. Conversión alimenticia en engordas puras y mixtas de Popoyote (Dormitator latifrons Richardson) en estanques de cemento. Rev AquaTIC 2005; 23:45-52. [ Links ]
4. CONAPESCA. Anuario Estadístico de Pesca, Comisión Nacional de Pesca y Acuicultura, México, 2009. [ Links ]
5. Crim LW, Sherwood NM, Wilson CE.Sustained hormone release. II. Effectiveness of LHRH analog (LHRHa) administration by either single time injection or cholesterol pellet implantation on plasma gonadotropin levels in a bioassay model fish, the juvenile rainbow trout. Aquaculture 1988; 74:87-95. [ Links ]
6. Duncan NJ, Rodríguez-M de O GA, Alok D., Zohar Y. Effects of controlled delivery and acute injections of LHRHa on bulleye puffer fish (Sphoeroides annulatus) spawning. Aquaculture 2003; 218: 625-635. [ Links ]
7. EcoCostas. El Cultivo de Chame (Dormitator latifrons) en el Estuario del Río Cojimíes. Proyecto para la Conservación y Desarrollo del Estuario de Cojimíes (Sustainable Coastal Communities and Ecosystem Project -SUCCESS) 2006. [ Links ]
8. FAO Fisheries Department. Fishery Inform, Data and Statistics Unit. FishStat Plus. Universal Software for Fishery Statistical Time series. Version 2.3.2000. 2009. [ Links ]
9. Fornies MA, Mananos E, Carrillo M, Rocha A, Laureau S, Mylonas CC, Zohar Y, Zanuy S. Spawning induction of individual European sea bass females (Dicentrarchus labrax) using different GnRHa delivery systems. Aquaculture 2001; 202:221-234. [ Links ]
10. Franco-Gordo C, Godinez-Domínguez E, Suárez-Morales E. Larval fish assemblages in water off the central Pacific coast of Mexico. J Plankton Res 2002; 24: 775-784. [ Links ]
11. García LMB. Dose dependent spawning response of mature female sea bass Lates calcarufer (Bloch), to pelleted luteinizing hormone-releasing hormone analogue (LHRHa). Aquaculture 1989; 77:85-96. [ Links ]
12. Gaudé A, Brown C, Green C. Awakening the sleeper: bringing Dormitator maculatus into full market potential as a premier marine bait for Louisiana. Book of Abstracts Aquaculture, World Aquaculture Society, EUA, 2010. [ Links ]
13. Gracia-López V, Rodríguez-Romero J, Pérez-Ramírez J. Inducción del desove con HCG y desarrollo embrionario y de larvas de la cabrilla sardinera Mycteroperca rosasea (Streets, 1877). Ciencias Marinas 2004; 30:279-284. [ Links ]
14. Hara S, Canto Jr T, Almendras ME. A comparative study of various extenders for milkfish, Chanos chanos (Forsskal), sperm preservation. Aquaculture 1982; 60:311-321. [ Links ]
15. Harris N, Wesley-Neal J, Perschbacher PW, Mace CE, Muñoz- Hincapíe M. Notes on hatchery spawning methods for bigmouth sleeper Gobiomorus dormitor. Aquaculture Research. 2011; 42:1145-1152. [ Links ]
16. Kather-Haniffa MA, Sridhar S. Induced spawning of spotted murrel (Channa punctatus) and catfish (Heteropneustes fossilis) using human chorionic gonadotropin and synthetic hormone (ovaprim). Veterinarski Arch 2002; 2:51-56. [ Links ]
17. Navarro-Rodríguez MC, González-Guevara LF, Flores-Vargas R, González-Ruelas ME, Carrillo-González FM. Composición y variabilidad del ictioplancton de la laguna El Quelele, Nayarit, México . Rev de Biol Marina Ocean 2006; 41:35–43. [ Links ]
18. Okamoto T, Kurokawa T, Gen K, Murashita K, Nomura K, Kim SH, Matsubara H, Ohta H, Tanaka H (Influence of salinity on morphological deformities in cultured larvae of Japanese eel, Anguilla japonica, at completion of yolk resorption. Aquaculture 2009; 293:113-118. [ Links ]
19. Patino R, Manipulations of the reproductive system of fishes by means of exogenous chemicals. The Progressive Fish-Culturist 1997; 59:18-128. [ Links ]
20. Rodríguez M de O, GA. Evaluación de la calidad del esperma del botete Diana Sphoeroides annulatus (Jenyns, 1834) en condiciones de cautiverio y bajo inducción hormonal con LHRHa. Tesis de Maestría. CIAD, A.C. Mazatlán Sin, 2001. [ Links ]
21. Sahoo SK, Giri SS, Chandra S, Sahu AK Effect of Ovaprim doses and latency periods on induced spawning of Clarias batrachus: observation on larval deformity. Indian J Exp Biol 2007; 45:920-922. [ Links ]
22. Santerre MT. Effects of temperature and salinity on the eggs and early larvae of Caranx mate (Cuv. & Valenc.) (Pisces: carangidae). Hawaii J Exp Marine Biol Ecol 1976; 21:51-68. [ Links ]
23. Steward-Fielder D, Bardsley-William J, Geoff A, Patricia M. The effects of salinity and temperature on growth and survival of Australian snapper, Pagrus auratus larvae. Aquaculture 2005; 250:201-214. [ Links ]
24. Todd ES. Vertical movement and development of the prolarvae of the eleotrid fish, Dormitator latifrons. Copeia 1975; 3:564- 568. [ Links ]
25. Yang Z, Chen Y. Salinity tolerance of embryos of obscure puffer Takifugu obscures. Aquaculture 2006; 253:393-397. [ Links ]
26. Yanong RPE, Martínez C, Watson CA. Use of Ovarpim in Ornamental Fish Aquaculture. University of Florida IFAS Extension. FA161, 2009. [ Links ]
27. Zohar Y, Mylonas C. Endocrine manipulations of spawning in culture fish: from hormones to genes. Aquaculture 2001; 197:99-136. [ Links ]
Notas
¤ Para citar este artículo: Rodríguez-Montes de Oca GA, Medina-Hernández EA, Velázquez-Sandoval J, López-López VV, Román-Reyes JC, Dabrowski K, Haws MC. Producción de larvas de Chame (Dormitator latifrons, Pisces: Eleotridae) usando GnRHa and LHRHa. Rev Colomb Cienc Pecu 2012; 25:422-429.