Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.25 no.3 Medellín July/Sept. 2012
ARTÍCULOS ORIGINALES
Effect of culture medium on growth and protein content of Chlorella vulgaris¤
Efecto del medio de cultivo sobre el crecimiento y el contenido proteico de Chlorella vulgaris
Efeito do diferentes meios de cultura sobre o crescimento e o conteúdo proteico em Chlorella vulgaris
Marcela Muñoz-Peñuela1, Biol Mar; Juan A Ramírez-Merlano1, Prof Acuic, MSc; Angélica M Otero- Paternina1, Prof Acuic, MSc; Víctor M Medina-Robles1, MVZ, MSc; Pablo E Cruz-Casallas1, MVZ, MSc, PhD; Yohana M Velasco-Santamaría1*, MV, MSc, PhD.
* Autor para correspondencia: Yohana M Velasco-Santamaría. e-mail: ymvelascos@unillanos.edu.co; ymvelasco@yahoo.com
1Grupo de Investigación sobre Reproducción y Toxicología de Organismos Acuáticos - GRITOX, Instituto de Acuicultura, Facultad de Ciencias Agropecuarias y Recursos Naturales Universidad de los Llanos, Km 12 vía Puerto López, Villavicencio, Colombia.
(Recibido: 11 mayo, 2011; aceptado: 30 septiembre, 2011)
Summary
The use of live food in larviculture and fingerling stages has become an excellent option in pisciculture to reduce mortality and production costs. Live food is cost-effective, nutritious, and it has enzymes necessary for fish development. Objective: this study evaluated the effect of several culture media (chu10 , NPK complex fertilizer, worm humus, and equine manure) on growth and protein content of Chlorella vulgaris. Methods: 3 L volumes with constant light and aeration were used for algae culture. Six replicates were used per each treatment. One mL of C. vulgaris was added to each experimental unit to obtain 8.3 x 106 cel/mL as initial density. Algae counts were conducted every two days using the Neubauer chamber to determine cell density, parameters such as temperature, dissolved oxygen, pH, nitrates, and phosphates were measured. Crude protein was determined with the Kjeldahl method. The assay lasted 82 days. Results: microalgae reached the highest density with complex fertilizer NPK (10.9 ± 1.6 x 106 cel/mL) on day 22, followed by worm humus (5.3 ± 1.1 x 106 cel/mL) on day 48, equine manure (4.9 ± 0.9 x 106 cel/mL) on day 18, and the last was chu10 (2.2 ± 0.6 x 106 cel/mL) on day 12. The highest protein content was found in algae grown in worm humus (56.8%), and the equine manure (32.5%), in contrast, complex fertilizer NPK had the lowest value (16.8%). Conclusion: this study showed that organic media are a good choice for the culture of C. vulgaris, providing proper growth and high protein content of microalgae.
Key words: live food, microalgae, nutrients, nutritional value, worm humus.
Resumen
En piscicultura, el uso de alimento vivo durante las fases de larvicultura y alevinaje se ha convertido en una opción para reducir la tasa de mortalidad y los costos de producción, debido a que es económico, nutritivo y posee enzimas necesarias para el desarrollo de las larvas de peces. Objetivo: el presente trabajo evaluó el efecto de diferentes medios de cultivo (chu10, fertilizante complejo NPK, humus de lombriz y equinaza) sobre el crecimiento y el contenido proteico en Chlorella vulgaris. Métodos: para su cultivo se utilizaron volúmenes de 3 L, con luz y aireación constante. De cada tratamiento se realizaron seis réplicas y en cada unidad experimental se adicionó 1 mL de C. vulgaris con una densidad de 8.3 x 106 cel/mL. Para determinar la densidad celular se realizaron conteos cada dos días haciendo uso de cámara de Neubauer. Se midió temperatura, oxígeno disuelto, pH, nitratos y fosfatos. La proteína cruda se determinó por el método de Kjeldahl. La duración total del ensayo fue de 82 días. Resultados: la microalga alcanzó su mayor densidad con fertilizante complejo NPK (10.9 ± 1.6 x 106 cel/mL) en el día 22, seguido del humus de lombriz (5.3 x 106 ± 1.1 x 106 cel/mL) en el día 48, equinaza (4.9 ± 0.9 x 106 cel/mL) en el día 18, y por último con el chu10 (2.2 ± 0.6 x 106 cel/mL) en el día 12. Se encontró mayor contenido proteico en las células cultivadas en humus de lombriz (56.8%) y equinaza (32.5%); a diferencia, el del fertilizante complejo NPK fue muy bajo (16.8%). Conclusiones: este estudio permite concluir que los medios orgánicos son una buena opción para cultivar C. vulgaris, otorgando un adecuado crecimiento y un alto contenido proteico de la microalga.
Palabras clave: alimento vivo, humus de lombriz, microalga, nutrientes, valor nutricional.
Resumo
Na piscicultura, o uso de alimento vivo durante as fases da cultura de larvas e juvenis têm sido convertidos em uma opção para reduzir a taxa de mortalidade e os custos de produção, porque é econômico, nutritivo e possui as enzimas necessárias para o desenvolvimento das larvas de peixe. Objetivo: o objetivo desta pesquisa foi avaliar a efeito de diferentes meios de cultura (chu10, fertilizante mineral complexo NPK, vermicomposto e esterco equino) sobre o crescimento e o conteúdo proteico em Chlorella vulgaris. Métodos: para a cultura, foram utilizados volumes de 3 L, com luz e aeração permanente. De cada tratamento, realizaram-se seis repetições e em cada unidade experimental, adicionou-se 1 mL de C. vulgaris com uma densidade de 8.3 x 106 cel/mL. Para determinar a densidade celular, realizaram-se contagens a cada dois dias usando a câmara de Neubauer. Aferiu-se a temperatura, oxigênio dissolvido, pH, nitratos e fosfatos. A proteína bruta foi determinada por o método de Kjeldahl. A duração total do ensaio foi de 82 dias. Resultados: os resultados mostraram que a microalga alcançou sua maior densidade com o fertilizante complexo NPK (10.9 ± 1.6 x 106 cel/mL) no dia 22, seguido do vermicomposto (5.3 ± 1.1 x 106 cel/mL) no dia 48, o esterco equino (4.9 ± 0.9 x 106 cel/mL) no dia 18 e por último com o chu10 (2.2 ± 0.6 x 106 cel/mL) no dia 12. Foi encontrado maior conteúdo proteico nas células cultivadas em vermicomposto (56.8%) e esterco equino (32.5%); a diferença, do fertilizante complexo NPK que foi muito baixo (16.8%). Conclusões: este estudo permitiu concluir que os meios orgânicos são uma boa opção para cultivar C. vulgaris, obtendo um crescimento adequado e um alto conteúdo proteico da microalga.
Palavras chave: alimento vivo, húmus de minhoca, microalga, nutrientes, valor nutricional, vermicomposto.
Introducción
En piscicultura, uno de los factores limitantes para la producción de peces es el suministro de alimento que supla las necesidades nutricionales de la especie cultivada, sobre todo durante las fases de larvicultura y alevinaje (Torrentera-Blanco y Tacon, 1989); por este motivo, en las últimas décadas los piscicultores han optado por el uso del alimento vivo para el levante de larvas y alevinos, en virtud de su alto contenido de proteína, carbohidratos y ácidos grasos insaturados; así mismo, porque el plancton posee enzimas que son necesarias para el desarrollo y crecimiento de las larvas (Sipaúba- Tavares y Rocha, 2003; Velasco-Santamaría y Corredor-Santamaría, 2011).
Las especies del género Chlorella tienen gran importancia a nivel económico y comercial debido a la facilidad en su cultivo (Yamamoto et al., 2004) y su alto valor nutricional (Moronta et al., 2006). Además, estas microalgas tienen amplios rangos de tolerancia a niveles de pH, salinidad, temperatura y luminosidad (Graeff, 2003; Mora et al., 2004; Rodrigues y Belli-Filho, 2004).
Estudios previos han demostrado que con el uso de fertilizantes agrícolas se obtiene un mayor crecimiento, una similar composición proximal y un menor costo que con aquellos medios que son específicos para el cultivo de microalgas como el f/2 (Valenzuela-Espinoza et al., 2005). Por ejemplo, Morris-Quevedo et al. (1999), reportaron altos valores de proteína (44.6%) en C. vulgaris cultivada con Triple 15. Por otro lado, otros estudios han usado medios orgánicos a base de estiércoles, los cuales son más económicos y generan densidades celulares altas (Granados-Machuca y Buckle- Ramírez, 1984; Faria et al., 2001)
La importancia de seleccionar el medio de cultivo para producir determinada especie de microalga radica en que el uso de un sustrato adecuado puede optimizar el valor nutricional de estos (Nieves-Soto et al., 1994). Por este motivo, el objeto del presente estudio fue evaluar diferentes medios de cultivo (chu10, fertilizante complejo NPK, humus de lombriz y equinaza) sobre el crecimiento y el contenido proteico de Chlorella vulgaris, con el fin de obtener microalga de buena calidad para ser usada como alimento vivo en la producción de zooplancton, y su posterior uso como fuente de alimento en el levante de larvas y alevinos de peces, principalmente silúridos, en los cuales existe un gran interés de introducirlos a los sistemas de producción nacional y así contribuir a la diversificación de la oferta de especies nativas del país.
Materiales y métodos
Área de estudio
La investigación se llevó a cabo en el Laboratorio de Alimento Vivo del Instituto de Acuicultura de la Universidad de los Llanos, localizado a 12 km de la ciudad de Villavicencio, capital del departamento del Meta, Colombia. El clima lo caracteriza una altura de 418 msnm, 25 ºC de temperatura ambiental, 4050 mm de precipitación pluvial promedio anual y 75% de humedad relativa.
Ensayo preliminar
Debido a que la literatura no reporta concentraciones para humus de lombriz y equinaza, inicialmente se llevó a cabo un estudio preliminar para determinar las concentraciones más adecuadas de estos dos medios orgánicos de cultivo.
Para este fin se utilizaron frascos de vidrio con un volumen útil de 500 mL. Se evaluaron en total nueve concentraciones (tratamientos), seis de equinaza (0.5, 1.0, 1.5, 12.2, 13.2 y 14.2 mL/L) y tres de humus de lombriz (6.1, 6.6 y 7.1 mL/L). Para cada tratamiento se hicieron tres réplicas y a cada una de ellas se le adicionó 1 mL de C. vulgaris a una densidad de 1.9 x 106 cel/mL. El stock del cual se tomó la microalga fue de un monocultivo que se encontraba aislado en medio Guillard F/2 mantenido en el laboratorio de alimento vivo de la estación piscícola de la Universidad de los Llanos.
Los tratamientos se ubicaron aleatoriamente en estantes metálicos con luz (lámparas de neón Phillips®, 72 Watts, Amsterdam, Holanda) y aireación constante suministrada por medio de un blower (Sweetwater S-41, Florida, USA). Este ensayo tuvo una duración de 18 días, durante los cuales se llevaron a cabo recuentos de células cada tres días. La densidad algal se determinó haciendo uso de la cámara de Neubauer (Boeco® Bright line, Hamburgo, Alemania) bajo un microscopio óptico (Nikon® Eclipse E200, Tokyo, Japón), siguiendo la metodología reportada por Sipaúba-Tavares y Rocha (2003).
Evaluación de los medios de cultivo
Para evaluar el efecto de cuatro medios de cultivo sobre las diferentes fases de crecimiento de C. vulgaris, se realizaron cultivos estáticos utilizando volúmenes de 3 L, con luz y aireación constantes, manteniendo las mismas condiciones del ensayo preliminar. De cada tratamiento se hicieron seis réplicas, ubicadas aleatoriamente en estantes metálicos. A lo largo de este periodo fueron suprimidas aquellas réplicas en las que la densidad celular se encontró por debajo de la densidad inicial de cultivo, tomando este momento como el final de su fase de crecimiento. Cuando se presentó este evento y solo una réplica se mantuvo viable en su respectivo tratamiento, este fue eliminado y el experimento continuó hasta que el último tratamiento quedase con una sola réplica siendo la duración total del ensayo de 82 días.
Los cuatro medios de cultivo que se emplearon para evaluar el crecimiento de C. vulgaris fueron: medio chu10 (1.0 mL/L de agua destilada), fertilizante complejo NPK (Abocol®, Cartagena, Colombia) (1.0 g/L de agua destilada), humus de lombriz líquido (San Rafael, Fusagasugá, Colombia) (6.6 mL/L de agua destilada) y equinaza (14.2 mL/L de agua destilada). Para preparar este último medio, se tomó una cantidad de estiércol seco de caballo de pastoreo y se tamizó para eliminar la presencia de bagazo de plantas forrajeras. Luego se pesaron 200 g con una balanza analítica (Ohaus® precisión 0.1 mg, Parsippany, USA) y se añadieron a 20 L de agua corriente en un acuario de 50 L. Esta mezcla se dejó en reposo durante 6 días para el ensayo preliminar y 53 días para el ensayo final, y posteriormente se filtró con la ayuda de un tamiz para separar el material sólido. El agua de equinaza resultante fue esterilizada en autoclave (Tuttnauer® 2540 MK, NY, USA) durante 45 min a una temperatura de 121 °C.
En cada unidad experimental se adicionó 1 mL de C. vulgaris con una densidad inicial de 8.3 x 106 cel/mL. Para determinar la densidad celular se realizaron conteos cada dos días haciendo uso de la cámara de Neubauer (Boeco® Brightline, Hamburgo, Alemania) bajo un microscopio óptico (Nikon® Eclipse E200, Tokyo, Japón). De igual forma, cada cuatro días se determinaron parámetros físicos y químicos de los cultivos como temperatura (°C), oxígeno disuelto (mg/L) y pH, determinado por medio de una sonda multiparamétrica (YSI professional plus, Yellow Springs, USA), mientras que nitratos (mg/L) y fosfatos (mg/L) fueron determinados usando un kit colorimétrico (Aquamerck®, Darmstadt, Alemania).
Análisis del contenido proteico
La materia prima para el análisis del contenido proteico se obtuvo sembrando la microalga en los diferentes medios de cultivo en tanques cilíndricos de 50 L, utilizando las mismas diluciones evaluadas en el ensayo anterior. Al alcanzar la máxima densidad algal en cada medio de cultivo, se pasó por una red de fitoplancton con un ojo de malla de 25 µm para obtener la mayor cantidad posible de C. vulgaris. La microalga colectada fue ubicada en beakers y conservada bajo refrigeración (4 °C), donde se dejó sedimentar durante un día con el fin de eliminar el exceso de agua y obtener una mayor concentración de algas, las cuales fueron almacenadas posteriormente a -20 °C hasta la determinación de proteína.
El porcentaje de proteína cruda se obtuvo por el método de Kjeldahl siguiendo la metodología descrita por Vásquez-Torres (2004). Este análisis fue realizado en el laboratorio de Nutrición Animal de la Universidad Nacional de Colombia, sede Bogotá.
Análisis estadístico
Para la asignación de los tratamientos se empleó un diseño completamente al azar. Los resultados fueron procesados por medio de estadística descriptiva y mostrados como media ± SEM. Para comprobar la homogeneidad de la varianza los datos fueron sometidos a una prueba de Bartlett y a un test de normalidad (prueba de Kolmogorov- Smirnov) para comprobar su distribución. Debido a la anormalidad tanto de los datos originales como los transformados, se realizó la prueba de Kruskal- Wallis con el fin de determinar diferencias entre los tratamientos, seguido de la prueba de Dunn cuando se encontraron diferencias significativas. Cuando fue necesario comparar sólo dos tratamientos se llevó a cabo una prueba U de Mann-Whitney. Para los análisis anteriores, se tomaron siete periodos de cultivo cada diez días a partir del día 2. Lo anterior se llevó a cabo haciendo uso del programa GraphPad InStat® versión 4.03, con un nivel de significancia de p<0.05. Adicionalmente se halló para cada curva de crecimiento, una línea de tendencia polinómica, que fue la que mejor se ajustó a los datos, con su respectiva ecuación y coeficiente de variación.
Resultados
Ensayo preliminar
En los tratamientos del ensayo preliminar, sólo se observaron diferencias significativas en el día 9 mostrando un mayor crecimiento en el medio con equinaza en las diluciones más altas (p>0.05) (Tabla 1). La densidad de algas con el humus de lombriz no presentó diferencias estadísticas entre las diluciones, sin embargo la dilución de 6.6 mL/L fue la que presentó un mayor valor (Tabla 1). En todo el ensayo, la máxima densidad celular con la equinaza se alcanzó con una dilución de 14.2 mL/L en el día 12 (4.3 ± 0.3 x 106 cel/mL), y en el humus de lombriz con 6.6 mL/L en el día 15 (5.0 ± 0.9 x 106 cel/mL). En consecuencia, en el ensayo final se trabajó con las diluciones mencionadas anteriormente.
Ensayo con cuatro medios de cultivo diferentes
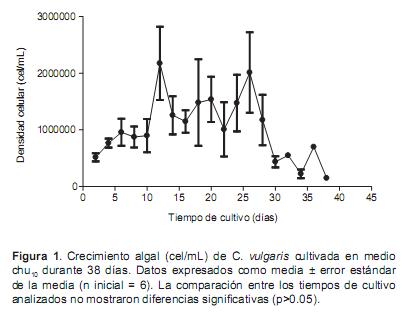
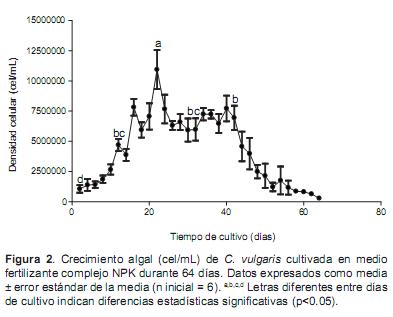
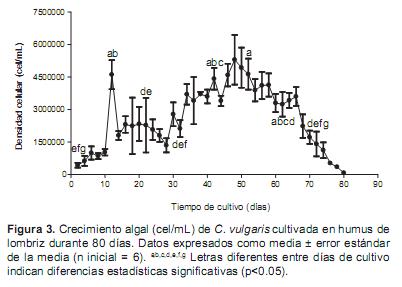
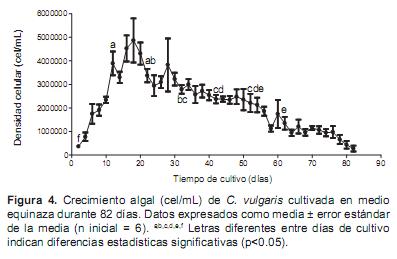
Los resultados del ensayo final de 82 días de duración mostraron que el cultivo en el medio chu10 fue el primero en declinar (38 días), seguido del fertilizante complejo NPK (64 días), humus de lombriz (80 días) y finalmente la equinaza (82 días). La mayor densidad celular se observó con el fertilizante complejo NPK (10.9 ± 1.6 x 106 cel/mL) y la menor con el chu10 (2.2 ± 0.6 x 106 cel/mL). Por su parte, las densidades máximas con el humus de lombriz y la equinaza fueron 5.3 ± 1.1 x 106 y 4.9 ± 0.9 x 106 cel/mL, respectivamente.
En el medio chu10 no se encontraron diferencias significativas entre los días de muestreo (p>0.05) (Figura 1), indicando que no hubo crecimiento de la microalga en este medio. Las mayores densidades se observaron en el día 12 (2.2 ± 0.6 x 106 cel/mL) y en el día 26 (2.0 ± 0.7 x 106 cel/mL).
Con el fertilizante complejo NPK se observaron diferencias significativas (p<0.05) en las densidades celulares entre los diferentes días de muestreo (Figura 2), indicando crecimiento de la microalga en este medio. El mayor crecimiento se observó a los 22 días (p<0.05).
Del mismo modo, en el cultivo con humus de lombriz se observaron diferencias significativas en las densidades celulares entre los diferentes días de muestreo (p<0.05) (Figura 3), siendo el mayor crecimiento observado a los 48 días.
En el tratamiento con equinaza se observó un rápido crecimiento y se encontraron diferencias significativas entre los diferentes días de cultivo (p<0.05) (Figura 4).
En la figura 5 se puede observar la coloración de los diferentes medios de cultivo de C. vulgaris a los 36 días. En el medio Chu10 no se observaron cambios en la coloración de los cultivos (5A), mientras que con el fertilizante complejo NPK los cultivos mostraron una coloración verde oscuro, y a partir del día 24 se formó una capa de espuma blanca en la superficie en todas las réplicas de este tratamiento (5B). Con el humus de lombriz fue dificil observar cambios en la coloración debido a la coloración natural oscura del humus de lombriz; sin embargo, a partir del día 24 se empezó a distinguir una coloración café verdoso (5C). Con respecto a la equinaza, los cultivos con este medio fueron los primeros en mostrar cambios en la coloración; sin embargo, esta nunca llegó a ser verde oscura, ni en los días donde se obtuvo la mayor densidad (5D).
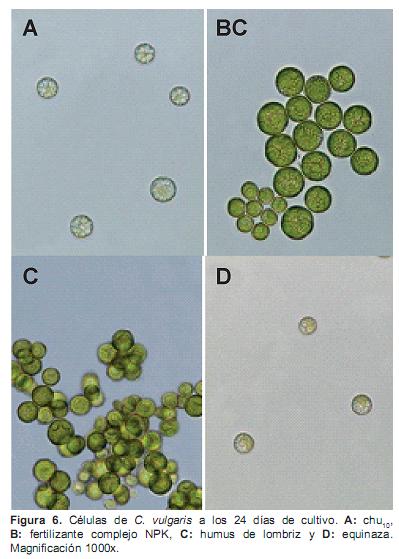
En la figura 6 se muestran las celulas de C. vulgaris mantenida en los diferentes medios de cultivo. Las células cultivadas en Chu10 se encontraron siempre solitarias y su coloración fue muy pálida, encontrándose zonas de la célula incoloras (6A), mientras que con el fertilizante complejo NPK (6B) y el humus de lombriz (6C), se encontraron en su mayoría aglomeradas con una coloración verde intensa homogénea. Por su parte, las células con la equinaza se encontraron solitarias y su coloración fue muy pálida, encontrándose zonas de la célula incoloras, como se observó con el medio chu10(6D).
En la figura 7 se puede observar una línea de tendencia polinómica del crecimiento de C. vulgaris en los diferentes medios de cultivo, mostrando de forma clara la duración aproximada de por lo menos tres fases de la curva de crecimiento de la microalga (exponencial, estacionaria y descendente).
El medio donde C. vulgaris tuvo una fase exponencial más prolongada fue con el de humus de lombriz (48 días), seguido de fertilizante complejo NPK (22 días), la equinaza (18 días) y finalmente el chu10 (12 días). En la fase estacionaria, el medio chu10 tuvo una duración de 15 días, en el fertilizante complejo NPK de 10 días, en el humus de lombriz de 12 días y en la equinaza 10 días. La fase descendente de la concentración de la microalga fue más larga con los medios de equinaza (54 días) y fertilizante complejo NPK (32 días); sin embargo, con el humus de lombriz (20 días) y el chu10 (11 días) la población decreció aceleradamente.
La tabla 2 muestra las diferencias entre tratamientos cada 10 días de cultivo. Como se observa, sólo se muestran los resultados hasta el día 62, puesto que para los otros días (72 y 82 días) sólo sobrevivió el tratamiento de equinaza. Hasta el día 12 no se encontraron diferencias entre los tratamientos (p>0.05). En los días 22, 32 y 42, el fertilizante complejo NPK fue el tratamiento que presentó las mayores densidades y crecimiento comparado con los otros tres medios de cultivo (p<0.05); sin embargo, entre el chu10, el humus de lombriz y la equinaza no hubo diferencias (p>0.05). En los días 52 y 62 se observaron diferencias significativas entre el humus de lombriz y la equinaza (p<0.05), siendo el humus de lombriz el que presentó mayor densidad celular con respecto a los demás medios de cultivo evaluados en esos tiempos de cultivo.
Parámetros físicos y químicos
Los valores de oxígeno disuelto en todos los medios de cultivo se encontraron dentro de un rango de 6.2 y 7.5 mg/L. La temperatura de los medios se mantuvo entre 23.0 y 26.5 °C, y la temperatura del laboratorio donde se desarrollaron los cultivos osciló entre 21.0 y 24.5 °C.
En cuanto al pH, con el fertilizante complejo NPK se observó una disminución a través del tiempo, a partir del día 12 presentó un valor por debajo de 5.0 y en el día 20 fue inferior a 3.0 llegando a 2.6. Con el humus de lombriz también se observó una reducción del pH, pues el cultivo inició con un valor de 10.1 y en los últimos muestreos alcanzó valores inferiores a 7.5. A diferencia, el medio chu10 comenzó con un pH de 5.8 y finalizó en 7.4. En el medio de equinaza el pH inicial fue de 6.5, a los 12 días subió a 9.1 y luego empezó a disminuir hasta llegar a 6.7 en su último día de cultivo.
La concentración de nitratos aumentó a través del tiempo desde 75 a 150 mg/L en los medios de fertilizante complejo NPK y humus de lombriz, y la de fosfatos se mantuvo constante en todos los medios de cultivo. La mayor concentración de estos dos nutrientes se observó con el fertilizante complejo NPK y el humus de lombriz (>150 mg/L para nitratos y >3 mg/L para fosfatos); sin embargo, en el chu10 y la equinaza no se detectaron valores para fosfatos (0 mg/L), y los de nitratos fueron bajos con respecto a los otros dos medios (75 mg/L).
Contenido proteico de C. vulgaris cultivada en los diferentes medios
El mayor porcentaje de proteína cruda se obtuvo con el humus de lombriz (56.8%), seguido de la equinaza (32.5%) y finalmente el fertilizante complejo NPK (16.8%). No se obtuvo el valor del contenido proteico de C. vulgaris con el chu10, debido a que en este medio no creció la suficiente cantidad de algas para obtener la materia prima necesaria para el análisis.
Discusión
Las densidades algales en general son más lentas en cultivos de mayor volumen (Hoff y Snell, 1987), razón por la cual probablemente se obtuvo una mayor densidad en menor tiempo en el ensayo preliminar que en el ensayo final. En el ensayo preliminar, la microalga creció un poco más cuando se cultivó en el medio humus de lombriz, pues este le aportó mayor cantidad de nutrientes que la equinaza; por lo tanto, se trabajó con la dilución más alta de equinaza (14.2 mL/L), incorporando mayor cantidad de medio de cultivo y compensar así la poca concentración de nutrientes.
La ausencia de crecimiento de C. vulgaris en el medio chu10, posiblemente está asociada a un menor aporte de nutrientes y por este motivo las células en este medio, al igual que con la equinaza, no se aglomeraron para incrementar la superficie de absorción y lograr capturar de manera más eficiente los pocos nutrientes disponibles a su alrededor (Curtis y Barnes, 2000; Montoya-Terreros et al., 2006). Se ha reportado que la deficiencia de nutrientes tales como nitrógeno (presente en el anillo tetrapirrólico de la clorofila) y magnesio (presente en un anillo orgánico de la clorofila) generan una decoloración en el alga, lo cual puede explicar la coloración pálida de las células cultivadas en el chu10, debido a insuficiencia de clorofila (Bellapart-Vilá, 1996); sin embargo, la escasez de fósforo también puede ocasionar que la microalga se vuelva clorótica (Vera et al., 2004).
Con el fertilizante complejo NPK se obtuvo en poco tiempo una densidad celular muy alta (cinco veces mayor que con el chu10 y el doble que con humus de lombriz y con equinaza), debido posiblemente a que este medio suministra una gran cantidad de nutrientes disponibles rápidamente para el consumo de la microalga. Sin embargo, esta rápida disponibilidad de nutrientes genera a su vez una alta pérdida del nitrógeno que no se alcanza a aprovechar (Bellapart-Vilá, 1996). Cuando hay exceso de nitrógeno y no está siendo utilizado, ocurre un proceso de desnitrificación, en el cual las bacterias reducen el nitrato a nitrógeno gaseoso (Margalef, 1983; de-Bashan y Bashan, 2010). Considerando que no se trabajó con cultivos axénicos, pues existían fuentes de contaminación como insectos y aire natural del laboratorio, es posible que haya ocurrido un proceso de pérdida de nitrógeno por medio de la volatilización, el cual es un proceso en el que se pierde nitrógeno desde la superficie hacia la atmósfera, liberándose como nitrógeno gaseoso (producido como consecuencia de la desnitrificación microbiana), óxidos de nitrógeno y amoniaco; aunque este proceso es mayor cuando el medio es básico, también puede ocurrir en medios ácidos, como en el caso del fertilizante complejo NPK (Wetzel, 1981). Lo anterior podría explicar la corta duración de la microalga en este medio con respecto a los medios orgánicos, pues en este caso Chlorella no tenía disponible suficiente nitrógeno para continuar su crecimiento a causa de la perdida de este.
No se pudo determinar el consumo o la pérdida de estos nutrientes en el medio, debido a que el método para medir nitratos y fosfatos se basa en una escala colorimétrica, y a medida que aumentaba el crecimiento de C. vulgaris, la coloración fue cambiando, tornándose más oscura, lo que dificultó y alteró la lectura de los valores de los nitratos y fosfatos. Sin embargo, hubo evidencias claras de pérdida de nitrógeno en el cultivo con fertilizante complejo NPK, como la formación de una espuma blanca en la superficie de los cultivos (lo cual es a su vez es un indicador de eutroficación) (Salas y Martino, 1996), y el contenido tan bajo de proteína cruda con respecto a los otros medios (tres veces menos que con el humus de lombriz y casi la mitad que con la equinaza). Este último hecho también puede atribuirse a la ausencia del manganeso en el fertilizante complejo NPK, el cual es un componente funcional de la asimilación del nitrato (Wetzel, 1981). En contraste con estos resultados, Andrade et al. (2007) y Morris-Quevedo et al. (1999) obtuvieron un porcentaje alto de proteína bruta (56.3 y 44.6%, respectivamente) en C. vulgaris cultivada con Triple 15, el cual es un fertilizante similar al fertilizante complejo NPK.
Con el humus de lombriz el crecimiento fue menor (casi la mitad) y más lento que en el fertilizante complejo NPK. Con respecto a la equinaza, la diferencia en las máximas densidades celulares no fue significativa (1.1 veces mayor que la equinaza) comparada con los otros medios de cultivo, pero el mayor número de células en el humus de lombriz se observó 30 días después que la máxima densidad observada con la equinaza; no obstante, el contenido proteico de C. vulgaris con el humus de lombriz fue muy alto. Debido a que gran parte del nitrógeno del humus era orgánico, por lo cual debío sufrir un proceso de mineralización para que el nitrógeno estuviera disponible para la microalga (Bellapart-Vilá, 1996; Rickleffs, 1998), la liberación tanto del nitrógeno como de los otros nutrientes fue lenta en este medio, lo que impidió que hubiera pérdida por exceso y por lo tanto mayor cantidad de nutrientes asimilados, contrario a lo ocurrido con el fertilizante complejo NPK. El alto valor en el contenido proteico también se le puede atribuir a la gran capacidad de adsorción que tiene el humus (Bellapart-Vilá, 1996).
Con la equinaza, el cultivo de C. vulgaris tuvo una duración muy larga y la máxima densidad la alcanzó más rápido que en el humus de lombriz (30 días antes) debido a que este medio ya había sufrido un proceso de mineralización en los 53 días que estuvo en reposo para su preparación, pero una vez que alcanzó su mayor densidad, tuvo una fase estacionaria relativamente corta (10 días) y luego empezó a caer muy lentamente durante 54 días. La fase descendente en este medio fue muy lento probablemente porque aun se seguían liberando muy pocos nutrientes al medio que permitían que algunas células se siguieran reproduciendo, pero no lo suficiente como para mantener a la población constante (Stoffella, 2005). Las densidades encontradas en el presente trabajo con este medio fueron superiores (3.9 x 106 cel/mL) a las encontradas por Dahril et al. (1998) (1.9 x 106 cel/ mL) en Chlorella spp. haciendo uso de la equinaza como medio de cultivo.
Las técnicas de cultivo de microalgas influyen de igual modo con su crecimiento. A este respecto, se han reportado densidades algales en especies del género Chlorella con valores de 348.57 x 106 cel/mL (Mora et al., 2004), 41.4 x 106 cel/mL (Vera et al., 2004) y 2.7 x 107 cel/mL (Graeff, 2003), las cuales son muy superiores a las encontradas en el presente ensayo, ya que se emplearon técnicas de cultivo diferentes.
Según Bellapart-Vilá (1996), el contenido y la cantidad de nutrientes que se estén aportando al medio no es lo único importante, sino también la forma y la velocidad en que estos son liberados, pues de esto depende la eficiencia en el consumo por parte del alga. El humus de lombriz es un claro ejemplo de lo anterior, ya que probablemente por la velocidad tan lenta en que este medio suministra los nutrientes, las microalgas lo incorporan más eficientemente. Por tal motivo, los medios orgánicos son una buena opción para el cultivo de microalgas debido a que no sólo generan un producto con buena fuente de proteína sino también se obtienen mayores densidades. A pesar que en este estudio se encontraron diferencias significativas entre las densidades de C. vulgaris cultivadas con fertilizante complejo NPK y los dos medios orgánicos, otros autores como Kumar et al. (2010) reportan que no existen diferencias significativas en el crecimiento de esta microalga haciendo uso de un medio inorgánico (8.76 x 106 cel/mL) y efluente del estiércol de cerdo (8.89 x 106 cel/mL). En el presente estudio, los cultivos orgánicos permanecieron durante mayor tiempo, siendo esta condición de gran utilidad en la alimentación de organismos usados en el levante de larvas y alevinos de peces de importancia comercial (González et al., 1999).
En cuanto a los parámetros de calidad de agua, la temperatura de todos los medios se mantuvo relativamente constante durante todo el periodo de cultivo, y dentro de los niveles óptimos para el crecimiento de las microalgas (Sipaúba-Tavares y Rocha, 2003). También se pudo observar que C. vulgaris es una microalga de fácil adaptación y tiene una gran tolerancia a diferentes condiciones ambientales y de cultivo (Mora et al., 2004), pues creció en medios con un bajo nivel de oxígeno disuelto (4.6 mg/L) y a diferentes rangos de pH, desde muy ácido con el fertilizante complejo NPK (2.7) hasta básico con el humus de lombriz (10.1) y la equinaza (9.1). Sin embargo, estudios previos han reportado que los valores de pH en los que mejor crece esta microalga están entre 6.3 y 9.0 (Mayo, 1997; Mora et al., 2004; Rodrigues y Belli-Filho, 2004), aunque otros estudios reportan mejores crecimientos en pH bajos como el de Cleber-Bertoldi et al. (2006), quienes reportaron crecimiento en un medio de aguas residuales con un pH de 5.0 y el de Sung et al. (1999) que encontraron que esta microalga crece adecuadamente con pH de hasta 4.0. Por debajo de este valor, a pH de 1.0 y 3.0, Moronta et al. (2006) reportan letalidad para la microalga C. sorokiniana, contrario a lo ocurrido con el fertilizante complejo NPK en donde C. vulgaris presentó una alta densidad con un pH de 2.7, lo cual refleja la resistencia de esta alga a pH ácidos.
De acuerdo con los resultados obtenidos en el presente estudio, se puede concluir que los medios orgánicos son una buena opción para el cultivo de C. vulgaris, pudiendo utilizarse como fuente de alimento para otros organismos, puesto que con sistemas de tratamiento adecuados para mineralizar sus nutrientes, se pueden obtener altas densidades, con alto contenido de proteína, y a muy bajo costo. En el presente estudio, el humus de lombriz fue el medio que mostró mejores densidades celulares y contenido proteico en C. vulgaris; sin embargo, aunque la equinaza mostró resultados satisfactorios en el contenido proteico, es necesario adicionar nutrientes orgánicos de bajo costo para optimizar su calidad con el fin de suministrar mayor cantidad de nutrientes y obtener mejores resultados en el cultivo de microalgas.
Agradecimientos
Los autores agradecen al Ministerio de Agricultura y Desarrollo Rural, y la Universidad de los Llanos (Convenio No. 015-02/06) por el apoyo financiero y al Instituto de Acuicultura de la Universidad de los Llanos por el apoyo logístico.
Referencias
1. Andrade RD, Torres R, Montes EJ, Fernández AC. Obtención de harina a partir del cultivo de Chlorella vulgaris y su análisis proteico. Temas Agrarios 2007; 12: 50-57. [ Links ]
2. Bellapart-Vilá C. Nueva agricultura biológica en equilibrio con la agricultura química. Madrid, España: Ediciones Mundi- Prensa; 1996. [ Links ]
3. Cleber-Bertoldi F, Sant'anna E, Villela-da Costa-Braga M, Barcelos-Oliveira JL. Lipids, fatty acids composition and carotenoids of Chlorella vulgaris cultivated in hydroponic wastewater. Grasas y Aceites 2006; 57: 270-274. [ Links ]
4. Curtis H, Barnes NS. Biología. 6ta ed. Madrid, España: Editorial Médica Panamericana; 2000. [ Links ]
5. Dahril T, Ahmad M, Lizuca S. Effect of various animal manures on the growth of a freshwater green algae (Chlorella spp.) and rotifer (Brachionus calyciflorus). Asian Fish Sci 1998; 11: 193- 201. [ Links ]
6. de-Bashan LE, Bashan Y. Immobilized microalgae for removing pollutants: Review of practical aspects. Bioresour Technol 2010; 101: 1611-1627. [ Links ]
7. Faria ACEA, Hayashi C, Soares C, Furuya WM. Dinâmica da comunidade fitoplanctônica e variáveis físicas e químicas em tanques experimentais submetidos a diferentes adubações orgánicas. Acta Sci Biol Sci 2001; 23: 291-297. [ Links ]
8. González B, Buitrago E, Frontado K. Evaluación de medios nutritivos para el crecimiento de tres microalgas marinas de uso común en acuicultura. Memoria 1999; LIX (151): 75-84. [ Links ]
9. Graeff A. Método para multiplicação da alga (Chlorella minutissima) para alimentação inicial de um sistema de produção de peixes fitoplantofagos. CIVA 2003: 127-131. [ Links ]
10. Granados-Machuca C, Buckle-Ramírez LF. Cultivo de las microalgas Monochrysis lutheri y Skeletonema costatum con nutrientes producidos por estiércoles digeridos. An Inst Cienc del Mar y Limnol Univ Nal Auton México 1984; 11: 241-256. [ Links ]
11. Hoff FH, Snell TW. Plankton culture manual. 5th ed. USA: Florida Aquafarms Inc; 1987. [ Links ]
12. Kumar MS, Miao ZH, Wyatt SK. Influence of nutrient loads, feeding frequency and inoculum source on growth of Chlorella vulgaris in digested piggery effluent culture medium. Bioresour Technol 2010; 101: 6012-6018. [ Links ]
13. Margalef R. Limnología. Barcelona, España: Ediciones Omega; 1983. [ Links ]
14. Mayo AW. Effects of temperature and pH on the kinetic growth of unialga Chlorella vulgaris cultures containing bacteria. Water Environ Res 1997; 69: 64-72. [ Links ]
15. Montoya-Terreros H, Gómez-Carrión J, Benavente-Palacios M. Poblaciones naturales y de cultivo de la microalga marina Mastigocoleus testarum Lagerheim ex Bornet et Flahault (Cyanophyta, Nostochopsaceae), primer registro para la flora peruana. Arnaldoa 2006; 13: 258-269. [ Links ]
16. Mora R, Moronta R, Ortega J, Morales E. Crecimiento y producción de pigmentos de la microalga nativa Chlorella sp. aislada de la Represa de Tulé, Municipio Mara, Estado Zulia, Venezuela. Ciencia 2004; 12: 117-124. [ Links ]
17. Moronta R, Mora R, Morales E. Respuesta de la microalga Chlorella sorokiniana al pH, salinidad y temperatura en condiciones axénicas y no axénicas. Rev Fac Agron 2006; 23: 27-41. [ Links ]
18. Morris-Quevedo HJ, Quintana-Cabrales MM, Almarales-Arceo A, Hernández- Nazario L. Composición bioquímica y evaluación de la calidad proteica de la biomasa autotrófica de Chlorella vulgaris. Rev Cubana Aliment Nutr 1999; 13: 123-128. [ Links ]
19. Nieves-Soto M, Cortes-Altamirano R, Gutiérrez-Corona C, Pacheco-Marges M. Producción de fitoplancton a bajo costo. 1. Aislamiento y cultivo de Monoraphidium sp. (Chlorophyceae) en un sistema estático en medio F y cuatro a base de fertilizantes agrícolas. An Inst Cienc del Mar y Limnol Univ Nal Auton México 1994; 21:119-127. [ Links ]
20. Rickleffs RE. Invitación a la ecología, La economía de la naturaleza. 4ta ed. Nueva York, USA: Editorial Médica Panamericana; 1998. [ Links ]
21. Rodrigues JBR, Belli-Filho P. Eficiência da microalga Chlorella minutissima no tratamento de residuos de suinocultura enriquecido com uréia. Biotemas 2004; 17: 7-26. [ Links ]
22. Salas HJ, Martino P. Curso de eutroficación en lagos cálidos tropicales, medidas de control y legislación para eutroficación (Santo Domingo, República Dominicana, 2-6 de septiembre de 1996). Lima, Perú: Organización Mundial de la Salud; 1996. [ Links ]
23. Sipaúba-Tavares LH, Rocha O. Produção de Plâncton (Fitoplâncton e Zooplâncton) para alimentação de Organismos Aquáticos. São Carlos, Brasil: RiMa editora; 2003. [ Links ]
24. Stoffella PJ. Utilización de compost en los sistemas de cultivo hortícola. Madrid, España: Mundi-Prensa Libros; 2005. [ Links ]
25. Sung KD, Lee JS, Shin CS, Park SC, Choi MJ. CO2 fixation by Chlorella sp. KR-1 and its cultural characteristics. Bioresour Technol 1999; 68: 269-273. [ Links ]
26. Torrentera-Blanco l, Tacon AGJ. La producción de alimento vivo y su importancia en acuacultura una diagnosis. Project Reports No. 12. Brasilia, Brasil: Organización de las naciones unidas para la agricultura y la alimentación -FAO-; 1989. [ Links ]
27. Vásquez-Torres W. Principios de nutrición aplicada al cultivo de peces. Villavicencio, Colombia: Universidad de los Llanos; 2004. [ Links ]
28. Valenzuela-Espinoza E, Lafarga-de la Cruz F, Millán-Núñez R, Núñez-Cebrero F. Crecimiento, consumo de nutrientes y composición proximal de Rhodomonas sp. cultivada con medio f/2 y fertilizantes agrícolas. Cienc Mar 2005; 31: 79-89. [ Links ]
29. Vera A, Martínez M, Morillo K, Montes S. Cultivo discontinuo de Chlorella sp. en medios enriquecidos con el exudado gomoso de Acacia macracantha. Bol Centro Invest Biol 2004; 38: 109- 119. [ Links ]
30. Velasco-Santamaría YM, Corredor-Santamaría W. Nutritional requirements of freshwater ornamental fish: A review. Rev MVZ Córdoba 2011; 16:2458-2469. [ Links ]
31. Wetzel RG. Limnología. Barcelona, España: Ediciones Omega; 1981. [ Links ]
32. Yamamoto M, Fujishita M, Hirata A, Kawano S. Regeneration and maturation of daughter cell walls in the autospore-forming green alga Chlorella vulgaris (Chlorophyta, Trebouxiophyceae). J Plant Res 2004; 117: 257- 264. [ Links ]
Notas
¤ Para citar este artículo: Muñoz-Peñuela M, Ramírez-Merlano JA, Otero-Paternina AM, Medina-Robles VM, Cruz-Casallas PE, Velasco-Santamaría YM. Efecto del medio de cultivo sobre el crecimiento y el contenido proteico de Chlorella vulgaris. Rev Colomb Cienc Pecu 2012; 25:438-449.