Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Colombia Forestal
versión impresa ISSN 0120-0739
Colomb. for. vol.16 no.1 Bogotá ene./jun. 2013
MACROINVERTEBRADOS ASOCIADOS A Guzmania mitis L.B. Sm. (Bromeliacea) EN DOS FRAGMENTOS DE ROBLEDAL
Macroinvertebrates associated with Guzmania mitis L.B. Sm. (Bromeliaceae) in two fragments of oak grove
Winston Wilches-Álvarez1, Manuel Fernando Botero-Á2 & Francisco Cortés-P.3
1Universidad Pedagógica y Tecnológica de Colombia. Tunja, Colombia. w2twister@gmail.com. Autor para correspondencia.
2Grupo de investigación EBAC. Universidad Pedagógica y Tecnológica de Colombia. Tunja, Colombia. manubotero_98@yahoo.com
3Grupo de investigación EBAC. Universidad Pedagógica y Tecnológica de Colombia. Tunja, Colombia. frcortes2001@yahoo.com
Recepción: 14 de julio de 2012 / Aprobación: 16 de diciembre de 2012
RESUMEN
Se estudió la composición y la abundancia de macroinvertebrados asociados a la bromelia terrestre Guzmania mitis en dos fragmentos de robledal con diferente estado de conservación en Arcabuco, Boyacá, con el objetivo de establecer si existen diferencias en la composición y en la abundancia de macroinvertebrados entre los fragmentos y analizar sus posibles causas, y con el fin de identificar grupos de macroinvertebrados que puedan servir de indicadores de alteración de los robledales. En dos fragmentos de robledales diferentes fisionómica y estructuralmente se hicieron dos muestreos de macroinvertebrados en la temporada seca, febrero, y en la temporada lluviosa, mayo del 2006. En cada muestreo se colectaron nueve bromelias por fragmento, de ellas se separaron e identificaron los macroinvertebrados presentes basados en una variante del método de lavado de las bromelias con agua. Se encontraron 12 258 individuos, pertenecientes a 20 órdenes, 52 familias y 89 morfoespecies, destacándose los órdenes Díptera y Coleóptera en estados larvales. Los análisis de agrupamiento en el fragmento disturbado asociaron las bromelias por la mayor abundancia de Chironomidae y baja abundancia de Scirtidae, mientras que en el fragmento conservado, los agrupamientos se dieron por la baja abundancia de Chironomidae y la alta abundancia de Scirtidae. No se halló una relación significativa entre la abundancia, diversidad (Shannon) y riqueza (Margalef) con la variación de los parámetros fisicoquímicos (O2 disuelto y pH), medidos en las bromelias. Las familias Chironomidae y Scirtidae se proponen como posibles indicadores del grado de intervención en los robledales estudiados.
Palabras clave: bioindicadores, bromelias terrestres, Chironomidae, Fitotelma, macroinvertebrados, Scirtidae.
ABSTRACT
The composition and abundance of macroinvertebrates associated with the terrestrial bromeliad Guzmania mitis in two fragments of oak grove with different conservation status in Arcabuco, Boyacá were studied. The study aimed to establish whether there are differences in the composition and abundance of macroinvertebrates between fragments and their possible causes, and to identify groups of macroinvertebrates that may serve as indicators of alterations to oak groves. Two macroinvertebrates samples were made, one in the dry season in February and one in the rainy season in May 2006, in two physiognomically and structurally different oak grove fragments. Nine bromeliads per fragment were collected from which the macroinvertebrates were identified. 12 258 individuals were found, belonging to 20 orders, 52 families and 89 morphospecies, with orders Diptera and Coleoptera prominent in larval stages. The cluster analysis in the disturbed fragment had a higher abundance of Chironomidae and low abundance of Scirtidae, whereas the conserved fragment had low abundance of Chironomidae and high numbers of Scirtidae. No significant relationship was found between abundance, diversity (Shannon) and richness (Margalef) and variation in physicochemical parameters (dissolved O2 and pH) measured in bromeliads. The families Chironomidae and Scirtidae are proposed as good candidates for possible indicators of the degree of intervention in oak groves.
Key words: bioindicators, terrestrial bromeliads, Chironomidae, Fitotelma, macroinvertebrates, Scirtidae.
INTRODUCCIÓN
Las bromelias tipo tanque mantienen reservas de agua durante todo el año y, adicionalmente, reciclan hojarasca y detritus de su medio circundante, por lo que pueden sostener cadenas tróficas complejas que involucran varios niveles como trituradores, colectores, detritívoros, filtradores y depredadores que facilitan y proporcionan alimento a otro tipo de organismos, como bacterias, algas, musgos, otras plantas vasculares, protozoos, hongos, invertebrados y algunos vertebrados (Ospina et al., 2004; Marino et al., 2012).
Los estudios de macroinvertebrados en estas plantas se han enfocado en la explicación de las cadenas tróficas y el flujo de nutrientes existentes dentro de las bromelias (Marino et al., 2012) y en estudios con insectos vectores de enfermedades que utilizan la planta para su crecimiento, sin tomar en cuenta parámetros estructurales del ecosistema circundante que pueden relacionarse con la abundancia y con la diversidad en las plantas tipo tanque. Estos procesos podrían estar relacionados con los efectos de la fragmentación, tales como la alteración microclimática tanto en el borde como en el interior de los fragmentos de bosque (robledal), su aislamiento dentro de una matriz de pastizales y cultivos (Kattan, 2002) y la afectación de la diversidad de flora y fauna dentro de los parches.
Los artrópodos y en especial los insectos son grupos que poseen una alta diversidad (Alba-Tercedor, 1996) y en su mayoría tienen una amplia capacidad de respuesta a los cambios ambientales (Ospina, 2004). En el caso de los macroinvertebrados asociados a las bromelias tipo tanque presentes en los robledales, se desconocen los efectos que sobre ellos podría tener la fragmentación; sin embargo, se piensa que estos cambios generan variación de la cantidad y de la calidad de los recursos alimenticios y de las condiciones físicas y químicas que pueden afectar a la comunidad asociada al tanque (Yanoviak, 2001a, 2001b; Ospina et al., 2004; Marino et al., 2012). Por esta razón, las comunidades de macroinvertebrados podrían ser utilizadas para detectar ecosistemas disturbados, por medio de los cambios en su composición y abundancia, indicando probablemente el grado de alteración del ambiente (Ospina et al., 2004).
El objetivo de este trabajo fue comparar la composición y la abundancia de la comunidad de macroinvertebrados asociados a la bromelia terrestre Guzmania mitis en dos fragmentos de robledales con distinto grado de intervención para establecer si existen diferencias entre ellos y conocer sus posibles causas, así como identificar posibles grupos de macroinvertebrados indicadores de la alteración de los robledales estudiados.
MATERIALES Y MÉTODOS
El trabajo se realizó en dos fragmentos de robledal ubicados en la vereda Peñas Blancas del municipio de Arcabuco, localizado al norte del departamento de Boyacá, a los 73°26’ N y 5°47’ W, a 2680 m de altitud, en la zona de vida bosque húmedo montano bh-M (Holdridge et al.,1971). El fragmento de robledal conservado (FC), según los habitantes de la zona, no presentó extracción maderera por ochenta años, mientras que el fragmento disturbado (FD) presentó entresaca de madera reciente. El clima de la región se caracteriza por presentar dos épocas lluviosas (marzo-abril y septiembre-noviembre), intercaladas con dos temporadas secas (diciembre-febrero y julio-septiembre), con una precipitación anual que oscila entre 1600 a 2000 mm; una humedad relativa media de 80 % y una temperatura promedio anual de 13 °C (Corpoboyacá, 2000; Herrera, 2005). La vegetación es de tipo boscoso, principalmente en las laderas de montaña a más de 2600 m, sobre pendientes de 20 % a 30 %, y con predominio de Quercus humboldtii (Corpoboyacá, 2000).
Se colectaron bromelias de un tamaño semejante en la temporada seca, del 7 al 10 de febrero de 2006, y en la temporada de lluvias, del 20 al 30 de mayo de 2006. En cada temporada fueron muestreadas 18 bromelias; nueve en el fragmento conservado y nueve en el disturbado, para un total de 36. Las bromelias se separaron del suelo, y el agua contenida en cada una de ellas junto a las plantas se guardó por separado en bolsas de polietileno que se etiquetaron y posteriormente se procesaron en un laboratorio de la Universidad Pedagógica y Tecnológica de Colombia, UPTC- Tunja.
El pH y la temperatura del agua contenida en cada bromelia se midieron en el momento previo a su recolección con un potenciómetro WTW(Wissenshafllich-TechnischeWerktätta) pH 330i/ set; el porcentaje de saturación de oxígeno disuelto fue medido mediante método titrimétrico según Winkler usando el test de oxígeno Aquamerck y la conductividad eléctrica se midió con un conductímetro Schott Gerate CG 858. Posteriormente se midió el volumen del agua contenida en cada bromelia utilizando una probeta graduada y se separó el material biológico del resto de la planta con base en una variante del método de Frank et al. (2004), que consistió en lavar y deshojar cada bromelia para recoger el material que se encontraba en medio de las axilas de las hojas. El material obtenido se filtró con un tamiz de 118 µ de tamaño de poro para eliminar el detritus y la hojarasca, luego se separaron los macroinvertebrados con ayuda de un estereoscopio binocular y se almacenaron en viales con alcohol etílico al 70 % (Borror et al., 1989). La determinación taxonómica y la ubicación en los grupos funcionales se llevaron a cabo con claves especializadas de (Borror et al. 1989; Booth et al.1990; Merritt & Cummins, 1984; White, 1983; Kitching, 2000), llegando hasta la categoría taxonómica de familia en la mayoría de los casos y situando el grupo funcional a este nivel.
Con los datos de composición de macroinvertebrados y morfoespecies dentro de cada familia se estimó la diversidad de Shannon-Wienner para cada bromelia (Moreno, 2001; Villareal et al., 2004). Para la comparación entre las bromelias de los dos fragmentos se evaluó la similitud con el coeficiente de similitud de Sorensen para datos cuantitativos modificado por Bray-Curtis (Magurran, 1989); para detectar qué grupos de macroinvertebrados podían caracterizar cada uno de los fragmentos de robledal y establecer si existía agrupamiento de las bromelias según el fragmento se realizó un análisis de clúster. Los dendrogramas se construyeron usando como método de vinculación el promedio de grupo y como unidad de medida la distancia euclidiana, usando el programa PCord versión 4.0.
Se realizó un análisis de componentes principales (PCA) para correlacionar la abundancia de macroinvertebrados acuáticos en las bromelias con los parámetros fisicoquímicos medidos con el fin de establecer si alguna variable agrupaba las especies de alguno de los fragmentos y épocas de muestreo. Finalmente se realizó una gráfica de dispersión de especies con la abundancia absoluta para determinar la estructura de las comunidades existentes en las bromelias y con la interpretación biológica del modelo al que representan en cada uno de los fragmentos de bosque y época de muestreo.
RESULTADOS
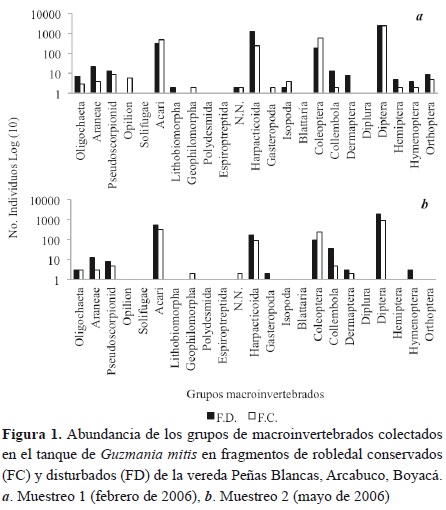
Se encontró un total de 12 258 individuos, pertenecientes a 20 órdenes, 52 familias y 89 morfoespecies (anexo 1). El 69.4 % representado por estados larvales, el 30.5 % por adultos y el 0.12 % por estadios juveniles. El orden Díptera fue el más abundante con 7602 individuos (62.01 %) del total, de los cuales 7597 se encontraban en estado larval. Se encontraron individuos en las familias Chironomidae con 5950 (48.53 %), Syrphidae con 574 (4.68 %), Tipulidae con 358 (2.92 %) y Psychodidae con 250 (2.03 %). Después del orden Diptera se destacó la clase Copepoda con 1692 individuos (13.8 %) y en tercer lugar la Coleoptera en estado larval con 909 (13.7 %), en su mayoría de la familia Scirtidae 868 (11.41 %). La clase Arachnida estuvo compuesta por 1644 Acari (13.41 %), 48 Araneae (0.39 %) 27 Pseudoescorpion (0.22 %), 6 Opilion (0.04 %) y un Solifugae (figura 1).
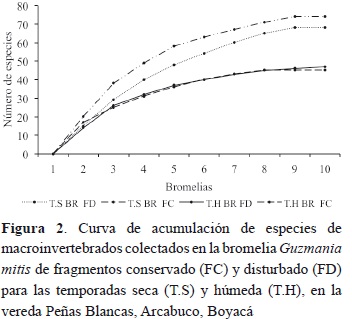
En la figura 2 se observa que el número de especies de macroinvertebrados aumentó rápidamente en los primeros censos y se estabilizó al acumular más bromelias, indicando que el número de bromelias utilizadas en este trabajo fue suficiente para caracterizar la comunidad de macroinvertebrados presentes en ellas, tanto por época de muestreo como por tipo de fragmento. En la temporada seca de febrero de 2006, primer muestreo, se observó que tanto el fragmento conservado como el disturbado presentaron una mayor riqueza de especies en comparación con la época lluviosa de mayo de 2006, segundo muestreo.
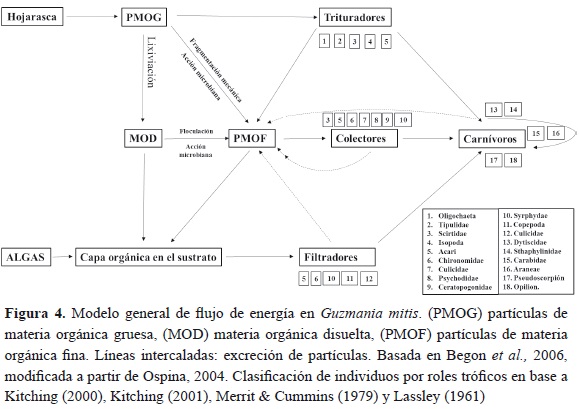
La distribución de abundancias en la figura 3 muestra variaciones en los fragmentos y en los periodos muestreados. En general, las abundancias de macroinvertebrados entre los fragmentos y épocas siguieron la misma distribución, salvo una tendencia a la reducción en la abundancia y riqueza de familias en la temporada lluviosa en ambos fragmentos. El tipo de gráfica se ajusta a una distribución de log N (Magurran, 1989; Moreno, 2001), donde los grupos de macroinvertebrados conforman una comunidad especializada y estable (Moreno, 2001), de acuerdo con los diferentes recursos ofertados por las bromelias, principalmente los productos que se derivan de la hojarasca como partículas de materia orgánica gruesa (PMOG), materia orgánica disuelta (MOD) y partículas de materia orgánica fina (PMOF; Kitching, 2000).
Al encontrar grupos especializados en cada uno de los niveles de descomposición de la hojarasca en Guzmania mitis, notamos que las comunidades de ambos fragmentos contienen especies en todos los niveles tróficos en el esquema del flujo de energía dentro del tanque de las bromelia, donde una fracción de partículas de materia orgánica gruesa (PMOG) proveniente de la hojarasca es transformada por lixiviación en materia orgánica disuelta (MOD), el remanente es entonces procesado a partículas de materia orgánica fina (PMOF) de tres maneras diferentes, fraccionamiento mecánico, fragmentación por degradación de microorganismos y fragmentación por trituradores; adicionalmente, todos los grupos de animales contribuyen con la formación de PMOF por medio de la producción de heces (Begon et al., 2006). Por último, se encuentran los depredadores que pueden disponer como alimento a cualquiera de los grupos presentes en la red trófica (figura 4).
Según los órdenes más representativos, los roles tróficos encontrados en el ciclo de fragmentación de la hojarasca para los dípteros fueron representados por los roles funcionales de trituradores, colectores y filtradadores; los coleopteros están representados en colectores, trituradores y carnívoros, mientras que los copépodos son principalmente filtradores de materia orgánica suspendida (Kitching, 2000).
En relación con las morfoespecies más abundantes se destacan los roles tróficos de Chironomidae como colectores-filtradores, los Scirtidae como trituradores-colectores (figura 4).
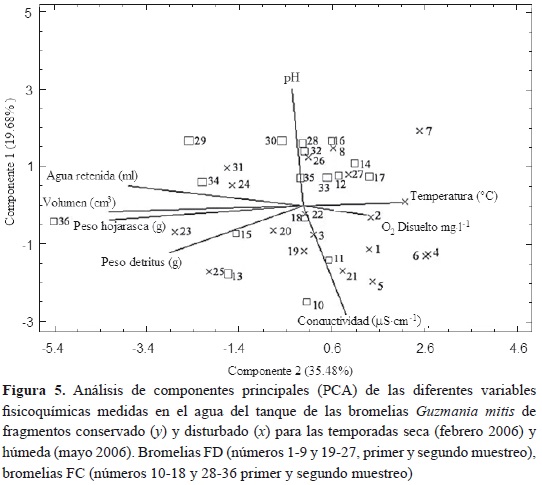
El análisis PCA, figura 5, mostró que la composición y la abundancia de macroinvertebrados de cada bromelia de los fragmentos evaluados no presentó agrupamiento con ninguna de las variables ambientales medidas, por lo que los puntos que representan a cada bromelia se encuentran dispersos por toda la gráfica sin mostrar patrones de agrupamientos en alguno de los ejes.
Los contenidos de oxígeno disuelto en el agua de las bromelias se ubicaron entre 0.3 y 1.5 mg l-1, en general estos valores corresponden a ambientes bajos en oxígeno. El pH fue ácido, entre 3.66 y 4.38, más bajo que los encontrados por Lasprilla (2003), donde fueron ligeramente ácidos. La temperatura promedio del agua fue de 12 oC, con variaciones que se debieron a la hora del día en la que se realizó el muestreo de las bromelias, puesto que a medida que avanzó el día la temperatura ambiente aumentó incrementando la temperatura al interior del tanque de las bromelias.
Los índices de diversidad de Shannon fueron de 1.46 en promedio para las nueve bromelias en el FD, en la temporada seca, en comparación con 1.85 de las 9 bromelias del FC. Para la época de lluvias se mantuvieron las diferencias, 1.49 en el FD y 1.74 en el FC.
En la figura 6a se muestran los dendrogramas usando las abundancias de macroinvertebrados de las bromelias colectadas en la temporada seca, en donde se observan dos grandes grupos de bromelias y dos grupos conformados por una sola bromelia. El primer grupo (1) es separado por poseer un menor número de Chironomidae, este se divide en un subgrupo 1A del FD, con menor número de larvas de Scirtidae, y el subgrupo 1B del FC se destaca por una mayor abundancia de individuos de Scirtidae. La bromelia 12 FC presenta semejanzas con las bromelias 10 y 14 del FC en el número de Chironomidae, Scirtidae y Syrphidae morfoespecie 2 (Mf 2), y se agrupa finalmente con la bromelia 14 FC, con un porcentaje de similitud muy alto, debido a que presentaron una cantidad parecida de Acari mf 5. El segundo grupo (2) se caracterizó por tener una mayor abundancia de Chironomidae, está conformado por el subgrupo (2A) del FD, con una mayor abundancia de copépodos; otro subgrupo (2B), sin o con muy pocos copépodos, presentó la mayor abundancia de Chironomidae de todas las bromelias.
En la figura 6b se muestran los agrupamientos de la abundancia de macroinvertebrados presentes en las bromelias en la temporada húmeda, donde se presentaron tres grupos de bromelias. El primer grupo (1), conformado por 6 bromelias del FD, presentó una alta abundancia de Chironomidae y un bajo número de Scirtidae. Además, dos bromelias (21 y 23) del FD, con un porcentaje de similitud muy alto, compartieron abundancias muy similares de Chironomidae y Acari Mf1.
El segundo grupo (2), constituido por 8 bromelias del FC, presentó abundantes larvas de Scirtidae y escasas de Chironomidae en comparación con el primer grupo. Las bromelias 30 y 32 del FC tienen similitud muy alta debido a que Chironomidae y Scirtidae presentan una abundancia muy similar de individuos. El tercer grupo (3) reúne a las bromelias 33 del FC y 3 bromelias del FD con el porcentaje más bajo de similitud y caracterizadas por tener una alta presencia de copépodos.
DISCUSIÓN
Según los habitantes de la zona, el FD sufrió una fuerte intervención por parte de los madereros de la zona en la década de los ochenta que dio como resultado la tala casi total de los robles. Luego de este evento, no se continuó con la actividad de extracción y se permitió una regeneración natural del parche hasta la actualidad. Este fragmento se encuentra en una etapa de sucesión secundaria expresada en menos estratos de vegetación, robles de menor porte y un dosel más abierto, ocasionando una diversidad de plantas menor al fragmento conservado. Como consecuencia de tener un dosel más abierto, se genera un microclima más cálido y seco por mayor penetración de la luz y menor capacidad de retención de la humedad.
La abundancia de macroinvertebrados colectados en G. mitis probablemente está relacionada con una mejor oferta de alimentos y con un ambiente acuático más estable brindado por la bromelia, en comparación con el ambiente circundante, aspecto compartido por (Lasprilla, 2003). A esta estabilidad ambiental en G. mitis quizás contribuyen los detritus que se forman por descomposición de la hojarasca que cae del dosel, y que sirven de alimento a los macroinvertebrados asociados al tanque de G. mitis, en lo que coincide Kitching (2000) en estudios sobre otras especies de bromelia, además, la hojarasca crea sombra y disminuye la pérdida de agua por evaporación. Esto probablemente permite el asentamiento de gran número de individuos en variedad de roles tróficos, y las interacciones entre organismos halladas en este trabajo permiten mostrar cadenas complejas de alimentación, similares a las reportadas por Richardson (1999), Begon et al. (2006), Srivastava (2006), Montero et al. (2010) y Brouard et al. (2012).
En trabajos para bromelias epífitas de bosques subandinos, andinos y altoandinos de Colombia, de Estupiñán & Muñoz (1992), Lasprilla (2003) y Ospina (2004), se reportan altas abundancias de ácaros, con dominancia de larvas de Diptera y Coleoptera en la artropofauna de Tillandsia turneri y Tillandsia complanata. En nuestro estudio con G. mitis,el cual contrasta con las anteriores, pues es una especie de bromelia terrestre, hallamos una composición de macroinvertebrados e insectos similar a la reportada en los trabajos citados, con la diferencia de que en G. mitis se encontró gran abundancia de copépodos, no reportados anteriormente y que en nuestro caso son un componente ecológico importante en abundancia (anexo 1) y con un rol trófico como filtradores de materia orgánica suspendida (Kitching, 2000), además, de acuerdo con Laessle (1961) y Kitching (2000, 2001) es usual la presencia de copépodos en bromelias y en otros ambientes fitotelmáticos.
Por su abundancia, los grupos más importantes fueron: Diptera, Copepoda y Coleoptera. Diptera es abundante por la capacidad de dispersión que les da el vuelo en etapa adulta, además sus larvas poseen adaptaciones morfológicas como sifones y espiráculos que les permiten respirar aire y desarrollarse en ambientes acuáticos con baja concentración de oxígeno (Merritt & Cummins, 1984), y son eficientes como colectores y filtradores de material orgánico fino proveniente de la fragmentación de la hojarasca, fuente alimenticia abundante dentro de la bromelia (Ospina et al., 2004). Finalmente, Coleoptera fue el grupo más biodiverso y con mayor variedad de roles tróficos, razón por la que lo postulamos como uno de los más importantes en nuestro trabajo, además, porque incluye a la familia Scirtidae con el mayor número de larvas, la mayoría de ellas reportadas por Kitching (2000), Greeney (2001) y Montero et al. (2010) como habitantes comunes en las hojas axilares con agua donde pueden ser trituradores y colectores, aprovechando el material vegetal en descomposición. Aunque los coleópteros descomponedores de materia orgánica fueron abundantes, este orden presentó también depredadores tanto en su etapa larval como adulta, entre las que se encuentran larvas de la familia Dytiscidae y adultos de las familias Staphylinidae y Carabidae (Merritt & Cummins, 1984).
Respecto a los parámetros físicos y químicos estudiados, los promedios de pH y de conductividad fueron similares en ambos fragmentos, sin embargo, la mayor concentración de oxígeno en el FD se puede deber a una creciente población de algas que, según Laessle (1961) y Brouard et al.(2012), se favorecería por una mayor penetración de la luz, lo que efectivamente ocurre en el fragmento disturbado ante la apertura del dosel en sitios con claros, y que además favorece a los macroinvertebrados que habitan en las bromelias.
El agua retenida en las bromelias mostró características típicas de los ambientes fitotelmáticos. Los niveles de acidez en el agua son una respuesta a la acumulación de hojarasca que promueve la formación de ácidos húmicos (Ospina et al., 2004) y a la actividad de la fauna presente por la liberación de CO2 (Kitching, 2000), incidiendo en la disminución del pH, convirtiéndose en un ambiente propicio para el desarrollo de larvas de dípteros, que efectivamente fueron el grupo dominante en este trabajo. La acidez en el agua guarda una relación con la baja concentración de oxígeno.
El bajo contenido de oxígeno probablemente se debe al consumo de los macroinvertebrados y de otros organismos (ranas y gasterópodos); a la presencia de hojarasca que disminuye la superficie para el intercambio gaseoso y genera una sombra que limita el crecimiento de algas, inhibiendo así la fotosíntesis (Laessle, 1961), y a la relación que existe entre la temperatura y la capacidad de retención de oxígeno de un cuerpo de agua, entre más caliente menos oxígeno (Kitching, 2000). En nuestro caso, la temperatura fluctuó a lo largo del día, sin embargo, el agua en la fitotelma ofrece un ambiente más uniforme y estable al ser menor la variabilidad de la temperatura que en el ambiente externo a ella (Kitching, 2000; Lasprilla, 2003). En esta agua, Laessle (1961) indica que los rangos de 0.025 a 7.6 mg l-1 de oxígeno disuelto favorecen el establecimiento de Culicidae, entre 0.2 y 0.8 mg l-1 de Chironomidae y de 0.8 a 2.5 mg l-1 de Syrphidae, que en este trabajo fueron los principales grupos.
Los promedios de los volúmenes de agua almacenados por las bromelias en temporada seca (febrero) del FC y FD fueron diferentes, y quizás ayuden a explicar las diferencias encontradas con el índice de diversidad de Shannon, menor en el FD, coincidiendo en esto con Armbruster et al. (2002). El factor que está generando menor cantidad de agua retenida y menor diversidad en el FD, probablemente, es que el FD es más pequeño, por ende las bromelias se encuentran más expuestas a luz solar y a corrientes de viento, por una mayor apertura del dosel que aumenta el poder desecante y, por ende, la evaporación del agua en las bromelias. Durante la temporada de lluvias, en cambio, la alta pluviosidad mantiene al límite la capacidad de almacenamiento de agua en las bromelias de ambos lugares.
No se encontró una relación estadística significativa entre el pH, la conductividad y la temperatura del agua de las bromelias con la diversidad (Shannon), mostrando que el cambio de estas variables no es determinante en la conformación de la comunidad de macroinvertebrados que contienen. Así mismo, no hubo una relación estadísticamente significativa entre el agua medida en cada bromelia, la hojarasca y el detritus con la riqueza y la diversidad, quizás debido a que al escoger bromelias de tamaños similares, las diferencias de estas variables no fueron significativas y no afectaron de manera perceptible la conformación de las poblaciones de macroinvertebrados (Armbruster et al., 2002).
Los dendrogramas de similitud de la abundancia de macroinvertebrados entre bromelias de los dos fragmentos muestran una separación de las bromelias, dependiendo del lugar donde se encuentren, resultados que concuerdan con los de De Lyra (2006), donde la fragmentación del ecosistema ocasiona apertura de claros y simplificación de la vegetación, generando cambios o disminución en las poblaciones de las comunidades de macroinvertebrados. La separación de las bromelias estuvo regida, principalmente, por un alto o bajo número de dos de las familias más abundantes; la mayor abundancia de las larvas de la familia Chironomidae estuvo asociada al FD, mientras que una mayor abundancia de larvas de la familia Scirtidae estuvo ligado al FC, mostrando así que algunas familias son sensibles al grado de disturbio (De Lyra, 2006).
En el FC hubo mayor abundancia de larvas de la familia Scirtidae. Esta (a veces referida como Helodidae, Elodidae, Cyphonidae o Dascillidae) se caracteriza por tener larvas acuáticas de coleópteros que luego dejan el agua para ser completamente terrestres en la fase adulta (Kitching, 2000). Según Richardson (1999), en una comparación de tres tipos de bosques de diferente gradiente altitudinal, la presencia de Scirtidae estuvo relacionada con bosques de árboles más grandes, una productividad primaria neta más alta y una mayor diversidad de plantas, lo que coincide con el robledal del FC de nuestro estudio. Esto tiene incidencia en la calidad de la hojarasca que llega a la bromelia, porque hay una mayor diversidad de plantas en el FC que ofrecería la posibilidad de obtener más hojas jóvenes, de mejor palatabilidad y fácil degradación (Kitching, 2001), frente a la hojarasca del FD, compuesta principalmente de hojas de roble (especie dominante en el FD), que son duras, de difícil degradación y poco nutritivas; esta situación puede estar favoreciendo el desarrollo de Scirtidae, debido a que estos se alimentan directamente de la hojarasca en descomposición al fragmentarla y hacerla obtenible para un nivel trófico inferior (Laessle, 1961; Ospina, 2004).
La presencia de larvas de Chironomidae fue mayor en el fragmento disturbado e inversa a las larvas de Scirtidae, lo cual disminuyó la competencia interespecífica por el recurso alimenticio y favoreció la dominancia de las mismas; adicionalmente, Laessle (1961) reportó que las larvas de la familia Chironomidae estaban relacionadas con lugares más luminosos; estas se veían beneficiadas por aumento en poblaciones de algas que le sirven como fuente de alimento. En el FD la temperatura en el día tiene una tendencia a ser mayor, debido a la estructura abierta de la vegetación, que favorece una mayor penetración de la luz.
Estos resultados muestran la probabilidad de que las familias Chironomidae y Scirtidae sean útiles como posibles bioindicadores de sistemas con diferentes grados de disturbio, por lo que se debe profundizar en el estudio de estos grupos, realizando muestreos por periodos de tiempo más extensos, que confirmen las tendencias aquí halladas en otros sistemas.
CONCLUSIONES
No hubo diferencias significativas en composición y abundancia de macroinvertebrados asociados a Guzmania mitis entre los fragmentos disturbado y conservado del robledal estudiado. Las únicas diferencias encontradas están entre las familias Scirtidae y Chironomidae. La abundancia de macroinvertebrados de las familias Scirtidae y Chironomidae es mayor en las bromelias de los fragmentos conservado y disturbado, respectivamente, y al parecer está relacionada con la mayor diversidad de material vegetal en FC, que favorecería a Scirtidae, y con la mayor entrada de luz y desarrollo de algas en las fitotelmas del FD, que favorecería a Chironomidae, por lo que se proponen estas dos familias como probables indicadores del grado de intervención en estos tipos de bosques.
La bromelia terrestre Guzmania mitis tiene la misma importancia como hábitat de muchas especies de macroinvertebrados que las bromelias epífitas estudiadas por otros autores en bosques de Colombia. Así lo demuestra el número de especies halladas, sus abundancias y los grupos funcionales que conforman, los cuales se mantienen por procesos de descomposición de la hojarasca hasta detritos y por las relaciones tróficas que conforman en la fitotelmata.
AGRADECIMIENTOS
Especiales agradecimientos a la Universidad Pedagógica y Tecnológica de Colombia por el apoyo logístico. A los profesores Fredy Molano Rendón por la confirmación en la determinación de algunas familias de insectos, a Daniel Galindo por los aportes hechos en el manejo estadístico de los datos. A Nelson Aranguren y Luis González por la revisión y sugerencias realizadas al documento
REFERENCIAS BIBLIOGRÁFICAS
Alba-Tercedor, J. (1996). Macroinvertebrados acuáticos y calidad de las aguas de los ríos. Almería: IV Simposio del Agua en Andalucía (SIAGA). 203-213 p. [ Links ]
Armbruster, P., Hutchinson, R., & Cotgreave, P. (2002). Factors influencing community structure in a South American tank bromeliad fauna. Oikos, 96(2), 225-234. [ Links ]
Bassett, M.Jr. (1963). The passive dispersal of small aquatic organisms and their colonization of isolated bodies of water. Ecological Monographs, 33(2), 161-185. [ Links ]
Begon, M., Townsend, C., & Harper, J. (2006). Ecology, from individuals to ecosystems (4th ed.). Malden-Oxford-Carlton: Blackwell publishing. 738 p. [ Links ]
Booth, R.G., Cox, M.L., & Madge, R.B. (1990). IIE Guides to insects of importance to man. 3. Coleoptera. Londes: International Institute of Entomology, The Natural History Museum. 384 p. [ Links ]
Borror, D.J., Triplehorn, C.A., & Johnson, N.F. (1989). An introduction to the study of insects (6th ed.). New York-Philadelphia: Saunders College Publisher. 875 p. [ Links ]
Brouard, O., Cereghino, R., Corbara, B., Leroy, C., Pélozuelo, L., Dejean, A., & Carrias, J.F. (2012). Ambientes de sotobosque influyen en la diversidad funcional de las comunidades de bromelias tanque. Freshwater Biology, 57, 815-823. [ Links ]
Corpoboyacá [Corporación Autónoma de Boyacá]. (2000). Esquema de ordenamiento territorial del municipio de Arcabuco. Tunja: Corpoboyacá. 405 p. [ Links ]
De Lyra, C.M. (2006). Análise da vegetação e da entomofauna de coleópteros ocorrentes em fragmentos de floresta serrana de brejo de altitude no estado da Paraíba. Paraíba: Universidade federal da Paraíba, Centro de ciências agrárias, Departamento de fitotecnia Programa de pósgraduação em agronomia. 102 p. [ Links ]
Estupiñán, L., & Muñoz, D. (1992). Estudio comparativo de la artropofauna presente en los receptáculos axilares de las epífitas Tillandsia turneri Baker en un bosque andino y Tillandsia complanata Bentham en un bosque subandino (Trabajo de pregrado, Biología). Bogotá: Universidad Nacional de Colombia, Facultad de Ciencias, Departamento de Biología. 22-100 p. [ Links ]
Frank, J., Sreenivasanb, S., Benshoffc, P.J., Deyrupd, M.A., Edwardse, G.B., Halberte, S.E., Hamone, A.B., Lowmanb, M.D., Mockfordf, E.L., Scheffrahng, R.H., Stecke, G.J., Thomase, M.C., Walkera, T.J., & Welbourn, W.C. (2004). Invertebrate animals extracted from native Tillandsia (Bromeliales: Bromeliaceae) in Sarasota Country, Florida. Florida Entomologist, 87(2), 10-35. [ Links ]
Greeney, H. (2001).The insects of plant-held waters: a review and bibliography. Journal of Tropical Ecology, 17, 241-260. [ Links ]
Herrera, Y. (2005). Diagnóstico y concertación del plan de manejo de la reserva forestal protectora "El Peligro". Tunja: Corporación Autónoma Regional de Boyacá. 705 p. [ Links ]
Holdridge, L.R., Grenke, W.C., Hatheway, W.H., Liang, T., & Tosi, Jr.-J.A. (1971). Forest enviroment in tropical life zones. New York: Pergamon Press. 747 p. [ Links ]
Kattan, G.H. (2002). Fragmentación: patrones y mecanismos de extinción de especies. En M. Guariguata & G. Kattan (eds.). Ecología y conservación de bosques neotropicales (pp. 561-590.). Cartago: Libro Universitario Regional. 691 p. [ Links ]
Kitching, R.L. (2000). Food webs and container habitats: The natural history and ecology of phytotelmata. New York: Cambridge University. 448 p. [ Links ]
Kitching, R.L. (2001). Food webs in phytotelmata: "bottom-up" and "top-down" explanations for community structure. Annual Review of Entomology, 46, 729-760. [ Links ]
Laessle, A. (1961). A microlimnological study of Jamaican bromeliads. Ecology, 42(3), 499-517. [ Links ]
Lasprilla, E. (2003). Entomofauna presente en los espacios interfoliares de la epifita Tillandsia complanata (Bromeliaceae) en un bosque altoandino del Parque Nacional Natural Pisba, Boyacá. Tunja. (Trabajo de pregrado, Biología). Tunja: Universidad Pedagógica y Tecnológica de Colombia-Escuela de Biología. 190 p. [ Links ]
Magurran, A. (1989). Diversidad ecológica y su medición. Barcelona: Vedrá. 202 p. [ Links ]
Marino, N., Srivastava, D., & Farjalla, V. (2012).The phytotelmata and foliage macrofauna assemblages of a bromeliad species in different habitats and seasons. Insect Conservation and Diversity, 3, 92-102. [ Links ]
Merritt, R.W., & Cummins, K.W. (eds). (1984). An introduction to the aquatic insects of North America. Dubuque: Kendall - Hunt Publishing Company, Dubuque iowa. 722 p. [ Links ]
Montero, G., Feruglio, S., & Barberis, I. (2010).The phytotelmata and foliage macrofauna assemblages of a bromeliad species in different habitats and seasons. Insect Conservation and Diversity, 3, 92-102. [ Links ]
Moreno, C.E. (2001). Métodos para medir la biodiversidad. M & T-Manuales y Tesis SEA (Vol. 1). Zaragoza: Sociedad Entomológica Aragonesa. 84 p. [ Links ]
Ospina, F. (2004). Comunidad de macroinvertebrados asociados a bromelias tipo tanque en dos fragmentos de bosque de montaña de la Cordillera Oriental. (Tesis de maestría, Ciencias Biológicas). Bogotá: Universidad de los Andes. 128 p. [ Links ]
Ospina, F., Betancur, J., & Realpe, E. (2004). Estructura y composición de la comunidad de macroinvertebrados acuáticos asociados a Tillandsia turneribaker (Bromeliacea) en un bosque altoandino colombiano. Acta Zoológica Mexicana, 20(1), 153-166. [ Links ]
Richardson, B. (1999). The bromeliad microcosm and the assessment of faunal diversity in a neotropical forest. Biotrópica, 31(2), 312-336. [ Links ]
Srivastava, D. (2006). Habitat structure, trophic structure and ecosystem function: interactive effects in a bromeliad-insect community. Oecologia, 149, 493-504. [ Links ]
Villareal, H., Álvarez, M., Córdoba, S., Escobar, F., Fagua, G., Gast, F., Mendoza, H., Ospina, M., & Umaña, A.M. (2004). Manual de métodos para el desarrollo de inventarios de biodiversidad. Programa Inventarios de Biodiversidad. Bogotá: Instituto de Investigación de Recursos Biológicos Alexander Von Humboldt. 236 p. [ Links ]
White, R.E. (1983). A field guide to the beetles of North America. The Peterson field guide series 29. Boston: Houghton Mifflin. 368 p. [ Links ]
Yanoviak, P. (2001a). Predation, resource availability, and community structure in neotropical water-filled tree holes. Oecologia, 126, 125-133. [ Links ]
Yanoviak, P. (2001b). The macrofauna of water-filled tree holes on Barro Colorado Island, Panamá. Biotrópica, 33 (1), 110-120. [ Links ]