Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombia Forestal
Print version ISSN 0120-0739
Colomb. for. vol.19 no.2 Bogotá July/Dec. 2016
https://doi.org/10.14483/udistrital.jour.colomb.for.2016.2.a02
Artículo de investigación
RECUPERACIÓN ECOLÓGICA DE ÁREAS AFECTADAS POR UN INCENDIO FORESTAL EN LA MICROCUENCA TINTALES (BOYACÁ, COLOMBIA)
Ecological recovery of affected areas by a forest fire in the Tintales watershed (Boyacá, Colombia)
Fernando Fernández-Méndez1, Verónica María Velasco-Salcedo2, Juanita Guerrero-Contecha3, Manuel Galvis4 & Andreza Viana Neri5
1 Grupo de investigación en biodiversidad y dinámica de ecosistemas, tropicales, Facultad de Ingeniería Forestal, Universidad del Tolima, Ibagué, Colombia fmendez@ut.edu.co. Autor de correspondencia.
2 Universidad del Tolima, Ibagué, Colombia. veronicamariavelascos@hotmail.com.
3 Universidad del Tolima, Ibagué, Colombia. jguerrerocontecha@gmail.com.
4 Universidad Pedagógica y Tecnológica de Colombia (UPTC). Tunja, Colombia. manuelgalvis@gmail.com.
5 Universidade Federal de Viçosa, Viçosa. Brasil. andreza.neri@ufv.br.
Fernández-Méndez, F., Velasco-Salcedo, V., Guerrero-Contecha, J., Galvis, M. & Viana-Neri, A. (2016). Recuperación ecológica de áreas afectadas por un incendio forestal en la microcuenca tintales (Boyacá, Colombia). Colombia Forestal, 19(2), 143-160.
Recepción: 11 de junio de 2015 / Aprobación: 8 de febrero de 2016
RESUMEN
La microcuenca Tintales, ubicada en el Santuraio de Fauna y Flora (SFF) de Iguaque, Boyacá, fue afectada por un incendio forestal. En esa área se evaluó la regeneración natural en 29 parcelas permanentes. Se evaluaron dos fitofisonomías, afloramiento rocoso y robledal para comparar riqueza, diversidad y dominancia, obteniéndose mayor riqueza y diversidad en afloramiento rocoso. La familia Asteraceae fue la que obtuvo mayor representatividad. Las especies con mayor dominancia fueron Hypoxis decumbens, Pteridium aquilinum y Andropogon bicornis. La diversidad en todo el muestreo fue baja y homogénea debido a la reiterada incidencia de incendios forestales que han ocasionado cambios en la estructura y composición de la vegetación. La vegetación encontrada no difiere sustancialmente de otros estudios reportados para esta zona de vida y la región, donde las dinámicas de uso de suelo son similares, con alta deforestación e incendios. La vegetación establecida después del incendio es dominada por especies colonizadoras y pioneras. En las dos fitofisonomías estudiadas después de un año del incendio se establecen dos comunidades vegetales con diferencias estadísticas significativas en riqueza y homogeneidad. Para iniciar procesos de restauraciÏn se recomienda usar como uno de los insumos las diferencias taxonómicas halladas entre robledal y afloramiento rocoso.
Palabras clave: Afloramiento rocoso, especies invasoras, regeneraciÏn natural, restauración ecológica, robledal.
ABSTRACT
The tintales watershed, located in the Santuario de Flora y Fauna (SFF) of Iguaque, Boyaca, was affected by a wildfire. In that area, the natural regeneration was evaluated in 29 permanent plots. Two phyto-physiognomies, a rocky outcrop and oak were evaluated to compare their richness, diversity and dominance, with rocky outcrop yielding a greater richness and diversity. The Asteraceae family was the one that obtained greater representation, with a dominance of species such as Hypoxis decumbens, Pterídium aquilinum and Andropogon bicornis. The diversity in the whole sampling was low and uniform due to the repeated incidence of forest fires that have caused changes in the structure and composition of vegetation. The vegetation found did not differ substantially from other studies reported for this ââlife zone and the region, where the dynamics of land use are similar, with high deforestation and fires. The vegetation established after the fire is dominated by colonizing and pioneering species. In the two phyto physiognomies studied after a year of the fire, two plant communities with statistically significant differences in wealth and homogeneity could be stablished. To start the restoration process, it is recommended to use as one of the inputs, the taxonomic differences found between oak and rocky outcrop.
Keywords: rocky outcrop, invasive species, natural regeneration, ecological restoration, oak.
INTRODUCCIÓN
Los bosques andinos oscilan entre 1000 y 3500 m de altitud en áreas tropicales (Rangel, 2000; Kapelle & Brown, 2001) y abarcan un conjunto diferenciado de ecosistemas, vertientes, cinturones altitudinales y exposiciones climáticas diversas, donde las áreas de bosque generalmente representan un porcentaje bajo en muchas cuencas, aún así, presentan concentraciones de biodiversidad y endemismos (Castaño, 2003; Brehm et al., 2008).
En los Andes colombianos hay 29 áreas protegidas de carácter nacional que representan el 9.1% de la región y han contribuido a la disminución de la deforestación y la incidencia de incendios (Rodríguez et al., 2012). Sin embargo, dichas áreas no están exentas de perturbaciones debido a dinámicas sociales y cercanía a poblaciones (Amaya-Villabona & Armenteas, 2012).
La región andina ha sido ampliamente modificada y su vulnerabilidad a incendios ha aumentado (Armenteras et al., 2011). Con el cambio climático es posible que algunas partes del bosque andino se tornen vulnerables a incendios forestales como consecuencia de la desecación (Young et al., 2011). Esto hace necesario conocer, conservar y restaurar ecosistemas de montaña por su función estratégica en la regulación del ciclo hidrológico y por albergar diversidad de flora y fauna (Kappelle & Horm, 2005).
La recuperación ecológica se define como el retorno de una población biológica o comunidad con algún aspecto de su condición inicial después de introducir un factor de estrés o perturbación (USEPA, 1998). En el caso de incendios, la recuperación de la vegetación depende del potencial biótico, sociodinámico e influyen factores como banco de semillas, individuos reproductores sobrevivientes y rebrotes con todos sus patrones de regeneración postquema (DAMA, 2000; Bohórquez, 2013).
Después de perturbaciones drásticas en los ecosistemas, la regeneración natural es el principal proceso que ayuda a recuperar la cobertura vegetal (SER, 2004). La regeneración natural es el proceso mediante el cual, a través del tiempo, se establecen o modifican la composición y estructura de la vegetacion en determinado lugar (Martins et al., 2012). El estudio de la regeneración natural permite comprender los mecanismos de cambios en la composición florística y estructural (Gómez & Burley, 1991).
Por otro lado, la restauración ecológica es el proceso de ayudar al reestablecimiento de un ecosistema que se ha degradado, dañado o destruido (SER, 2004), logrando así el reestablecimiento artificial total o parcial de los atributos ecológicos, estructurales y funcionales de un ecosistema a escala de tiempo humano, teniendo como referencia el estado de predisturbio (MAVDT & CONIF, 2006). La restauración busca recuperar las condiciones ambientales de vegetación, flora, fauna, clima, agua, suelo y microorganismos de un ecosistema perturbado (Jackson et al., 1995; DAMA, 2000). Por lo cual, caracterizar la regeneración establecida naturalmente diagnostica la capacidad de recuperación del ecosistema y se convierte en la base para proponer estrategias de restauración (SER, 2004).
El Santuario de Flora y Fauna (SFF) Iguaque es un área importante para la conservación de coberturas vegetales que prestan el servicio ecosistémico de regulación hídrica para la región de Villa de Leiva. Iguaque se ha caracterizado por presentar históricamente eventos de incendios forestales que han modificado, degradado y alterado el paisaje (MAVDT & UAESPNN, 2006) reduciendo significativamente el número de especies que inician los procesos de regeneración natural y que logran alcanzar estados sucesionales avanzados y así favorecer la regulación hídrica.
Los incendios forestales contribuyen de manera directa al incremento de la deforestación y dificultan el manejo sostenible de los ecosistemas (MAVDT et al., 2000; Armenteras & Rodríguez-Eraso, 2014). Esta situación se ha convertido en uno de los problemas ecológicos que sufren los ecosistemas (Pérez, 1987) y son una de las causas del deterioro y pérdida de flora y fauna en Colombia (MAVDT & CONIF, 2008). En febrero de 2010 se presentó un incendio forestal en el área del SFF de Iguaque con una duración de ocho días, dejando como resultado 1245 ha afectadas (MAVDT & UAESPNN, 2010).
En ese marco del efecto de los incendios en la sucesión vegetal, se plantean los objetivos del estudio: 1) caracterizar taxonómicamente la vegetación establecida naturalmente después de un incendio severo en la microcuenca Tintales; y 2) evaluar si existen diferencias significativas en la diversidad de las especies vegetales que surgen por regeneración natural después de un incendio forestal en dos fitofisonomías predominantes en la microcuenca Tintales, las cuales son vegetación en afloramiento rocoso y robledal. Aportando conocimiento básico que sirve como uno de los insumos para proponer procesos de restauración y rehabilitación en la región.
MATERIALES Y MÉTODOS
Área de estudio
El SFF Iguaque se localiza al oeste de la Cordillera Oriental en el departamento de Boyacá, en los municipios de Arcabuco, Chíquiza, Sáchica y Villa de Leyva, entre las coordenadas 5°36´02" N - 73°22´57 O" y 5°44´38" N - 73° 31´20" O (INDERENA, 1996). Tiene un área aproximada de 6960 ha con altitud entre 2400–3890 m de altitud (MAVDT & UAESPNN, 2007).
El sector afectado por el incendio de febrero de 2010 se ubica en la microcuenca Tintales, vereda Centro del municipio de Villa de Leyva y surte al acueducto del barrio El Carmen. La zona afectada va desde 2300–2850 m de altitud. El área de muestreo es de 50 ha correspondiente a la zona afectada por el incendio desde 2437 a 2731 m de altitud (UAESPNN, 2010).
Climáticamente presenta dos zonas bien diferenciadas, la zona norte con precipitación de 1600 mm año-1 y temperatura media anual de 12.7º C y la zona sur con 1000 mm año-1 y temperatura media anual de 16.5º C.
Recolección de datos en campo
Se realizó una salida de campo en junio de 2010, cuatro meses después de ocurrido el incendio, en la cual se caracterizó la zona afectada de la microcuenca Quebrada Tintales. Se verificó en la cartografía del plan de manejo a qué fitofisonomías correspondia el área quemada. Las parcelas permanentes de monitoreo (PPM) se distribuyeron en las márgenes derecha e izquierda aguas abajo de la quebrada Tintales y se seleccionaron al azar los sitios dentro de dos fitofisonomías previamente mapeadas en la zona por el plan de manejo de parque (UAESPNN, 2007) la primera vegetación en afloramiento rocoso (en adelante afloramiento rocoso) y la segunda vegetacion dominada por Quercus humboldtii (en adelante robledal), estas dos fitofisonomías se tomaron en cuenta debido a las diferencias marcadas que se tienen caracterizadas en cuanto a suelo, pendiente y vegetación establecida (figura 1).
Se establecieron 29 PPM, se estratificaron proporcionalmente al azar, 20 en afloramiento rocoso y nueve en robledal, ya que el robledal representa 30% del área objeto de estudio. En la margen derecha aguas abajo 10 en afloramiento rocoso y cinco en robledal, en la margen izquierda aguas abajo 10 en afloramiento rocoso y cuatro en robledal (Guerrero & Velasco, 2011).
Las PPM que se georreferenciaron fueron de tipo anidado de 5x5m (25 m2) con una subparcela de 2x2 m (4 m2). Se realizaron cuatro muestreos, cada dos meses durante ocho meses. En cada parcela de 25 m2 se registró la regeneración natural, teniendo en cuenta las plántulas, herbáceas, líquenes, arbustos, helechos, gramíneas, y se realizó el conteo de plántulas de cada especie, en el caso de las gramíneas se realizó el conteo de número de macollas y se estimó el porcentaje de cobertura en la parcela de 4 m2.
La determinación de especies se realizó mediante la comparación de registros fotográficos tomados en campo y con los especímenes colectados fuera del área del santuario, procesados en el Herbario del Instituto Alexander von Humboldt (IAvH) de Villa de Leyva, Herbario Universidad PedagÏgica y TecnolÏgica de Colombia (UPTC), Laboratorio de Dendrología y Herbario Toli de la Universidad del Tolima. Los nombres científicos fueron verificados en The Plant List vs1.1. (2013).
Análisis de datos
Se calcularon índices de Shannon (H’) y Simpson (D) (Magurran, 1988), para la diversidad total de la parcela de 25 m2 y se calculó la cobertura en porcentaje en la parcela de 4m2. Se realizaron pruebas de comparación de medias con el test t de Student con nivel de confianza del 95% de la regeneración natural de afloramiento rocoso y robledal a las variables trasformadas a logaritmo natural de riqueza de especies (S), número de individuos (N) y los índices de Shannon y Simpson del primer y último registro, el procesamiento se realizó con el paquete estadístico Infostat versión 2009 (Di Rienzo et al., 2009).
RESULTADOS
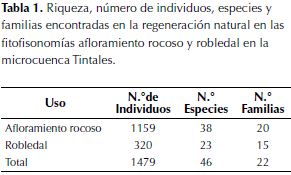
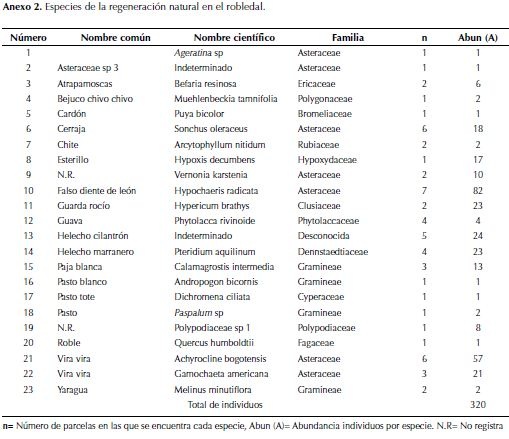
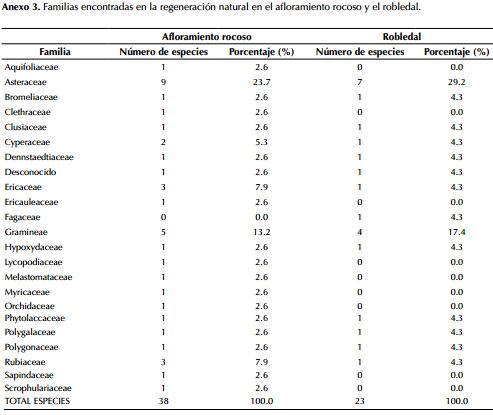
Se encontraron 1479 individuos correspondientes a 46 especies y 22 familias. Fue en afloramiento rocoso la cobertura de mayor riqueza con 1159 individuos, 38 especies y 20 familias. En robledal, mientras tanto, se encontraron 320 individuos distribuidos en 23 especies y 15 familias (tabla 1).
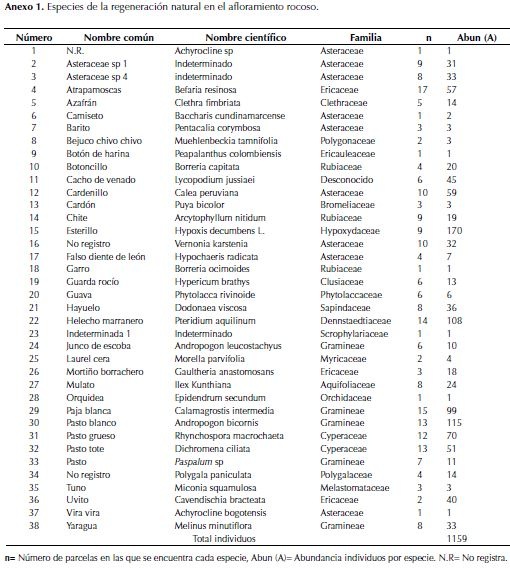
En afloramiento rocoso Befaria resinosa, Calamagrostis intermedia y Pteridium aquilinum se encuentran en un mayor número de parcelas, mientras que las especies Achyrocline bogotensis, Achyrocline sp., Epidendrum secundun, Borreria ocimoides y Paepalanthus colombiensis únicamente se presentaron en una parcela con un solo individuo. Las especies que presentan mayor número de individuos fueron Hypoxis decumbens, Andropogon bicornis y P. aquilinum con 170, 115 y 108 respectivamente (anexo 1).
En robledal dominan Hypochaeris radicata, Achyrocline bogotensis y Sonchus oleraceus, los cuales se encuentran en un mayor número de parcelas. Mientras que las especies Ageratina sp., Asteraceae 3sp., Puya bicolor, A. bicornis, Dichromena ciliata y Q. humboldtii únicamente se presentaron en una parcela con un solo individuo. Las especies que presentan mayor número de individuos fueron H. radicata y A. bogotensis con 82 y 57 respectivamente (anexo 2).
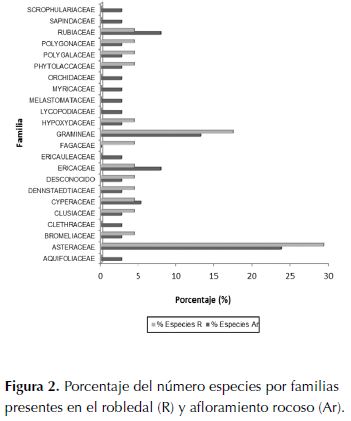
Las familias con mayor número de especies en afloramiento rocoso son Asteraceae, Poaceae, Rubiaceae y Ericaceae con 9, 5, 3 y 3 especies respectivamente. En robledal la familia que tiene mayor representatividad es Asteraceae con 7 especies y Poaceae con 4 especies. La familia Asteraceae representa el mayor porcentaje de presencia tanto en afloramiento rocoso como en robledal, siendo mayor en este último con un 29.2%, aparece luego la familia Poaceae con más representatividad en robledal (17.4%). En afloramiento rocoso las familias Rubiaceae y Ericaceae están representadas con un 7.9% (figura 2, anexo 3).
Se observó un proceso de regeneración de las coberturas vegetales sobre afloramiento rocoso a partir de rebrotes vegetativos de las especies Calea peruviana, Ilex kunthiana, Puya bicolor, Clethra fimbriata, Morella parvifolia, Befaria resinosa y Dodonaea viscosa, presencia de Pteridium aquilinum, Paramiflus glandulosus y gramíneas como Andropogon bicornis, Andropogon leucostachyus, Melinus minutiflora, Calamagrostis effusa y Calamagrostis intermedia. En los relictos boscosos de Q. humboldtii se registraron pocas especies vegetales entre las que se encuentran Hypochaeris radicata, P. aquilinum, musgos del género Bryum y Polytrichum juniperinum.
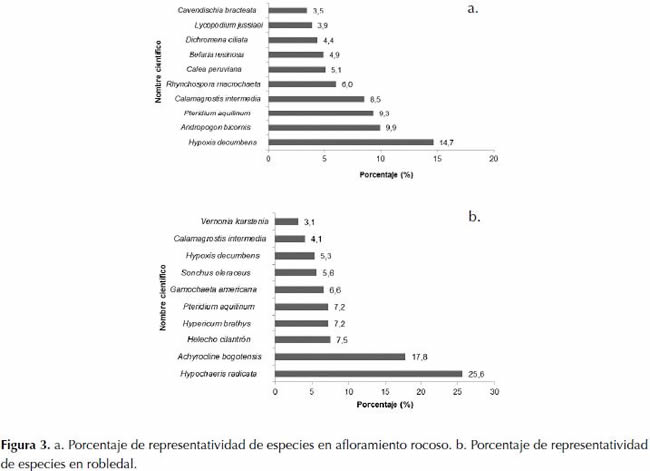
En cuanto a porcentaje de cobertura, en afloramiento rocoso se evidenció la dominancia de H. decumbens con 170 individuos correspondientes al 14.7% del total de los individuos presentes (1159), seguido por A. bicornis con 11 individuos representando el 9.9%, P. aquilinum con 108 individuos (9.3%), C. intermedia con 99 individuos (8.5%), las demás especies presentaron menos de 60 individuos, y especies como P. colombiensis, Achyrocline sp, Borreria ocimoides, A. bogotensis y E. secundun únicamente registraron 1 individuo (figura 3a).
La especie con mayor representatividad en robledal fue H. radicata con 82 individuos correspondientes a un 25.6%, seguido por A. bogotensis con 57 individuos representando el 17.6%, helecho cilantrón (Indeterminado) con 24 individuos (7.5%), P. aquilinum y H. brathys con 23 individuos (7.2%), se destaca en robledad la dominancia en la comunidad de una especie (figura 3b).
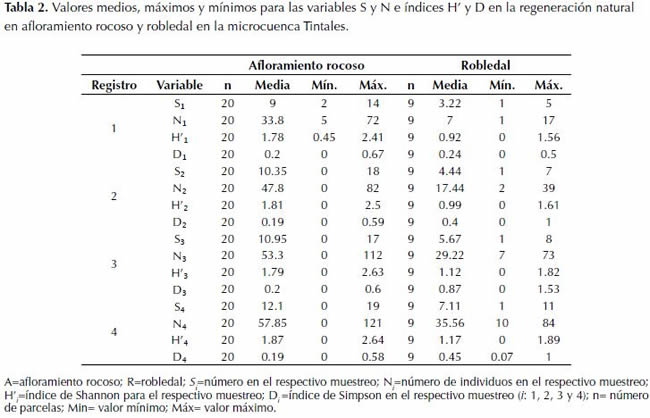
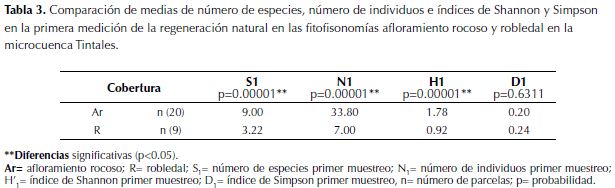
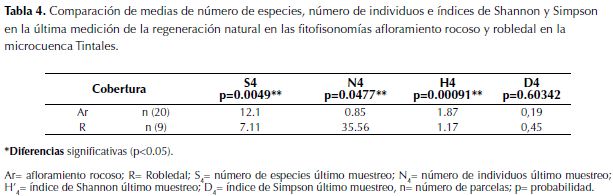
La regeneración natural evaluada mostró los valores promedios más altos en el afloramiento rocoso, en el cual se registró el mayor número de especies (S4) con 12.1 y número de individuos (N4) de 57.85. Para el caso del robledal los valores promedios correspondieron a S4 con 7.11 y N4 con 35.56. En cuanto a los índices de Simpson (D) se observa que en el último registro fue mayor en robledal (0.45) que en afloramiento rocoso (0.19). El indice de Shannon (H’) fue mayor en afloramiento rocoso con un valor promedio de 1.87 mientras que en robledal se observó un valor promedio de 1.17 menos heterogéneo (tabla 2).
Sonchus oleraceus, Gamochaeta americana y Solanum sp. únicamente se encontraron en robledal. Están presentes solamente en afloramiento rocoso las especies Pentacalia corymbosa, Cavendischia bracteata, Miconia squamulosa, Gaultheria anastomosans, Polygala paniculata y P. colombiensis (anexos 1 y 2).
En la comparación de medias se observa que el número de especies, número de individuos (N), e índice de Shannon (H’) presentan diferencias estadísticamente significativas (p<0.05) en la primera y la cuarta medición. El índice de Simpson (D) no muestra diferencias significativas, lo que determina comunidades igualmente inequitativas dominadas por pocas especies (tabla 3 y tabla 4).
DISCUSIÓN
La cobertura del afloramiento rocoso presentó los valores máximos en cuanto a número de especies e individuos registrados con respecto al robledal. Este comportamiento es típico en la asociación robledal por la dominancia de Q. humboldtii que hace que las demás especies encontradas sean escasas, lo que torna su diversidad baja (Marín & Betancur, 1997), en este ecosistema se reconoce una alelopatía observada que según Lozano & Torres (1974), representa una ventaja competitiva del roble sobre las otras especies, en este caso después del incendio se considera la sombra de los árboles muertos en pie como un factor que posiblemente influye en el establecimiento de la regeneración natural.
Algunos estudios han planteado que el número de especies por unidad de área aumenta en proporción inversa a la calidad del suelo (León et al., 2009). En este caso el afloramiento rocoso, donde los suelos presentes corresponden a suelos poco profundos limitados por la presencia de roca y en proceso de erosión que han perdido la capa laborable (MAVDT & UAESPNN, 2006), registraron los valores promedios más altos de número de individuos y especies, lo cual sugiere que en este caso de cambios en el suelo se presenta una relacion inversa entre la riqueza y el suelo a escala local. La relación suelo vegetacion a nivel local es importante para la restauración y según León et al., (2009) debe ser evaluada puntualmente, para conocer estos patrones, los cuales son importante en la conservación y manejo de la cobertura en los Andes.
De acuerdo con Farfán & Jiménez (2005), estas condiciones con afloramiento de roca pueden explicar el predominio de especies herbáceas perennes y de arbustos con un sistema de raíces bien desarrollado en xilopodio con amplios rangos de tolerancia a las condiciones ambientales y a las perturbaciones por el fuego. Por su composición florística, las coberturas estudiadas corresponden a una composición típica de la formación andina, que se caracterizan por presentar especies con dominancia notoria como H. decumbens, A. bicornis, P. aquilinum y C. intermedia (Cuatrecasas, 1958; León et al., 2009). Lo que muestra que efectivamente en la región el fuego ha sido factor determinante para moldear estas fitofisonomías de porte bajo y dominado por gramíneas, tal como se evidenció en este estudio.
La presencia de P. aquilinum en altos porcentajes, tanto en afloramiento rocoso como en robledal, está asociado a un aumento en la inflamabilidad de la comunidad, las plantas, por su variedad genética, traen propiedades únicas al ecosistema las cuales según Mutch (1970) pueden inhibir o estimular la inflamabilidad de la comunidad. Para Barrera et al. (2002), esta especie exótica se convierte en un agente tensionante que afecta la recuperación natural de los bosques, pues presenta atributos biológicos y fisiológicos que la convierte en especies susceptibles a promover incendios forestales. Stiling (1996) la considera invasora a nivel mundial; y su abundancia según Farfán & Jiménez (2005) se puede explicar porque posee mecanismos de reproducción sexual y asexual, una alta tasa reproductiva, dispersión anemófila, ciclo de vida corto, asociación con ambientes intervenidos por el hombre y su condición subcosmopolita.
Se registraron especies como A. bogotensis, B. bogotensis, H. radicata, P. corymbosa, C. bracteata, M. tamnifolia, P. aquilinum, C. fimbriata, M. parvifolia. M. squamulosa, P. bogotensis y géneros como Ageratina reportadas en zonas quemadas (Rangel & Aguirre, 1986; Farfán & Jiménez, 2005). Adicionalmente se encontraron especies como M. parvifolia, C. fimbriata. M. tamnifolia, y géneros como Pentacalia, Baccharis, Ageratina, Puya, Gaultheria, que según DAMA (2000), constituyen especies dinamogenéticas que gracias a sus atributos vitales, capacidad constructiva y sociabilidad pueden ayudar a restablecer áreas que han sido alteradas por disturbios principalmente de origen antrópico.
Una especie pionera que se observó regenerar a partir de rebrotes es B. resinosa, característica de los estadios tempranos de sucesión después de la dominancia de pastos y hierbas, luego de disturbios por quemas y pastoreo, con aptitud pionera en sustratos arenosos y cuchillas y terrenos muy expuestos, drenados y erosionados, suele encontrarse en canteras abandonadas (Barrera et al., 2002).
La presencia de especies como H. brathys, P. glandulosus en altitudes inferiores a 2500 m, evidencian el fenómeno conocido como sabanización paramizadora, lo cual según IAvH (1999) ha sido producto de la fragmentación de los bosques debido a la acción reiterada del fuego y la tala, que conlleva a la presencia de un mayor número de formaciones herbáceas y arbustivas, las cuales permiten la colonización y consolidación de especies de páramo en pastizales y matorrales a altitudes inferiores a 2300 m.
En cuanto al número de familias, en afloramiento rocoso se registraron 20, siendo la familia Asteraceae la de mayor representatividad con nueve especies correspondientes a un 23.7%, de igual forma esta fue la más representativa en robledal con un 30.4%, de las 14 familias registradas (tabla 5). Diversos estudios (Valencia & Jørgensen, 1992; Farfán & Jiménez, 2005; Alvear et al., 2010) coinciden en que dicha familia ha sido detectada dentro de las más importantes en los bosques andinos del Ecuador y Colombia.
Gentry (1992) afirma que la familia Asteraceae es típica de las selvas andinas entre los 2300 y 3700 m de altitud, cuya riqueza de especies la hace más importante dentro de estas áreas. De igual forma se reporta como la más representativa por Acosta-Calderón (2010), en el corredor de bosque ripario de Q. humboldtii de la microcuenca La Colorada SFF Iguaque, que se encuentra ubicada paralelamente a la microcuenca Tintales, donde se registraron 33 especies y 19 familias tras la incidencia del incendio ocurrido en febrero de 2010.
En el robledal, después de un año, domina la familia Asteraceae y Poaceae. No obstante, las familias que se esperarían encontrar con mayor representatividad en los relictos boscosos de Q. humboldtii corresponden a las familias Lauraceae, Myrtaceae y Melastomataceae, según la composición florística promedio de otros bosques altoandinos (Moscoso & Diez, 2005) en los cuales las lauráceas son el elemento predominante, así como también se reporta en diversos estudios la importancia de las familias Melastomataceae y Rubiaceae (Henderson et al., 1991; Gentry 1992; Giraldo, 1993). La ausencia de estas familias puede entenderse como el resultado de perturbaciones cuyo efecto varía de acuerdo con su magnitud, intensidad y tasa de ocurrencia, las cuales según Andrade (1993) y Vargas (2002) incluyen cambios geológicos y climáticos, además de algunos tipos de erosión, vientos y fuego.
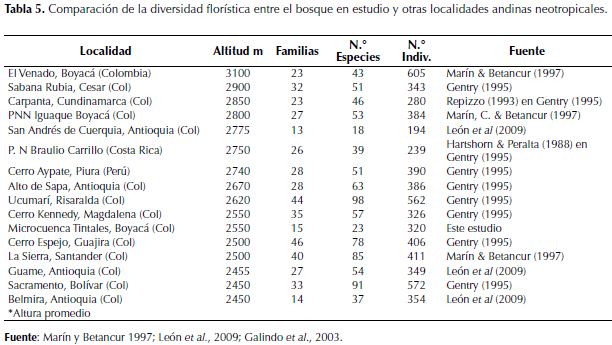
Al comparar los resultados del presente estudio con los obtenidos en localidades andinas neotropicales recopilados por Marín & Betancur (1997) y León et al. (2009) (tabla 5), se observa que bosques como El venado en Boyacá (3100 m), Ucumarí en Risaralda (2620 m) presentan diversidad de especies significativamente superior a las demás. Si se observa la diversidad florística de bosques de Colombia entre 2450 y 2550 m (tabla 5), se evidencia que el número de familias y especies con relación a los valores registrados en el presente estudio (15 familias y 23 especies) son bajos, siendo un poco aceptable los valores de número de individuos (320) cuyo rango se encuentra entre los 562 y 326 individuos, lo cual es justificable por el corto tiempo de recuperación de la cobertura evaluada, tan solo un año.
En cuanto al índice de diversidad de Shannon (H’), en afloramiento rocoso el valor promedio fue de 1.87 mayor que en Robledal 1.17, valor que indica según Marín & Betancur (1997) que la diversidad es baja, lo cual está correlacionado con la dominancia y abundancia de unas pocas especies dentro de la comunidad. Molano (1990), afirma que esa baja diversidad se puede relacionar con la ecología del paisaje y evolución, ya que históricamente los paisajes construidos por las sociedades en los Andes manifiestan distintos grados de intervención, desequilibrio, uso y degradación. Estos ecosistemas se han visto afectados reiteradamente por incendios forestales, factores como las condiciones del sitio, tipo e intensidad de perturbación, distancia al bosque original, fauna, topografía y clima local determinan la velocidad con la que las coberturas boscosas se recuperan (Saldarriaga, 1991; Finegan, 1996; Guariguata & Ostertag, 2001; Kennard, 2001; Yepes et al., 2010).
La historia de los sitios parece ser un factor determinante en la composición florística y la riqueza de especies, en cuanto que las perturbaciones localizadas según su frecuencia, tamaño y duración pueden inducir o afectar la regeneración natural de los sitios y la ocurrencia de especies (Denslow, 1980; Hartshorn, 1980). Los Andes centrales no son excepción a estos patrones de perturbación, en donde se destaca el fuego (León et al., 2009; Silva, 1999). En los bosques andinos el fuego tiene un importante efecto en la composición florística de las áreas degradadas, según Silva (1999), se presenta una reducción significativa en el número de especies que inician los procesos de regeneración natural cuando los incendios son renuentes, haciendo que la vegetación original sea reemplazada por una amplia proporción de especies colonizadoras de rápido crecimiento.
Aunque no se han establecido conclusiones generales exactas acerca de los efectos y la ecología de los incendios, los efectos asociados a estos, de acuerdo con Dwyer et al. (1998), están ligados a cada combinación de regiones, climas, asociaciones vegetales de bosques, tipos de suelos y especies de plantas que deben ser consideradas individualmente. Bremer & Ham (2002) afirman que el fuego incentiva la actividad biológica y Vega et al. (2000) estudiaron microorganismos en los primeros 5 cm de suelo cuando este es afectado por el fuego, encontrando aumento de los fijadores libres de nitrógeno. Tambien se ha determinando que el mayor factor afectado por los incendios en coberturas andinas es la materia orgánica del suelo; asimismo y se ha evidenciado que después de tres años de un incendio la materia orgánica no se ha recuperado en áreas del Parque Nacional Los Nevados (Camargo-Garcia et al., 2012) lo cual debe influir considerablemente en el filtraje ambiental de las especies en la regeneración natural, convirtiendo este tema en un potencial importante para seguir investigando el efecto del fuego en las sucesiones de los Andes colombianos.
Los eventos de fuego benefician especies y formaciones pioneras y secundarias, más colonizadoras, resistentes o ligadas al fuego (especies pirogénicas), como M. parvifolia, P. bicolor, A. bicornis entre otras (MAVDT & UAESPNN, 2006), también se ha reportado Ulex europaeus como especie que facilita el desarrollo del fuego (Armenteras et al., 2011). Otros factores que han incidido en la fragmentación generalizada y el creciente deterioro de estos ecosistemas, se relacionan con la gran potencialidad de los robledales para la extracción de madera y el aumento de la frontera agrícola (Galindo et al., 2003). Lo que se manifiesta en una alta degradación y pérdida paulatina de diversidad, generando cambios graves en la composición y estructura de las comunidades vegetales (Alzate et al., 2001), todas estas dinámicas hacen que los ecosistemas de la zona de Iguaque sean prioritarios para procesos de restauración ecológica y monitoreo a largo plazo.
Finalmente, es de destacar que la condición de amenaza que presentan los ecosistemas de bosque altoandino y páramo, debido a su baja resiliencia, alta fragilidad, alta densidad poblacional de la zona y el fuego, cuyo patrón ha sido intensificado por el hombre, esta contribuyendo en gran medida a la transformación de estos ecosistemas (Andrade, 1993; Etter, 1993; Armenteras & Rodríguez-Eraso, 2014), dicha transformación se evidenció claramente en este estudio, donde se mostró que las dos comunidades estudiadas difieren, obedeciendo a las propiedades y oferta ambiental de los dos ecosistemas previos al incendio. Estos factores conducen a procesos sucesionales contrastantes y por tal razón deben ser tratadas de modo individual al momento de desarrollar actividades de restauración.
CONCLUSIONES
La vegetación establecida después del incendio forestal en la microcuenca Tintales esta dominada por especies colonizadoras y pioneras, que se han adaptado a la historia de uso del suelo de los Andes, moldeada por una perturbación antrópica típica en la región en la cual se destacan los incendios. La presencia de P. aquilinum en altos porcentajes en las dos coberturas evaluadas hace que la vegetación que se recupera después del incendio sea una comunidad que tienda a la homogeneidad y permanece asociada a un aumento en la inflamabilidad de la comunidad, lo que la hace vulnerable año a año a los incendios.
La regeneración natural registrada en afloramiento rocoso y el robledal, presentó diferencias significativas en el número de especies, número de individuos e índice de Shannon, siendo más altos los valores promedios registrados en afloramiento rocoso. Estas diferencias deben ser tomadas en cuenta para el diseño de medidas y actividades de restauración en la zona, ya que las condiciones biofísicas de cada cobertura determinan el éxito de dichas actividades. Se recomienda monitorear a largo plazo estas coberturas para generar lineamientos de recuperación y ecosistemas de referencia para la región.
Finalmente, la vegetación caracterizada después de un año del incendio sirve como apoyo a la línea base para iniciar una eventual restauración y demuestra que es importante fomentar la restauración pasiva para aprovechar la capacidad de recuperación que tiene la vegetación local, ayudando a recuperar la comunidad vegetal mediante procesos naturales. Esto permitirá hacer diseños de restauración que aprovechen las condiciones generedas por la recuperación ecológica durante períodos de un año o más.
AGRADECIMIENTOS
Los autores agradecen a la Unidad Administrativa Especial Sistema de Parques Nacionales Naturales, funcionarios del SFF de Iguaque. José Gregorio Velasco Cordero. Instituto Alexander von Humboldt, directivos y personal administrativo del Herbario de Villa de Leyva. Herbario y Biblioteca Jorge Palacios Preciado de la Universidad Pedagógica y Tecnológica de Colombia-UPTC. CORPOBOYACÁ por el apoyo logístico. A los dos evaluadores anónimos quienes con sus recomendaciones, preguntas y discusión, enriquecieron la consistencia del manuscrito.
REFERENCIAS BIBLIOGRÁFICAS
Acosta-Calderón, A. (2010). Descripción de la vegetación riparia post-incendio 4 meses después del disturbio de febrero del 2010, microcuenca la Colorada, municipio Villa de Leyva, Colombia. (Trabajo de pregrado, Ecología). Bogotá: Pontificia Universidad Javeriana. 98p. [ Links ]
Alvear , M., Betancur, J. y Franco, P. (2010). Diversidad florística y estructura de remanentes de bosque andino en la zona de amortiguación del Parque Nacional Natural Los Nevados, Cordillera Central Colombiana. Caldasia, 32(1), 39-62. [ Links ]
Alzate, F., Cardona, F. & Callejas, R. (2001). Diversidad y composición de epífitas vasculares en robledales de Antioquía, Colombia. Actualidades Biológicas, 23(74), 25-31. [ Links ]
Amaya-Villabona, D. & Armenteras-Pacual, D. (2012). Incidencia de Incendios Sobre la Vegetación de Cundinamarca y Bogotá D.C. (Colombia), entre 2001 y 2010. Acta Biológica Colombiana, 17(1), 143-158. [ Links ]
Andrade, G.I. (1993). Paisaje y biodiversidad en las selvas de los Andes. En: Andrade, G. (ed.). Carpanta, selva nublada y páramo. Ecología y conservación de un sistema alto andino. (pp. 31-47). Bogotá: Fundación Natura. [ Links ]
Armenteras, D. & Rodríguez-Eraso N. (2014) Dinámicas y causas de deforestación en bosques de latino américa: una revisión desde 1990. Colombia Forestal, 17(2), 233-246. [ Links ]
Armenteras-Pascual, D., Retana-Alumbreros, J., Molowny-Horas, R., Roman-Cuesta, R. M., Gonzalez-Alonso, F., & Morales-Rivas, M. (2011). Characterising fire spatial pattern interactions with climate and vegetation in Colombia. Agricultural and Forest Meteorology, 151(3), 279-289. [ Links ]
Barrera, J., Ríos, H. & Pinzón, C. (2002). Planteamiento de la propuesta de restauración ecológica de áreas afectadas por el fuego y/o invadidas por el retamo espinoso (Ulex europaeus L) en los cerros de Bogotá D.C. Pérez Arbelaezia, 6(13), 55-71. [ Links ]
Bohórquez, D.C . (2013). Determinación del Potencial de Restauración Ecológica en el Parque Nacional Enrique Olaya Herrera, II Etapa. Colombia Forestal, 16(2), 200-215. [ Links ]
Brehm, G., Homeier, K., Fiedler, I., Kottke, J., Illug, N., Noske, F. & Werner, S. (2008). Mountain Rain Forests in Southern Ecuador as a Hotspot of Biodiversity – Limited Knowledge and Diverging Patterns. Ecological Studies, 198(1), 15-23. [ Links ]
Bremer, D.J. & Ham, J.M. (2002). Measurement and modeling of soil co2 flux in a temperate grassland under mowed and burned regimes. Ecological Applications, 12, 1318-1328. [ Links ]
Camargo-Garcá, J.C., Dossman, M.A., Rodríguez, J.A., árias, L.M. & Galvis-Quintero, J.H. (2012). Cambios en las propiedades del suelo, posteriores a un incendio en el Parque Nacional Natural de Los Nevados, Colombia. Acta Agronómica, 61(2), 151-165. [ Links ]
Cardona, P.L. (2007). Biodiversidad: Todas las claves de la biodiversidad. Barcelona: Océano, DL. 207p [ Links ]
Castaño, C. (2003). Colombia Altoandina y la significancia ambiental del bioma páramo en el contexto de los Andes Tropicales: Una aproximación a los efectos futuros por el cambio global (Global Climatic Tensor). Recuperado de: https://rubielmontoya.files.wordpress.com/2014/08/capitulo1.pdf. [ Links ]
Cuatrecasas, J. (1958). Aspectos de la vegetación natural de Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 10(40), 221-264. [ Links ]
Denslow, J. (1980). Gap partitioning among tropical rainforest trees. Biotropica, 12, 47-55. [ Links ]
Departamento Técnico Administrativo del medio ambiente (DAMA) . (2000). Protocolo Distrital de Restauración Ecológica. Guía para la Restauración de ecosistemas nativos para áreas rurales de Bogotá D.C. (1a. Ed.). Bogotá D.C., Colombia, 288p. [ Links ]
Di Rienzo, J.A., Casanoves, F., Balzarini, M.G., Gonzalez, L., Tablada, M. & Robledo, C.W . (2009) InfoStat versión 2009. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. [ Links ]
Dwyer, E., Grégoire, J. & Malingreau, J. (1998). A Global Analysis of Vegetation Fires Using Satellite Images. Spatial and Temporal Dynamics. Ambio, 27(3), 175-181. [ Links ]
Etter, A. (1993). Diversidad Ecosistémica en Colombia hoy. En Cárdenas, S & Correa, H.D. (eds.). Nuestra Diversidad Biológica (pp. 47-66). Bogotá: Fundación Alejandro ángel Escobar-CEREC. 296p. [ Links ]
Farfán, S.Y. & Jiménez, M.C. (2005). Estudio comparativo de la vegetación y algunos atributos edáficos entre áreas quemada y no quemada en una zona de Bosque altoandinos del Santuario de Fauna y Flora de Iguaque Boyacá- Colombia (Trabajo de pregrado, biología). Tunja: Universidad Pedagógica y Tecnológica de Colombia. 125p. [ Links ]
Finegan, B. (1996). Pattern and process in neotropical secondary rain forest: the first 100 years of succession. Trends in Ecology & Evolution, 11, 119-124. [ Links ]
Galindo, T.R., Betancur, J. & Cadena M.J. (2003). Estructura y Composición Florística de cuatro Bosques Andinos del Santuario de Flora y Fauna Guanentá Alto Río Fonce, Cordillera Oriental Colombiana. Caldasia, 25(2), 313-335. [ Links ]
Gentry, A.H. (1992). Diversity and floristic composition of Andean forest of Peru and adjacent contries: implication for their conservation. Memorias del museo de historia natural, U.N.M.S.M., 21, 11-29. [ Links ]
Giraldo, D. (1993). Estructura y composición de un bosque secundario fragmentado en la cordillera central, Colombia. En Churchill, S.P., Balslev, H. Forero, E. & Luteyn, J.L. Neotropical Montane Forests: Biodiversity and Conservation (pp. 159-167). U.S.A.: The New York Bot. 112p. [ Links ]
Gómez, A. & Burley, F.W. (1991). The management of natural tropical forest. En: Gómez-Pompa, A., Whitmore, T.C. & Handley, M. Rain Forest Regeneration and Management (pp. 3-18). Paris, Francia: UNESCO. [ Links ]
Guariguata, M. & Ostertag, R. (2001). Neotropical secondary forest successions: changes in structural and functional characteristics. Forest Ecology and Management, 148, 185-206. [ Links ]
Guerrero-Contecha J. & Velasco-Salcedo V.M. (2011). Efecto del enriquecimiento con encenillo Weinmannia tomentosa L.F sobre la regeneración natural en el sector afectado por un incendio forestal, en la microcuenca Tintales, Santuario de Fauna y Flora de Iguaque, departamento de Boyacá. (Trabajo de pregrado, Ingeniería Forestal) Ibagué: Universidad del Tolima. 139p. [ Links ]
Hartshorn, G. (1980). Neotropical forest dynamics. Biotropica, 12, 23-30. [ Links ]
Henderson, A., Churchill, S. & Luteyn, J. (1991). Neotropical plant diversity. Nature, 351, 21-22. [ Links ]
Instituto de Investigación de Recursos Biológicos Alexander von Humboldt (IAvH). (1999). La cobertura vegetal del municipio de Villa De Leyva. Bogotá D.C., Colombia: Instituto Alexander von Humboldt. 141p. [ Links ]
Instituto Nacional de los Recursos Naturales Renovables y del Ambiente (INDERENA) . (1996). Delineamientos generales para el plan de manejo del Santuario de Fauna y Flora de Iguaque (1a. ed.). Bogotá D.C., Colombia. 55p. [ Links ]
Jackson, L., Lopoukhine, N. & Hillyard, D. (1995). Ecologycal restauration: A definition and comments. Restoration Ecology, 3, 71-75. [ Links ]
Kappelle, M. & Brown, A. D. (Eds.). (2001). Bosques Nublados del Neotrópico. Santo Domingo de Heredia, Costa Rica. INBio Press, 698p. [ Links ]
Kappelle, M. & Horn, S. P. (Eds.). (2005). Páramos de Costa Rica. Santo Domingo de Heredia, Costa Rica: INBio Press. 605p. [ Links ]
Kennard, K. (2001). Secondary forest succession in a tropical dry forest: patterns of development across a 50-year chronosequence in lowland Bolivia. Journal of Tropical Ecology, 18(1), 53-66. [ Links ]
León, J., D., Vélez, G. & Yepes, A.P. (2009). Estructura y composición florística de tres robledales en la región norte de la cordillera central de Colombia. Revista de Biología Tropical, 57(4), 1165-1182. [ Links ]
Lozano, G. & Torres, J. (1974). Aspectos generales sobre la distribución, sistemática fitosociológica y clasificación ecológica de los bosques de robles (Quercus) en Colombia. Ecología Tropical, 1(2), 45-79. [ Links ]
Magurran, A. (1988). Ecological Diversity and its Measurement. Princeton University, Princeton, NJ. 179p. [ Links ]
Marín, C. A. & Betancur, J. (1997). Estudio florístico en un robledal del Santuario de Flora y Fauna de Iguaque (Boyacá, Colombia). Revista Academia Colombiana, 21(80), 249-259. [ Links ]
Martins, S.V., Rodrigues, R.R., Gandolfi, S. & Calegari, L. 2012. Sucessão Ecológica: Fundamentos e Aplicações na Restauração de Ecossistemas Florestais. Em: Martins, S. V. (ed) Ecologia de Florestas Tropicais do Brasil. MG Viçosa. BR. (21-52). [ Links ]
Ministerio de Ambiente Vivienda y Desarrollo Territorial (MAVDT) & Corporación Nacional de Investigación y Fomento Forestal (CONIF) . (2006). Protocolo de restauración de coberturas vegetales afectadas por incendios forestales. (1a. ed.) Bogotá D.C., Colombia: Intersolugráficas Ltda. 59p. [ Links ]
Ministerio de Ambiente Vivienda y Desarrollo Territorial (MAVDT) & Unidad Administrativa Especial Sistema de Parques Nacionales Naturales (UAESPNN) . (2007). Plan de manejo del Santuario de Fauna y Flora Iguaque, Documento ejecutivo. Bogotá D.C., Colombia: Alen-Impresores. 30p. [ Links ]
Ministerio de Ambiente, Vivienda y Desarrollo Territorial (MAVDT) & Corporación Nacional de Investigación y Fomento Forestal (CONIF). (2008). Guía para la formulación de planes de contingencia en incendios forestales (1a. ed.). Bogotá D.C., Colombia. 37p. [ Links ]
Ministerio de Ambiente, Vivienda y Desarrollo Territorial (MAVDT) & Unidad Administrativa Especial Sistemas Parques Nacionales Naturales (UAESPNN). (2010). Evaluación de impacto ambiental del incendio presentado en febrero de 2010 en el Santuario de Fauna y Flora Iguaque (1a. ed.). Villa de Leyva, Colombia. 45p. [ Links ]
Ministerio de Medio Ambiente Vivienda y Desarrollo MAVDT & Unidad Administrativa Especial Sistema de Parques Nacionales Naturales (UAESPNN). (2006). Plan de manejo del Santuario de Flora y Fauna Iguaque, Versión 2006 corregida para ser aprobada por resolución. Bogotá D. C., Colombia. 379p. [ Links ]
Ministerio del Medio Ambiente (MINAMBIENTE), Ministerio de Comercio Exterior, Ministerio de Desarrollo Económico, Departamento Nacional de Planeación, Ministerio de Agricultura y Desarrollo Rural & Corporación Nacional de Investigación y Fomento Forestal (CONIF) . (2000). Plan Nacional de Desarrollo Forestal. Bogotá D.C., Colombia. 71p. [ Links ]
Molano, J. C. (1990). Villa de Leyva: ensayo de interpretación social de una catástrofe ecológica (Trabajo de grado, maestría). Universidad de Los Andes, Bogotá D.C. 279p. [ Links ]
Moscoso, L. B. & Diez, M. C. (2005). Banco de semillas en un bosque de roble de la Cordillera Central Colombiana. Revista Facultad Nacional de Agronomía, 58(2), 2931-2943. [ Links ]
Mutch, R. (1970). Wildfires and Ecosystems - A Hypothesis. Ecology, 51(6), 1046-1051. [ Links ]
Pérez, F.L. (1987). Soil Moisture and the Upper Altitudinal Limit of Giant Paramo Rosettes. Journal of Biogeography, 14(2), 173-186. [ Links ]
Rangel, J. O. & Aguirre, J. (1986). Estudios ecológicos en la Cordillera Oriental colombiana III. La vegetación de la Cuenca del Lago Tota. Caldasia, 15(71-75), 263-311. [ Links ]
Rangel, J.O. (2000). Colombia Diversidad Biótica III. La región de vida paramuna. Bogotá D.C., Colombia: Instituto de Ciencias Naturales & Instituto Alexander von Humboldt. 901p. [ Links ]
Rodríguez, N., Armenteras, D., & Retana, J. (2012). Effectiveness of protected areas in the Colombian Andes: deforestation, fire and land-use changes. Regional Environmental Change, 13(2), 423-435. [ Links ]
Saldarriaga, J. G. (1991). Estudios en la Amazonía colombiana V: Recuperación de la Selva de "Tierra Firme" en el alto río Negro Amazonía colombiana-venezolana. Bogotá D.C., Colombia: TROPENBOS Colombia. 201p. [ Links ]
Silva, M. (1999). Notas sobre afectación a la conservación de ecosistemas estratégicos por la ocurrencia de incendios forestales en las áreas del Sistema de Parques Nacionales de Colombia. Bogotá D.C., Colombia: Unidad Administrativa Especial Sistema de Parques Nacionales Naturales. 60p. [ Links ]
Society for Ecological Restoration (SER) International, Grupo de trabajo sobre ciencia y políticas. (2004). Principios de SER International sobre la restauración ecológica. Recuperado de: www.ser.org [ Links ]
Stiling, P. (1996). Ecology theories and applications. New Jersey, U.S.A.: Prentice hall. 638p. [ Links ]
The Plant List (2013). Versión 1.1. Recuperado de: http://www.theplantlist.org/. [ Links ]
Unidad Administrativa Especial Sistema de Parques Nacionales Naturales (UAESPNN) . (2010). Resumen ejecutivo Plan de Manejo Parque Nacional Natural Los Nevados, 2005-2009. Colombia. 39p. [ Links ]
USEPA . (1998). Guidelines for Ecological Risk Assessment. Federal Registry 63, 26845-26924. CRC Press, NW. USA. 899p. [ Links ]
Valencia, R. & Jørgensen, P.M. (1992). Composition and structure of a humid montane forest on the Pasachoa volcano, Ecuador. Nordic Journal of Botany, 12, 239-247. [ Links ]
Vargas, O. (2002). Disturbios, patrones sucesionales y grupos funcionales de especies en la interpretación de matrices del paisaje en los páramos. Pérez Arbelaezia, 6(13), 73-89. [ Links ]
Vega, J. A., Landsberg, J., Bará, S., Paysen, T., Fontúrbel, M. T. & Alonso, M. (2000). Efectos del fuego prescrito bajo arbolado de P. pinaster en suelos forestales de Galicia y Andalucía Recuperado de: http://www.secforestales.org/buscador/pdf/c9-acta12.pdf. [ Links ]
Yepes, A., Del Valle, J.I., Jaramillo, S.L. & Orrego, S.A. (2010). Recuperación estructural en bosques sucesionales andinos de Porce (Antioquia, Colombia). Revista de Bilogía Tropical, 58(1), 427-445. [ Links ]
Young, B., Young, K.R. & Josse, C. (2011). Vulnerability of Tropical Andean Ecosystems to Climate Change. En: Herzog, S.K., Martinez, R., Jorgensen, P.M. & Tiessen, H. (eds), Climate Change and Biodiversity in the Tropical Andes. SCOPE, IAI. (pp. 170–181). [ Links ]
ANEXOS