INTRODUCCIÓN
Mauritia flexuosa es una palma característica de Suramérica que forma extensos palmares conocidos como morichales, cananguchales, aguajales, achuales o buritizales (Kahn & de Granville, 1992). En Colombia, se distribuye en la Amazonía y la Orinoquía, donde se conoce como palma de moriche, aguaje, canangucha o mirití (Marmolejo et al., 2008). Se caracteriza por ser una especie dioica de tallo solitario que alcanza alturas de hasta 25 m y diámetros de hasta 60 cm (Kahn & de Granville, 1992; Galeano & Bernal, 2010). Crece en suelos ácidos con alta saturación de agua (Bernal & Galeano, 2013), para lo cual ha desarrollado un sistema de raíces aéreas (neumatóforos) y subterráneas que le permiten sobrevivir a las condiciones anaeróbicas de los suelos inundados (Kahn & de Granville, 1992).
Es una especie pionera de gran densidad en las comunidades de palmares (Kahn & de Granville, 1992) y coloniza áreas de relieve semicóncavo saturadas de agua a través de agrupaciones de propágulos, los cuales crecen simultáneamente hasta formar un dosel continuo. En consecuencia, los individuos adultos cambian gradualmente las condiciones ambientales por cierre del dosel, y el alto aporte de materia orgánica se colmata en el suelo en gruesas capas, lo cual crea ambientes propicios para el establecimiento de otras especies vegetales (González-B & Rial, 2011; Bernal & Galeano, 2013).
Dichas condiciones bióticas y abióticas son consideradas como el principal factor para el crecimiento de la especie, pues eventos como la formación de espádices y la maduración de los frutos requieren de una alta radiación solar y máximos niveles de precipitación (Freitas et al., 2021). Sin embargo, con el aumento de la densidad, disminuye la filtración de luz solar en los estratos bajos y reduce el reclutamiento (González-B & Rial, 2011), lo cual, de acuerdo con González-B. (1987) (citado en Fernández, 2007) eventualmente da origen a un bosque. Estos procesos suelen desarrollarse en grandes periodos de tiempo -por ejemplo, el tiempo que tarda la especie en completar el ciclo fenológico es de un año (Núñez & Carreño, 2013), el periodo germinativo es de un año y dos meses (Ponce et al., 1999) y la producción está entre 6 a 8 hojas por año (Kahn & de Granville, 1992).
Los morichales constituyen un gran reservorio de carbono debido a su alto aporte de materia orgánica (Bernal & Galeano, 2013; González-B, 2016). Así mismo, tienen un importante rol en la disponibilidad del recurso hídrico durante todo el año, pues mantienen flujos de agua subterránea mediante retención gradual en la superficie (González-B & Rial, 2011). Además, proporcionan hábitats y recursos a numerosas especies silvestres (Ponce, 2002; Lasso et al., 2016). Igualmente, tienen gran valor para las comunidades humanas, que reportan el uso de las hojas para techos y artesanías, de la pulpa de los frutos y el aceite de las semillas como parte de su dieta alimenticia y de peciolos y fibras en la construcción de puertas, muebles, cuerdas y hamacas, entre otros (Sampaio et al., 2008). Sin embargo, los impactos antrópicos han aumentado la fragilidad ambiental de los morichales. Un ejemplo de esto es el aprovechamiento intensivo con técnicas no sostenibles, que ocasionan perjuicios a las comunidades de morichal, sobre las cuales no existe ningún tipo de protección (Lasso et al., 2013).
La información biológica para la conservación de la especie en Colombia es aún incipiente, como consecuencia de los escasos estudios poblacionales, pues se han enfocado en el manejo y uso (Virapongse et al., 2017). En Brasil resaltan las publicaciones de Cardoso et al. (2002), quienes se enfocan exclusivamente en la estructura poblacional. Otros autores han analizado los factores de regeneración (De Souza, 2013), la estructura etaria en diferentes grados de antropización (Resende et al., 2012), los impactos en la cosecha (Sampaio et al., 2008) y los usos de la especie (Soares, 2009). En Ecuador, Holm et al. (2008) estimaron la tasa de crecimiento poblacional para evaluar escenarios de cosecha en poblaciones de la Amazonía ecuatoriana. En Colombia, Escamilla y Bustos (2018) compararon poblaciones de la Orinoquía colombiana para determinar el aprovechamiento de las hojas de la especie. Por su parte, Isaza et al. (2017), a partir de modelos de proyección integral, analizaron rasgos demográficos para plantear alternativas de manejo y aprovechamiento en la Amazonía, mientras que Zamora et al. (2016) analizaron la dinámica poblacional a partir de proyecciones para determinar el estado de conservación de la especie en el territorio amazónico colombiano. Finalmente, en la frontera colombo-peruana, Freitas et al. (2020) se plantearon generar información poblacional para proponer alternativas de manejo sostenible.
Por lo anterior, esta investigación tuvo por objetivo de determinar la estructura poblacional de M. flexuosa en un área conservada en el municipio de Puerto Gaitán, Meta, Colombia, con el fin de aumentar el conocimiento de los ecosistemas de morichal y así contribuir a la conservación y diseño de estrategias de recuperación en áreas degradadas.
MATERIALES Y MÉTODOS
Este estudio se realizó en el mes de marzo de 2021 en la Finca Manacacías de la Universidad de los Llanos, localizada en el municipio de Puerto Gaitán del departamento del Meta, con coordenadas 4°10'19.4'' latitud norte - 72°2'31.8'' longitud oeste y un rango altitudinal entre los 163 y los 195 m. Es un área conservada que hace parte de la región de la altillanura, caracterizada por un sistema de lomeríos y planicies ligeramente planos a ondulados, con zonas bajas o interfluvios condicionados al encharcamiento temporal por inundación estacional debido al proceso de escurrimiento en temporada de lluvia (Rangel-Ch et al., 2019). La temperatura de la zona fluctúa entre los 20 y los 34 °C, con precipitación media anual de 2230 mm y dos temporadas bien marcadas: una seca (diciembre a marzo) y una húmeda (abril a noviembre) (Duque, 2020).
Para el análisis de la estructura poblacional, se seleccionaron tres sectores. En cada uno se establecieron dos transectos de 20 x 50 m a lo largo del morichal, desde el borde hacia el interior, perpendiculares al flujo de la corriente. En los transectos 1 y 2 (T1 y T2) se observaron suelos permanentemente inundados con varios flujos de agua y sotobosque denso; los transectos T3 y T4 presentaron inundación cerca de las corrientes de agua y vegetación con mayor cobertura del dosel. En los transectos T5 y T6, se observó suelo principalmente seco, cubierto por capa de hojarasca de vegetación leñosa y sotobosque poco denso. En cada transecto se contaron todos los individuos de M. flexuosa y se midieron las variables de altura total (estimada de forma indirecta con un clinómetro), número de hojas y número de pinnas (solo por un lado de la hoja). Adicionalmente, para los individuos adultos se registró la altura del estípite (estimada de forma indirecta con un clinómetro) y el número de estructuras reproductivas (bráctea, inflorescencia o infrutescencia). Con lo anterior, teniendo en cuenta la división básica sugerida por Bernal y Galeano (2013) para las palmas de Colombia y lo establecido por Isaza et al. (2013) para la especie en la Amazonía colombiana, se definieron cuatro clases de tamaño: plántulas (individuos sin estípite con ≤7 pinnas a un solo lado de la hoja), juveniles I (individuos con entre 8 y ≥31 pinnas a un solo lado de la hoja, sin estípite), juveniles II (con estípite ≤4, sin estructuras reproductivas) y adultos (individuos con estípite y evidencia de estructuras reproductivas).
Asimismo, se calculó el patrón de distribución a través del método de muestreo propuesto por Byth & Ripley (1980) con ayuda de transectos lineales de 50 m, dividido en cinco puntos separados por una distancia de 10 m. En cada punto, se midió la distancia al individuo (x i ) más cercano de la especie, y posteriormente se midió la distancia entre el individuo (x i ) y su vecino más cercano (r i ). Una vez obtenida la información se empleó el índice de Hopkins & Skellam (1954):
h = Σ(x i 2)/Σ(r i 2)
I H = h / 1 + h = Σ(x i 2) / Σ(x i 2) + Σ(r i 2)
Donde: h: prueba estadística de Hopkins; x i : distancia del punto al individuo más cercano; r i : distancia del individuo anterior a su vecino más cercano.
De esta manera, los valores obtenidos cercanos a 0 indican uniformidad, mientras que el aumento del valor a 1 denota agrupamiento (Ledo et al., 2012).
Una vez calculada la distribución, se estimó la densidad de acuerdo con lo sugerido por Diggle (1975), i.e., mediante la fórmula N 3 = √N 1 N 2
Donde: N 3 : estimador compuesto de la densidad poblacional; N 1 : estimador de la densidad basado en la distancia entre el punto y el individuo (N 1 = n / (π Σ (x i 2))); N 2 : estimador de la densidad basado la distancia entre el individuo anterior y el vecino más cercano (N 2 = n / (π Σ (r i 2))); n: tamaño de la muestra (Byth & Ripley, 1980).
Se determinaron las clases altimétricas con base en la regla de Sturges (1926). Se registraron las variables altura y número de hojas con el fin de analizar la distribución de los individuos respecto a los principales caracteres de crecimiento. Asimismo, se analizó el estado fenológico registrado con ayuda del software Minitab 19.1 (2019).
RESULTADOS
Clases de tamaño
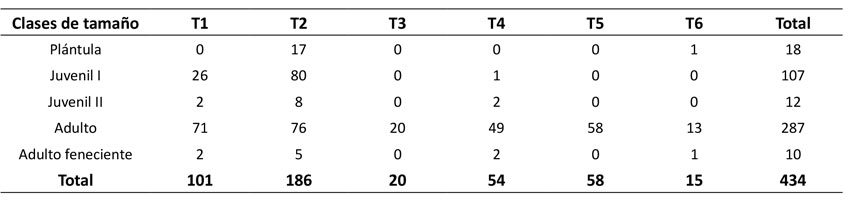
Se registraron 434 individuos de M. flexuosa en 0.6 ha, donde 4 % fueron plántulas, 28 % juveniles y 68 % adultos (Tabla 1). Se evidenció una tendencia en forma de J sesgada a la derecha. Las mayores abundancias se registraron en T1 y T2 (con 186 y 101 individuos respectivamente), seguidos por T5 (58), T4 (54), T3 (20) y T6 (15), en los cuales se destaca la ausencia de plántulas y juveniles.
Distribución altimétrica
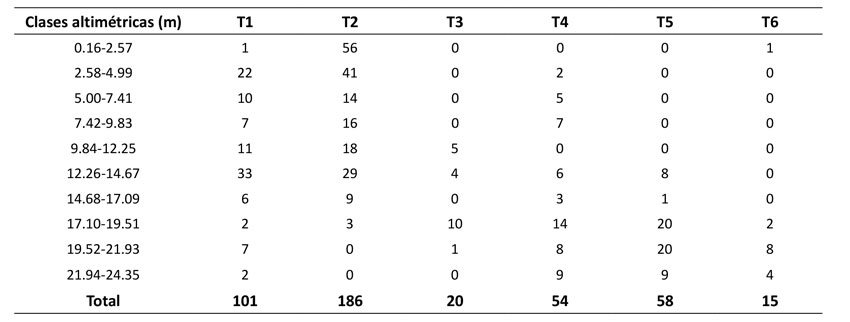
Las clases altimétricas presentaron una tendencia en forma de J invertida con asimetría positiva en las categorías entre 0.16 y 4.99 m de altura en T1 y T2, que corresponden a plántulas y juveniles. Entretanto, en los demás transectos se evidenció una distribución sesgada a la izquierda, que demuestra una disminución de las clases más pequeñas y la dominancia de individuos adultos (Tabla 2).
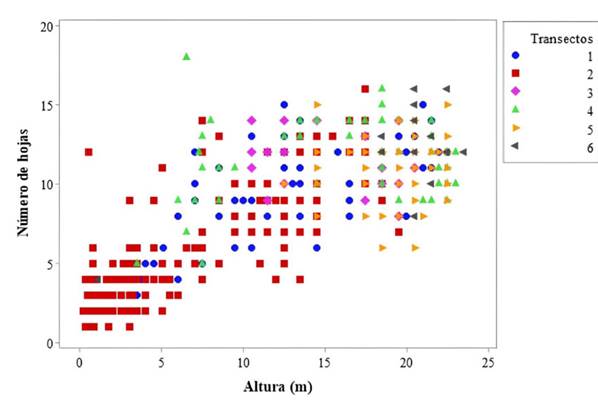
Los individuos se concentraron en los valores más bajos de las variables de altura y número de hojas en T1 y T2, que corresponden a las clases de tamaño de plántulas y juveniles. Por el contrario, T5 y particularmente T6 mostraron una agrupación hacia los valores más altos registrados para las mismas variables, mientras que, en T3 y T4, los individuos estuvieron dispersos en los valores intermedios (Figura 1).
Distribución y densidad poblacional
La población de M. flexuosa obtuvo 0.82 unidades para el Índice de Hopkins y Skellam, lo que refleja un patrón de distribución espacial agregado. En cuanto a la densidad, los valores más altos se registraron en T2 (630 palmas.ha-1), T1 (564 palmas.ha-1), T5 (500 palmas.ha-1) y T3 (455 palmas.ha-1). La distribución fue baja en T4 (84 palmas.ha-1) y T6 (32 palmas.ha-1).
Estado fenológico y producción
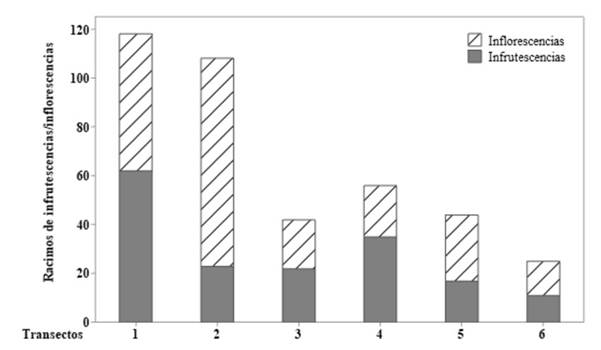
Se evidenció que alrededor del 51 % de los individuos adultos registrados para la especie se encontraron en fase fenológica (floración y/o fructificación) (Figura 2). En cuanto a la producción de racimos, se registró un total de 170 racimos de M. flexuosa en 0.6 ha muestreadas.
DISCUSIÓN
La estructura poblacional presentó una baja ocurrencia de individuos en las primeras clases de vida, lo que indica una baja regeneración natural (Freitas et al., 2020). Este patrón es similar a lo encontrado por Narváez-Ortiz et al. (2021) para un morichal sin intervención en Casanare. Esto, en contraste con otras poblaciones estudiadas en la Orinoquía y en la Amazonía, donde se ha registrado una alta abundancia de las clases más jóvenes, lo cual caracteriza una distribución típica de las poblaciones en recambio, a pesar de las afectaciones atribuidas a incendios, la depredación (ganadería bovina y porcina) o el aprovechamiento intensivo (Cardoso et al., 2002; Holm et al., 2008; Sampaio et al., 2008; Resende et al., 2012; Isaza et al., 2013; Escamilla & Bustos, 2018; Narváez-Ortiz et al., 2021). En el morichal objeto de estudio, única e históricamente hasta el año 2019 se registraron incendios naturales y otros inducidos anualmente en fincas vecinas con el fin de quemar el pasto seco e incentivar el crecimiento de retoños para el consumo del ganado. Desde la fecha no se han registrado nuevos incendios en el área de estudio (Martín, encargado de la finca, com. pers.).
En este sentido, el comportamiento de las clases etarias se atribuye a la ocurrencia intermitente de eventos reproductivos y/o situaciones ambientales específicas que favorecen el ingreso de nuevos individuos en la población (Galeano et al., 2015), al igual que a limitantes ambientales como niveles de anegamiento, filtración de luz solar, condiciones de sombra y acumulación de hojarasca (Freitas et al., 2021; Cardoso et al., 2002). Otros factores que podrían influir son las altas tasas de mortalidad, la herbivoría, la muerte accidental por la caída de hojas de los mismos progenitores y ramas de árboles y el lento crecimiento antes de la formación del tallo, que, en condiciones de sombra, suele atrofiarse por mucho tiempo, pues tiene un alto requerimiento energético, lo que provoca una baja abundancia de individuos jóvenes (Ponce et al., 1996; Ponce et al., 1999; Galeano et al., 2015; González-B, 2016; Zamora et al., 2016).
A nivel de transecto, la tendencia en forma de J invertida de las clases altimétricas en T1 y T2 está relacionada con el reclutamiento regular de individuos en la población (Resende et al., 2012), lo que sugiere una continuidad en el crecimiento, la mortalidad y la supervivencia para ascender a la siguiente clase y reemplazar los individuos ascendidos en la clase inferior (Barot et al., 1999; Araujo-Murakami et al., 2006; Sampaio et al., 2008). Entretanto, la concentración de individuos hacia los valores más altos en los demás transectos puede explicarse con lo descrito por González-B y Rial (2011): un evento simultáneo de establecimiento, reclutamiento y crecimiento de individuos de la misma altura origina un dosel continuo que puede inhibir el crecimiento de nuevos individuos por disminución de la radiación lumínica en los estratos bajos, lo cual aumenta la probabilidad de muerte por caída de hojas megáfilas (Ponce et al., 1996).
En cuanto a las variables altura y número de hojas, se evidenció una transición de la población de un morichal hacia un bosque, lo cual concuerda con lo descrito por González-B (1987, citado en Fernández, 2007). Así, los transectos T1 y T2 presentaron una alta densidad, lo que traduce en una alta concentración de juveniles que no logran cerrar el dosel debido a la baja producción de hojas, lo cual permite la regeneración de la población. Por el contrario, la disminución gradual de las primeras clases desde T3 hacia T6 y la presencia de individuos con mayor altura y producción de hojas junto con especies arbóreas generan el cierre del dosel que inhibe el desarrollo de las clases iniciales debido a su intolerancia a la sombra (González-B & Rial, 2011; Zamora et al., 2016). Dado que el crecimiento de los individuos depende fundamentalmente de la luz, y debido a que se trata de una especie pionera, existe una alta competencia entre individuos por el recurso (González-B, 2016). Entretanto, la baja irradiancia en el entorno causa una baja producción de hojas, que no protege de daños mecánicos a la yema de crecimiento. Por ende, no se obtiene la energía necesaria para el desarrollo del tallo (Ponce et al., 1999).
Las densidades de moriche registradas en T6 y T4 fueron menores (32 y 84 individuos.ha-1) con respecto a lo registrado en otras investigaciones en la Orinoquía y Amazonía, a pesar de que no se ha realizado ningún tipo de intervención, si bien, en los demás transectos, la densidad sí fue similar a lo registrado en estas regiones. Por ejemplo, en la Orinoquía colombiana, Escamilla y Bustos (2018) encontraron 454 y 842 individuos.ha-1 en morichales en aparentemente buen estado de conservación en Vistahermosa y Puerto López respectivamente. Asimismo, Narváez-Ortiz et al. (2021) registraron entre 120 y 195 individuos.ha-1 en un morichal sin intervención y entre 305 y 520 individuos.ha-1 en un morichal bajo restauración pasiva. Para la Amazonía colombiana Isaza et al. (2013) registraron 2736 individuos.ha-1 en un morichal con aprovechamiento intensivo, y Galeano et al. (2015) encontraron 735 individuos.ha-1. En el caso de la Amazonía brasileña, Soares (2009) y De Souza (2013) registraron alrededor de 2000 individuos.ha-1 cada uno. En poblaciones peruanas, Freitas (2012) registró en promedio 194 individuos.ha-1. Dichas variaciones se relacionan con las condiciones microclimáticas de luz, humedad, temperatura y fertilidad del suelo que influyen en los requerimientos de la especie para la adecuada germinación de semillas, el establecimiento de plántulas y el desarrollo de individuos (Cardoso et al., 2002; González-B, 2016).
Los hallazgos relacionados con la distribución agregada y los valores altos de densidad en T1, T2, T3 y T5 tienen que ver con la corta dispersión de las semillas, lo cual genera un patrón de concentración de individuos alrededor de los progenitores (Matteucci & Colma, 1982; Barot et al., 1999). Dado que M. flexuosa depende de agentes dispersores como la fauna o el agua, existe una alta tendencia a que las semillas germinen en sitios de alimentación de fauna o en sitios topográfica y edáficamente ricos en nutrientes con las condiciones necesarias para su establecimiento (Ponce et al., 1999; Barot et al., 1999; Ponce, 2002; Resende et al., 2012). Por otra parte, la disminución de la agregación se relaciona con el bajo nivel de inundación del suelo y la densa capa de hojarasca observada en zonas con baja densidad poblacional, lo cual favorece el establecimiento de árboles y arbustos (Cardoso et al., 2002; Galeano et al., 2015).
Por otro lado, la producción de racimos estimada fue similar a la reportada en poblaciones peruanas con aprovechamiento (Freitas et al., 2020). Cabe resaltar que la capacidad de producción depende de los recursos y energía que se capturan y destinan a la reproducción (Ponce, 2002). Dichos recursos son obtenidos del ambiente, de manera que las condiciones identificadas pueden influir en la producción, la fenología y la cantidad de frutos de una población (Freitas et al., 2021). En consecuencia, una baja producción de frutos en dichas zonas impide la regeneración natural de la población y produce una baja presencia de plántulas, pues disminuye la probabilidad de que germinen semillas que sobrevivan a las siguientes clases etarias. Así, las tasas de crecimiento de la población dependen primordialmente de los adultos (Isaza et al., 2017). En definitiva, la proporción de las clases depende de la tasa de supervivencia y reproducción, pues, al aumentar el número de adultos, aumenta el número de semillas, lo que incrementa la probabilidad de aparición de plántulas que pasarán al siguiente estadio (Araujo-Murakami et al., 2006).
CONCLUSIONES
La estructura de la población reflejó una progresión del ecosistema de morichal a un bosque de galería, donde las zonas con alta densidad, los procesos de regeneración natural y la presencia de las cuatro clases de tamaño dan cuenta de un morichal cerrado. Por otra parte, la disminución de la densidad y la ausencia de las clases juveniles permiten identificar un morichal de transición. Estos procesos podrían estar relacionados con variaciones de acumulación de materia orgánica y la disminución de los niveles de saturación de agua en el suelo. Se recomienda realizar una investigación de dinámica poblacional a largo plazo que permita comprender el comportamiento de esta población.