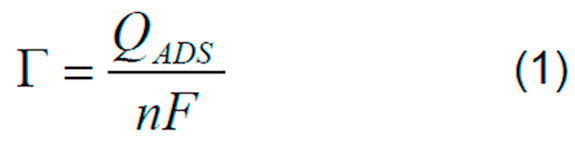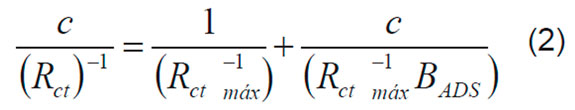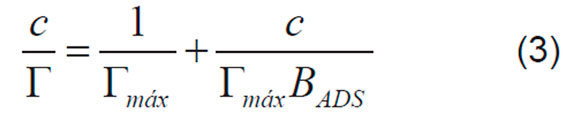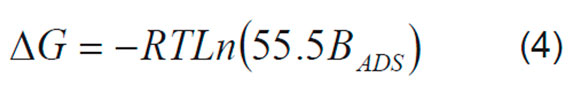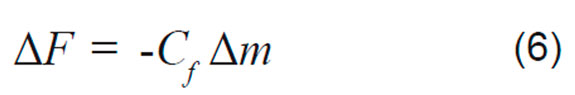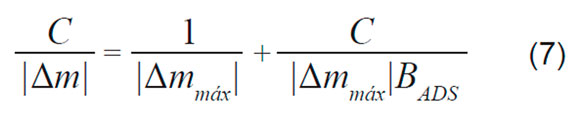Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista ION
versão impressa ISSN 0120-100X
Rev. ion vol.24 no.1 Bucaramanga jan./jun. 2011
PROTEÍNAS SOBRE RECUBRIMIENTOS DE ÁCIDO POLILÁCTICO
LEIDY MARCELA GELVES JEREZ; NERLY DEYANIRA MONTAÑEZ SUPELANO;
YURLEY KARINA ANAYA JAIMES; HUGO ARMANDO ESTUPIÑÁN DURAN;
DARIO YESID PEÑA BALLESTEROS*; CUSTODIO VÁSQUEZ QUINTERO,
DIONISIO A. LAVERDE C
Grupo de Investigaciones en Corrosión (GIC), Universidad Industrial de Santander (UIS),
Cra. 27 Calle 9, Bucaramanga, Colombia.
*icorros@uis.edu.co
Fecha Recepción: 16 de junio de 2010
Fecha Aceptación: 11 de marzo de 2011
En este trabajo se ha realizado una activación superficial mediante irradiación con luz UV, en películas de Ácido Poli-Láctico (PLA), depositadas sobre cristales de cuarzo Au/Cr sobre la cual se estudia la adhesión y direccionamiento de proteínas de colágeno y albumina bovina (BSA), bajo la imposición de un sobrepotencial electroquímico anódico, hallado mediante voltametría cíclica, el cual garantiza una condición de hidratación y adsorción de la proteína. Cambios de masa, de la capacitancia interfacial y de la impedancia de adsorción de la monocapa proteínica, fueron evaluados mediante microbalanza de cristal de cuarzo (QCM) y Espectroscopía de Impedancia Electroquímica (EIS). Variaciones en la temperatura y en las concentraciones de las proteínas, fueron realizadas, para obtener parámetros termodinámicos de adsorción. Se planteó un modelo de circuito equivalente que muestra la adhesión de proteína preferencialmente direccionada sobre la superficie irradiada. Para verificar los resultados y los cambios obtenidos, se caracterizó la superficie empleando microscopía óptica y FT-IR.
Palabras clave: colágeno, BSA, adsorción, Gibbs, Langmuir.
ON POLYLACTIC ACID COATING
A superficial activation was made with the use of UV irradiation on Poly-lactic acid films (PLA) that were deposited on quartz crystal (Au/Cr). These are used to study the adhesion, and orientation of collagen, and bovine serum albumin (BSA) proteins under imposition of an electrochemical overpotential of anodic polarization and to be analyzed by cyclic voltammetry, which guarantees a condition of moisture and adsorption of the protein. Mass change of interfacial capacitance and impedance of adsorption of the monolayer protein was assessed using quartz crystal microbalance (QCM) and electrochemical impedance spectroscopy. Variations in temperature and concentrations of proteins were carried out to obtain thermodynamic parameters of adsorption. An equivalent circuit model was proposed which illustrated the preferential adhesion of protein directed towards the irradiated surface. To verify the results and changes, the surface was characterized with the use of optical microscopy and FT-IR.
Keywords: collagen, BSA, adsorption, Gibbs, Langmuir.
La adsorción de proteínas juega un papel fundamental en la producción de implantes biocompatibles. La biocompatibilidad de los materiales depende en gran medida de las interacciones que ocurren entre la superficie y el ambiente biológico [1]. Las propiedades de la superficie influyen en la adsorción de proteínas siguiendo ciertas tendencias generales, como lo son: la afinidad de la superficie, la hidrofilicidad, la disminución de la estabilidad de la proteína [2-5]. Las proteínas con cargas eléctricas opuestas a las de la superficie, se adsorben con mayor afinidad [6,7]. El tamaño y la forma de la proteína pueden desempeñar un papel importante en la adsorción, ya que el número de sitios de unión por proteína adsorbida, se incrementan.
El colágeno es una proteína de la matriz extracelular, cuya estructura es la más grande del reino animal que contiene secuencias de aminoácidos, los cuales pueden ser reconocidos por células receptoras [8]. La albumina es una proteína globular de forma de esferoide con dimensiones 4nm * 4nm * 14nm, abundante en el plasma sanguíneo que desempeña un papel importante en el transporte de compuestos de bajo peso molecular por la sangre [9,10]
Como respuesta a los requerimientos direccionales de las proteínas para la formación de tejidos, se han implementado numerosas técnicas. Usando flujo, como la extrusión mecánica, canales microfluidilizados, anisotropía química, campos magnéticos, electrospinning. Estas son técnicas que tienen una limitación importante por el uso de solventes tóxicos y corrosivos [11-15]. Debido a estos problemas, se ha presentado un enfoque alternativo, la manipulación electroquímica, la cual puede disminuir el tiempo de proceso a minutos u horas, utilizando como variables claves, el voltaje y la corriente, en donde al aplicarse un voltaje determinado, se produce el direccionamiento de la proteína [16]. En este trabajo se estudiaron las propiedades termodinámicas de la adsorción direccionada electroquímicamente de colágeno y BSA, en superficies de PLA, activadas por irradiación con luz UV. Haciendo un monitoreo en tiempo real de la adsorción mediante técnicas electroquímicas y microgravimétricas.
Acido Poli-Láctico (PLA) fue sintetizado por policondensación del Acido L-láctico (MERCK) con Zn como catalizador. Este polímero fue disuelto en Acetona (MERCK) a 0,15 g/mL para realizar las electrodeposiciones. La Solución Salina Amortiguada por Fosfatos (PBS) utilizada para la dilución de la proteína se preparó a partir de NaCl (MERCK), Na2HPO4·2H2O (CarloErba), KCl (MERCK), K2HPO4 (CarloErba) y tamponado a un pH de 7,4. La Albumina Bovina (BSA) 98% p para electroforesis (Sigma A7906). El colágeno fue utilizado como polvo liofilizado (RSAD08I25201).
Los recubrimientos sobre los cristales de cuarzo fueron obtenidos con una solución de PLA en Acetona al 0,15 g/mL, una Fuente de Voltaje, donde el cátodo fue conectado con el cristal de cuarzo de Au-Cr y un ánodo que fue conectado a una lámina de acero austenítico durante un tiempo de 5 min y a 3 V. Posteriormente el cristal fue irradiado con luz UV.
Se prepararon soluciones de proteínas en PBS a concentraciones de 5, 12,5 y 20 μg/mL. Para las mediciones electroquímicas y de la QCM simultáneas, se utilizó una celda plana vertical, en donde el electrodo de trabajo fue el cristal recubierto, un contra-electrodo de grafito, un electrodo de referencia Ag-AgCl. Las mediciones electroquímicas se realizaron usando un potenciostato GAMRY PC4/750 y las mediciones de la QCM se realizaron con una QCM200. Las mediciones de espectroscopía de impedancia fueron desarrolladas en un rango de frecuencia de 0,01 a 100.000 Hz a 0,30 V de sobre potencial respecto al electrodo de referencia. Este sobre potencial fue obtenido por la técnica de voltametría cíclica para cada proteína. La amplitud de la señal de corriente alterna fue de 10mV.
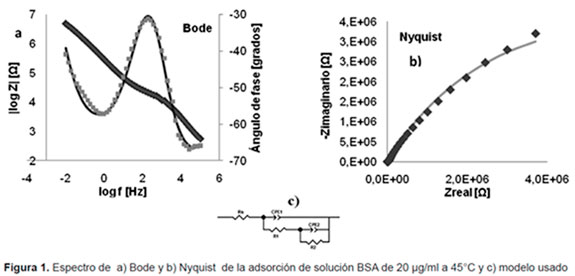
La técnica de EIS fue aplicada para investigar la adsorción de BSA y Colágeno en el recubrimiento de PLA. La Figura 1 muestra un espectro para la adsorción obtenida de solución para BSA de 20 μg/ml a 45°C.
La presentación de los datos en forma de espectro de Bode, muestra dos constantes de tiempo, una a alta y otra a baja frecuencia. Esta última, representa la transferencia de carga en la doble capa electroquímica, por lo tanto, es posible representar, el fenómeno de adsorción mediante un circuito eléctrico equivalente característico al usado, para interpretar los procesos electroquímicos en un material con recubrimiento poroso, como se muestra en la Figura 1b.
En este orden de ideas, asumiendo las dos constantes de tiempo representadas en el circuito (1c), los datos experimentales fueron obtenidos mediante simulación usando el software Zview 2.
En este circuito los elementos eléctricos representan la resistencia del electrolito (PBS + proteína) Rs entre el electrodo de trabajo y el electrodo de referencia, la resistencia de los procesos Faradaicos R1 y la capacitancia representada como un elemento de fase constante a altas frecuencias CPE1, la resistencia a la transferencia de carga Rct y la capacitancia de la doble capa eléctrica en la interface polímero-solución de proteínas CPE2 a bajas frecuencias. El ajuste obtenido presentó una mínima diferencia entre los datos teóricos y experimentales (línea continua y punteada, respectivamente en la Figura 1), del orden de chi2 de 10-4. Las resistencias a la transferencia de carga pueden ser utilizadas como una medida de la velocidad de reacción y de la cantidad de proteína adsorbida en la superficie.
El inverso de la resistencia a la transferencia de carga R-1ct, es directamente proporcional a la cantidad de proteína adsorbida Γ (mol.cm-2) y a la densidad de carga superficial, QADS(C.cm-2), como se muestra en la Ecuación 1
F es la constante de Faraday y n es el número de electrones transferidos. Se asume n=1 para los cálculos con las dos proteínas. El ajuste de estos parámetros a la ecuación de Langmuir (Ecuación 2 y 3), expresa la relación entre la concentración de la proteína, c, y la cantidad de material adsorbida en la superficie, para representar una monocapa adsorbida [17,18].
Donde BADS es el coeficiente de adsorción y Γmáx representa la máxima cantidad de material que se puede adsorber en la superficie. Estos, valores se obtuvieron del intercepto y la pendiente de la curva de c/Γ contra c, respectivamente.
El BADS está relacionado con la afinidad de la proteína a ser adsorbida en la superficie del electrodo a una temperatura dada. Por lo tanto se puede obtener la energía libre de adsorción mediante la Ecuación 4:
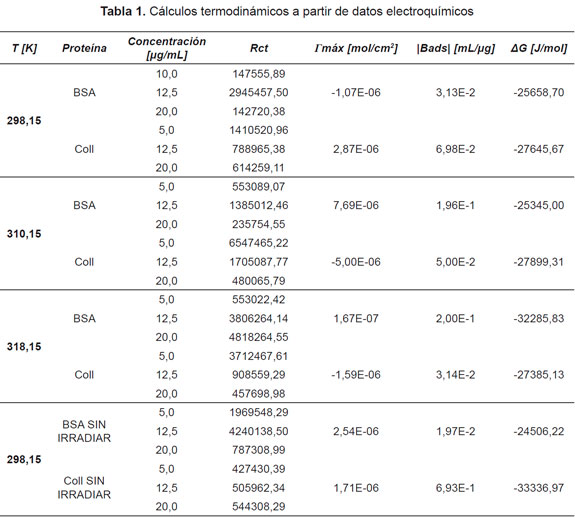
Los resultados mostraron que la adsorción de proteínas (BSA y Colágeno) fue espontánea a las diferentes temperaturas, los datos calculados se muestran en la Tabla 1.
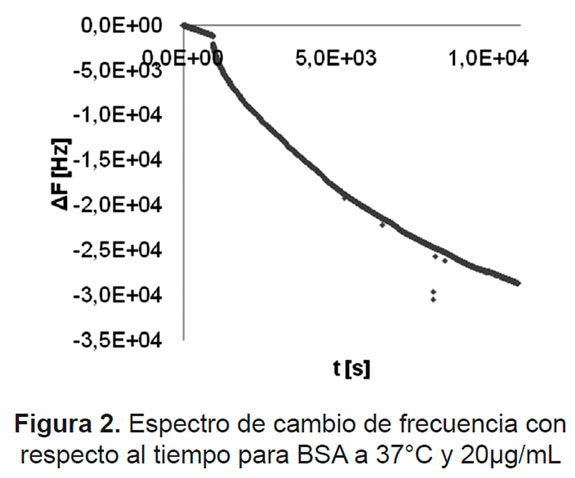
La Figura 2 muestra una respuesta típica de cambio de frecuencia vs tiempo causada por la adsorción de BSA a 37°C, de una solución de 20μ g/mL, obtenida usando la QCM.
Similares curvas se obtuvieron para todas las concentraciones disminuyendo la pendiente con la disminución en la concentración, de igual forma para el colágeno. Con base en los cambios de frecuencia en estado de equilibrio de adsorción, se calculó la cantidad de proteína adsorbida en la superficie del recubrimiento de PLA usando la ecuación de Sauerbrey.
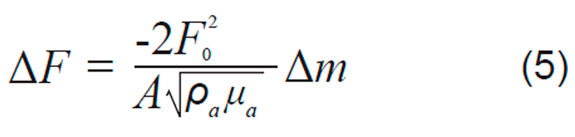
Donde ΔF es la medición de cambio de frecuencia [Hz], F0 es la frecuencia de resonancia del modo fundamental microbalanza de cuarzo [Hz], A es el área efectiva del electrodo, ρa es la densidad del cuarzo 2,648 [g cm-3], μa es el módulo de corte del cuarzo [2,947 x 1011 g cm-1.s-2], Δm es el cambio de masa [μg], por lo tanto tomando agrupando todos los valores constantes, tenemos que:
El factor de sensibilidad para el cristal Cf tiene un valor 56,6 Hz μg-1.cm2 para un cristal AT-cut 5 MHz.
La Ecuación 6 fue empleada para el sistema de estudio, donde la influencia de los cambios de la viscoelasticidad del polímero fueron despreciables, debido a que se emplearon bajos tiempos de exposición al medio acuoso, obviando el efecto de degradación del polímero a tiempos mayores. Se observó una relación lineal entre el cambio de masa y frecuencia de la QCM en aire y en solución acuosa. En consecuencia, basados en los cambios de frecuencia en el estado de equilibrio de adsorción, se calculó la cantidad de proteína adsorbida específicamente en el recubrimiento de PLA (Δm [μg/cm2]). Los datos de la QCM, obtenidos simultáneamente con los datos electroquímicos, también pueden ser ajustados a una isoterma de adsorción de Langmuir. En donde el cambio específico de masa Δm [μg/cm2] se sustituye por la cantidad de proteína adsorbida Γ y se reemplaza en la Ecuación 3.
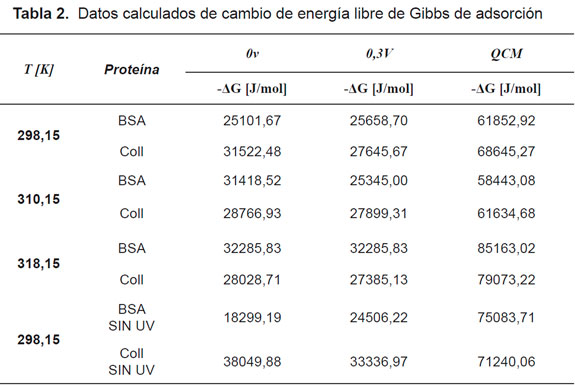
Consecuentemente, de la curva de C/|Δm| contra la concentración C, se obtuvo una relación lineal de la cual se obtuvieron los valores de BADS y |Δmmáx| de la pendiente y del corte con la ordenada, respectivamente. De esta forma, se puede obtener los parámetros de ΔG (Tabla 2).
Tanto de las técnicas de EIS y de QCM se obtuvieron las propiedades termodinámicas, los resultados obtenidos fueron comparados. De acuerdo a preliminares, al aplicar un voltaje de 0,3V se pretendió una activación superficial. Un aumento en el ΔG corroboró la hipótesis planteada de la activación en el PLA, al ser irradiado con luz ultra violeta a una misma temperatura.
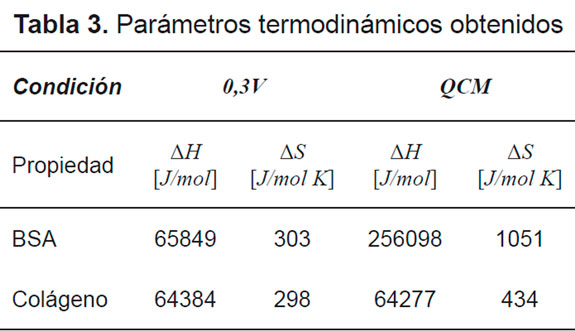
En la Tabla 3 se muestran los parámetros termodinámicos de adsorción de cambio de entropía y de entalpía como la pendiente y el punto de corte de gráfica ΔG vs T, respectivamente.
Los resultados obtenidos de entalpía y entropía concordaron con los obtenidos en otros trabajos [19,20]. Los valores hallados de entalpía muestran que a pesar de mostrar un proceso de adsorción endotérmico, no implica que el proceso sea no espontáneo.
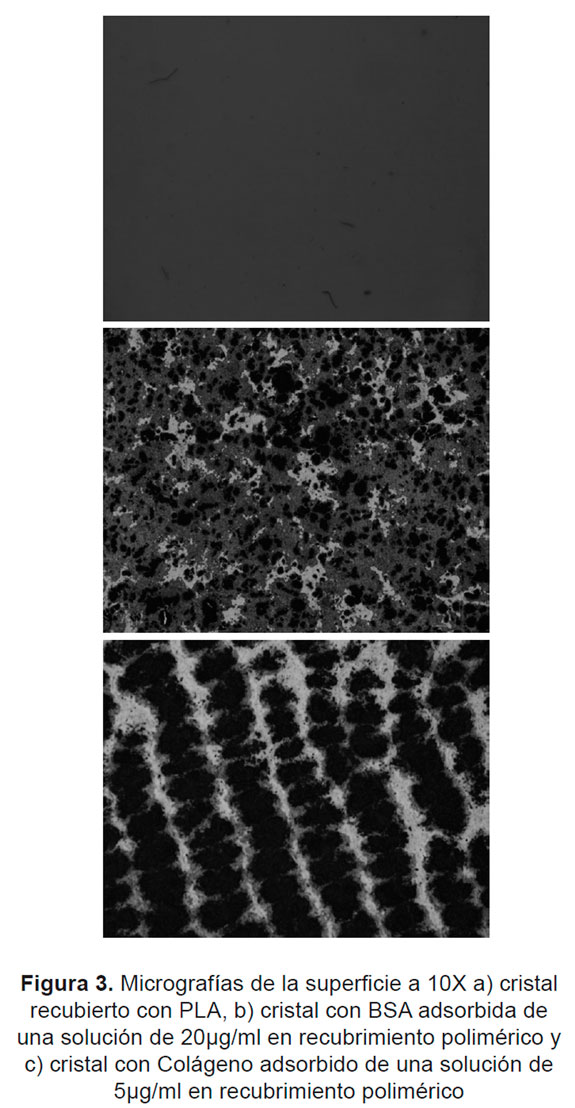
En la Figura 3 se muestran las micrografías de las superficies de PLA con las proteínas adsorbidas. La adsorción de proteína de BSA sobre la superficie polimérica de PLA, se llevó a cabo sobre sitios aleatorios y para el colágeno, con un ordenamiento u orientación relacionada con una mayor afinidad de la proteína por los grupos funcionales de la superficie y con la linealidad de la estructura de PLA.
La proteína de colágeno presentó mayor adsorción que la proteína de BSA, en la superficie del PLA, tanto en la superficie activada como en la no activada. Esto se debe muy probablemente a su forma helicoidal que le permite una mejor acomodación espacial que la BSA, la cual posee forma esférica.
La capacidad de adsorber y de ser más biocompatible del PLA aumentó al activar la superficie de material usando un sobre potencial, debido a un aumento en la hidrofilicidad y al aumento en la energía libre de Gibbs. Sin embargo, la albumina bovina a 25°C no presentó ese comportamiento, posiblemente por una desorción de la proteína a esta temperatura.
[1] David F. Williams, The Williams Dictionary of Biomaterials. Liverpool University Press, 1999. [ Links ]
[2] Andrade J. D., Hlady V., Wei A. P., Ho C. H., Lea A. S., Jeon S. I., Lin Y., Stroup E., "Proteins at interfaces: principles, multivariate aspects, protein resistant surfaces, and direct imaging and manipulation of adsorbed proteins". Clinical Materials 11 (1-4), 1992, 67-84. [ Links ]
[3] Thomas A. Horbett; John L. Brash, "Proteins at interfaces II". TA Horbett and JL Brash Edition, no. 602 in ACS Symposium series, Washington DC, 1995. [ Links ]
[4] McGuire Joseph; Wahlgren Marie C.; Arnebrandt Thomas, "Structural stability effects on the adsorption and Dodecyltrimethylammonium Bromide-Mediated, elutability of bacteriophage T4 lysozyme at silica surfaces". Journal of Colloid and Interface Science, 170 (1), 1995, 182-192. [ Links ]
[5] Willem Nord, "Driving forces for protein adsorption at solid surfaces". Macromolecular Symposium, 103 (1), 1996, 5-81. [ Links ]
[6] Blomberg E.; Claesson P. M., "Proteins at interfaces II". TA Horbett and JL Brash Edition, no. 602 in ACS Symposium series, Washington DC, 1995. [ Links ]
[7] Andrade J. D.; Hlady V. H., "Protein adsorption and materials biocompatibility: A tutorial review and suggested hypotheses". In Advances in polymer science, 79, 1986, 1-63. [ Links ]
[8] Grinnell Frederick; Nakagawa Shigenori and Ho Chin-Han, "The collagen recognition sequence for fibroblasts depends on collagen topography". Exp. Cell Res, 182 (2), 1989, 668-672. [ Links ]
[9] T. Peters Jr., All About Albumin: Biochemistry, Genetic and Medical Applications. Academic Press, San Diego, 1996. [ Links ]
[10] Huang Bill X.; Kim Hee-Yong; Dass Chhabil, "Probing three-dimensional structure of bovine serum albumin by chemical cross-linking and mass spectrometry". J. Am. Soc. Mass Spectrom, 15 (8), 2004, 1237-1247. [ Links ]
[11] Denis FA, Pallandre A, Nysten B, Jonas AM, Dupont-Gillain CC. "Alignment and assembly of adsorbed collagen molecules induced by anisotropic chemical nanopatterns". Small, 1 (10), 2005, 984-91. [ Links ]
[12] Guo Cheng; Kaufman Laura J. "Flow and magnetic field induced collagen alignment". Biomaterials, 28 (6), 2007, 1105-14. [ Links ]
[13] Lee Philip; Lin Rob; Moon James; Lee Luke P. "Microfluidic alignment of collagen fibers for in vitro cell culture". Biomedical Microdevices, 8 (1), 2006, 35-41. [ Links ]
[14] Silver FH, Christiansen DL, Snowhill PB, Chen Y. "Role of storage on changes in the mechanical properties of tendon and self-assembled collagen fibers". Connective Tissue Research, 41 (2), 2000, 155-64. [ Links ]
[15] Matthews JA, Wnek GE, Simpson DG, Bowlin GL. "Electrospinning of collagen nanofibers". Biomacromolecules, 3 (2), 2002, 232-8. [ Links ]
[16] Cheng Xingguo; Gurkan Umut A.; Dehen Christopher J.; Tate Michael P.; Hillhouse Hugh W.; Simpson Garth J.; Akkus Ozan. "An electrochemical fabrication process for the assembly of anisotropically oriented collagen bundles". Biomaterials, 29 (22), 2008, 3278-3288. [ Links ]
[17] Jia Xueen; Xie Qingji; Zhang Youyu; Yao Shouzhuo. "Simultaneous Quartz Crystal Microbalance - Electrochemical Impedance Spectroscopy Study on the Adsorption of Antihuman Immunoglobulin G and Its Immunoreaction at Nanomaterial-modified Au Electrode Surfaces". Anal. Sci., 23 (6), 2007, 689-96. [ Links ]
[18] Wright Jennifer E.I.; Roscoe Sharon G. "Electrochemical impedance spectroscopy and quartz cristal nanobalance (EQCN) studies of insulin adsorption on Pt". Journal of Electroanalytical Chemistry, 564, 2004, 185-197. [ Links ]
[19] Smiechowski Matthew F.; Lvovich Vadim F.; Roy Shuvo; Fleischman Aaron; Fissell William H.; Riga Alan T. "Electrochemical detection and characterization of proteins". Biosensors and Bioelectronics, 22 (5), 2006, 670-677. [ Links ]
[20] Milonjic Slobodan K. "A consideration of the correct calculation of thermodynamic parameters of adsorption". J. Serb. Chem. Soc., 72 (12), 2007, 1363-1367. [ Links ]