Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista ION
Print version ISSN 0120-100X
Rev. ion vol.24 no.1 Bucaramanga Jan./June 2011
Miller Y DISMINUCIÓN DE SU CONCENTRACIÓN POR
ADSORCIÓN EN COLUMNA CON CARBÓN ACTIVADO
LUZ AMPARO LOZANO URBINA*1; CARLOS MUVDI NOVA2; LUZ DARY MEJÍA URIBE1
1Escuela de Química, Universidad Industrial de Santander (UIS), Cra 27 Calle 9, Bucaramanaga, Colombia.
*luzloz@uis.edu.co
2Escuela de Ingeniería Química, Universidad Industrial de Santander (UIS), Cra 27 Calle 9, Bucaramanaga, Colombia.
Fecha Recepción: 21 de septiembre de 2010
Fecha Aceptación: 4 de abril de 2011
Aloe vera (Aloe barbadensis Miller) pertenece a la familia Aloaceae; la importancia de este género radica en los metabolitos secundarios producidos por estas plantas y en sus aplicaciones en la industria cosmética y medicinal. El objetivo de este trabajo se basó en obtener un gel de Aloe barbadensis con una concentración de barbaloína próxima a la permitida por la Internacional Aloe Science Council, y una alta concentración de azúcares reductores. Para este estudio, se trabajó en columnas empacadas con carbón activado con diferentes alturas de lecho empacado y evaluadas a diferentes caudales de alimentación. Los mejores resultados (producto final con una concentración de barbaloína de 10 mg/L) se obtuvieron con un caudal de alimentación de 30 mL/min y una altura de lecho de carbón activo de 23 cm. Los análisis se realizaron por fotometría y método del ácido dinitrosalicílico (DNS), a longitudes de onda de 360 nm y 540 nm para la barbaloína y azúcares reductores respectivamente. Igualmente se cuantificó la producción de los metabolitos, aloína y aloe-emodina por cromatografía líquida de alta resolución; haciendo posible el seguimiento de la degradación de la aloína a aloe-emodina, en muestras tratadas y no tratadas. De estos resultados se evidencia la poca influencia del proceso de estabilización en el contenido de aloe-emodina en el gel de aloe, como si ocurre en el caso de la aloína, su precursor. Los resultados obtenidos en estudio muestran la eficacia de la técnica propuesta (a escala de laboratorio) para la estabilización de gel de aloe Barbadensis Miller, con concentraciones de aloína en solución permitidas por el Aloe Science Council; manteniendo el contenido de azúcares presentes en el gel.
Palabras clave: aloína, columnas empacadas, fotometría, DNS
CONCENTRATION DECREASING BY ACTIVATED COAL
PACKED COLUMNS ADSORPTION TECHNIQUE
Aloe vera (Aloe barbadensis Miller) belongs to the Aloaceae family; the most important issue of this variety is the presence of the secondary metabolites produced by this plant and its use on cosmetic and medical industry. The objective of this work was to obtain an Aloe barbadensis gel with a barbalonia concentration allowed by the International Aloe Science Council, and a high concentration of reducer sugars. This work is based on activated coal packed columns technique, changing the packing height and evaluated with different feed rates. The best results (final product with 10 mg/L barbaloina concentration) were gotten with a feed rate of 30 mL/min and an activated coal bed height of 23 cm. The quantification was developed by colorimetric and dinitrosalicylic acid method (DNS) analysis at 360 nm and 540 nm wave lengths for barbaloina and reducer sugars respectively. It was quantified the production of the metabolites aloine and aloe-emodine as well, by high resolution liquid chromatography; making possible to follow the aloine degradation to aloe-emodine, in treated and no treated samples. This results show a low influence of the stabilization treatment on the aloe-emodine content in the aloe gel, as it happens with the aloine, its precursor. The results obtained with this work show the efficacy of the technique studied (laboratory scale) for the aloe Barbadensis Miller gel stabilization, with aloine concentrations allowed by the Aloe Science Council; assuring the sugar aloe gel content.
Keywords: aloin, packed columns, photometric, DNS
La sociedad moderna centrada en la calidad de los productos que consume ha condicionado a la investigación a buscar nuevos productos -naturales- que permitan, suministrar elementos nutritivos y contribuir a favorecer su calidad de vida. El Aloe barbadensis Miller también se enmarca dentro de esta nueva tendencia, ya que puede ser considerado como materia prima para la elaboración de alimentos funcionales debido a los más de 75 compuestos específicos [1].
El Aloe presenta propiedades interesantes como: su acción emoliente, cicatrizante, hidratante, antialérgica y antiinflamatoria. Sin embargo esta planta también exhibe componentes que producen cierta toxicidad por su uso prolongado, pues generan un efecto laxativo y confieren deficientes características organolépticas [2].
El International Aloe Science Council es el organismo encargado de controlar los productos a base de Aloe para consumo humano; este ha certificado la concentración máxima de barbaloína-derivado hidroxiantracénico objeto del estudio aquí realizado- para consumo humano alrededor de 10 mg/L. En el mundo son conocidas más de 360 especies y de éstas, el Aloe barbadensis Miller es considerada como la más utilizada en la medicina natural [2,3].
La aloína se encuentra en alta concentración en el acíbar (jugo viscoso de color amarillo y sabor amargo que se obtiene de las hojas del Aloe barbadensis al ser cortadas transversalmente).
La designación química usual es 10-glucopiranosil-1,8-dihidroxi-3-hidroximetil-9(10H)-antracenona. Esta antraquinona existe en forma de dos isómeros denominados, barbaloína (Aloína A) e isobarbaloína (Aloína B), que difieren por la posición del grupo glucosa en la base del grupo antraceno, Figura 1, siendo más abundante el isómero A [3,4].
Esta investigación tiene como objetivo principal disminuir la concentración de la aloína en el proceso de obtención del gel, mediante una columna empacada, utilizando carbón activado como medio adsorbente, para obtener un producto a la concentración permitida.
La metodología empleada durante el desarrollo experimental para la obtención del gel de aloe es indicado en la Figura 2.
La materia prima empleada, fueron plantas con edad superior a 2 años; asegurando con esto un alto contenido en carbohidratos [5]. La estabilización es una etapa que permite conservar por más tiempo las propiedades del gel obtenido [6]. El primer paso en la estabilización es añadir proporciones de un catalizador oxidante no tóxico. Los mejores resultados se obtuvieron utilizando el peróxido de hidrógeno en solución acuosa al 30% (Merck), en cantidades alrededor de 0.3 mL por cada 5 L del gel preparado [7]. El gel se somete a calentamiento en un rango de temperatura de 35 a 80°C, el oxidante no tóxico se añade con agitación, y el calentamiento se continúa hasta los 30 min cuando la solución tiene una apariencia menos viscosa. [8].
Una vez la etapa de oxidación se ha completado, es necesario añadir un material antioxidante, con el fin de detener la oxidación catalítica, mediante el empleo de ácido ascórbico agregando alrededor de 0,15 g/L de gel de Aloe vera [8,9]. Posteriormente, el ácido cítrico se añade en cantidad de 3,74 g/L de Aloe vera con el fin de mantener el pH de la composición definitiva dentro de un rango de 4 a 6 [8,9].
Método de UV-Vis para cuantificación inicial del Aloe y azúcares reductores
Para la determinación de la concentración inicial de aloína en el gel de Aloe barbadensis, se realizaron dos curvas de calibración; de 0 - 50 mg/L y de 0 - 5 mg/L, utilizando un patrón de aloína (Sigma-Aldrich 97%). Para ello se tomaron muestras de gel de Aloe barbadensis adicionándole etanol analítico. Posteriormente la mezcla fue centrifugada y el sobrenadante recuperado para la lectura a 360 nm de la aloína.
El análisis de azúcares reductores presentes en el gel de Aloe barbadensis se realizó en muestras antes y después de ser tratadas con la columna de carbón activado. La concentración se determinó por colorimetría utilizando el método DNS. Se construyó una curva de calibración a partir de una solución de glucosa (1000 mg/L), la cual se diluyó a las diferentes concentraciones de patrón, a cada solución patrón se adicionó cierta cantidad del reactivo DNS (ácido dinitrosalicílico). La lectura de absorbancia del blanco y cada solución patrón fue determinada a 540 nm [10].Las muestras se prepararon por duplicado.
La Figura 3 muestra la curva de calibración de una solución patrón de glucosa 1000 mg/L y sus diluciones. La concentración de la muestras fueron determinadas mediante regresión lineal.
El gel estabilizado de Aloe obtenido en el proceso de estabilización presentó una concentración inicial entre 90 y 150 ppm de aloína, y entre 3000 y 5000 ppm de azúcares reductores.
Cuantificación de Aloína y aloe-emodina
El método utilizado para cuantificar la concentración de aloína y aloe-emodina fue cromatografía líquida de alta resolución (HPLC), y se emplearon patrones de aloína y aloe-emodina (Sigma-Aldrich).
El sistema de HPLC consistía en un equipo de bomba cuaternaria tipo Agilent 1100, con detector DAD y lámpara UV-Vis, columna Agilent Eclipse XDB-C18 4.6 mm de diámetro interno y150 mm de longitud.
La fase móvil utilizada consistió en una mezcla agua (A) y acetonitrilo (B) con un gradiente de elución así: 0 min, 80A/20B durante 9 min, 100%B durante 16 min. Después de cada corrida se empleó un tiempo de lavado de 5 min y un tiempo de equilibrio de 15 min con 100% Acetonitrilo.
Para la determinación de la concentración de aloína en el gel de Aloe barbadensis, se realizó una curva de calibración, utilizando un patrón de Aloína-A (Sigma-Aldrich 97%).
De igual forma la determinación de la concentración de aloe-emodina se realizó por medio de una curva de calibración; de 1-30 mg/L, utilizando un patrón de aloe-emodina (Sigma-Aldrich ≥95%).
Las muestras utilizadas para determinación de la cantidad de aloína y aloe-emodina fueron muestras tratadas hasta la etapa de estabilización mostrada anteriormente.
A estas muestras se les realizó un tratamiento antes de ser analizadas por al equipo de HPLC; este proceso se llevó a cabo para adecuar el extracto de aloe y eliminar las interferencias para la lectura por cromatografía líquida [11].
Las Figuras 4 y 5 corresponden a las curvas de calibración para la aloína y aloe-emodina respectivamente.
Extracción de Barbaloina en Columna de Carbón Activado
Una vez estabilizado el material vegetal, se pasó por gravedad a una columna de vidrio de longitud de 49 cm y un diámetro de 5,2 cm. Esta columna fue equipada con mallas de acero inoxidable No. 60, soportes de PVC para garantizar una distribución uniforme del gel y empacada con carbón activado (CA) (canadiense ref.bc830, granulado entre 0,85 y 2,36 mm). Se trabajó con caudales de 10 y 30 mL/min y alturas de lecho (carbón activado) de 7, 13 y 23 cm, obteniendo que las mejores condiciones para la extracción fueron a 23 cm de CA, y un caudal 30 mL/min.
Influencia del Caudal en la retención de Aloína
La Tabla 1 muestra los porcentajes de retención de barbaloína y azúcares reductores en el jugo total recuperado después de la realización de los experimentos para los caudales de 10 y 30 mL/min.
Se evidencia que el caudal no afecta considerablemente la retención de aloína para el producto total tratado. Se aprecia claramente que la cinética para un caudal de 30 mL/min evidencia una menor retención de azucares; debido a que, al aumentar el caudal, se disminuye el tiempo de residencia y con ello las interacciones de los azúcares con el medio; esto acompañado de una cinética de adsorción lenta para estos compuestos.
Influencia del Carbón Activado en la retención de Aloína
La Tabla 2 muestra los porcentajes de retención de aloína y azucares reductores en el jugo total recuperado, se observa que existe una mayor interacción entre la aloína y el carbón activo en comparación con los azúcares y el agente retenedor.
Se considera una altura de 23 cm de carbón activado como la más adecuada, pues con ella se obtuvo un producto con una concentración próxima a la permitida según la International Aloe Science Council para consumo humano la cual es 10 mg/L.
Obtención de aloína con concentración de 10 mg/mL
Análisis sobre la retención de aloína y azúcares reductores en la columna empacada.La figura 3 se presenta el porcentaje de retención de aloína y azúcares reductores teniendo en cuenta los parámetros de los resultados obtenidos anteriormente (caudal de 30 mL/min utilizando, altura de carbón de 23 cm (225 g) y humectación).
De la Figura 6 se evidencia un comportamiento lineal en cuanto al porcentaje de retención de aloína en el carbón. Igualmente se observa que transcurrido un tiempo de 140 min, el porcentaje de retención es del 88% (este porcentaje asegura una concentración final inferior a 10 mg/L). Estos porcentajes fueron calculados con la diferencia entre las concentraciones iniciales de aloína y azúcares en el gel de aloe y las concentraciones luego de ser pasado por el lecho de carbón activado. Por otra parte, se presenta una disminución significativa de la retención de azúcares en el tiempo, exhibiéndose el mayor cambio durante el minuto 20 al 40, lo que indica que el carbón presenta una posible saturación con respecto a los azúcares.
El proceso se detuvo a los 40 min, debido a pruebas preliminares, las cuales mostraron que a este tiempo, el análisis del jugo total recuperado daba como resultado la máxima concentración de aloína permitida (10 mg/L). Una vez realizado este proceso, las características del jugo integrado a los 140 min presentó una densidad de 1.02 g/mL, humedad de 99%, pH 3.8, sólidos 0.72%, cenizas 0,03%; grasas 0.49%, proteínas 0,27% en base seca y una concentración final de aloína de 10,5 ± 1 y 3160 ± 10 ppm de azúcares reductores, el cual representa una retención de 88 ± 2 y 41 ± 1% respectivamente.
Las muestras analizadas por el equipo de HPLC fueron muestras estabilizadas y muestras sin estabilizar del aloe. Esto se realizó con el fin de identificar si la oxidación de aloína lleva al aumento del componente de aloe-emodina. Las muestras fueron analizadas cada 15 días durante 45 días de duración de la prueba; los resultados obtenidos se resumen en la Tabla 3, corresponden a análisis realizados con el mismo intervalo de tiempo.
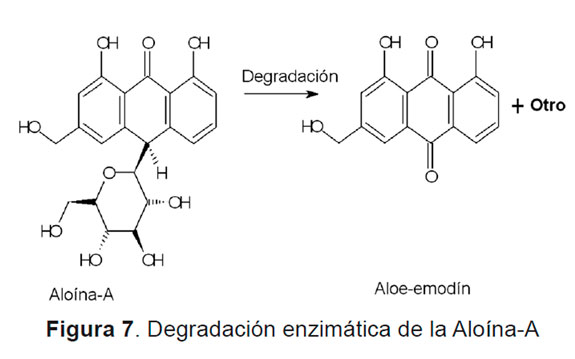
De la Tabla 3 se observa como la concentración de aloína para la muestra estabilizada y no estabilizada decrece un 61 y 70% respectivamente, lo que indica que esta especie química sufre una degradación. En contraste a esto, la concentración de aloe-emodina sufre un incremento de un 11 y 43% respectivamente, lo que evidencia que no toda la aloína se degrada a aloe-emodina, y hay posible formación de crisofanol, rheina, fisición, rheína y otros [12].
La Figura 7 muestra esquemáticamente la degradación enzimática que sufre la aloína.
La Figura 8 corresponde al cromatograma obtenido para una muestra de gel de aloe a la que se le realizó el proceso de estabilización. Los dos picos indicados, uno con un tiempo de retención de 11,146 min leída a 360nm correspondiente a la aloína y la otra con un tiempo de retención de 11,705 min leída a 257,16nm correspondiente al aloe-emodina. Ésta asignación de picos a cada uno de los compuestos se realizó tomando como base los tiempos promedio de retención de los patrones de aloína y aloe-emodina.
Se implementó un método eficaz para la estabilización de soluciones de gel de aloe Barbadensis Miller que permite disminuir significativamente la concentración de aloína en la solución, manteniendo el contenido de azúcares presentes en el gel.
El estudio permitió la estandarización de los métodos UV-VIS y HPLC para la cuantificación de aloína y aloe-emodina en el gel de aloe.
El proceso de estabilización no produce cambios significativos en el contenido de aloe-emodina en el gel de aloe como si ocurre en el caso de la aloína, su precursor.
Los autores reconocen el apoyo financiero de la Dirección de Investigaciones de la Facultad de Ciencias de la UIS, a través del proyecto con Código 5272.
[1] LOOTS D.; WESTHUIZEN F.; BOTES L. "Aloe ferox leaf gel phytochemical content Antioxidant Capacity and possible healf benefits". J. Agric. Food Chem., 55 (17), 2007, 6891-6896. [ Links ]
[2] VEGA G.; AMPUERO C.; DIAZ N.; LEMUS M. "El Aloe vera (Aloe barbadensis miller) como componente de alimentos funcionales." Rev. Chil. Nutr., 32 (3), 2005, 201-214. [ Links ]
[3] PARK, J.; KWON S. New Perspectives of Aloe. Chemical components of Aloe and its analysis. Park, Y. I. y Lee, S. K. (Eds.). Springer Science+Business Media, New York, 2006, 27. [ Links ]
[4] KUSUYA H.; TAMAI I.; BEPPU H.; SHIMPO K.; CHIHARA T. "Determination of aloenin, barbaloin and isobarbaloin in Aloe species by micellar elecrokinetic chromatography". J. Chrom. B, 752 (24), 2001, 91-97. [ Links ]
[5] HU Y.; XU J.; HU Q. "Evaluation of Antioxidant Potential of Aloe vera (Aloe barbadensis Miller) extracts". J. Agric. Food Chem., 51 (26), 2003, 7788- 7791. [ Links ]
[6] MAUGHAN R. PATENT No. 4,465,629. U.S. 1984. [ Links ]
[7] COBBLE H. PATENT No. 3,892,853. U.S. 1975. [ Links ]
[8] McANALLEY B. PATENT No. 4,957,907. U.S. 1990. [ Links ]
[9] COATS B. PATENT No. 4,178,372. U.S 1979. [ Links ]
[10] MILLER G. "Use of dinitrosalicylic reagent for determination of reducing sugar". Anal. Chem., 31 (3), 426-428. [ Links ]
[11] ELSOHLY M.; KHAN I.; AVULA B. "Determination of the Anthraquinones Aloe-Emodin and Aloin-A by Liquid Chromatography with Mass Spectrometry and Diode Array Detection". J. A.O.A.C Inter., 90 (1), 2007, 28-42. [ Links ]
[12] MARTÍNEZ A. "Quinonas y compuestos relacionados". Facultad de Química Farmacéutica. Universidad de Antioquia. Septiembre 29 de 2005. Disponible: http://farmacia.udea.edu.co/~ff/quinonas.pdf [ Links ]