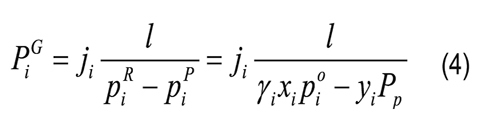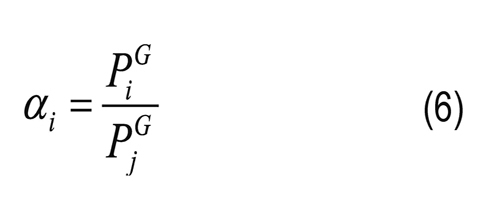Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista ION
Print version ISSN 0120-100X
Rev. ion vol.25 no.1 Bucaramanga Jan./June 2012
membranas de polidimetilsiloxano (PDMS) por pervaporación
Oscar Johnny Jaramillo Pineda; Miguel Ángel Gómez García;
Javier Fontalvo Alzate*
Universidad Nacional de Colombia - Sede Manizales - Facultad de Ingeniería y Arquitectura -
Departamento de Ingeniería Química â Laboratorio de Intensificación de Procesos y Sistemas Híbridos -
GIANT: Grupo de Investigación en Aplicación de Nuevas Tecnologías -
Cra 27 No. 64-60, Manizales, Apartado aéreo 127 - Colombia.
*jfontalvoa@unal.edu.co
Fecha Recepción: 15 de enero de 2012
Fecha Aceptación: 5 de abril de 2012
La producción de etanol a partir de materiales lignocelulósicos incluye procesos de pretratamiento, hidrólisis y fermentación. Durante la etapa de pretratamiento e hidrólisis se producen compuestos no deseables para la fermentación. La toxicidad de estos compuestos, llamados inhibidores, sobre los microorganismos es uno de los principales factores limitantes en el rendimiento de etanol durante la fermentación. Aunque han sido propuestos en la literatura diferentes métodos biológicos, físicos y químicos para eliminar estos compuestos inhibidores, el uso de tecnologías de membrana ha recibido poco interés como método de remoción, y específicamente, hasta la fecha no se conocen estudios en donde se use la pervaporación como método de detoxificación. En este estudio se preparó y evaluó el desempeño de una membrana de polidimetilsiloxano (PDMS) para la remoción de inhibidores presentes frecuentemente en el pretratamiento e hidrólisis ácida de material lignocelulósico proveniente del bagazo y las hojas de caña de azúcar. La membrana preparada permite la remoción de ácido acético, ácido fórmico y furfural. No se encontró permeación alguna del ácido levulínico, xilosa, glucosa y hidroximetilfurfural (HMF). Los resultados indican que es posible realizar la detoxificación de hidrolizados del bagazo y las hojas de la caña de azúcar mediante pervaporación.
Palabras clave: pervaporación, hidrólisis de bagazo, inhibidores, intensificación de procesos, tecnología de membranas.
polydimethylsiloxane (PDMS) membranes by pervaporation
Pretreatment and fermentation are previous processes for ethanol production from lignocellulosic material. During pretreatment, several undesirable compounds are formed. These compounds, known as inhibitors, reduce yeast activity and they are one of the main limiting factors of ethanol yield in the fermentation process. Although, several biological, physical, and chemical processes have been proposed in the literature to remove inhibitor compounds, little attention has received membrane technology as a removal alternative. To date, there are not known studies where pervaporation has been used as a removal technology for inhibitors. In this work, a membrane of polydimethylsiloxane (PDMS) was prepared and experimentally evaluated for removal of inhibitors usually produced from pretreatment and acid hydrolysis of bagasse and leaves of sugar cane. The prepared membrane is able to remove acetic acid, formic acid and furfural. Levulinic acid, xylose, glucose and hydroxymethylfurfural (HMF) did not permeate through the membrane. These results show that it is possible to detoxicate hydroxylates from bagasse and leaves of sugar cane by pervaporation.
Keywords: pervaporation, hydrolysis of bagasse, inhibitors, process intensification, membrane technology.
Para el año 2013 se estima que en Colombia la producción de bioetanol alcanzará más de 513ML cuando entren en operación las plantas de Bioenergy (Meta) y de Agrifuels (Magdalena). Y en el 2015, con la entrada en operación de tres proyectos más, la producción de alcohol podría alcanzar más de 800ML [1]. Las plantas productoras de etanol existentes y las nuevas que entrarán en operación producirán el etanol a partir del jugo de la caña de azúcar. Esto implica que sólo se puede ampliar la producción sembrando más tierra. Por ejemplo para la planta Bioenergy, con la cual se estima una capacidad de producción de 0,48ML de etanol diarios, se deben sembrar y cosechar 125x106 m2 más para cumplir con los requerimientos de 6,8kt diarias de caña de azúcar [2]. No obstante, si se aprovechan los residuos agroindustriales de la caña de azúcar, caña panelera y caña miel se puede producir más etanol sin aumentar el área cultivada.
El microorganismo con mayor capacidad para la fermentación de la xilosa es la levadura de la Pichia stipitis, que en fermentaciones por lotes produce entre 41 y 50x10-3kg/L de etanol con rendimientos del 0,44-0,48kg etanol/kg de xilosa [3,4]. Sin embargo, en general, las levaduras que fermentan xilosa cuando se comparan con la levadura Saccharomyces cerevisiae son más vulnerables a los compuestos inhibidores como el furfural y compuestos fenólicos [5,6]. Para convertir la xilosa en etanol es necesario detoxificar el hidrolizado, y así realizar la fermentación en tiempos cortos y obtener rendimientos mayores al 80%p.
Entre los principales compuestos tóxicos que se generan en la hidrólisis ácida de materiales lignocelulósicos están los compuestos fenólicos, los furaldehídos (hidroximetilfurfural - HMF y furfural) y los ácidos alifáticos (acético, fórmico y levulínico) todos ellos formados durante la etapa de pretratamiento. El proceso de remoción de inhibidores se puede llevar a cabo por métodos biológicos, químicos y físicos [7â9]. Los acondicionamientos biológicos generalmente remueven los compuestos fenólicos de forma efectiva (~80-90%); no obstante, tienen tiempos de detoxificación de días y a veces no remueven los furaldehídos y generan pérdidas de azúcar [10,11]. Evaporación, nanofiltración, electrodiálisis y extracción (en fase líquida o sólida) están incluidos entre los acondicionamientos físicos. La evaporación remueve completamente el furfural y gran parte del ácido acético y fórmico (~40-70%p) pero no remueve efectivamente los compuestos fenólicos [11,12]. Las tecnologías de membrana como la nanofiltración y electrodiálisis han sido usadas para la detoxificación y concentración simultánea de los hidrolizados hemicelulósicos, pero la literatura reporta pérdidas de azúcar y poco acerca de la eficacia en la remoción de los compuestos tóxicos [13â16]. Entre los solventes efectivos para la extracción en fase líquida de los compuestos fenólicos está el acetato de etilo con remociones hasta del 80%, aunque casi siempre por esta técnica hay que evaporar para retirar la fracción remanente de solvente [17,18]. Por extracción en fase sólida las resinas de intercambio aniónico o catiónico, las zeolitas y el carbón de madera son efectivos en la remoción de furfural y los compuestos fenólicos con remociones de ambos mayores al 70%, no obstante, la resina y las zeolitas generan pérdidas de azúcares mayores al 5% [11,19,20]. Por último están los acondicionamientos químicos en donde los compuestos tóxicos reaccionan con agentes reductores convirtiendo los furaldehídos (HMF y furfural) y compuestos fenólicos en sustancias menos tóxicas [21]. La desventaja del acondicionamiento químico son las pérdidas de azúcares [22] y la formación de un precipitado que requiere una filtración posterior.
Hasta el momento no se conocen estudios de pervaporación como método de acondicionamiento de hidrolizados y concretamente el uso de membranas de polidimetilsiloxano (PDMS). Sagehashi et al. [23] estudiaron la remoción de furfural, ácido acético y fenoles por pervaporación de una solución acuosa generada a partir de la descomposición de material lignocelulósico por pirólisis, los factores de enriquecimiento oscilaron entre 20-70 para furfural y fenoles en el intervalo de temperatura de 40-120°C.
En este estudio se preparó y evaluó el desempeño de membranas de polidimetilsiloxano PDMS en la remoción selectiva de compuestos inhibidores. Se determinan las permeancias y selectividades de los azúcares (glucosa y xilosa), ácidos orgánicos (acético, fórmico y levulínico) y furaldehídos (hidroximetilfurfural y furfural) para establecer si las membranas son eficientes en la remoción de los compuestos tóxicos sin pérdidas de azúcares con el objetivo de contribuir en la solución de uno de los principales obstáculos en la fermentación de las pentosas y hexosas para la producción de etanol.
La caña de azúcar usada en este estudio fue recolectada en la zona rural del departamento de Caldas por FEDEPANELA, variedad POJ28-78. La caracterización de las hojas y el bagazo se llevó a cabo siguiendo el procedimiento de laboratorio "Determination of Structural Carbohydrates and Lignin in Biomass" de la agencia NREL [24].
La membrana se fabricó por recubrimiento de PDMS sobre soportes cerámicos tubulares de 3mm de diámetro y 0,3m de longitud mediante la técnica de "dip-coating" con espesores de aproximadamente 1micrómetro [25]. Los soportes constituidos de α-Al2O3 tienen una porosidad del 30% con diámetros de poro de 300nm, sobre el soporte se depositó γ- Al2O3 con un tamaño de poro inferior a 80nm [26]. Como capa superficial se depositó el PDMS.
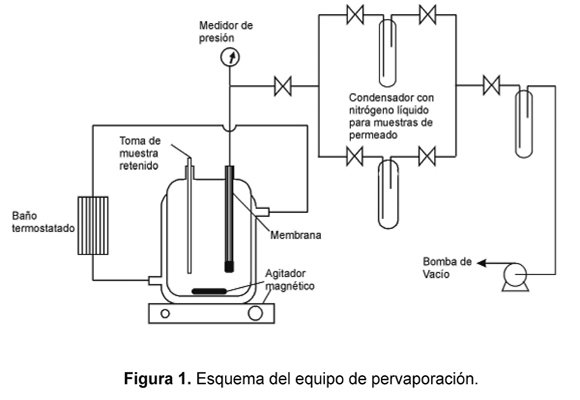
Los experimentos de pervaporación se llevaron a cabo en un vaso enchaquetado a diferentes temperaturas (35, 50 y 65°C). En este vaso se ubicó la solución de retenido y la membrana Figura 1. El volumen de retenido (2L) fue suficientemente elevado para asegurar composiciones del retenido en esencia constantes durante cada experimento. Mayores detalles de este equipo experimental se pueden encontrar en otra parte [26â28]. La presión del permeado (< 500N/m2) se obtuvo mediante una bomba de vacío y el permeado fue condensado con una trampa con nitrógeno líquido.
La composición química de la solución de retenido permaneció esencialmente constante durante todo el experimento, siendo: glucosa (1,9g/L), xilosa (22,7g/L), ácido fórmico (0,89g/L), ácido acético (2,9g/L), ácido levulínico (0,95g/L), HMF (0,56g/L) y furfural (0,47g/L).
El retenido fue mezclado con un agitador magnético (900rpm) para minimizar los efectos de resistencia a la transferencia de masa y calor sobre la superficie de la membrana. Se tomaron muestras de retenido y permeado en función del tiempo por periodos de 0,33 a 0,58h. El tiempo de estabilización se identificó cuando las diferencias relativas entre los datos de flujo másico total en función del tiempo fueron bajas (< 1,3%), esto ocurrió en general después de 5 mediciones o periodos.
La masa total (Mtotal) del permeado se determinó por gravimetría y el flujo másico total a través de la membrana (kg/m2h) se determinó así:
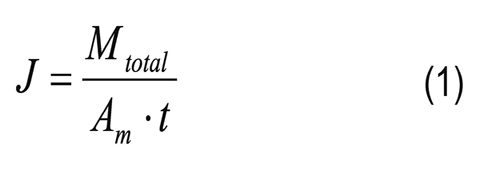
El flujo másico por componente a través de la membrana se determina a partir del flujo másico total a través de la membrana y la composición del permeado. Las composiciones de retenido y permeado se determinaron por cromatografía líquida de alta presión (HPLC) con un detector de índice de refracción y una columna ROH-801 (Transgenomic), con una temperatura del horno de 50°C y temperatura del detector de 35°C por elución isocrática (flujo de 4.2x10-2 L/h, fase móvil: H2SO4 0,0025N).
A continuación se presentan algunas definiciones que se utilizan en este artículo para evaluar el desempeño de las membranas [29]. Las definiciones se aplican para mezclas binarias y se extienden para sistemas multicomponentes cuando el componente j representa el remanente de la mezcla.
Flujo molar:
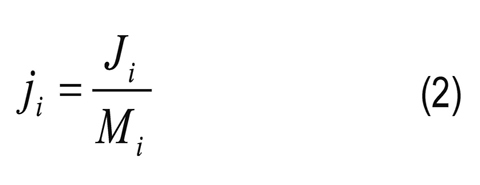
Factor de separación (con frecuencia llamado selectividad por algunos autores):
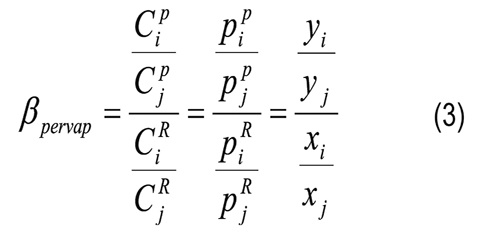
Permeabilidad [29]:
Permeancia [29]:
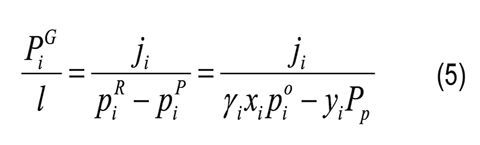
Selectividad [29]:
Donde CiP y CiR son las concentraciones molares del componente i en el permeado y retenido, respectivamente; ji es el flujo molar; Ji es el flujo másico; Mi es el peso molecular del componente i; yi y xi son las composiciones molares del componente i en el permeado y retenido, respectivamente; l es el espesor de la membrana; pi0 es la presión de vapor del componente i puro; piR y piP son las presiones parciales del componente i en el retenido y permeado, respectivamente; γi es el coeficiente de actividad (calculado por el método de UNIFACDortmund) del componente i; Pi es la presión en el permeado y PjG está definido por la Ecuación 4 aplicada al componente de referencia j. En las selectividades y factores de separación de cada compuesto, reportados en este artículo, se toma el agua como componente de referencia.
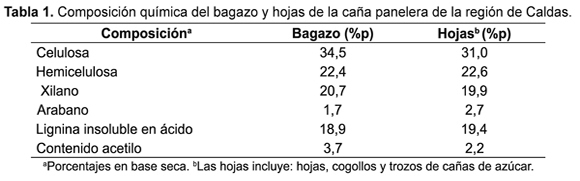
Los resultados de la caracterización de los residuos de la caña panelera en porcentaje en base seca se reportan en la Tabla 1. El contenido de holocelulosa fue del 56,9%p para bagazo y 53,6%p para las hojas. Comparando la composición de los carbohidratos del bagazo y las hojas de la caña panelera de la región de Caldas con el resultado promedio calculado a partir de información reportada en la literatura [30â37], se encontró que el contenido fue menor en 6,4%p para celulosa y 6,0%p para hemicelulosa.
En Colombia en el año 2009 la superficie total sembrada de caña panelera fue de 19x108m2, por lo tanto, a nivel nacional se producen aproximadamente 2,62Mt de bagazo y 0,72Mt de hojas [38]. Asumiendo rendimientos en la sacarificación y fermentación del 80%p en xilosa y del 90%p en glucosa y a partir de los resultados de la Tabla 1 es posible producir 302 y 278L de etanol por tonelada de bagazo y hojas, respectivamente.
Estos resultados implican que los residuos de la caña panelera en Colombia representan alrededor de 320ML de etanol al año, si se utiliza la tercera parte de éstos.
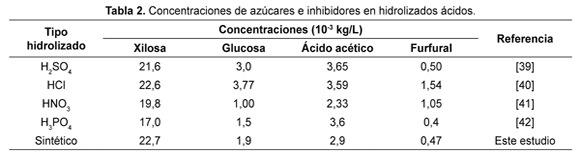
La composición del hidrolizado sintético se escogió de acuerdo con los resultados reportados en la literatura de hidrolizados ácidos a partir de bagazo de caña (ver Tabla 2). La composición de los residuos de la Tabla 1 se comparó con aquellos reportados en las referencias presentadas en la Tabla 2. La composición de los residuos está dentro de los valores de concentración reportados en la literatura y consecuentemente se esperan los valores de concentración de los diferentes inhibidores, como se reportan en la Tabla 2.
Del hidrolizado sintético sometido a pervaporación se determinó que permearon el agua, el ácido acético, el ácido fórmico y el furfural. Por el contrario, no permearon los azúcares (xilosa, glucosa), el ácido levulínico y el hidroximetilfurfural. Las permeancias del ácido levulínico, HMF, glucosa y xilosa posiblemente son cero porque, los dos primeros compuestos tienen una presión de vapor muy baja y en los azúcares esta presión es básicamente nula.
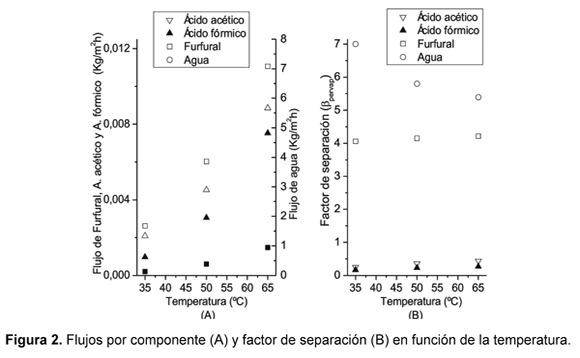
Los valores de flujo por componente a través de la membrana y los factores de separación obtenidos a partir de los datos experimentales para diferentes temperaturas se muestran en la Figura 2. Cuanto mayor es la temperatura mayor es el flujo por componente (Figura 2A) y consecuentemente, el flujo total. El factor de separación se incrementa levemente con la temperatura para el furfural, ácido acético y ácido fórmico, sin embargo para el agua disminuye (Figura 2B). Se podría inferir que la membrana es "selectiva" retirando agua (βH2O ≥ 5,0) y furfural (βfurfural ≅ 4,0) porque los factores de separación son mayores a la unidad, mientras que para ácido acético y fórmico son menores a la unidad. Sin embargo, factores de separación mayores a la unidad no implican necesariamente membranas selectivas [29].
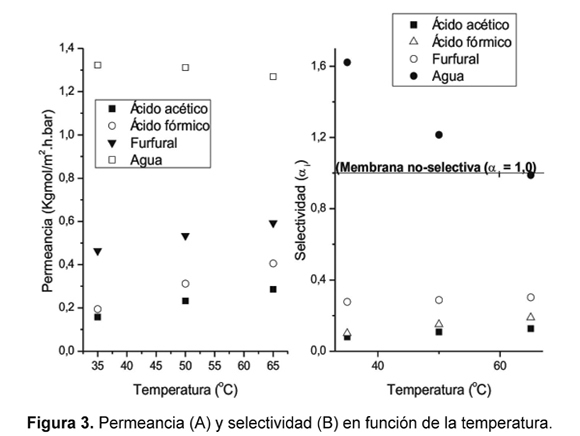
La permeancia es el flujo molar a través de la membrana por componente normalizado respecto de la fuerza impulsora aplicada. En la Figura 3A se observa que la permeancia casi no cambia para el agua. Consecuentemente el flujo de agua a través de la membrana depende por completo de su fuerza impulsora. Se debe notar que cuanto mayor es la temperatura, mayor es la presión de vapor del agua en el retentado (o mayor la fuerza impulsora). En cambio, las permeancias del ácido fórmico y ácido acético cambiaron aun cuando se sustrae el efecto de la fuerza guía, Figura 3A. A 35°C la permeancia fue de 0,194kgmol x m-2h-1bar-1 para ácido fórmico y de 0,175kgmol x m-2h-1bar-1 para ácido acético, y a 65°C aumentaron hasta 0,406kgmol x m-2h-1bar-1 y 0,286kgmol x m-2h-1bar-1, respectivamente.
En la Figura 3B se reporta la selectividad de la membrana (Ec. 6) y se traza una línea continua que representa una membrana que no contribuye a la separación (αi = 1). En esta figura se observa que la membrana es solo selectiva al agua y que la selectividad aparente de la membrana retirando furfural observada en la Figura 2B se debe a su volatilidad. Si se compara con la evaporación, por ejemplo, en la pervaporación a 35°C la concentración de furfural en el permeado debería estar alrededor de los 3,0g/L para igualar el desempeño alcanzado en la evaporación; sin embargo, experimentalmente se encontró una concentración de aproximadamente 2,0g/L. La separación de furfural por evaporación es más selectiva que los valores encontrados experimentalmente para la membrana de PDMS por pervaporación.
También se observa en la Figura 3B que la membrana es más eficiente que la evaporación para retirar agua a temperaturas menores de 50°C (αi ≥ 1 ). A temperaturas mayores esta eficiencia disminuye hasta equipararse con el proceso de la evaporación a 65°C.
La disminución en la selectividad de la membrana hacia el agua se debe principalmente al aumento de las permeancias de los ácidos orgánicos (aumentando la permeancia desde 0,352kgmol x m-2h-1bar-1 a 35°C hasta 0,692kgmol x m-2h-1bar-1 a 65°C) y en una menor proporción al incremento de la permeancia del furfural (que aumentó desde 0,464kgmol x m-2h-1bar-1 a 35°C hasta 0,593kgmol x m-2h-1bar-1 a 65°C). La disminución en la selectividad de remoción del agua no se debe a la disminución de la permeancia del agua, la cual permaneció aproximadamente constante. Generalmente, si la temperatura aumenta también lo hace la difusión y explicaría el aumento de la movilidad de los ácidos orgánicos y el furfural dentro la membrana. Este efecto también se aplica al agua, sin embargo la membrana está saturada con una composición tan alta de agua que el efecto es relevante para los componentes que se transfieren en menor proporción. Los diámetros de Stokes del ácido fórmico, ácido acético y el furfural son de 0,323ηm, 0,412ηm y 0,348ηm, respectivamente [16] y los incrementos en las permeancias al aumentar la temperatura desde 35°C hasta 65°C del ácido fórmico, ácido acético y el furfural fueron del 109, 82 y 28% respectivamente. Entonces, el aumento en la temperatura incrementa la difusión de estos componentes, pero la difusión en si sola no puede explicar un aumento tan significativo en las permeancias.
Por otro lado, la temperatura afecta la viscosidad reduciéndola y aumentando el flux, si el mecanismo de transporte se parece a aquel de flujo viscoso en medios porosos [43]. Consecuentemente, los resultados parecen indicar que existe una contribución de flujo viscoso en poros sobre el transporte de estos inhibidores a través de la membrana. En este sentido, la permeancia del agua entonces debería aumentar también, sin embargo, la membrana sintetizada en este trabajo es organofílica (Figura 3) y al aumentar el paso de los componentes orgánicos se afecta negativamente la permeancia del agua justificando su disminución leve desde 1,323kgmol x m-2h-1bar-1 a 35°C hasta 1,270kgmol x m-2h-1bar-1 a 65°C. La remoción de furfural se puede comparar con los resultados de Sagehashi et al. [23], quienes usaron membranas de PDMS. Las membranas utilizadas por Sagehashi et al. son selectivas a la remoción de furfural en todo el intervalo de temperaturas (40 â 120°C) con una selectividad máxima alrededor de los 60°C y luego disminuye, a pesar de esto la membrana siempre es más eficiente removiendo furfural que en un proceso de evaporación convencional. Las permeancias del furfural obtenidas por Sagehashi et al. y esta investigación, a 60°C, fueron de 0,106kgmol x m-2h-1bar-1 y 0,570kgmol m-2h-1bar-1, respectivamente. Sin embargo, la membrana de Sagehashi et al. es 20 veces más selectiva al furfural que en este estudio. Las altas permeancias obtenidas en este trabajo se deben a la diferencia de espesores de la membrana, Sagehashi et al. con un espesor de 200μm y en este trabajo con un espesor aproximado de 1μm. Con estos espesores de membrana se calcularon las permeabilidades y se encontró que la permeabilidad de la membrana del estudio de Sagehashi et al. 2007 es 37 veces menor comparada con la permeabilidad de la membrana de este estudio. Esto implica que las membranas deben ser preparadas con espesores mucho mayores para mejorar la selectividad, reduciendo el flujo a través de la membrana. Y sugiere que es la difusión a través de la membrana el mecanismo que controla principalmente la selectividad de la misma y no la solubilidad de los componentes en el polímero.
Se preparó y evaluó el desempeño de una membrana de PDMS para la remoción de inhibidores presentes frecuentemente en el pretratamiento de material lignocelulósico proveniente del bagazo y las hojas de caña panelera.
La membrana preparada permite la remoción de ácido acético, ácido fórmico y furfural mientras no se presentó permeación alguna del ácido levulínico, xilosa, glucosa y HMF en el intervalo de temperaturas de 35 a 65 °C.
El aumento de la temperatura incrementa las permeancias en el siguiente orden: ácido fórmico > ácido acético > furfural.
Los resultados indican que es posible realizar la detoxificación de hidrolizados mediante pervaporación y que para mejorar la selectividad del proceso es necesario preparar membranas con mayores espesores y/o mejores propiedades organofílicas.
Estos resultados permitirán explorar nuevas membranas y nuevos procesos híbridos de fermentación en donde se realiza la remoción simultánea de productos e inhibidores por pervaporación.
Se agradece el soporte financiero de COLCIENCIAS bajo el proyecto 1119-405-20248 y el contrato CT-018-2007.
[1] Londoño LF. Informe anual 2010-2011. Cali, Valle del Cauca, Colombia; 2011. [ Links ]
[2] Flórez-Muñoz JL. Que Hacemos. Bioenergy Industrial (sitio en Internet). Bioenergy S.A. Disponible en: http://www.bioenergy.com.co/espanol/Paginas/QueHacemosSAS.aspx, Consultado el 15 de enero 2011. [ Links ]
[3] Jeffries TW, Grigoriev IV, Grimwood J, Laplaza JM, Aerts A, Salamov A, et al. Genome sequence of the lignocellulose-bioconverting and xylose-fermenting yeast Pichia stipitis. Nat. Biotechnol. 2007;25(3):319â26. [ Links ]
[4] Agbogbo FK, Coward-Kelly G. Cellulosic ethanol production using the naturally occurring xylose-fermenting yeast, Pichia stipitis. Biotechnol. Lett. 2008;30(9):1515â24. [ Links ]
[5] Delgenes J. Effects of lignocellulose degradation products on ethanol fermentations of glucose and xylose by Saccharomyces cerevisiae, Zymomonas mobilis, Pichia stipitis, and Candida shehatae. Enzyme Microb. Technol. 1996;19(3):220â5. [ Links ]
[6] Tsao GT, Cao N, Gong CS. Hemicellulose conversion. En: Encyclopedia of Bioprocess Technology, Fermentation, Biocatalysis and Bioseparation. Flickinger MC, Drew SW, Editor. United States of America: John Wiley & Sons, Inc. 1999. p. 1391â400. [ Links ]
[7] Mussatto SI, Santos JC, Roberto IC. Effect of pH and activated charcoal adsorption on hemicellulosic hydrolysate detoxification for xylitol production. J. Chem. Technol. Biotechnol. 2004;79(6):590â6. [ Links ]
[8] Palmqvist E. Fermentation of lignocellulosic hydrolysates. I: inhibition and detoxification. Bioresour. Technol. 2000;74(1):17â24. [ Links ]
[9] Pienkos PT, Zhang M. Role of pretreatment and conditioning processes on toxicity of lignocellulosic biomass hydrolysates. Cellulose. 2009;16(4):743â62. [ Links ]
[10] Jönsson LJ, Palmqvist E, Nilvebrant NO, Hahn-Hägerdal B. Detoxification of wood hydrolysates with laccase and peroxidase from the white-rot fungus Trametes versicolor. Appl. Microbiol. Biotechnol. 1998;49(6):691â7. [ Links ]
[11] Larsson S, Reimann A, Nilvebrant NO, Jönsson LJ. Comparison of Different Methods for the Detoxification of Lignocellulose Hydrolyzates of Spruce. Appl. Biochem. Biotechnol. 1999;77(1-3):91â104. [ Links ]
[12] Carvalheiro F, Duarte LC, Lopes S, Parajó JC, Pereira H, Gírio FM. Evaluation of the detoxification of brewery's spent grain hydrolysate for xylitol production by Debaryomyces hansenii CCMI 941. Process Biochem. 2005;40(3-4):1215â23. [ Links ]
[13] Murthy GS, Sridhar S, Sunder MS, Shankaraiah B, Ramakrishna M. Concentration of xylose reaction liquor by nanofiltration for the production of xylitol sugar alcohol. Sep. Purif. Technol. 2005;44(3):221â8. [ Links ]
[14] Sreenath H, Jeffries TW. Production of ethanol from wood hydrolyzate by yeasts. Bioresour. Technol. 2000;72(3):253â60. [ Links ]
[15] Stoutenburg RM, Perrotta JA, Amidon TE, Nakas JP. Ethanol production from a membrane purified hemicellulosic hydrolysate derived from sugar maple pichia stipitis NRRL Y-7124. BioResources. 2008;3(4):1349â58. [ Links ]
[16] Weng YH, Wei HJ, Tsai TY, Lin TH, Wei TY, Guo GL, et al. Separation of furans and carboxylic acids from sugars in dilute acid rice straw hydrolyzates by nanofiltration. Bioresour. Technol. 2010;101(13):4889â94. [ Links ]
[17] Cruz JM, Domínguez JM, Domínguez H, Parajó JC. Solvent extraction of hemicellulosic wood hydrolysates: a procedure useful for obtaining both detoxified fermentation media and polyphenols with antioxidant activity. Food Chem. 1999;67(2):147â53. [ Links ]
[18] Parajó JC, Domínguez H, Domínguez JM. Xylitol production from Eucalyptus wood hydrolysates extracted with organic solvents. Process Biochem. 1997;32(7):599â604. [ Links ]
[19] Miyafuji H, Danner H, Neureiter M, Thomasser C, Bvochora J, Szolar O, et al. Detoxification of wood hydrolysates with wood charcoal for increasing the fermentability of hydrolysates. Enzyme Microb. Technol. 2003;32(3-4):396â 400. [ Links ]
[20] Ranjan R, Thust S, Gounaris CE, Woo M, Floudas CA, Keitz MV, et al. Adsorption of fermentation inhibitors from lignocellulosic biomass hydrolyzates for improved ethanol yield and value-added product recovery. Microporous Mesoporous Mater. 2009;122(1-3):143â8. [ Links ]
[21] Persson P, Andersson J, Gorton L, Larsson S, Nilvebrant NO, Jönsson LJ. Effect of Different Forms of Alkali Treatment on Specific Fermentation Inhibitors and on the Fermentability of Lignocellulose Hydrolysates for Production of Fuel Ethanol. J. Agric. Food Chem. 2002;50(19):5318â25. [ Links ]
[22] Alriksson B, Sjöde A, Nilvebrant NO, Jönsson LJ. Optimal Conditions for Alkaline Detoxification of Dilute-Acid Lignocellulose Hydrolysates. Appl. Biochem. Biotechnol. 2005;130(1-3):599â611. [ Links ]
[23] Sagehashi M, Nomura T, Shishido H, Sakoda A. Separation of phenols and furfural by pervaporation and reverse osmosis membranes from biomass - superheated steam pyrolysis - derived aqueous solution. Bioresour. Technol. 2007;98(10):2018â26. [ Links ]
[24] Sluiter A, Hames B, Ruiz R, Scarlata C, Sluiter J, Templeton D, et al. Determination of Structural Carbohydrates and Lignin in Biomass Determination of Structural Carbohydrates and Lignin in Biomass (sitio en Internet). Disponible en: http://www.nrel.gov/biomass/pdfs/42618.pdf. Consultado el 16 de agosto de 2011. [ Links ]
[25] Noriega MA. Remoción de etanol en sistemas de fermentación alcohólica mediante pervaporación. Manizales, Colombia: Universidad Nacional de Colombia; 2010. [ Links ]
[26] Peters TA, Fontalvo J, Vorstman MAG, Benes NE, Van Dam RA, Vroon ZAEP, et al. Hollow fibre microporous silica membranes for gas separation and pervaporation. Synthesis, performance and stability. J. Membr. Sci. 2005;248:73â80. [ Links ]
[27] Verkerk AW, Male P, Vorstman MAG, Keurentjes JTF. Description of dehydration performance of amorphous silica pervaporation membranes. J. Membr. Sci. 2001;193:227â38. [ Links ]
[28] Verkerk AW, Male P, Vorstman MAG, Keurentjes JTF. Properties of high flux ceramic pervaporation membranes for dehydration of alcohol/water mixtures. Sep. Purif. Technol. 2001;22-23:689â95. [ Links ]
[29] Baker RW, Wijmans JG, Huang Y. Permeability, permeance and selectivity: A preferred way of reporting pervaporation performance data. J. Membr. Sci. 2010;248(1-2):346â52. [ Links ]
[30] Neureiter M, Danner H, Thomasser C, Saidi B, Braun R. Dilute-acid hydrolysis of sugarcane bagasse at varying conditions. Appl. Biochem. Biotechnol. 2002;98-100(1-9):49â58. [ Links ]
[31] Rabelo SC, Filho RM, Costa AC. A comparison between lime and alkaline hydrogen peroxide pretreatments of sugarcane bagasse for ethanol production. Appl. Biochem. Biotechnol. 2008;144(1):87â100. [ Links ]
[32] Vargas Betancur GJ, Pereira N. Sugar cane bagasse as feedstock for second generation ethanol production. Part I : Diluted acid pretreatment optimization. Electron. J. Biotechnol. 2010;13(3):1â9. [ Links ]
[33] Lee YJ, Chung CH, Day DF. Sugarcane bagasse oxidation using a combination of hypochlorite and peroxide. Bioresour. Technol. 2009;100(2):935â41. [ Links ]
[34] Buaban B, Inoue H, Yano S, Tanapongpipat S, Ruanglek V, Champreda V, et al. Bioethanol production from ball milled bagasse using an on-site produced fungal enzyme cocktail and xylose-fermenting Pichia stipitis. J. Biosci. Bioeng. 2010;110(1):18â25. [ Links ]
[35] Sindhu R, Binod P, Satyanagalakshmi K, Janu KU, Sajna KV, Kurien N, et al. Formic acid as a potential pretreatment agent for the conversion of sugarcane bagasse to bioethanol. Appl. Biochem. Biotechnol. 2010;162(8):2313â23. [ Links ]
[36] Ferreira-Leitão V, Perrone CC, Rodrigues J, Franke APM, Macrelli S, Zacchi G. An approach to the utilization of CO2 as impregnating agent in steam pretreatment of sugar cane bagasse and leaves for ethanol production. Biotechnol. Biofuels. 2010;3:1â8. [ Links ]
[37] Krishnan C, Sousa LDC, Jin M, Chang L, Dale BE, Balan V. Alkali-based AFEX pretreatment for the conversion of sugarcane bagasse and cane leaf residues to ethanol. Biotechnol. Bioeng. 2010;33(8):1â10. [ Links ]
[38] Curbelo A, Bárbara G, Moreda G, Valdes A. Generación de electricidad a partir de bagazo en Cuba. En: Reunión regional sobre generación de electricidad a partir de biomasa. Montevideo, Uruguay (sitio en Internet). Oficina regional de la FAO para América Latina y el Caribe; 1994. Disponible en: http://www.fao.org/docrep/T2363s/t2363s0n.htm. Consultado el 23 de junio de 2011. [ Links ]
[39] Aguilar R, Ramírez J, Garrote G, Vázquez M. Kinetic study of the acid hydrolysis of sugar cane bagasse. J. Food Eng. 2002;55(4):309â18. [ Links ]
[40] Bustos G, Ramírez JA, Garrote G, Vázquez M. Modeling of the hydrolysis of sugar cane bagasse with hydrochloric acid. Appl. Biochem. Biotechnol. 2003;104(1):51â68. [ Links ]
[41] Rodríguez-Chong A. Hydrolysis of sugar cane bagasse using nitric acid: a kinetic assessment. J. Food Eng. 2004;61(2):143â52. [ Links ]
[42] Gámez S, Ramírez JA, Garrote G, Vázquez M. Manufacture of fermentable sugar solutions from sugar cane bagasse hydrolyzed with phosphoric acid at atmospheric pressure. J. Agric. Food Chem. 2004;52(13):4172â7. [ Links ]
[43] Bird RB, Stewart WE, Lightfoot EN. Transport Phenomena. New York: John Wiley & Sons Inc. 2002. p.189-92. [ Links ]