Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista ION
Print version ISSN 0120-100X
Rev. ion vol.27 no.1 Bucaramanga Jan./June 2014
Pb-Ca-Sn por medio de técnicas electroquímicas
Hugo A. Estupiñán Duran1*; Darío Y. Peña Ballesteros2; Edison A. Quijano2; Rafael A. Peñate2
1* Departamento de Materiales y Minerales, Universidad Nacional de Colombia, Calle 75 Nº 79A-51 Núcleo Robledo, Medellín, Colombia.
*haestupinand@unal.edu.co
2 Escuela de Ingeniería Metalúrgica y Ciencia de los materiales, Universidad Industrial de Santander, Cra. 27 calle 9, Bucaramanga, Colombia.
Fecha Recepción: 07 de octubre de 2013
Fecha Aceptación: 13 de mayo de 2014
En el presente trabajo, se evaluó la influencia del aumento de la temperatura en la velocidad de corrosión de la aleación Pb-Ca-Sn, componente primario de la rejilla negativa de una batería de arranque de automóvil, mediante técnicas electroquímicas: RPL, curvas potenciodinámicas, Tafel y EIS. Mediante microscopia óptica, SEM-EDS y DRX, se caracterizaron los compuestos formados sobre las rejillas durante los ensayos. La capa pasiva formada sobre las rejillas empleadas como cátodo y ánodo en baterías de plomo-ácido, permite el anclaje en la interfase rejilla-PAM (Material Activo Positivo) o NAM (Material Activo Negativo). Un mal proceso de formación de esta capa ocasiona el desprendimiento del PAM/NAM, conduciendo a fallas prematuras. La temperatura influye directamente sobre la cinética de degradación y la termodinámica de las reacciones redox que tienen lugar en el sistema rejilla-PAM/ NAM. Un incremento en la temperatura produce variaciones en la composición química, favoreciendo la formación de mezclas de óxidos y sulfatos en la interfase rejilla-PAM/NAM, cuyo volumen y estructura porosa la hace susceptible a fallas por esfuerzos triaxiales sobre la interfase, produciendo grietas y el desprendimiento del PAM o NAM y disminuyendo el tiempo de vida útil de la batería. Se encontró que las aleaciones Pb-Ca-Sn en solución 0,5M de H2SO4 forman un sistema multicapa comprobándose con base en los resultados obtenidos de EIS y SEM, con los cuales se detectó una capa compacta de PbO2 y una capa porosa de PbSO4. Al incrementar la temperatura se encontró una capa más porosa de PbSO4, lo cual implica una mayor cinética de corrosión de la aleación Pb-Ca-Sn.
Palabras Clave: batería plomo-ácido, material activo negativo, corrosión, técnicas electroquímicas.
by electrochemical techniques
In this paper, the influence of increasing temperature on the corrosion rate of Pb-Ca-Sn alloy, the primary component of the negative grid of a starter battery car, was evaluated by electrochemical techniques: RPL, potentiodynamic curves, Tafel and EIS. By optical microscopy, SEM -EDS and XRD, the compounds formed on the grids were characterized during testing. The passive layer formed on the grids used as cathode and anode in lead-acid batteries allows the anchor in grid-PAM interface (Positive Active Material) or NAM (Negative Active Material). A bad process of to form this layer produces the detachment of PAM/NAM, leading to premature failure. The temperature directly affects the kinetics and thermodynamics degradation of the redox reactions taking place in the system grid-PAM/NAM. An increase in temperature causes variations in the chemical composition, favoring the formation of oxides and sulphates mixtures in grid-PAM/NAM interface, its volume and porous structure make it susceptible to failure by tri-axial stress on the interface, producing cracks and detachment of PAM or NAM and reducing the lifetime of the battery. It was found that the Pb-Ca-Sn alloys in 0.5M H2SO4 solution form a multilayer system, verified by the results of EIS and SEM, in which a compact layer of PbO2 and porous layer by PbSO4. Porous layer of PbSO4 was obtained, when the temperature was increased implying greater corrosion kinetics of Pb-Ca-Sn alloy were detected.
Keywords: lead-acid battery, negative active material, corrosion, electrochemical techniques.
através de técnicas eletroquímicas
Neste trabalho, a influência do aumento da temperatura sobre a taxa de corrosão da liga de Pb-Ca-Sn, o principal componente da grade negativa da bateria de arranque de um carro, foi avaliada por técnicas eletroquímicas: RPL, curvas potenciodinâmica, Tafel e EIS. Por microscopia óptica, SEM- EDS e XRD, os compostos formados nas grades foram caracterizados durante o teste. A camada passiva formada nas grades usadas como cátodo e o ânodo em baterias de chumbo-ácido, permite a âncora na interface de rede-PAM (Material Positivo Ativo) ou NAM (negativo material ativo). Um mau processo de formar esta camada leva ao desenvolvimento de PAM/NAM,conduzindo a falhas prematuras. A temperatura afeta diretamente a cinética de degradação e termodinâmica das reações redox que ocorrem no grade- PAM/NAM sistema. Um aumento da temperatura faz com que as variações na composição química, favorecendo a formação de misturas de óxidos e sulfatos na interface grade-PAM/NAM, o volume e estrutura porosa tornam susceptíveis de falha por stress triaxial na interface, produzindo fissuras e desprendimento do PAM ou NAM e reduzindo o tempo de vida da bateria. Verificou-se que as ligas de Pb-Ca-Sn em solução 0,5M de H2SO4 formar um sistema de múltiplas camadas , a verificação com base nos resultados da EIA e SEM , com as quais foi detectada uma camada compacta de PbO2 e camada porosa PbSO4. Ao aumentar a temperatura de uma camada porosa de PbSO4 foi encontrado, o que implica maiores cinética de corrosão de liga de Pb-Ca-Sn.
Palavras-chave: bateria de chumbo-ácido, material ativo negativo, corrosão, técnicas eletroquímicas.
Citar como: Estupiñán Duran HA, Peña Ballesteros DY, Quijano EA, Peñate RA. Evaluación de la corrosión de una aleación Pb-Ca-Sn por medio de técnicas electroquímicas. rev.ion. 2014;27(1):71-80.
Las baterías plomo-ácido, son diseñadas para operar a temperaturas entre -18 y 40°C. La capacidad de la batería se incrementa al aumentar la temperatura; sin embargo, esto no significa que a mayor temperatura se obtenga un mejor desempeño [1,2]. Si bien, las baterías pueden estar expuestas a un rango entre -20 y 70°C, al alcanzar las temperaturas más elevadas, el proceso electroquímico de óxido-reducción se ve afectado cinética y termodinámicamente, debido a las reacciones de reducción que tienen lugar, como la evolución de hidrógeno, la reducción de iones hidrógeno y la formación de oxidrílos, por la reducción de oxígeno. Bajo las condiciones antes mencionadas, se genera la formación de compuestos como sulfato de plomo (PbSO4) y óxido de plomo (PbOx) con x entre 1 y 2. Estos óxidos y sulfatos presentan una estructura porosa y de mayor volumen, por tal motivo se generan esfuerzos triaxiales sobre el PAM (Material Activo Positivo) y el NAM (Material Activo Negativo), formando grietas con posterior propagación y desprendimiento de dichos compuestos, lo cual influye de manera directa sobre la vida útil de la batería, generando un electrolito de mayor viscosidad, producto del desprendimiento del PAM y NAM [3,4]. Este tipo de degradación, termodinámicamente no reversible, se produce independientemente de la corriente que circule por el acumulador de energía [5]. La mayoría de las baterías plomo-ácido trabajan con una solución de H2SO4 concentrado, donde las aleaciones de plomo empleadas como cátodo y ánodo en el acumulador de energía trabajan adecuadamente. La capa pasiva formada en la interfase rejilla-PAM y rejilla-NAM son claves para garantizar el funcionamiento adecuado.
Una variable que influye de manera directa en la cinética de degradación de la rejilla es el cambio de la temperatura. Las variaciones en la temperatura se deben al mal diseño del habitáculo donde está ubicada la batería, el cual permite la trasferencia de calor por radiación y convección desde el motor del automóvil; de igual manera la temperatura es función del sitio donde se encuentre operando la batería [6].
La aleación Pb-Ca-Sn (0,3% de estaño y 0,09% de calcio) es empleada como soporte estructural para el NAM actuando como ánodo en el proceso de descarga en el acumulador de energía. La caracterización metalográfica de la aleación, se realizó por microscopia óptica sobre un área de 1cm2 dispuesta en baquelita, desbastada hasta lija de SiC número 1200, pulida con alúmina 0.5μ con dos paños para metal no ferroso y atacado con ácido acético glacial y H2O2 (30%) relación 3:1 durante 15s.
Con el fin de evaluar la corrosión, se tomó una muestra de un área superficial de aproximadamente 5cm2 y se unió a un cable tipo filamento teniendo la precaución de cubrir la unión con resina epóxica para evitar la formación de un par galvánico. Cada electrodo se expuso a un tiempo de curado de cuarenta y ocho horas aproximadamente. En los ensayos electroquímicos se utilizó como electrodo de referencia Calomel Saturado (SCE) y dos electrodos auxiliares de grafito. Los ensayos experimentales consistieron en sumergir la aleación Pb-Ca-Sn en una solución 0,5M de H2SO4 a temperaturas de 25, 35, 45, 55 y 65°C simulando las condiciones más severas de temperatura a la cuales estaría expuesta una batería durante su vida útil [7]. Para cada ensayo se usaron aproximadamente 800ml de esta solución y cada ensayo electroquímico se realizó por duplicado. Antes de cada ensayo electroquímico se aplicó un potencial de -1,2V durante 5min sobre el electrodo de trabajo, con el objetivo de eliminar cualquier óxido formado durante el pre-tratamiento. En la determinación de la extrapolación de Tafel se aplicó una velocidad de barrido de 7,5mV/min desde un potencial de -250 hasta 250mV, respecto al potencial del electrodo de referencia de calomel. Para obtener la resistencia a la polarización línea (RPL), se usó una velocidad de barrido de 10mV/ min desde un potencial de -20 a 20mV (respecto al potencial de calomel) y para observar el estado pasivo de la aleación se utilizó la técnica de polarización potenciodinámica anódica, aplicando una velocidad de barrido de 7,5mV/min desde un potencial de -50 hasta 800mV. Las curvas fueron generadas a partir de un bipotenciostato galvanostato ACM Gill guiado por el software del equipo y se manejó un tiempo de estabilización de 300 segundos entre ensayo. La caracterización del óxido se llevó a cabo por medio de la técnica de espectroscopia de impedancia electroquímica (EIS). Para esta técnica se aplicó una amplitud de potencial de 10mV en circuito abierto, con una frecuencia de barrido de 105 a 1Hz. Las curvas experimentales fueron analizadas mediante circuitos equivalentes por medio del software Zview® 2.9. Se estabilizó el sistema mediante la técnica de DC OCP (potencial en circuito abierto) por un tiempo de aproximadamente de 3600s.
Por último, se analizó la capa de óxido formada sobre las muestras expuestas a 25 y 65°C mediante microscopia óptica y microscopia electrónica de barrido (SEM). Los compuestos cristalinos formados como subproducto de las reacciones electroquímicas que tuvieron lugar en la interfase rejilla-electrolito, se caracterizaron mediante DRX. Se realizó en un difractómetro de polvo marca RIGAKU modelo D/MAX IIIB donde el análisis cualitativo de las fases presentes (Identificación de fases cristalinas de óxidos de plomo) en la muestra se realizó mediante comparación del perfil observado con los perfiles de difracción reportados en la base de datos PDF-2 del International Centre for Diffraction Data (ICDD) a un voltaje de 40kV, corriente de 30mA y muestreo de 0,02° (2θ).
En la Figura 1 se observa la sección transversal de un alambre de una rejilla de Pb-Ca-Sn.
El alambre de la rejilla muestra una estructura típica de una aleación de plomo con 0,23% de estaño y 0,09% de calcio obtenida mediante el proceso "metal expandido" cuyos granos son alargados producto del mismo proceso de conformado (Figura 2).
Las muestras se prepararon para su respectivo análisis metalográfico según norma ASTM E3 [8]. Se determinó el tamaño de grano de la aleación en la rejilla, según norma ASTM E112, utilizando el método planimétrico de Jefrie [9]. En la Tabla 1 se presentan los resultados obtenidos.
El calcio en la aleación Pb-Ca-Sn se adiciona para proveerle mejores propiedades mecánicas, este aumento se da por la formación de precipitados de Pb3Ca después de realizar tratamientos de envejecido a temperatura ambiente.
Cabe mencionar que esta aleación es ampliamente empleada en las baterías de plomo-ácido, porque es una aleación que en presencia de ácido sulfúrico genera sobrepotenciales electroquímicos altos en las reacciones de reducción tales como la evolución de hidrógeno y la formación de oxidrílos, lo que significa que la batería es de libre de mantenimiento [10,11].
Cinética de corrosión
Los valores de Rp fueron obtenidos según la norma ASTM G-59[12]. Los resultados de resistencia a la polarización con respecto a la temperatura mostrados en la Figura 3, corresponden a un decaimiento progresivo entre 25 y 40°C; lo cual implica, un aumento en la velocidad de corrosión en este rango de temperatura, que continua hasta más de 60°C.
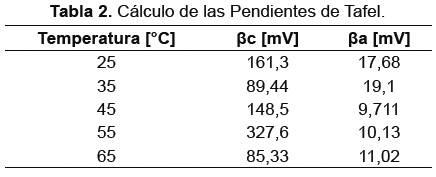
Los resultados de las pendientes anódicas y catódicas de las rejillas ensayadas a las diferentes temperaturas, se muestran en la Tabla 2.
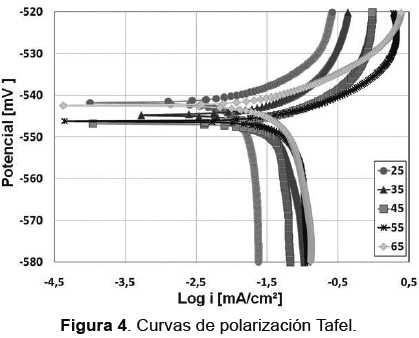
Estos resultados fueron obtenidos de la extrapolación de Tafel según la norma ASTM G3- 89 [13]. En la Figura 4 se muestran las curvas potenciodinámicas obtenidas, con las cuales se obtuvieron las pendientes de Tafel.
En la Figura 4 se observa que existe una tendencia a aumentar las velocidades de corrosión, con el incremento de temperatura, así como la tendencia a generar una corriente límite más alta relacionada con la difusión de oxígeno y la evolución de hidrógeno, con el incremento de temperatura, observándose que la temperatura influye en la cinética de las reacciones de reducción (Tabla 2). Igualmente en el rango de polarización anódica, es posible distinguir una formación de capa de óxido (posiblemente porosa, sustentado esto por la corriente límite presentada); sin embargo, es posible que se requiera de realizar curvas potenciodinámicas anódicas en un rango mayor al empleado en este trabajo, para verificar esta formación. En la Figura 5 se presenta los resultados del cálculo en milímetros por año de la velocidad de corrosión a las diferentes temperaturas, observándose un aumento en la velocidad de corrosión, a excepción de la temperatura de 35°C, lo cual se puede relacionar con efectos de protección de material o a la formación de productos intermedios de corrosión que podrían contribuir a retardar la cinética de corrosión.
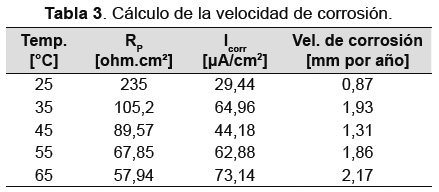
Los valores de RP y de velocidad de corrosión calculados para los ensayos experimentales realizados se muestran en la Tabla 3 Para los cálculos de estos valores se utilizó la norma ASTM G 59 [12] y G102 [14].
De acuerdo a esto, la tendencia a disminuir los valores de resistencia a la polarización con la temperatura, concuerda con el incremento de la velocidad de corrosión con esta (a excepción del valor de velocidad de corrosión obtenido a 35°C) En la Figura 6 se muestra una gráfica de corriente de corrosión contra el inverso de la temperatura, la cual permite obtener una aproximación a la cinética de formación de óxidos afectada por la temperatura en las rejillas estudiadas. Se puede observar que existen dos cambios en el control del sistema, del punto X1 a X2 predomina un aumento en la velocidad de corrosión hasta aproximadamente 35°C. Después de esta temperatura, la corriente de corrosión disminuye; es decir, los óxidos son más estables en este rango.
De la misma forma, del punto X2 a X3 predomina un aumento progresivo de la velocidad de corrosión a medida que se incrementa la temperatura, pero con una cinética de corrosión menor que la evidenciada desde el punto X1 a X2 [15]. Esto tiene concordancia con lo observado anteriormente en la curvas Tafel, donde se observa un cambio en la cinética del sistema. Además de una posible explicación al cambio de velocidad de corrosión en el rango de temperaturas entre 40 y 50°C. Las curvas potenciodinámicas anódicas obtenidas para los electrodos expuestos se muestran en la Figura 7.
Se puede observar que a medida que se aumenta la temperatura, la densidad de corriente en la zona activa (de -550mV aproximadamente, hasta -150mV) disminuye. Ya en la zona pasiva (mayor de -100Mv), la densidad de corriente aumenta con la temperatura. Esto implica que en la formación de los productos de óxido sobre las rejillas, están implicados procesos difusivos que se hacen más notables a medida que las capas de óxido alcanzan una mayor porosidad, en la cual la temperatura tiene gran efecto. Una posible explicación a este fenómeno se da con el empleo de la técnica de Espectroscopia de Impedancia Electroquímica, con la cual se pudo corroborar que los productos de óxido formados, pierden sus propiedades dieléctricas con la temperatura
Espectroscopia de Impedancia Electroquímica
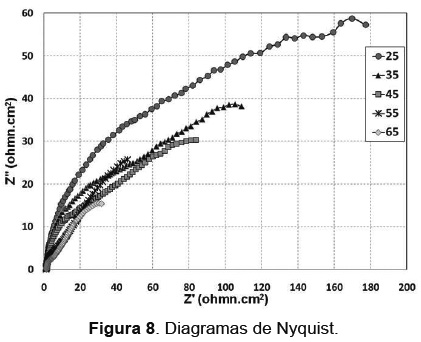
Los diagramas de Nyquist obtenidos en la Figura 8, muestran la presencia de dos relajaciones (dos arcos que se muestran traslapados); lo que puede indicar que las capas de óxidos formadas no sean completamente homogéneas, además de muestra que, a medida que se incrementa la temperatura del electrolito, estos arcos son más pequeños (una menor impedancia) lo cual corrobora los resultados obtenidos por la técnica de resistencia a la polarización lineal.
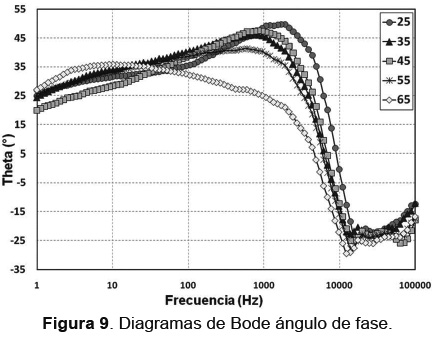
De la Figura 9 a altas frecuencias, hace referencia a la capa porosa de sulfato de plomo, con un comportamiento de capa resistiva y una segunda capa compacta a media y baja frecuencia que se traslapa con el comportamiento de la aleación, se relaciona al PbO2, menos resistivo que la capa de sulfato de plomo, corroborando lo observado por otros investigadores. Esto se evidencia con los resultados de SEM y EDS, donde se observa claramente una capa porosa de sulfato de plomo y una capa compacta de PbO2. Los diagramas de Bode de ángulo de fase que se observan en la Figura 9, muestran que el ángulo máximo que se encuentra a altas frecuencias, disminuye de un valor de aproximadamente 48° a un valor de 30° a medida que la temperatura se incrementa. Confirmando la formación de una capa menos densa [10].
El ángulo de fase a bajas frecuencias, tiende a aumentar para las temperaturas de 55 y 65°C, posiblemente porque la capa de óxido es menos estable y el sistema sólo depende de la doble capa porosa o capacitiva, es decir; sólo ocurre intercambio iónico entre el metal solución sin una barrera física que lo impida. Para lo cual se propone un circuito similar al de un material con recubrimiento poroso (Figura 11). Los diagramas de Bode (Logaritmo Frecuencia vs Impedancia) mostrados en la Figura 10, confirman la formación de una capa de óxido más porosa a medida que se aumenta la temperatura, se evidencian dos cambios de pendientes lo cual implicará dos constantes de tiempo. Variaciones en la impedancia entre 10000 y 100000Hz, son atribuidos a efectos de disolución localizada por la acidez del electrolito.
Teóricamente se afirma que para que en un sistema ocurra difusión, es necesario que la pendiente del segundo domo sea igual a 0,5 en condiciones ideales. Sin embargo, como se trata de semicírculos este valor está influenciado por el efecto de los elementos de fase constante involucrados en el circuito [17]. El factor η representa la pendiente del semicírculo a bajas frecuencias, se puede decir que a la frecuencia a la cual se trabajó no alcanza a los valores en los cuales se evidencia la presencia de difusión en el sistema por lo que los valores obtenidos no alcanzan el valor de 0,5. Los valores para cada uno de los elementos constituyentes del circuito modelo se calcularon a partir de los datos experimentales y luego fueron simuladas por medio del software Zview 2.9® (Figura 11), con el objeto de ajustar y corroborar que tan exactos eran los datos experimentales en comparación con los ideales [10,18].
De acuerdo con los fenómenos electroquímicos observados en los ensayos de impedancia se describe el circuito de la siguiente manera:
- Rsol: Resistencia del electrolito.
- R1: Resistencia de la primera capa (metalsolución).
- EFC1: Resistencia y capacitancia interna de la primera capa, pero debido a que el valor de η sea 0,4, se puede considerar como un medio resistivo.
- R2: Resistencia de la doble capa electroquímica y es donde se lleva a cabo el intercambio iónico.
- EFC2: Resistencia y capacitancia de la doble capa electroquímica y por lo que el valor de η tiende a 0,6, se puede considerar como un medio capacitivo.
En la Tabla 4 se muestran los resultados obtenidos de la técnica y de la simulación y ajuste a un modelo que mostrado en la Figura 11), indicando con estos resultados que a medida que aumenta la temperatura, la primera capa pasa de ser capacitiva a resistiva, y lo contrario sucede con la segunda capa que pasa de ser capacitiva a ser resistiva (película porosa). Este significado puede estar dado por la actividad de los elementos presentes en la aleación, los cuales pueden ser más estables en ciertos valores de potencial. Se propone que en un rango de potenciales por debajo de -50mV, hay presencia de óxidos que son más estables a temperaturas mayores, sin embargo, por encima de este potencial dichos compuestos tienden a ser menos estables, es decir la película de óxido se degrada perdiendo sus propiedades protectoras [10,16].
Los óxidos formados después de realizar los ensayos electroquímicos estos fueron analizados mediante microscopia óptica y microscopia electrónica de barrido, para esto se utilizaron dos probetas expuestas a dos temperaturas; la primera a 25°C y la segunda a una temperatura de 65°C, las cuales fueron utilizadas durante los ensayos electroquímicos. Las dos muestras fueron montadas en resina epóxica, y posteriormente, cortadas y pulidas para su observación.
Se observa en la Figura 12), la caracterización del óxido formado para la aleación Pb-Ca-Sn expuesta a 25°C, se puede decir que a esta temperatura se observa una corrosión uniforme y una capa densa (capa pasiva), lo que coincide con el perfil en 3D para esta probeta mostrado en la Figura 13).
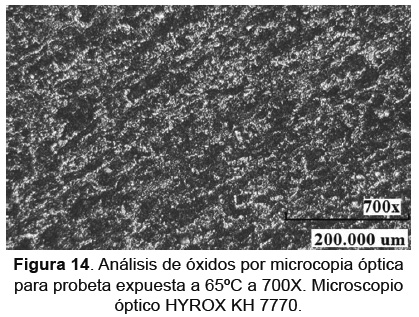
La caracterización física para el óxido formado en la probeta expuesta a 65°C se muestra en la Figura 14, en esta se observa una capa de óxido poco uniforme. De igual manera, en la reconstrucción en 3D mostrada en la Figura 15, se analiza que es una estructura muy delgada y que no cubre totalmente algunos sectores de la superficie de la probeta.
Por otra parte en la Figura 16 se presentan los cortes transversales de la probeta expuesta a 25°C en solución 0,5M de H2SO4 a 20μm, los cuales se les realizo análisis morfológico y de composición química con ayuda de SEM y EDS. En esta fotografía se observa la presencia de dos capas, lo cual es concordante con lo obtenido en los análisis realizados con EIS.
Según la micrografía anterior, la capa superficial es una capa poco compacta y de una estructura porosa, la cual corresponde a sulfato de plomo (Anglesita), esto fue corroborado posteriormente con un ensayo DRX para dicha muestra (Tabla 5), evidenciándose la presencia de este compuesto, además de estar relacionado con el hecho de que teóricamente el PbSO4 es encontrado en la superficie [19].
Por otra parte, se puede afirmar que la segunda capa corresponde al PbO2, la cual muestra una apariencia más compacta. Se puede afirmar que a esta temperatura la capa pasiva tiende a ser más protectora, debido a la formación de una doble capa que bloquea la superficie [17].
Sin embargo, es notable que a medida que se incrementa la temperatura esta capa se degrada tendiendo a ser más delgada, como se muestra en la Figura 17; la cual fue tomada al corte transversal de la probeta expuesta a 65°C a 2μm, debido a que a 20μm el objetivo era demasiado pequeño y delgado.
Se puede observar la presencia de sulfato de plomo y algunos compuestos de estaño, lo cual también se corroboró experimentalmente con un análisis de difracción de rayos X (Tabla 6).
Se evidencia un aumento en la cinética de corrosión con el aumento de la temperatura de las aleaciones Pb-Ca-Sn, al ser expuesto a una solución de 0,5 Mde H2SO4.
Las aleaciones Pb-Ca-Sn en solución 0,5M de H2SO4 forman un sistema multicapa, comprobándose con base en los resultados obtenidos de EIS y SEM, con los cuales se detectó una capa compacta de PbO2 y una capa porosa de PbSO4. Al incrementar la temperatura se encontró una capa más porosa de PbSO4, lo cual implica una mayor cinética de corrosión de la aleación Pb-Ca-Sn.
La aleación Pb-Ca-Sn tiene tendencia a pasivarse independientemente de la temperatura. Se presenta un aumento en la cinética de corrosión en función de la temperatura seguida de la pasivación de la misma, presentando menores densidades de corriente y una mayor estabilidad, observándose este aspecto en la ventana de sobrepotencial trabajada.
En el intervalo de temperatura de 25 a 45°C se evidencia una cinética de corrosión elevada, a diferencia de lo observado, en el intervalo de temperaturas entre 45 a 55°C, siendo la temperatura de transición en la cual el óxido formado en la superficie adquiere sus máximas propiedades protectoras, conllevando a que la velocidad de corrosión se mantenga constante.
Al Grupo de Investigaciones en Corrosión de la Universidad Industrial de Santander, al Centro de Materiales y Nanomateriales CMN-UIS y al Laboratorio de Difracción de Rayos X de la Universidad Industrial de Santander.
[1] Ruetschi P. Aging mechanisms and service life of lead-acid batterie. J. Power Sources. 2004;127(1-2):33-44. [ Links ]
[2] Ferg E E, Loyson P. The addition of red lead to flat plate and tubular valve regulated miners cap lamp lead-acid batteries. J. Power Sources. 2006;155(2):428-39. [ Links ]
[3] Albers J. Heat tolerance of automotive lead acid batteries. Journal of J. Power Sources. 2009 190(1):162-72. [ Links ]
[4] Petkova G, Pavlov D. Influence of charge mode on the capacity and cycle life of lead - acid batteries negatives plates. J. Power Sources. 2003;113(2):355-62. [ Links ]
[5] Energex. Efecto de temperatura en baterías tipo plomo-ácido (sitio en Internet). Disponible en: http://www.energex.com.co/pdf/temperaturabaterias.pdf; 2005. Acceso 10 de julio de 2012. [ Links ]
[6] D'alkaine CV, Mengarda P, Impinnisi PR. Discharge mechanisms and electrochemical impedance spectroscopy measurements of single negative and positive lead-acid battery plates. J. Power Sources. 2009:191(1):28-35. [ Links ]
[7] Osórioa W, Aoki C, García A. Hot corrosion resistance of a Pb-Sb alloy for lead acid battery grids. J. Power Sources. 2008;185(2):1471-7. [ Links ]
[8] American Society for Testing and Materials. ASTM E3-01, Guide for Preparation of Metallographic Specimens. Philadelphia, Estados Unidos; 2007. [ Links ]
[9] American Society for Testing and Materials. ASTM E112-96, Standard Test Methods for Determining Average Grain Size. Philadelphia, Estados Unidos; 2004. [ Links ]
[10] Slavkov D, Haran B, Popov B, Fleming F. Effect of Sn and Ca doping on the corrosion of Pb anodes in lead acid batteries. J. Power Sources. 2002;112(1):199-208. [ Links ]
[11] Bourguignon G, Rocca E. Electrochemical study in sulphuric acid of the hardening L12 phases of Pb-Ca-Sn Alloys. J. Power Sources. 2003;113(2):301-7. [ Links ]
[12] American Society for Testing and Materials. ASTM G59-97, Standard Test Method for Conducting Potentiodynamic Polarization Resistance Measurements, Philadelphia, Estados Unidos; 2009. [ Links ]
[13] American Society for Testing and Materials. ASTM G3-89, Standard Practice for Conventions Applicable to Electrochemical Measurements in Corrosion Testing. Philadelphia, Estados Unidos; 2010. [ Links ]
[14] American Society for Testing and Materials. ASTM G102-89, Standard Practice for Calculation of Corrosion Rates and Related Information from Electrochemical Measurements. Philadelphia, Estados Unidos; 2010. [ Links ]
[15] Szcze'sniak B, Cyrankowska M, Nowacki A. Corrosion kinetics of battery zinc alloys in electrolyte solutions. J. Power Sources. 1998;75(1):130-8. [ Links ]
[16] Shervedani R, Asghar Z, Khodavisy R, Hatefimehrjardi A. Electrochemical investigation of the anodic corrosion of Pb-Ca-Sn-Li grid alloy in H2SO4 solution. J. Power Sources. 2007;164(2):890-5. [ Links ]
[17] Zhong S, Wang J, Liu HK, Dou SX Skyllas-Kazacos M. Influence of silver on electrochemical and corrosion behaviors of Pb- Ca-Sn Al grid alloys Part II: A.c. impedance and scanning electron microscopy studies. J. Appl. Electrochem. 1999;29(2):177-83. [ Links ]
[18] Metiko's-Hukovi'c M, Babić R, Brinić s. EIS in situ characterization of anodic films on antimony and lead-antimony alloys. J. Power Sources. 2006;157(1):563-70. [ Links ]
[19] Bourguignon G, Rocca E, Steinmetz J. Corrosion management of Pb-Ca-Sn alloys in lead-acid batteries: Effect of composition, metallographic state and voltage conditions. J. Power Sources. 2006;161(1):666-75. [ Links ]