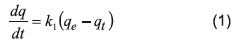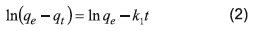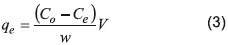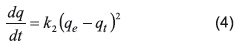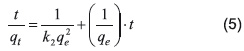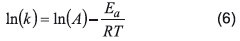Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista ION
versão impressa ISSN 0120-100X
Rev. ion vol.28 no.2 Bucaramanga jul./dez. 2015
https://doi.org/10.18273/revion.v28n2-2015005
DOI: http://dx.doi.org/10.18273/revion.v28n2-2015005
Carlos Mejía Miranda; *Dionisio Laverde; Verónica Avella; Darío Yesid Peña Ballesteros
Escuela de Ingeniería Química, Grupo de Investigaciones en Corrosión, Universidad Industrial de Santander (UIS)
Cra. 27 Calle 9, Bucaramanga, Colombia.
*caumejia@gmail.com
Fecha Recepción: 16 de diciembre de 2014
Fecha Aceptación: 22 de junio de 2015
La presencia de iones metálicos en aguas residuales genera un efecto tóxico para ecosistemas marinos y la salud pública. Las arcillas son materiales naturales con alta capacidad de adsorción y de bajo costo, viables para su implementación a nivel a industrial para la remoción de iones metálicos. Su implementación está limitada al desarrollo de alternativas para la utilización de estas arcillas a gran escala y en procesos continuos. La peletización de las arcillas permite su utilización en columnas de lecho fijo. En este trabajo se evaluó la cinética de adsorción de iones níquel sobre una arcilla bentónica peletizada. Los extrudados se prepararon por humectación de la arcilla con una solución acidifi cada con ácido nítrico al 2%v. La proporción en volumen arcilla/solución acuosa fue 2:1. Se evaluó la remoción de iones níquel a 20, 40, 100 y 160 minutos y temperaturas de 25, 40 y 60°C. La cinética de adsorción de Ni(II) se ajustó a un modelo de pseudo segundo orden. Las constantes cinéticas del modelo fueron 2,792x10-3, 8,085x10-4 y 6,292x10-4g/mg.min para las temperaturas de reacción 25, 45 y 60°C, respectivamente. A partir de la lineación de la ecuación de Arrhenius se determinó la energía de activación y el factor de frecuencia para la reacción de adsorción de iones níquel sobre arcilla bentonítica, siendo 29,58kJ/mol y 507,15g/mg.min, respectivamente. La magnitud de la energía de activación indica que la etapa controlante en la adsorción es la quimisorción de los iones níquel sobre la superfi cie de la arcilla.
Palabras clave: níquel, adsorción, bentonitas, arcillas, cinética.
The presence of metal ions in wastewater generates a toxic effect on marine ecosystems and public health. Clays are naturally occurring materials with high adsorption capacity, low cost, practical for implementation in industrial scale for the removal of metal ions. Its implementation is limited to the development of alternatives to the use of these clays on a large scale and continuous processes. Pelletizing clays can be used in fi xed bed columns. In this work the kinetics of adsorption of nickel ions on a benthonitic pelletized clay was evaluated. The extrudes were prepared by wetting the clay with a solution acidifi ed with nitric acid at 2%v. The proportion of clay / aqueous solution volume was 2:1. The adsorption kinetics of Ni(II) a pseudo second-order model is adjusted. The kinetic constants of the fi tted model were 2.792x10-3, 8.085x10-4 and 6.292x10-4g/mg.min and reaction temperatures for 25, 45 and 60°C, respectively. From the lineation of Arrhenius activation energy and frequency factor for the reaction of adsorption of nickel ions onto bentonite clay was determined to be 29.58kJ/mol and 507.15g/mg.min, respectively. The magnitude of the activation energy indicates that the controlling step in the adsorption is the chemisorption of the nickel ions on the clay surface.
Keywords: nickel, adsorption, bentonites, clays, kinetic.
A presença de íons metálicos em águas residuais gera um efeito tóxico sobre os ecossistemas marinhos e de saúde pública. Argilas são materiais naturais com alta capacidade de adsorção, de baixo custo, práticas relativas à aplicação em escala industrial para a remoção de íons metálicos. A sua aplicação é limitada para o desenvolvimento de alternativas à utilização de uma destas argilas em processos contínuos em grande escala e. Grânulos de argila podem ser utilizados em colunas de leito fixo. Neste estudo a cinética de adsorção de iões de níquel sobre grânulos de argila bentônicos foi avaliada. Os extrudados foram preparados por molhar a argila com uma solução acidificada com ácido nítrico a 2%v. A proporção da solução aquosa de argila / volume era de 2:1. A remoção de iões de níquel 20, 40, 100 e 160 minutos a temperaturas de 25, 40 e 60°C, foi avaliada. A cinética de adsorção de Ni (II) a um modelo de pseudo-segunda ordem foi ajustado. As constantes cinéticas do modelo foram 2,792x10-3, 8,085x10-4 e 6,292x10-4g/mg.min a temperaturas de reacção 25, 45 e 60°C, respectivamente. A partir do traçado da energia de activação de Arrhenius e a equação factor de frequência para a reacção de iões de níquel de adsorção em argila de bentonite foi determinada como sendo 29,58kJ/mol e 507,15g/mg.min, respectivamente. A magnitude da energia de activação indica que o passo de controlo é a adsorção em quimissorção os iões de níquel sobre a superfície da argila.
Palabras-chave: níquel, absorção, bentonite, argilas, cinética.
Cita: Mejía Miranda C, Laverde Cataño D, Avella V, Peña Ballesteros DY. Adsorción de iones Ni(II) sobre una arcilla bentonítica peletizada. rev.ion. 2015;28(2):61-68.
La presencia de metales pesados en efluentes acuosos provenientes de residuos industriales, es un tema de gran interés debido al impacto sobre el ambiente y la salud pública. Además, los niveles tóxicos inhiben los procesos biológicos con efectos adversos sobre las plantas de tratamiento de aguas residuales [1]. Entre las industrias que generan la mayor cantidad de residuos acuoso, con altas concentraciones de metales pesados, están la galvanoplastia, la minería, fabricación de baterías, producción de pinturas y pigmentos, metalurgia extractiva y energía nuclear, entre otras [2-4]. El níquel es un metal utilizado ampliamente en la industria de la galvanoplastia, siendo uno de los metales de mayor concentración en los efluentes residuales generados por esta industria [3]. La exposición a altas concentraciones de níquel causa disminución en el peso corporal, daño en el corazón e hígado e irritación en la piel. El consumo de agua con alta concentraciones de Ni(II) puede causar daño en los pulmones, riñones, además de problemas gastrointestinales. Los síntomas de intoxicación aguda por Ni(II) son: dolor de cabeza, mareo, náusea y vómitos, dolor en el pecho, tos seca y dificultad para respirar [2,5,6]. Entre los métodos más comunes para la remoción de iones metálicos de los efluentes industriales se encuentra: intercambio iónico, precipitación química, electrodeposición, ósmosis inversa, extracción con solventes, ultrafiltración y adsorción entre otros, [2,4,5,7]. Estos métodos son a menudo inefectivos o costosos, principalmente para la remoción de iones de metales pesados a bajas concentraciones. Por tal motivo, hay una necesidad para desarrollar tecnologías eficientes y amigables ambientalmente para reducir el contenido de metales pesados de aguas industriales. La adsorción es reconocida como un método eficaz y económico para la eliminación de contaminantes de las aguas residuales, que ha sido ampliamente estudiando para diferentes aplicaciones. Su aplicabilidad radica en utilizar adsorbentes de bajo costo y con altas propiedades superficiales. El uso de arcillas como adsorbentes tiene ventajas sobre adsorbentes disponibles comercialmente en términos de bajo costo, una disponibilidad abundante, las altas propiedades de adsorción, la alta área de superficie específica, no toxicidad, y gran potencial para el intercambio de iones [2,4,8]. Debido a su bajo tamaño de partícula la utilización de arcilla para la adsorción de iones metálicos, está principalmente direccionado a sistemas donde la arcilla se encuentra en suspensión, lo cual dificulta la posterior recuperación de los iones, incrementando los costos de operación y reduciendo su aplicabilidad a nivel industrial. En este trabajo se propone la utilización de una arcilla bentonítica para la remoción de iones níquel de efluentes industriales. Se elaboraron pellets de arcilla bentonítica por un método de extracción y se evaluó la capacidad de adsorción. Se determinaron parámetros cinéticos de adsorción de la arcilla bentonítica peletizada.
En este trabajo se utilizó una arcilla bentonítica suministrada por una empresa colombiana, con un tamaño de partícula menor a 33μm.
Caracterización de la arcilla bentonítica. Se determinó la composición mineralógica mediante difracción de rayos X, usando un difractómetro de polvo RIGAKU D/MAX IIIB. La identificación de grupos funcionales característicos se determinó mediante Espectroscopia de Infrarrojo, en un equipo SHIMADZU FT-IR 8400s. La composición química elemental de la arcilla fue determina por Fluorescencia de rayos X usando un equipo SHIMADZU EDX 800HS.
Peletización de la arcilla. Los extrudados se prepararon por humectación de la arcilla con una solución acidificada con ácido nítrico al 2%v, con el objetivo de aumentar la plasticidad de la arcilla. La proporción en volumen arcilla/solución acuosa fue 2:1. Se utilizó una extrusora con un diámetro de boquilla de 2mm. La longitud de los extrudados fue de 5mm. Una vez extrudada la arcilla, se deshidrató en una estufa a 120°C durante cuatro horas y posteriormente se sinterizó a 500°C en atmósfera de aire, durante seis horas. Se realizó un ensayo con la arcilla extrudada en solución acuosa con una relación en masa arcilla/solución, 1%, a una velocidad de 250rpm y 25°C, con el fin de determinar la estabilidad mecánica de la arcilla. Se determinó la densidad absoluta de la arcilla extrudada, usando la norma ASTM D792. Mediante Microscopia Electrónica de Barrido usando un equipo Quanta 650 FEG, se tomaron las micrografías de la arcilla extrudada para observar los acabados superficiales.
Preparación de la solución de Níquel. Se preparó una solución con concentración de 200ppm de iones níquel, a partir de Ni(NO3).6H2O. El pH de la solución se ajustó a 5, utilizando ácido nítrico.
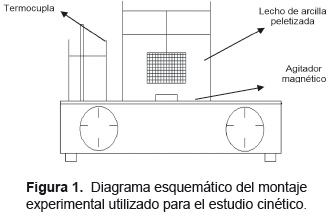
Estudio cinético. Se utilizó 5 gramos de arcilla bentonítica peletizada por 50mL de solución acuosa con iones níquel. En la Figura 1, se presenta un esquema del montaje experimental utilizado. La arcilla peletizada se suspendió en una malla de Nylon dentro de la solución acuosa. La velocidad de agitación en todos los ensayos fue 250rpm. Se evaluó la cinética de adsorción para tiempos de reacción de 20, 40, 100 y 160min y temperaturas de 25, 45 y 60°C.
El seguimiento a la reacción se realizó cuantificando la concentración de ion níquel en la solución, usando un espectrofotómetro de adsorción atómica Perkin Elmer 2380. La cinética de adsorción sobre materiales adsorbentes, ha sido descrita por diferentes autores, utilizando modelos de pseudo primer y segundo orden [9-13]. La ecuación de pseudo primer orden es la expresión más utilizada para describir sistemas de adsorción:
Después de aplicar una integral definida con las siguientes condiciones límite:
qt = 0 para t = 0
qt = qt, para t = t
La expresión de pseudo primer orden se transforma en la siguiente expresión:
Donde qt (mg/g), es la cantidad adsorbida en un tiempo t (min). qe (mg/g), es la capacidad de adsorción en el equilibrio. k1 (min-1) es la constante de velocidad de la ecuación cinética. La constante cinética, k1, puede ser obtenida de la pendiente de la graficar ln(qe - qt). La capacidad de adsorción en el equilibrio se calculó a partir de la siguiente expresión:
Donde Co (mg/L) es la concentración inicial, Ce (mg/L) es la concentración en el equilibrio, V(L) es el volumen de solución y W(g) es la masa de adsorbente usada.
El modelo cinético de pseudo segundo orden se describe a través de la siguiente expresión:
Integrando para las mismas condiciones límites utilizadas para la expresión cinética de pseudo primer orden, se obtiene:
Una gráfica de t/qt vs t permite determinar la constante cinética k2 (g/mg.min). La energía de activación para la adsorción de iones níquel sobre esta arcilla bentonítica se determinó usando la ecuación de Arrhenius expresada de acuerdo a la Ecuación 6.
Donde, k es la constante cinética específica para cada temperatura de reacción (g/mg.min), Ea es la energía de activación de adsorción (kJ/mol), A es el factor de Arrhenius, k es la constante universal de los gases (8,314J/mol.K) y T es la temperatura en Kelvin (K). Una gráfica de ln(k) vs 1/T genera una línea recta con pendiente Ea/RT. La energía de activación depende de la naturaleza química de las especies involucradas en la reacción y es generalmente usada para distinguir entre procesos de adsorción física y química. Las reacciones controladas por adsorción física llegan rápidamente al equilibrio, son reversibles y por lo tanto los requerimientos de energía son pequeños (5-50kJ/mol) [18,19]. Las reacciones controladas por adsorción química son lentas y requieren grandes cantidades de energía (40-800kJ/mol) [18,19].
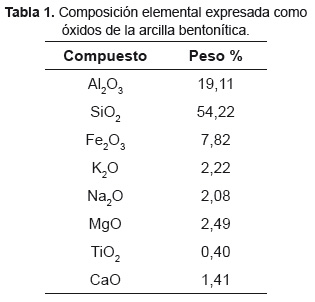
Caracterización de la arcilla. La composición mineralógica de la arcilla usando Difracción de Rayos X, evidencia la presencia de montmorrillonita (76,51%), cuarzo (15,14%) y amorfos (8,35%). En la Tabla 1, se presenta la composición elemental expresada como óxidos de la bentonita. La relación en peso SiO2/Al2O3 igual a 2,83 corresponde a este tipo de arcillas bentoníticas.
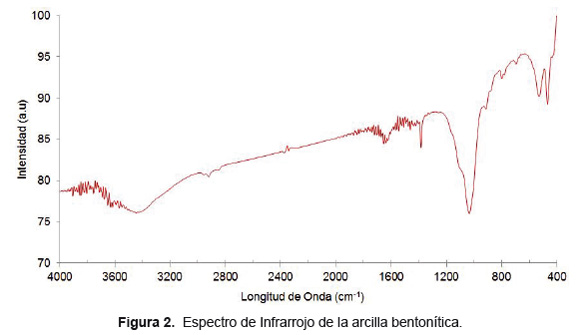
El espectro de infrarrojo de la arcilla bentonítica, medido en modo transmitancia, se presenta en la Figura 2.
Una pequeña banda a 3621 y una banda ancha 3446cm-1 de la vibración por estiramiento OH de grupos hidroxilos y agua, son característicos de este tipo de arcillas. En la región de frecuencias más bajas se presenta una banda fuerte a 1050cm-1, correspondiente al estiramiento por vibración Si-O en el plano. Las bandas a 913 y 848cm-1 corresponde a enlaces Al-Al-OH y Al-Fe-OH. La banda a 1645cm-1 corresponde a frecuencias OH de moléculas de agua.
La densidad de la arcilla en polvo fue de 2,41g/cm3.
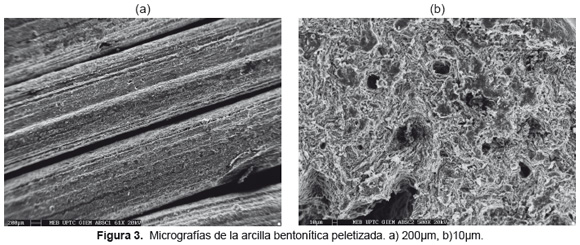
Peletización de la arcilla bentonítica. La densidad de la arcilla extrudada fue 2,15g/cm3, reduciéndose en 10,79% con respecto a la arcilla en polvo. Bajo las condiciones experimentales, se observó un porcentaje de pérdida de masa en los extrudados de 0,12% en peso. En la Figura 3, se presenta una micrografía de la arcilla bentonítica peletizada.
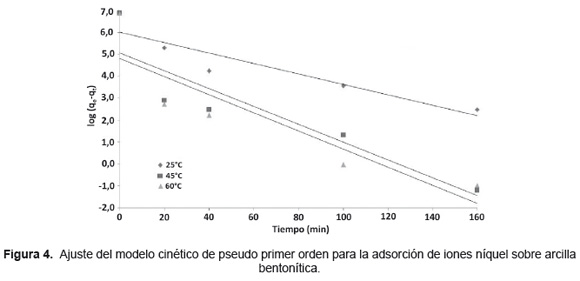
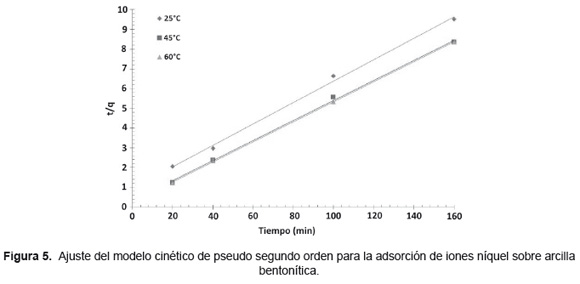
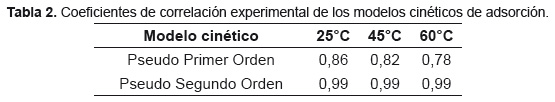
Estudio cinético de adsorción. En las Figuras 4 y 5 se presenta el ajuste de la reacción de adsorción de iones níquel sobre arcilla bentonítica a los modelos de pseudo primer y segundo orden, respectivamente. Los coeficientes de correlación indican que la cinética de adsorción del níquel bajo las condiciones de estudio se ajusta a un modelo de pseudo segundo orden, Tabla 2. Las constantes cinéticas determinadas para el modelo de pseudo segundo orden fueron 2,792x10-3, 8,085x10-4 y 6,292x10-4 para las temperaturas de reacción 25, 45 y 60°C, respectivamente.
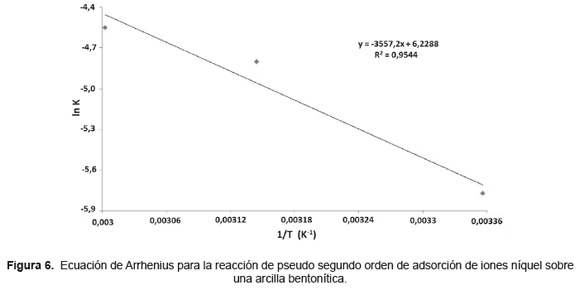
A partir de la lineación de la ecuación de Arrhenius se determinó la energía de activación y el factor de frecuencia para la reacción de adsorción de iones níquel sobre arcilla bentonítica, siendo 29,58kJ/mol y 507,15g/mg.min, respectivamente. El coeficiente de correlación de los datos experimentales a la ecuación de Arrhenius fue 0,95 (Figura 6).
La magnitud de la energía de activación indica que la etapa controlante en la adsorción es la quimisorción de los iones níquel sobre la superficie de la arcilla [15-17].
La peletización de arcilla bentonítica es una alternativa viable para incrementar la aplicabilidad de estos materiales en procesos de descontaminación de efluentes industriales. Se determinó el modelo cinético de adsorción de iones Ni(II) sobre arcilla bentonítica peletizada. La ley de velocidad se ajustó a un modelo de pseudo segundo orden, siendo la energía de activación y el factor de frecuencia 29,58kJ/mol y 507,15g/mg.min, respectivamente. La magnitud de la energía de activación indica que la adsorción está controlada por procesos de quimisorción.
[1] Kiptoo JK, Ngila JC, Sawula GM. Speciation studies of nickel and chromium in wastewater from an electroplating plant. Talanta. 2004;64:54-9. [ Links ]
[2] Priya PG, Basha CA, Ramamurthi V, Begum SN. Recovery of Nickel (II) Ions from Electroplating Rinse Water Using Hectorite Clay. Modern Applied Science. 2009;3(9):37- 51. [ Links ]
[3] Elshazly AH, Konsowa AH. Removal of nickel ions from wastewater using a cationexchange resin in a batch - stirred tank reactor. Desalination, 2003;158:189-93. [ Links ]
[4] Djomgoue P, Siewe M, Djoufac E, Kenfack P, Njopwouo D. Surface modification of Cameroonian magnetite rich clay with Eriochrome Black T. Application for adsorption of nickel in aqueous solution. Appl. Surf. Sci. 2012;258:7470-9. [ Links ]
[5] Kadirvelu K, Thamaraiselvi K. Namasivayam C. Adsorption of nickel (II) from aqueous solution onto activated carbon prepared from coirpith. Sep. Purif. Technol. 2001;24:497-505. [ Links ]
[6] Malamis S, Katsou E. A review on zinc and nickel adsorption on natural and modified zeolite, bentonite and vermiculite: Examination of process parameters, kinetics and isotherms. J. Hazard. Mater. 2013;252-53:428-61. [ Links ]
[7] Olgun A, Atar N. Equilibrium, thermodynamic and kinetic studies for the adsorption of lead (II) and nickel (II) onto clay mixture containing boron impurity. Ind. Eng. Chem. 2012;18:1751-7. [ Links ]
[8] Vengris T, Binkiene R, Sveikauskaite A. B. Nickel, copper and zinc removal from waste water by a modified clay sorbent. Appl. Clay Sci. 2001;18:183-90. [ Links ]
[9] Adebowale KO, Unuabonah EI, Olu-Owolabi BI. Kinetic and thermodynamic aspects of the adsorption of Pb2+ and Cd2+ ions on tripolyphosphate-modified kaolinite clay. Chem. Eng. J. 2008;136:99-107. [ Links ]
[10] Arias F, Sen TK. Removal of zinc metal ion (Zn2+) from its aqueous solution by kaolin clay mineral: A kinetic and equilibrium study. Colloid Surface A. 2009;348:100-8. [ Links ]
[11] Sari A, Tuzen M, Citak D, Soylak M. Equilibrium, kinetic and thermodynamic studies of adsorption of Pb (II) from aqueous solution onto Turkish kaolinite clay. J. Hazard. Mater. 2007;149:283-91. [ Links ]
[12] Li W, Tang Y, Zeng Y, Tong Z, Liang D, Cui W. Adsorption behavior of Cr (VI) ions on tanninimmobilized activated clay. Chem. Eng. J. 2012;193-194:88-95. [ Links ]
[13] Bhattacharyya KG, Gupta SS. Removal of Cu (II) by natural and acid-activated clays: An insight of adsorption isotherm, kinetic and thermodynamics. Desalination. 2011;272:66- 75. [ Links ]
[14] Alabarse FG, Conceicao RV, Balzaretti NM. In-situ FTIR analysis of bentonite under highpressure. Appl. Clay Sci. 2011;51:202-8. [ Links ]
[15] Mahmood T, Saddique MT, Naeem A, Mustafa S, Zeb N, Shah KH, et al. Kinetic and thermodynamic study of Cd (II), Co (II) and Zn (II) adsorption from aqueous solution by NiO. Chem. Eng. J. 2011;171(3):935-40. [ Links ]
[16] Malkoc E. Ni (II) removal from aqueous solutions using cone biomass of Thuja orientalists. J. Hazard. Mater. 2006;B137:899- 908. [ Links ]
[17] Weng CH, Sharma YC, CHU SH. Adsorption of Cr(VI) from aqueous solutions by spent activated clay. Journal of Hazardous Materials. 2008;155:65-75. [ Links ]
[18] Lin J, Zhan Y, Zhu Z. Adsorption characteristics of copper (II) ions from aqueous solution onto humic acid-immobilized surfactant-modified zeolite. Colloid Surface A. 2011;384:9-16. [ Links ]
[19] Boparai H.K, Joseph M, O'Carroll D.M. Kinetics and thermodynamics of cadmium ion removal by adsorption onto nano zero valent iron particles. J. Hazard. Mater. 2011;186:458-65. [ Links ]