Introducción
El etanol es utilizado en la industria química como producto intermedio para la producción de otros compuestos tales como dietil éter, acetaldehído, ácido acético, acetato de etilo, acrilato de etilo y etilaminas, y como combustible automotor por sí solo o en mezclas con gasolina. Recientemente, se han publicado estudios de algunas reacciones de interés del etanol tales como el reformado con vapor de agua para la producción de hidrógeno 1, la deshidratación para la producción de etileno 2,3, y la oxidación para la producción de ácido acético 4.
La obtención de etanol a partir de etileno es un proceso catalítico que fue descubierto por la compañía Shell 5 y se lleva a cabo en fase gaseosa a presiones en el rango de 30 a 100 bar y temperaturas en el rango de 480 a 598K, sobre un catalizador ácido (H3PO4 soportado en SiO2). El ácido fosfórico presente en el catalizador constituye entre el 55 y 75% del peso total.
Sin embargo, el catalizador de H3PO4/SiO2 se desactiva hidrotérmicamente debido a que se presenta una elución del ácido fosfórico desde el sólido hacia la corriente gaseosa por evaporación del ácido a la temperatura de operación del reactor 6,7,8. Algunas alternativas para reemplazar el catalizador H3PO4/SiO2 han tratado de igualar su acidez, cambiando el soporte del ácido fosfórico o sustituyendo el catalizador por mezclas de compuestos que posean una elevada acidez y estabilidad a las condiciones de reacción 8,9,10,11,12. Entre estas mezclas de compuestos se destacan dos catalizadores ácidos generados por la mezcla de óxidos metálicos de tungsteno y zirconio (WZ) o de tungsteno y titanio (WT), los cuales se obtienen por el método de impregnación húmeda incipiente.
En ellos se encuentra una variación en la acidez inherente del tipo Lewis al tipo Brønsted, por lo que estos catalizadores pueden usarse en reacciones orgánicas donde la acidez del catalizador es fundamental 13. Por otra parte, estos sólidos han sido probados con éxito en la reacción de hidratación catalítica del etileno en fase gaseosa, obteniéndose resultados similares al catalizador comercial de ácido fosfórico (selectividades elevadas y los mismos subproductos de oxidación) 11,14,15,16.
También se han propuesto mejoras tecnológicas para el proceso de hidratación directa como, por ejemplo, un sistema mejorado para la dosificación y la reposición del ácido fosfórico que se evapora gradualmente hacia la corriente gaseosa por la acción continua del vapor de agua y el uso de intercambiadores de calor de placas para la recuperación efectiva de calor en las unidades de reacción, separación y purificación de la planta de proceso 17. Sin embargo, no se había planteado hasta ahora un cambio de condiciones de reacción que permitiera efectuar ésta en una fase distinta a la fase gaseosa.
Un reciente estudio termodinámico de los equilibrios químico y de fases combinados reveló que si la reacción se lleva a cabo en un sistema de dos fases (líquida y gaseosa), con una relación molar de agua a etileno de 5:1, una temperatura de 200°C y una presión de 40bar, la conversión termodinámica de etileno a etanol puede sufrir un aumento del 30% en comparación con la conversión obtenida cuando la reacción se lleva a cabo en fase gaseosa y a las mismas condiciones 18.
La implementación a nivel industrial de la reacción de hidratación en presencia de las dos fases líquida y gaseosa haría posible la aplicación del concepto de intensificación de procesos, al integrar las secciones de reacción y separación de la planta, mediante el uso de una columna de destilación reactiva en lugar de un reactor y dos columnas de destilación como se hace industrialmente. Hasta el momento, la posibilidad de aumentar la conversión utilizando una mezcla de dos fases líquida y gaseosa se ha determinado utilizando métodos teóricos de modelación termodinámica de los equilibrios químico y de fases combinados 18, por lo que se requiere adicionalmente un estudio experimental de la reacción catalizada y en presencia de las dos fases para confirmar esa posibilidad e identificar los catalizadores que sean más convenientes para lograr ese aumento de conversión.
En este trabajo se estudiaron dos catalizadores sólidos ácidos obtenidos por el método de impregnación húmeda incipiente, empleando para ello óxidos metálicos como soportes y una sal de tungsteno como precursor, de modo que al finalizar la síntesis se obtuvieron catalizadores WZ de óxido de tungsteno soportado sobre óxido de zirconio (WO3/ZrO2) y catalizadores WT de óxido de tungsteno soportado sobre óxido de titanio (WO3/ TiO2), con cargas másicas de tungsteno de 10, 30 y 40%. A los catalizadores sólidos sintetizados se les determinó la densidad superficial, estabilidad térmica, estructura morfológica y transiciones de fases asociadas a las cargas de tungsteno empleadas, y se les evaluó la actividad catalítica para la hidratación de etileno a etanol, cuando los sólidos están en contacto con una mezcla de las fases líquida y gaseosa, a presiones entre 30 y 40bar y empleando una relación equimolar de etileno a agua.
Parte experimental
Preparación de los catalizadores
Paratungstato de sodio (Na2[WO4]•2H2O, Aldrich) fue impregnado sobre óxido de zirconio (ZrO2, Aldrich) y óxido de titanio (TiO2, Merck) para obtener los catalizadores WO3/ZrO2 y WO3/TiO2 (10, 30 y 40% de tungsteno en peso). El método empleado para tal efecto fue el de impregnación húmeda incipiente, donde inicialmente se disolvió el peso necesario para obtener el porcentaje deseado de paratungstato de sodio, en agua caliente, con agitación continua hasta obtener una solución con una concentración 0,36M. Seguidamente esta solución fue impregnada de manera lenta sobre el peso respectivo del soporte, añadiendo 1mL del surfactante Genapol (Clariant LRO), y entonces fue sometida a calentamiento y agitación a 343K durante 4 horas, y a un secado posterior a 383K durante 12 horas. Las muestras de los sólidos resultantes fueron calcinadas dentro de un reactor de cuarzo en un horno tubular a 1073K, con un flujo de oxígeno de 0,1mL/min. El catalizador WO3/ZrO2 fue denotado como WZ [n%W] y el catalizador WO3/TiO2 fue denotado como WT [n%W], donde n corresponde al valor de la carga másica de tungsteno en el catalizador.
Caracterización de los catalizadores
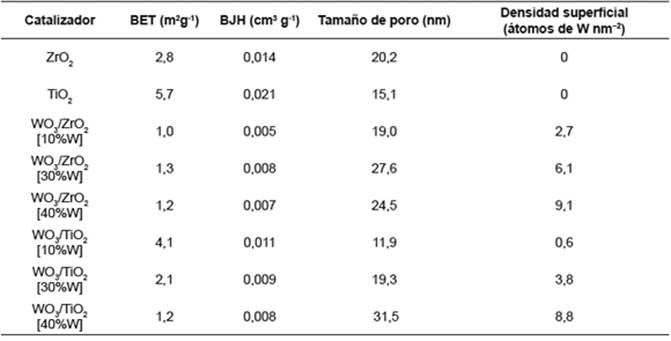
Los estudios FT-IR, fueron llevados a cabo en un equipo SHIMADZU FT-IR 8400, empleando el método de pastilla de KBr, en la región de 500 a 4000cm-1 para la absorción de radiación infrarroja. Los espectros DRX fueron tomados en un equipo X’PERT PRO PAN empleando un rango de medida 2θ entre 20-90° en tubo de cobre, con paso de ángulo 0,02º. Los espectros DRX fueron refinados empleando el programa GSAS (General Structure Analysis System) mediante el método de Rietveld. Las morfologías superficiales y las composiciones elementales de los catalizadores calcinados fueron observadas por medio de la microscopia electrónica de barrido (MEB) junto a escaneos EDX, los cuales fueron realizados en un equipo JEOUL JSM-6490LV Scanning Electron Microscope con dispersor de rayos X EDS OXFORD INSTRUMENTS. Los estudios de medición de área superficial para los catalizadores calcinados se hicieron empleando los métodos BET y BJH, por medio de adsorción de nitrógeno (N2) a 77K en un equipo MICROMERITICS ASAP 20/20 luego de la desgasificación de las muestras a 500K durante 12 horas. A partir de las medidas de área superficial se calcularon las densidades superficiales de tungsteno de los catalizadores obtenidos, empleando una ecuación que relaciona la carga másica empleada de tungsteno (en g de WO3/g de catalizador) con el número de átomos de tungsteno presentes por unidad de masa (constante de Avogadro/peso molecular de WO3) y el área superficial analizada para cada catalizador (m2 /g de catalizador) 19.
Los perfiles termogravimétricos de los catalizadores calcinados fueron medidos en un equipo TA INSTRUMENTS Q 600. El procesamiento fue realizado para muestras de 30mg colocadas en una celda de platino calentada desde 298 hasta 773K en una corriente de oxígeno de 1mL/min. Los productos de reacción fueron identificados y cuantificados por medio de la técnica de resonancia magnética nuclear (RMN) protónica con un equipo BRUKER AVANCE DRX300, de 300 MHz, utilizando un estándar 0,02M de la sal sódica del ácido 2,2,3,3-d4-(trimetilsilil) propanoico (TSP). Por último, la cuantificación fue realizada empleando el software ACD/NMR PROCESSOR.
Reacción catalítica en una mezcla de dos fases La hidratación catalítica de etileno en una mezcla de fases líquida y gaseosa fue llevada a cabo en un reactor de acero inoxidable tipo PARR de 250mL, con una relación molar 1:1 de los reactivos. Para garantizar esta proporción, se empleó la siguiente expresión para determinar el volumen de etileno requerido (V e ):
En la Ecuación 1, V T es el volumen del reactor, M w y M e son los pesos moleculares del agua y el etileno, respectivamente, y ρ e y ρ w son las densidades másicas del etileno y el vapor de agua, respectivamente. Se tuvo en cuenta que la densidad del etileno varía con respecto a la presión 18,20. Las temperaturas de reacción de 473 y 523K fueron controladas mediante un pirómetro digital y se empleó un magneto para agitar la fase líquida en el reactor PARR. Las reacciones se llevaron a cabo durante un tiempo de 24 horas.
Resultados y Discusión
Caracterización de catalizadores
Los espectros FT-IR de los catalizadores WO3/ZrO2 (Figura 1) y WO3/TiO2 (Figura 2) calcinados a 1073K no presentan bandas de tensión o deformación de grupos O-H (provenientes del solvente), grupos N-H (provenientes de la sal precursora), o grupos C-H (provenientes del surfactante).
Los exámenes IR muestran bandas de tensión que aumentaron en intensidad con el aumento de la carga másica de tungsteno empleada. El aumento de la carga conduce a un aumento en la densidad superficial de tungsteno como se indica en la Tabla 1. La densidad superficial permite considerar el nivel de recubrimiento de los óxidos soporte (valores de monocapa) y las estructuras superficiales que se encuentran en los catalizadores; con base en lo cual se identificó al trióxido de tungsteno (WO3) como la estructura soportada sobre los óxidos correspondientes 21. Igualmente, se observa la presencia de bandas de tensión del enlace W=O (1010-910cm-1) y de bandas de tensión del ion tetraédrico [WO4 ] 4- (668,25-793,12cm-1). Ambas bandas son más intensas cuando las densidades superficiales de tungsteno sobrepasan los valores de monocapa (Tabla 1), que fueron constatados con base en la literatura 13,19,22.
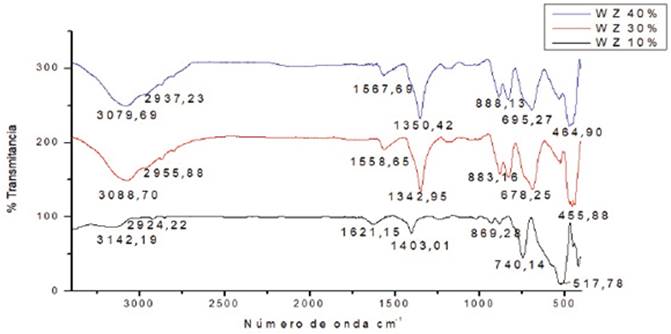
Figura 1 Espectro infrarrojo de los catalizadores WO3/ZrO2 calcinados (a) WO3/ZrO2 [10%W] (b) WO3/ZrO2 [30%W] (c) WO3/ZrO2 [40%W].
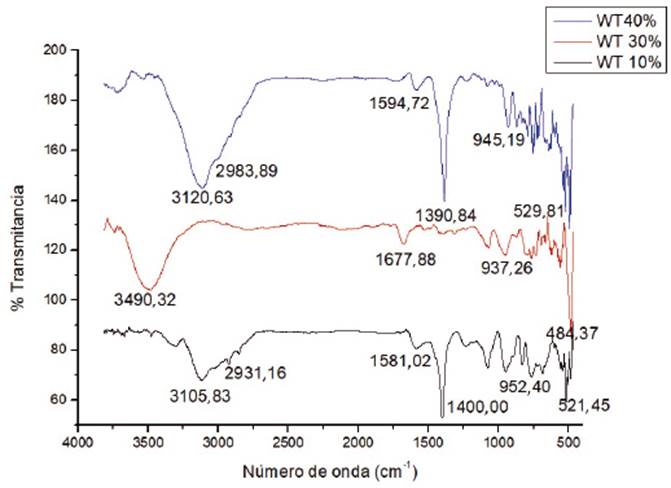
Figura 2 Espectro infrarrojo de los catalizadores WO3/TiO2 calcinados (a) WO3/TiO2 [10%W] (b) WO3/TiO2 [30%W] (c) WO3/TiO2 [40%W].
En lo que concierne al estudio por difracción de rayos X (DRX), los difractogramas de los sistemas WO3/ZrO2, se muestran en la Figura 3. El óxido ZrO2 presentó un grupo espacial P121/c1, que lo clasifica como una celda monoclínica primitiva con parámetros de celda a = 5,1472 ± 0,0001Å, b = 5,2085 ± 0,0001Å y c = 5,3134 ± 0,0001Å. El volumen de celda correspondiente es igual a 142Å3. La celda tiene una densidad másica de 6,009g/cm3 y un peso por fórmula igual a 508,866uma. El tamaño de cristalito perpendicular obtenido es 63,267nm, mientras que el tamaño de cristalito paralelo es 67,48nm, indicando que los cristalitos son ligeramente alargados. Los picos representativos de esta fase se encuentran a valores de 2θ iguales a 28,1° y 31,4°, respectivamente. Todos los catalizadores a base de ZrO2 de diferente concentración en WO3 presentaron estructuras cristalinas pertenecientes a fases monoclínicas de WO3 libre, las cuales se incrementan en intensidad al aumentar la carga empleada, confirmando así la presencia de la especie de paratungstato a la que pertenecen las bandas observadas en el FT-IR. Para la carga másica de tungsteno de 30%, solamente se observa la especie Na2WO4 y los tres parámetros de celda son idénticos e iguales a 9,1307 ± 0,0001Å. El volumen de celda correspondiente es igual a 761,215Å3, mientras que el tamaño de cristalito perpendicular es 233,96nm y el tamaño de cristalito paralelo es 122,64nm, indicando que los cristalitos son achatados. En lo que respecta al ZrO2 en el sistema con una carga másica de tungsteno de 40%, el tamaño de cristalito perpendicular aumenta de 63,267nm a 78,38nm y el tamaño de cristalito paralelo aumenta de 67,48nm a 79,04nm, de modo que los cristalitos son prácticamente esféricos. Se observó una leve transición de fase en el soporte al encontrarse picos de la fase tetragonal del soporte ZrO2, para valores de 2θ iguales a 29,5° y 35,4°, los cuales coexisten a temperatura ambiente gracias a la estabilización generada por la especie de tungsteno. Sin embargo, la transición de fase en este soporte es muy baja (menor al 8% en peso) en comparación con la observada en otros estudios 10,23. Esto podría mejorarse al emplear un hidróxido amorfo de zirconio, por ejemplo, Zr(OH)4, debido a que es más fácil modificar su estructura cristalina por medio de la impregnación y consecuente calcinación.
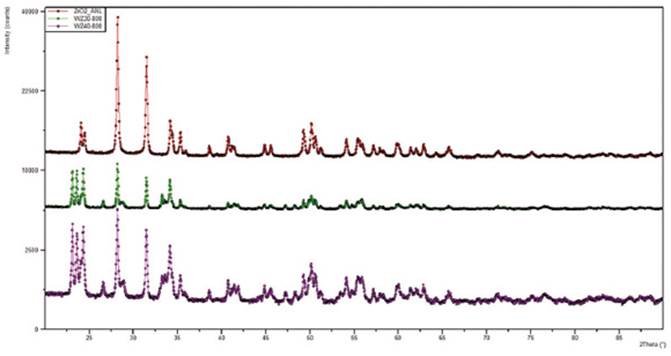
Figura 3 Patrones DRX de los catalizadores WO3/ZrO2 calcinados a 1073K; indicando las fases monoclínica (Δ) y tetragonal (□) del ZrO2 y la fase monoclínica (◊) del WO3.(a) ZrO2, (b) WO3/ZrO2 [30%W], (c) WO3/ZrO2 [40%W].
En lo que respecta al TiO2 (Figura 4), los patrones DRX refinados muestran la presencia de las fases anatasa y rutilo. La anatasa pertenece al grupo espacial I4d/amd, con una forma cristalina tetragonal centrada en el cuerpo, siendo los parámetros de celda a = b = 3,7867 ± 0.0001Å, c = 9,5075 ± 0,0004Å, con un volumen de celda unitaria igual a 136,326Å3. El tamaño de cristalito perpendicular es 30,25nm, mientras que el tamaño de cristalito paralelo es 25,41nm. La otra fase que se encontró, el rutilo, pertenece al grupo espacial P42/mnm, con un sistema tetragonal primitivo. Los parámetros de celda son a = b = 4,5971 ± 0,0006Å, c = 2,9627 ± 0,0004Å. El volumen de la celda unitaria es igual a 62,611Å3 y los tamaños de cristalito perpendicular y paralelo son 30,25 y 39,45nm, respectivamente.
Los patrones DRX refinados de los sistemas WO3/TiO2 [10%W] (Figura 4) indicaron que la proporción en peso de las fases en el sistema WO3/TiO2 es 9%/91%. Además, se encuentra presente la fase Na2WO4 que pertenece al grupo espacial Fd-3m, siendo una estructura cúbica centrada en las caras, con parámetros de celda a = b = c = 9,1329 ± 0,0001Å y con un volumen de celda unitaria igual a 761,780Å3. Para esta fase, los tamaños de cristalito perpendicular y paralelo son 164,50 y 144,57nm, respectivamente. En lo que respecta al TiO2, se observó una transición de fase completa en el óxido soporte, puesto que la fase rutilo desapareció y para la fase anatasa presente, los tamaños de cristalito perpendicular y paralelo se incrementaron considerablemente al pasar de 30,25 y 25,41nm a 128,17 y 128,17nm, respectivamente, de modo que los cristalitos resultan ser esféricos. Para el WO3, la fase presente es la Na2WO4. Por otro lado, al incrementar la carga másica de tungsteno a 40% se produjo la aparición de una nueva fase, H4Na2WO6, que pertenece al grupo espacial Pbca, siendo el sistema cristalino el de una celda primitiva ortorrómbica y con parámetros de celda a = 8,4848 ± 0,0001Å, b = 10,5952 ± 0,0018Å y c = 13,8582Å. El volumen de la celda unitaria es igual a 1245,814Å3. Finalmente, los tamaños de cristalito perpendicular y paralelo son 712,98 y 1066,69nm, respectivamente.
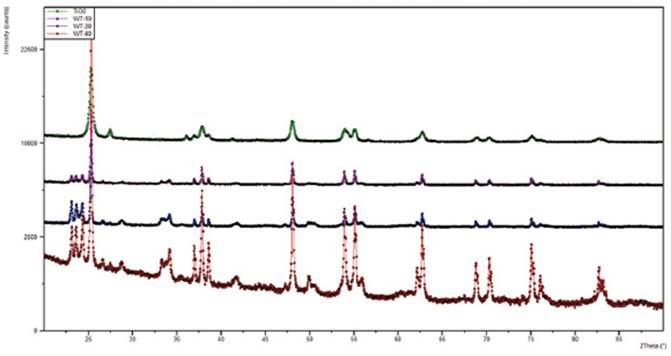
Figura 4 Patrones DRX de los catalizadores WO3/TiO2 calcinados a 1073K; indicando las fases monoclínica (Δ) y tetragonal (□) del TiO2 y la fase monoclínica (◊) del WO3. (a) TiO2, (b) WO3/TiO2 [10%W], (c) WO3/TiO2 [30%W] y (d) WO3/TiO2 [40%W].
Con base en estudios previos realizados por Chu et al.15, es deseable tener una mayor presencia de una estructura cristalina del óxido soporte en fase tetragonal acompañada por cristales monoclínicos de la especie WO3, ya que se considera que la interacción de los cristales WO3 con la fase tetragonal del óxido genera cambios electrónicos responsables de la actividad catalítica en reacciones de hidratación directa del etileno en fase gaseosa 14,16,24. Los catalizadores fueron evaluados mediante microscopia electrónica de barrido (SEM/EDS). La Figura 5 revela para los sistemas WO3/ZrO2 un mayor agrupamiento molecular de cristalitos irregulares con tamaño micrométrico a medida que se aumenta la carga empleada en el óxido de zirconio. Por otra parte, la Figura 6 muestra que para el sólido WO3/TiO2, el aumento en la carga másica de tungsteno en el soporte de óxido de titanio favoreció la formación de nanocristalitos esféricos con un menor espaciamiento intermolecular 25.

Figura 5 Imágenes SEM de los catalizadores WO3/ZrO2. (a) WO3/ZrO2 [10%W], (b) WO3/ZrO2 [30%W], (c) WO3/ZrO2 [40%W].

Figura 6 Imágenes SEM de los catalizadores WO3/TiO2. (a) WO3/TiO2 [10%W], (b) WO3/TiO2 [30 %W], (c) WO3/TiO2 [40%W].
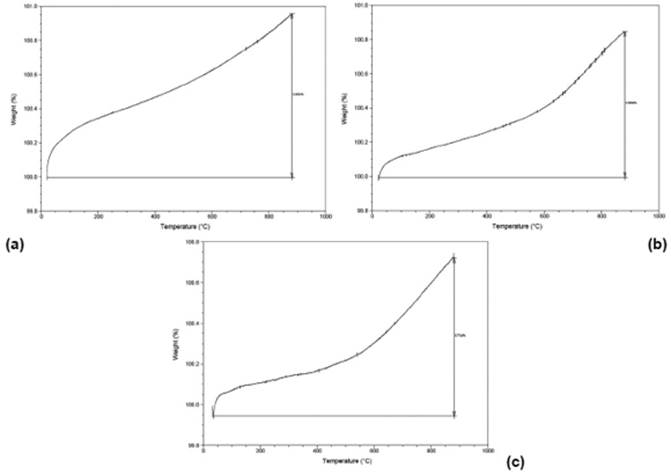
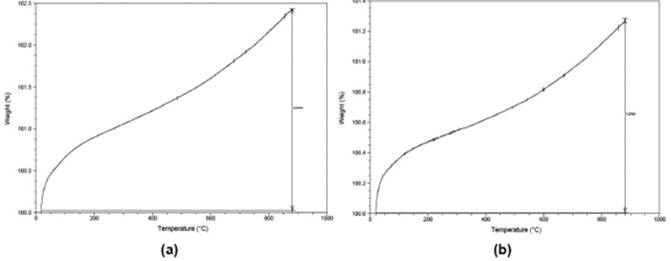
Los experimentos de análisis termogravimétrico (TGA) que se llevaron a cabo bajo una corriente de oxígeno, tuvieron como propósito estudiar la estabilidad térmica de los compuestos luego de la calcinación realizada (Figuras 7 y 8). Todos los compuestos sintetizados son térmicamente estables hasta temperaturas de 500°C. Las curvas observadas en todos los catalizadores presentan un comportamiento característico de la oxidación superficial debido al incremento de peso registrado en los exámenes 26. Se registraron incrementos hasta del 1% en peso en muestras soportadas en ZrO2 a medida que se aumentó la carga empleada del WO3. Para las muestras soportadas en TiO2 se encontraron incrementos hasta del 3% en peso. Esto concuerda con los resultados encontrados por el método DRX en donde se puede observar una mayor presencia de la fase tetragonal en el soporte, aumentándose así su estabilidad térmica.
Los resultados de la fisisorción de nitrógeno se encuentran consignados en la Tabla 1. Primeramente, se puede decir que los diferentes sistemas poseen áreas superficiales pequeñas que son típicas de sistemas cristalinos másicos. El decremento en las áreas superficiales que se observa en los catalizadores soportados en dióxido de zirconio (WO3/ZrO2) es consecuencia de sus valores bajos de fase tetragonal, que indican una escasa unión entre los cristales monoclínicos de WO3, lo que impide que disminuya la pérdida de área superficial por efecto de la alta temperatura de calcinación. Para los sistemas de dióxido de titanio (WO3/TiO2) los cuales presentan una importante transición de fases por parte del soporte luego de la calcinación, los valores altos de fase tetragonal evitan la pérdida de área superficial, lo que confirma el comportamiento inhibidor de la sinterización por parte de la especie impregnada WO3 que, permite la presencia de la fase tetragonal en los soportes, como se encuentra referenciado en la literatura 27,28. Por último, la fisisorción de nitrógeno también permitió identificar, para todos los catalizadores sintetizados, isotermas de adsorción tipo IV, características de sólidos mesoporosos 29. Aunque se encontraron valores bajos en las áreas superficiales, de todos modos los resultados están asociados a sólidos mesoporosos que poseen superficies lisas.
Evaluación de la actividad catalítica de WO3/ZrO2 y WO3/TiO2 para la reacción de hidratación catalítica de etileno a etanol en presencia de una mezcla de fases líquida y gaseosa
El presente estudio exploratorio, buscó determinar si las condiciones de reacción estudiadas previamente por medio de la modelación termodinámica de los equilibrios químico y de fases combinados 18, permiten obtener etanol dentro de un reactor tipo PARR cargado con agua líquida y etileno gaseoso, empleando catalizadores de tungsteno soportados en zirconia o titania. Los resultados iniciales para los catalizadores WO3/ZrO2 se consignan en la Tabla 2. El estudio exploratorio indicó que los catalizadores WO3/ZrO2 presentan conversiones de etileno a etanol muy bajas y que los mayores valores de conversión (0,5%) y de selectividad (98,2%) se logran con la carga másica del 10% de tungsteno a una presión de 30bar. Sin embargo, se debe mencionar que trabajos anteriores sobre las reacciones de hidrólisis de acetato de etilo en un exceso de agua y de esterificación de ácido acético con etanol, mostraron conversiones bajas con un catalizador similar, el sistema MoO3/ZrO2. Los sistemas calcinados a 1073K fueron los más activos para la hidrólisis (11.
Tabla 2 Conversión y selectividades para la hidratación catalítica de etileno a etanol en presencia de una mezcla de fases líquida y gaseosa utilizando los catalizadores WO3/ZrO2. Relación etileno/agua 1:1, temperatura 200°C, 0 ,5g de catalizador.

Por otra parte, en la Tabla 3 se indican los resultados obtenidos en el estudio exploratorio al emplear los catalizadores WO3/TiO2. Se observa que el catalizador con el 10% en peso de tungsteno y a una presión de 40bar presenta los mayores valores de conversión (0,5%) y de selectividad (98,8%). Como ocurre también para los catalizadores WO3/ZrO2, para los catalizadores WO3/TiO2 se obtuvieron valores de densidad superficial iguales o superiores a la monocapa. La conversión del etileno no se incrementa al cambiar el catalizador de WO3/ZrO2 a WO3/TiO2 y además se observa la aparición de un subproducto inesperado (etilenglicol), lo cual genera una disminución de la selectividad hacia etanol en la reacción.
Por otro lado, también se observa una conversión de etileno extremadamente baja, que se debe principalmente al tipo de reactor empleado, el cual no permitió una buena interacción entre los reactivos y el catalizador. Además, estos resultados muestran una gran diferencia con respecto a los trabajos efectuados en fase gaseosa, en los cuales se ve favorecida la conversión y selectividad hacia el etanol a medida que aumenta la densidad superficial de tungsteno y resulta máxima cuando estos valores corresponden al recubrimiento en tipo monocapa de los respectivos soportes 30. Se debe resaltar que hasta el momento no se había reportado la presencia de etilenglicol como sub-producto en una reacción de hidratación de etileno. Esto se puede atribuir a la elevada acidez que poseen los catalizadores a base de tungsteno sintetizados y a que las condiciones de reacción permiten la interacción del sólido con un exceso de agua 31. Adicionalmente, se constató la obtención de ácido acético, lo que posiblemente ocurre al generarse el alcohol monohidroxílico y posteriormente efectuarse una segunda hidratación.
Tabla 3 Conversión y selectividades para la hidratación catalítica de etileno a etanol en presencia de una mezcla de fases líquida y gaseosa utilizando los catalizadores WO3/TiO2. Relación etileno/agua 1:1, temperatura 200°C, 0,5 g de catalizador.

Con base en los resultados obtenidos y con el fin de incrementar los porcentajes de conversión, se hace necesario emplear un reactor en continuo de lecho fijo que permita una mejor interacción de los reactivos (en fases líquida y gaseosa) con el catalizador sólido.
Conclusiones
Los análisis realizados indican que los catalizadores sintetizados son sólidos térmicamente estables en los cuales el óxido de tungsteno (WO3) es la especie impregnada en ambos óxidos de soporte; sin embargo, el WO3 se encuentra mejor asociado con el soporte de TiO2, al presentar el TiO2 una mayor transición de fases (monoclínico a tetragonal) permitiendo que los catalizadores WO3/ TiO2 mantengan una elevada área superficial en comparación con los catalizadores cuyo soporte es el ZrO2, tanto para valores bajos de densidad superficial como para valores en los que se excede la monocapa.
Aunque la actividad catalítica en estos sólidos es muy baja, se logró observar la obtención de etanol como producto de la reacción de hidratación catalítica de etileno en presencia de una mezcla de las fases líquida y gaseosa de los reactivos, empleando como catalizadores a los sólidos WO3/ ZrO2 y WO3/TiO2 y fijando una proporción equimolar de etileno y agua.