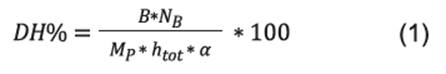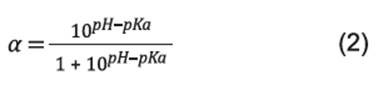Introducción
El ácido láctico es un compuesto higroscópico, orgánico, incoloro e inodoro, de baja volatilidad, utilizado en procesos alimenticios, farmacéuticos y químicos 1. Se proyecta que su mercado mundial alcance una tasa de crecimiento anual compuesta de 16,7 %, en el periodo 2017-2021 (Business Wire Inc., 2017). En el caso de Colombia, los datos del Departamento Administrativo Nacional de Estadística (DANE) muestran una producción nacional casi nula, junto con una marcada tendencia de incremento en la importación del ácido láctico y de sus sales (lactatos) 2. El 90 % de su producción a nivel mundial se lleva a cabo por vía biotecnológica mediante mecanismo fermentativo, el cual tiene la ventaja de formar uno de sus dos isómeros ópticos, (dextrógiro D(-) o levógiro L(+)), dependiendo principalmente del microorganismo seleccionado y de las condiciones dispuestas en el medio de fermentación 1),(3. El L(+) ácido láctico es deseable para aplicaciones de grado alimenticio y para la producción de plásticos biodegradables 4.
Las bacterias del género Lactobacillus son de amplio uso para este tipo de procesos fermentativos gracias a su capacidad de metabolizar monosacáridos y disacáridos como la glucosa y la lactosa con buenos rendimientos y productividades. Sin embargo, estos microorganismos, requieren como fuente de nitrógeno complejos nutricionales, ricos en aminoácidos y vitaminas que estimulen su crecimiento y por ende la producción de ácido láctico. Este aspecto juega un papel fundamental en la productividad y en la factibilidad económica del proceso, por lo cual su adecuada selección es muy importante 5. En la literatura se ha reportado el uso de extracto de levadura, 6), (7), (8, debido a que es una fuente de nitrógeno de fácil asimilación, que conduce así, a productividades más altas, gracias al contenido de purinas, pirimidinas y vitamina B 9. Sin embargo, al considerar una aplicación de tipo industrial, su elevado costo disminuye la rentabilidad del proceso, razón por la cual en los últimos años se han estudiado fuentes de mayor disponibilidad y bajo costo que conduzcan a un proceso competitivo y sostenible.
Una de las fuentes de nitrógeno alternativas con potencial uso en procesos fermentativos puede obtenerse mediante el aprovechamiento de la fracción proteica del lactosuero; subproducto obtenido durante la elaboración del queso. Se estima que se producen 9 dm3 de lactosuero por cada kg de queso, conteniendo alrededor del 20 % de las proteínas de la leche, entre las que se encuentra la β-lactoglobulina (β-Lg), la α-lactoalbúmina (α-La), la albúmina sérica bovina (BSA) y las inmunoglobulinas (Ig) 10. Las propiedades más relevantes de las proteínas del lactosuero se presentan en la Tabla 1. A pesar de su contenido nutricional, el lactosuero ha sido considerado un residuo y al ser vertido directamente a fuentes hídricas resulta en un serio problema ambiental, motivo por el cual se ha venido buscando nuevas y mejores alternativas de uso 11.
Tabla 1 Propiedades principales de las proteínas del lactosuero.
| Propiedad fisicoquímica | β-Lg | α-La | BSA | Ig |
|---|---|---|---|---|
| Peso molecular (kDa) | 18,3 | 14,2 | 66,4 | ≥146 |
| Punto isoeléctrico | 5,2 | 4,2- 4,5 | 4,7- 4,9 | 5,5- 8,3 |
| Concentración en el lactosuero (g/dm3) | 2- 4 | 1-1,5 | 0,4 | 0,4- 1 |
Modificado de 10.
De esta manera, el objetivo del presente trabajo consistió en estudiar una estrategia de aprovechamiento del lactosuero, mediante la separación por desnaturalización térmica y ácida de sus proteínas (requesón), para su posterior hidrólisis enzimática a las condiciones más favorables de pH y temperatura, y finalmente evaluar su utilización como fuente de nitrógeno en la fermentación láctica de la lactosa utilizando Lactobacillus casei (L.casei) ATCC 393.
Metodología
Desnaturalización térmica y ácida
Se utilizó lactosuero ácido proveniente de las actividades de producción de queso hilado del Sena C.A.S.A. Piedecuesta (Santander, Colombia) y se sometió a tratamiento térmico y ácido a 93 ºC y pH 4,4 durante 40 min 12. El lactosuero clarificado fue drenado, mientras que el requesón obtenido fue recuperado mediante filtración en tela tipo dril de 70 hilos/pulgada en urdimbre y 42 hilos/ pulgada en trama.
Hidrólisis
Se realizó un diseño experimental aleatorio, con tres niveles, analizando la influencia del pH y de la temperatura sobre el grado de hidrólisis (DH) con tres niveles para cada variable: 8, 9, y 10; 55 ºC, 60 ºC y 65 °C, respectivamente (definidos de acuerdo a intervalos de trabajo indicados en la ficha técnica de la enzima). Se empleó la proteasa líquida comercial Gelzyme L500© (PROENZIMAS S.A.) y como sustrato el requesón obtenido en la etapa previa, diluido en agua destilada para alcanzar un contenido de proteína de 4,2 %p/v, con una relación enzima sustrato del 1 %p, en un volumen de trabajo de 200 cm3 y una duración de 90 min 13), (14.
El grado de hidrólisis (DH) fue determinado mediante la técnica pH-state 15,16, que relaciona el DH con el volumen de NaOH utilizado para mantener el pH de trabajo constante, según la siguiente ecuación:
Donde, B representa el volumen acumulado de NaOH (cm3); N B la concentración de NaOH (2N); Mp la masa total de proteína hidrolizada (g); h tot el número total de enlaces peptídicos, tomado como 8,8 meq/g para proteína del lactosuero 16, α(pH, pKa) el grado de disociación de grupos amino liberados durante la hidrólisis. Se tomó 7,1 como el pKa promedio para proteínas del lactosuero 15 y α(pH,pKa) fue determinado mediante la ecuación 2.
Con las mejores condiciones de pH y T identificadas, se realizaron las hidrólisis hasta estabilización del DH. La inactivación de la enzima se realizó a 95 °C durante 15 min. Los hidrolizados fueron caracterizados en % de nitrógeno total (A.O.A.C. 991,20), % de nitrógeno amino (Método Kjeldahl sin digestión), determinación del tamaño de las especies proteicas mediante electroforesis tricina SDS-PAGE al 16 % de acrilamida bisacrilamida AB-3 y tinción de Coomassie 16. Los hidrolizados se mantuvieron en congelación a -20 ºC para su posterior uso como fuente de nitrógeno en la fermentación láctica de lactosa.
Fermentación
Se utilizó la cepa Lactobacillus casei (L. casei) ATCC 393 (Microbilogics®) en presentación kwik stick, activada en agar MRS (Merck®), e incubada a 37 ºC en placas de Petri durante 24 h y luego conservadas a 4 °C para su posterior uso.
Se transfirió una azada del microorganismo activado a 200 cm3 de medio de precultivo con la siguiente composición: lactosa (Merck®) 44 g/dm3; extracto de levadura (Merck®) 10 g/dm3; KH2PO4 (Merck®) 0,5 g/dm3; K2HPO4 (Merck®) 0,5 g/dm3; MnSO4.H2O (Merck®) 0,05 g/dm3; MgSO4.7H2O (Merck®) 0,2 g/dm3. El tiempo de incubación fue cercano a las 12 h y correspondió al tiempo de crecimiento del microorganismo para garantizar una población de entre 106 y 108 UFC/cm3 (Unidades Formadoras de Colonia por centímetro cúbico).
Las fermentaciones se realizaron por duplicado, en modo de operación batch durante 96 h en matraces Erlenmeyer de 500 cm3 (volumen de trabajo de 200 cm3), a una temperatura de 37 ºC, 130 rpm (agitación orbital), sin control de pH (pH inicial de 6,5), en tres medios de fermentación distintos con la misma concentración de lactosa y cofactores (KH2PO4, K2HPO4, MnSO4.H2O, MgSO4.7H2O), pero con diferentes características de la fuente de nitrógeno como se muestra en la Tabla 2.
Tabla 2 Contenidos de la fuente de nitrógeno en los medios de fermentación (% en base seca).
| Fuente de nitrógeno (%p/p) | Medio 1 | Medio 2 | Medio 3 |
|---|---|---|---|
| Extracto de levadura | 1% | - | - |
| Hidrolizado de proteína del lactosuero | - | 1% | 7% |
Fuente: Elaboración propia
El crecimiento microbiano se determinó mediante conteo de UFC y medición de la densidad óptica 0 fermentación obtenido se caracterizó en cuanto a concentración de ácido láctico y lactosa por HPLC, empleando una columna Coregel 107H acoplada a un equipo UFLC LC 20AD (Shimadzu), seguida de un detector de índice de refracción RID-10A. El equipo operó en modo isocrático a 80 °C, con flujo de 0,6 cm3/min. La fase móvil empleada fue ácido sulfúrico 8mM, con tiempo de análisis de 25 min. Adicionalmente, se hizo seguimiento al pH durante el transcurso de las fermentaciones.
(D.O.) a 660 nm. El cálculo de la velocidad (3) específica de crecimiento máxima (µmáx) se realizó mediante la estimación de la pendiente de la sección lineal de la gráfica de Ln (N/N0) vs tiempo, siendo N las UFC/cm3 en un tiempo (4) dado y N las UFC/cm3 iniciales. El caldo de El cálculo del rendimiento (γ) y de la productividad (Ƥ) se realizó mediante las Ecuaciones 3 y 4 espectivamente1
Resultados y discusión
Desnaturalización e hidrólisis de las proteínas del lactosuero
La caracterización del requesón obtenido en la etapa de desnaturalización térmica y ácida de las proteínas del lactosuero se muestra en la tabla 3.
En la figura 1, se muestra el %DH de proteínas de lactosuero a los diferentes niveles de temperatura y pH analizados
Tabla 3 Análisis bromatológico del requesón obtenido en la etapa de desnaturalización de las proteínas del lactosuero.
| Análisis | (%p/v) |
|---|---|
| Humedad | 81,61 |
| Materia seca | 18,39 |
| Proteína | 11,23 |
| Ceniza | 0,57 |
| Grasa | *DLD |
| Carbohidratos totales | 6,58 |
Fuente: Elaboración propia. *Debajo del límite de detección
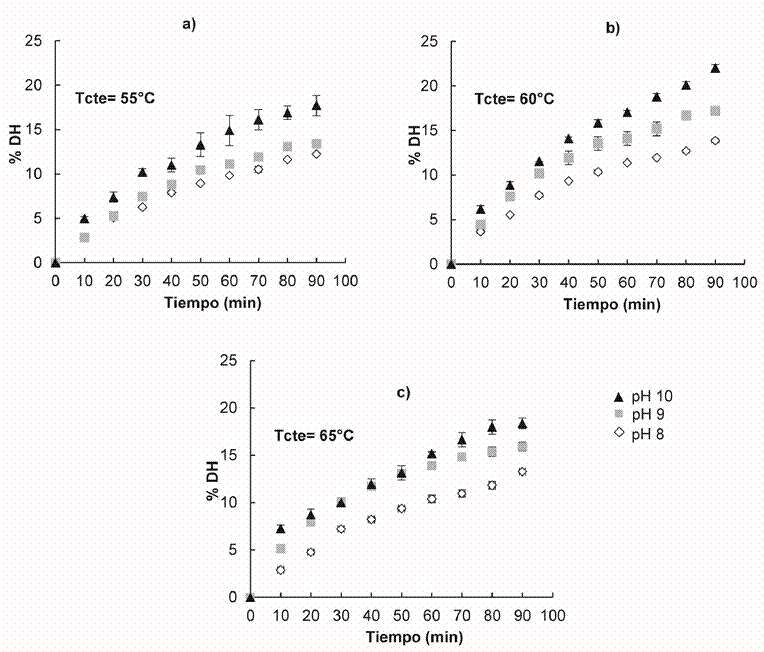
Figura 1 Comportamiento del DH en el tiempo para las siguientes condiciones del medio: pH de 8, 9 y 10 y temperaturas de a) 55ºC, b) 60ºC y c) 65ºC. Fuente: Elaboración propia.
Se observa la curva del grado de hidrólisis de forma creciente con una tendencia a estabilizarse para los diferentes valores de pH y temperatura. Dicho comportamiento también se ha encontrado en la literatura para otras proteasas como la Tripsina, la Papaína, la Pancreatina y la Flavourzyme, la Alcalasa, la Neutrasa, entre otras 14), (18), (19), (20. Se realizó un análisis estadístico del diseño factorial planteado en el software Minitab ®16, encontrando diferencias significativas para los dos efectos analizados, pH y T, con p-valores<0,006 en ambos casos. De forma general, se evidenció mayor grado de ruptura de enlaces peptídicos a pH de 10, mientras que a 60ºC fue la mejor condición, alcanzándose así un %DH de 22,0±0,4%. A resaltar la facilidad para duplicar las hidrólisis a las diferentes condiciones evaluadas, obteniendo curvas cinéticas similares bajo las mismas condiciones de operación.
Por otro lado, se observaron cambios en la apariencia del requesón antes y después de la hidrólisis, para cada una de las condiciones experimentales evaluadas. El requesón diluido antes de la hidrólisis presentaba un color blanco (similar al de la leche), mientras que durante el transcurso de la hidrólisis (a 60 ºC, pH 10) y de la desactivación enzimática (95 ºC durante 15 min) tomó un color ámbar, muy similar al que se obtiene al preparar una solución de extracto de levadura y esterilizar en autoclave a 125ºC durante 15 min. Este cambio de color se presenta por dos razones: la aparición de especies proteicas de diferentes tamaños moleculares (DH) y por la pérdida de las estructuras de orden superior (desnaturalización de las proteínas) 18.
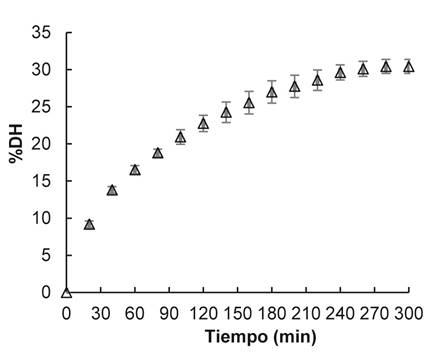
En la figura 2 se muestra la curva de evolución del DH, trabajando a un pH de 10 y a 60 ºC hasta alcanzar su estabilización, logrando un %DH de 30,4±0,9 a los 300 min.
Este valor es alto, al compararlo con otros estudios de hidrólisis de lactosuero crudo, como el reportado en Coelho et al. (13, en el que se emplea Pancreatina y Papaína como enzimas. En dicho estudio la hidrólisis se estabilizó durante 240 min, logrando un %DH no mayor a 24 %. Este resultado contrasta con Zheng et al.21, en el que se emplea concentrado de proteína (WPC) a una concentración de 78 %p y Alcalasa, obteniendo 30 % de DH a los 180 min. Se deduce que estas diferencias se deben a varios factores, en primer lugar, al sustrato, el cual fija la disposición en que se encuentran las proteínas y su concentración y, en segundo lugar, la enzima utilizada 22.
Por otra parte, en la tabla 3, se muestra la determinación del % de nitrógeno total y el nitrógeno amino de los hidrolizados antes y después del hidrólisis, y la comparación con el % de nitrógeno total y nitrógeno amino determinado para el extracto de levadura. En ella se evidencia una menor disposición de nitrógeno amino (%AN) por parte del hidrolizado, pero se encuentra similitud entre los porcentajes de nitrógeno total.
Tabla 3 Porcentaje de nitrógeno amino y nitrógeno total en base seca durante la hidrólisis de las proteínas del lactosuero (WP) y del extracto de levadura comercial.
| Medio | Extracto de levadura | Requesón previo a la hidrólisis | Hidrolizado a los 150 min | Hidrolizado a los 300 min (tiempo de estabilización) |
| Nitrógeno amino (%NA) | 4,79 | 0,35 | 0,53 | 0,54 |
| Nitrógeno total (%NT) | 10,64 | 9,35 | 9,34 | 9,34 |
| %NA/%NT | 0,45 | 0,087 | 0,056 | 0,057 |
En los primeros 150 min de hidrólisis, la velocidad de reacción es mayor dando como resultado más liberación de nitrógeno durante este tiempo, sin embargo, a los 300 min estos valores muestran estabilización. Según Prieto 20, una menor relación AN/TN por parte del hidrolizado, sugiere que la especie proteica al finalizar la hidrólisis tiene mayor tamaño molecular a la encontrada en el extracto de levadura.
En la figura 3 se muestran los electroferogramas obtenidos mediante la técnica tricina-SDS PAGE para: el requesón previo a la hidrólisis (figura 3.a), el hidrolizado a los 150 min (figura 3.b), el hidrolizado a los 300 min (figura 3.c) y el marcador de proteínas usado como patrón para establecer el tamaño molecular de cada especie (figura 3.d). El rango de tamaños moleculares fijado por el patrón empleado permitió la identificación de especies con un tamaño entre 66,0 y 6,5 kDa . En cada una de las figuras, se indica el porcentaje o abundancia de la especie inyectada en cada carril junto a su respectivo peso molecular.
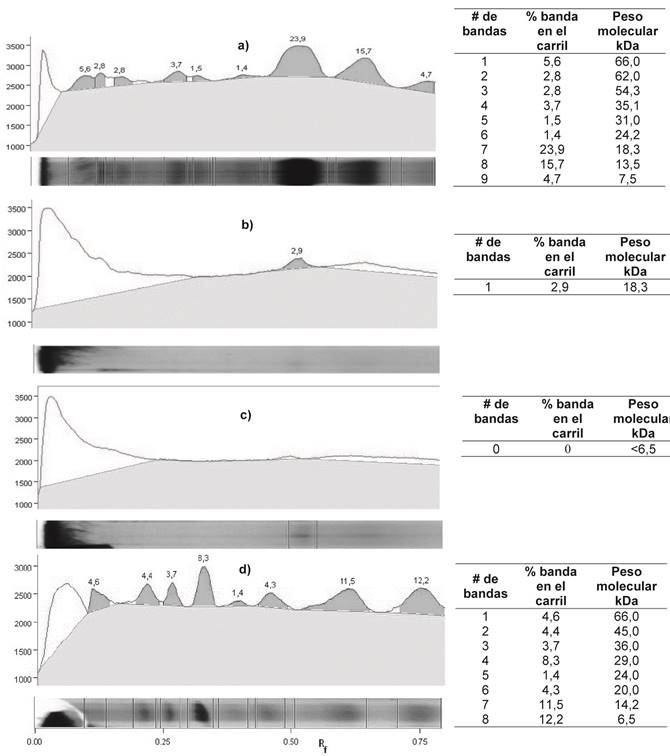
Figura 3 Electroferograma por Tricina-SDS PAGE de: a) Solución de proteínas de lactosuero previo a la hidrólisis; b) Proteínas de lactosuero hidrolizadas durante 150 min (tiempo medio a la estabilización); c) Proteínas de lactosuero hidrolizadas durante 300 min. d)Marcador de proteínas utilizado como patrón. Fuente: elaboración propia.
Al igual que en el trabajo de Ghosh et al.17 para la hidrólisis de suero pasteurizado empleando Flavourzyme, previo a la hidrólisis, el análisis por tricina-SDS PAGE muestra dos bandas principales las cuales corresponden a las proteínas β-lactoglobulina (18,3 kDa) y α-lactoalbúmina (13,5 kDa); las cuales están en mayor concentración en el lactosuero. Al transcurrir el tiempo de hidrólisis estas bandas se hicieron menos intensas y otras zonas descendentes se tornan oscuras indicando la presencia de especies proteicas menores a 6,5 kDa.
Evaluación de los hidrolizados de proteína como fuente de nitrógeno en la fermentación láctica de la lactosa.
El crecimiento de L. casei ATCC 393 en el precultivo utilizado para su activación previa a la fermentación, fue caracterizado en términos de densidad óptica y UFC/cm3 (tabla 4), con el fin de estandarizar el tamaño del inóculo y conseguir una población entre 106 y 108 UFC/cm3; lo que garantiza que la bacteria se encuentre en su fase exponencial de crecimiento 23.
Se realizaron dos series de fermentaciones que partieron de inóculos con D.O. de 0,285 y 0,135, para el original y duplicado, respectivamente, teniendo así, en ambos casos, un inóculo añadido en la fase exponencial de crecimiento. Cabe resaltar que la mayor D.O. registrada para el precultivo de la prueba original, sugiere que la concentración de microorganismos añadida al medio de fermentación en este caso fue un poco mayor que la añadida en la segunda fermentación.
Tabla 4 Seguimiento de la concentración del precultivo mediante medición de (D.O.) 660 nm y recuento de UFC/ cm3, para L. casei ATCC 393.
| Tiempo (h) | D.O. 660 nm | Recuento (UFC/cm3) |
|---|---|---|
| 0 | 0,001 | 6,0x107 |
| 4 | 0,224 | 1,1x108 |
| 8 | 0,757 | 4,0x108 |
| 12 | 0,872 | 4,0x109 |
Fuente: elaboración propia.
En la figura 4.a, se muestra el seguimiento al crecimiento microbiano en las pruebas de fermentación realizadas mediante recuento de UFC/cm3, medición de D.O. (figuras 4.b y 4.c) y pH (figuras 4.d y 4.e). Se distinguen con claridad las fases de crecimiento del microorganismo en los 3 medios en estudio. En todos los casos la fase de adaptación fue <4 h (tiempo de muestreo inicial) debido a la similitud entre el medio de precultivo y los medios de fermentación.
La fase de crecimiento exponencial tuvo una duración de 34 h para los medios con extracto de levadura al 1 %p e hidrolizado al 1 %p, deteniéndose su crecimiento en una concentración microbiana de 2,1*109 UFC/cm3 y 1,9*109 UFC/ cm3, respectivamente, mientras que para el medio con hidrolizado al 7 %p se presentó un crecimiento más lento, finalizando la fase exponencial a las 48 h con una concentración microbiana final de 9,5*108 UFC/cm3.
El medio con hidrolizado al 7 %p además de presentar el menor crecimiento microbiano, registró el pH más alto al finalizar las fermentaciones, con un valor de 4,5±0,1, mientras que para los medios con hidrolizado al 1 %p y extracto de levadura al 1 %p el pH final fue 3,7±0,1 y 3,4±0,0, respectivamente. Dicha inhibición para el medio con hidrolizado al 7 %p, podría presentarse por 2 razones principales: la alta concentración de cenizas (minerales) y la alta concentración de nitrógeno total en el medio. Los % de ceniza y nitrógeno estimados en cada medio se presentan en la Tabla 5.
Tabla 5 Porcentajes de ceniza y nitrógeno total estimados en los medios de fermentación.
| Componente | Medio con E. levadura al 1% | Medio con hidrolizado al 1% | Medio con hidrolizado al 7% |
|---|---|---|---|
| Cenizas | 0,11%p/p | 0,10%p/p | 0,50%p/p |
| Nitrógeno total | 0,10%p/p | 0,093%p/p | 0,65%p/p |
De la tabla anterior se observa una importante similitud en el contenido de ceniza y nitrógeno total para los medios con extracto de levadura e hidrolizado al 1 %p, lo cual justifica el comportamiento similar en cuanto a crecimiento microbiano y evolución del pH en las fermentaciones. Por otra parte, el % de nitrógeno total para el medio con hidrolizado al 7 % es alto y superior en más de 2 veces al % de nitrógeno total del caldo MRS (~0,28 %p), medio de referencia usado para el crecimiento de bacterias del género Lactobacillus. Adicionalmente, en la literatura las máximas concentraciones de extracto de levadura reportadas en fermentaciones lácticas son del orden de 30 g/L, es decir, aproximadamente 0,3 %p de nitrógeno total en el medio. Lo señalado anteriormente indicaría que el exceso de nitrógeno en el medio en mención podría haber afectado el desempeño de la fermentación.
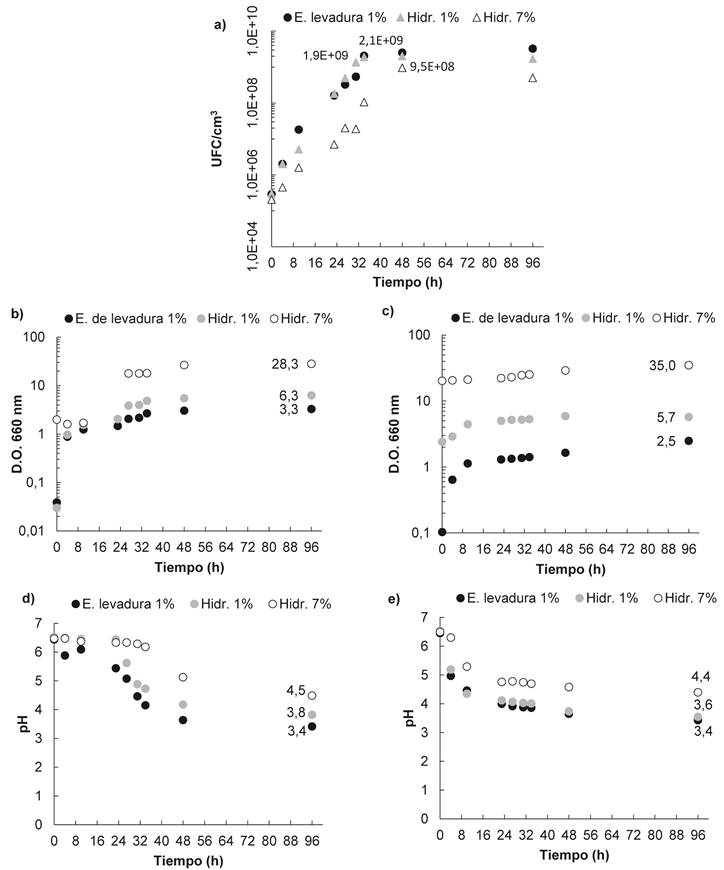
Figura 4 a) Curva de evolución de las UFC/cm3; b) y c) D.O. 660 nm original y duplicado, respectivamente; c) y d) seguimiento al pH original y duplicado, respectivamente. Fuente: elaboración propia.
Por otra parte, Castro 23, reporta un tiempo de cese en el crecimiento a las 28 h para L. casei ATCC 334, utilizando un medio a base de lactosuero desproteinizado, los mismos cofactores del presente estudio, extracto de levadura al 1 %p/v, un precultivo activado en caldo MRS y sin control de pH. No obstante, la utilización de una cepa diferente, su activación en caldo MRS (medio de cultivo rico en compuestos nitrogenados como proteasa de peptona, extracto de carne, entre otros), junto con el aprovechamiento de otros nutrientes (principalmente nitrógenados) presentes en el lactosuero, pudo favorecer una mayor velocidad de crecimiento del microorganismo. Por otra parte, la literatura indica que la especie L. casei presenta inhibición a pH<5, aspecto confirmado en el presente trabajo y evidenciado en las figuras 4.d y 4.e, donde se aprecia un cese en el crecimiento a un pH de 3,4; 3,8 y 4,5, para los medios con extracto de levadura al 1 %p, hidrolizado al 1 %p e hidrolizado al 7 %p, respectivamente. Es de apreciar que en la segunda serie de fermentaciones el descenso en el pH es más rápido en comparación a la primera fermentación, con lo cual se podría pensar que el haber añadido un inóculo con una menor concentración inicial de microorganismos (menor D.O.), favoreció la adaptación al medio de fermentación. De esta manera estudiar el efecto del tamaño del inóculo en los medios analizados permitiría determinar la concentración inicial de microorganismos más favorable. En la figura 5 se muestra el ajuste lineal del Ln (N/No) (UFC/cm3) vs tiempo, realizado para la estimación de µmáx , tal como se mencionó en la metodología, para las tres fuentes de nitrógeno estudiadas en la primera serie de fermentaciones. Los valores de 0,26 h-1; 0,25 h-1 obtenidos para los medios con extracto de levadura e hidrolizado de proteínas al 1 %p, respectivamente, fueron similares entre sí y son acordes a los obtenidos por Ghaly & Kamal 24 y Altiok et al.25, quienes trabajaron con extracto de levadura y lactosuero, presentando una µmáx de 0,25 h-1 y 0,26 h-1, respectivamente. Esta similitud en la velocidad específica de crecimiento evidenciada para los medios de fermentación con extracto de levadura al 1 %p y con hidrolizado de proteína del lactosuero al 1 % indican que el hidrolizado a esta concentración, en términos de crecimiento microbiano, representa una alternativa de interesante potencial. Por otra parte, la µmáx de 0,17 h-1 alcanzada para el medio con hidrolizado al 7 %p muestra que el crecimiento pudo haberse ralentizado por exceso de nitrógeno en el medio. Adicionalmente, la determinación del ácido láctico inicial y final en el medio de fermentación junto con la concentración inicial y final de lactosa permitió el cálculo de los rendimientos y las productividades en los distintos medios; los resultados se muestran en la tabla 5. Se distinguen rendimientos muy similares para los medios con extracto de levadura e hidrolizado al 1%p/p, mientras que para el medio con hidrolizado al 7%p/p presentó una reducción del 25%. La mayor productividad alcanzada se registró para el medio con extracto de levadura comercial, sin embargo, la obtenida con el hidrolizado de proteína del lactosuero al 1% p/p se asemeja al de esta fuente de nitrógeno convencional; pero que tiene la ventaja de un menor costo para el proceso de fermentación. Castro 23 reporta un rendimiento de 0,64 g ác. láctico producido/g lactosa consumida y una productividad de 0,55 g ác. láctico producido/g lactosa consumida, utilizando extracto de levadura al 1% p/p y un medio de fermentación con los mismos cofactores y fuente de carbono usados en el presente trabajo. Büyükkileci & Harsa 26 obtuvieron una concentración final de ácido láctico de 46 g/dm3 (rendimiento de 0,93) y una productividad de 1,87 g/dm3.h durante 30 h. Sin embargo, utilizaron carbonato de calcio como agente de control de pH lo cual evitó alcanzar el pH de inhibición del microorganismo, permitiendo prolongar la fase exponencial del microorganismo e inducir el consumo total de la lactosa presente en el medio. Se debe recordar que las soluciones preparadas presentan concentración inicial de ácido láctico ya que dichas proteínas fueron recuperadas de lactosueros ácidos, los cuales contienen una cantidad menor de ácido láctico.
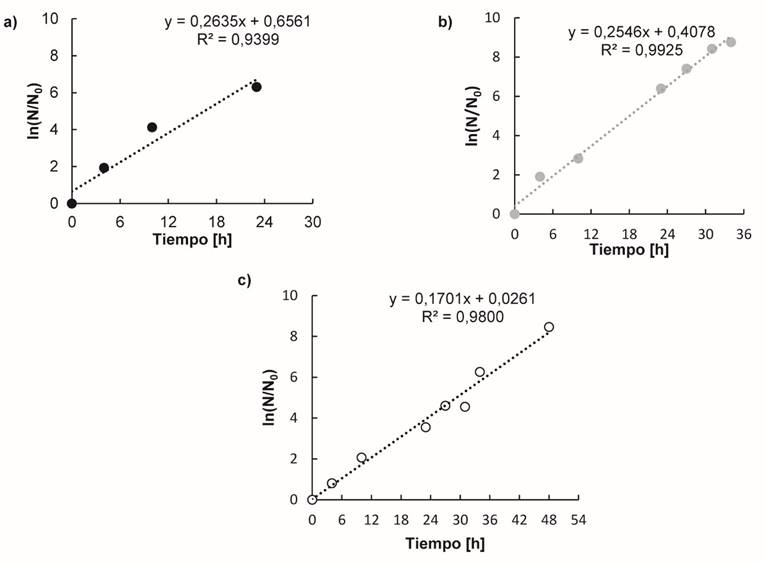
Figura 5 Determinación de la velocidad específica de crecimiento máxima (µmáx) de Lactobacillus casei ATCC 393 utilizando como fuente de nitrógeno: a) Extracto de levadura al 1%p/p, b) Hidrolizado al 1%p/p y c) Hidrolizado al 7%p/p. N (UFC/cm3) Fuente: elaboración propia.
Tabla 5 Determinación del rendimiento y la productividad de ácido láctico para los 3 medios, a las 27 h de fermentación.
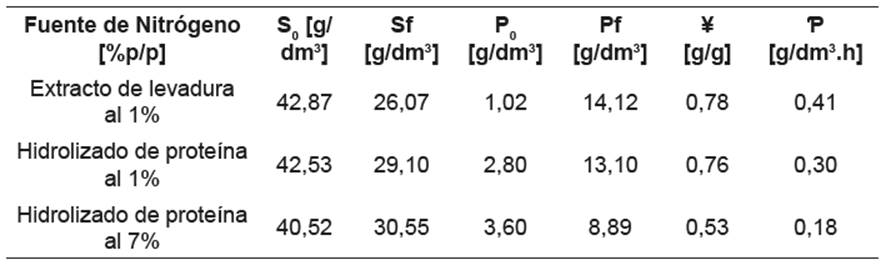
Fuente: elaboración propia.
S0 y Sf concentración de lactosa inicial y final, respectivamente. P0 y Pf: concentración de ácido láctico inicial y final, respectivamente; ¥: rendimiento; Ƥ: productividad
Conclusiones
Dentro del rango de trabajo estudiado, se determinaron las mejores condiciones para la hidrólisis de proteínas de lactosuero (pH de 10 y 60 ºC) utilizando la enzima Gelzyme L500©, alcanzando un DH de 30 % en 300 min. Se pudo observar la desaparición progresiva de las proteínas y la formación de especies nitrogenadas de tamaño molecular menor a 6,5 kDa.
El uso de los hidrolizados como fuente de nitrógeno en las fermentaciones mostró similitudes en el desempeño de los medios con extracto de levadura al 1 %p e hidrolizado de proteína al 1 %p, en términos de crecimiento microbiano (2,1*109 y 1,9*109 UFC/cm3, rendimiento (0,78 y 0,76 g/g) y productividad (0,41 y 0,30 g/dm3.h), respectivamente. Los medios con hidrolizado de proteína al 7 % registraron menor crecimiento microbiano (9,5*108 UFC/cm3), rendimiento (0,53 g/g) y productividad (0,18 g/dm3.h), lo cual podría asociarse a una inhibición por exceso de nitrógeno en este medio de fermentación. El presente estudio permitió mostrar el interesante potencial que tienen los hidrolizados de proteína de lactosuero para ser usada como fuente de nitrógeno de bajo costo en la fermentación láctica.