Introducción
La determinación de H2O2 en diferentes tipos de matrices ambientales y biomédicas es de suma importancia ya que a nivel industrial es usado como agente blanqueador en la industria de papel y en tintes para el cabello y sus desechos son arrojados sin ningún control sobre fuentes hídricas 12), (13), (14), (15. Por otro lado, el H2O2 juega un papel muy importante en diferentes tipos de reacciones bioquímicas, por ejemplo, concentraciones elevadas de H2O2 contribuyen al daño oxidativo de diferentes enzimas y proteínas que podrían estar correlacionadas con enfermedades como el cáncer 16. Por lo tanto, es muy importante no únicamente detectar el H2O2 sino también determinar su concentración exacta. Actualmente, existen métodos bastante precisos y exactos basados en técnicas analíticas como: espectrometría, cromatografía acoplada a masas y HPLC 9), (17), (18), (19. Sin embargo, estos métodos presentan desventajas tales como: largos tiempos de análisis, uso de personal capacitado, costos elevados, entre otros.
Los biosensores electroquímicos son dispositivos bio-analíticos que integran un elemento de reconocimiento biológico (enzimas, proteínas, virus, tejidos celulares, bacterias, etc.) en la superficie de un transductor y mediante un voltaje operacional se produce una corriente en función de la concentración del analito a determinar. Actualmente, son ampliamente utilizados debido a características operacionales tales como: respuesta rápida, rango lineal de respuesta, niveles mínimos de detección y en la mayoría de los casos no requiere preparación de la muestra 1), (2), (3.
Entre los elementos de reconocimiento biológico de mayor interés en la construcción de biosensores están las peroxidasas (PODs), las cuales son enzimas de tipo oxidorreductasas que catalizan la oxidación de aminas y fenoles usando como agente oxidante el peróxido de hidrógeno (H2O2) 2), (4. La POD de rábano picante (PRP) es la enzima comercial más estudiada gracias a su amplia especificidad frente a diferentes sustratos. No obstante, en aplicaciones biotecnológicas que requieren el uso de altas temperaturas, pHs extremos y altas concentraciones de H2O2, la Peroxidasa de rabano picante (PRP) presenta una disminución notable tanto en su actividad bio-catalítica como en su estabilidad 4. Estas desventajas han motivado a la comunidad científica a la búsqueda de nuevas fuentes naturales de la peroxidasa, es así como en las últimas décadas se han encontrado nuevas peroxidasas provenientes de maní, soya, palmas y otros tipos de plantas tropicales. Recientemente, dos tipos de PODs encontradas en la palma real (Roystonea regia) y el pasto guinea (Panicum maximum) cultivadas en territorio santandereano (Colombia) han sido purificadas y caracterizadas bioquímicamente 4), (5. La peroxidasa de pasto guinea (PPG) fue inmovilizada sobre electrodos serigrafiados de grafeno y usada en la construcción de un biosensor amperométrico para la detección de triclosán con un potencial redox de 0,37 V y un límite de detección de 3x10-6 M 6. Por otro lado, la Peroxidasa de rabano picante (PRP) ha sido usada en la construcción y fabricación de biosensores amperométricos sobre electrodos de grafeno y electrodos de oro modificados con nanotubos de péptidos para detección de H2O27), (8.
Los últimos avances en el campo de la nanotecnología y las nanociencias, en lo que a fabricación de novedosos materiales se refiere, ha permitido desarrollar nanomateriales para la construcción de nuevos electrodos serigrafiados. Uno de los nanomateriales con más aplicaciones electroquímicas son los puntos cuánticos (PC). Los PCs son nanopartículas semiconductoras (Ej: PbX, CdX, ZnX (X: Se, S, Te)) constituidos por aproximadamente de 100 a 100000 átomos por partícula 9. El caparazón metálico presente en la estructura de los PCs es favorable para la construcción de biosensores electroquímicos debido al mejoramiento en las propiedades electrónicas y al microambiente protector que pueden ofrecer a las enzimas 10), (11. Por otro lado, gracias al tamaño nanométrico de los PCs ha sido posible la fabricación de electrodos robustos, rentables, maleables y fáciles de miniaturizar.
Por ejemplo, Manan et al., desarrollaron un nanocomposito de celulosa nanocristalina decorado con PCs y funcionalizado con tirosinasa para detección electroquímica de fenol 11. En otro estudio, Ali et al.., lograron detectar ácido úrico mediante un biosensor electroquímico altamente sensible fabricado a base de PCs de ZnO 11. La integración de glucosa oxidasa con puntos cuánticos de grafeno (PCG) sirvió como base para la construcción de un biosensor electroquimioluminiscente para detección de glucosa 11. Uno de los pocos estudios que integran las peroxidasas con PCs fue el llevado a cabo por Muthurasu et al., quienes inmovilizaron la PRP sobre la estructura de electrodos de PCG para detección electroquímica de H2O211.
Teniendo en cuenta los antecedentes mencionados, en este estudio se inmovilizó la PPG sobre la superficie de electrodos serigrafiados de puntos cuánticos para la determinación de H2O2. Las técnicas electroanalíticas usadas demostraron la eficiencia del biosensor para reducir electrocatalíticamente el H2O2, y permitieron la obtención de parámetros analíticos tales como nivel mínimo de detección, rango lineal y la sensibilidad con valores de 45,21 µM, 0,5-4 mM y 23,50 µA/mM, respectivamente. De esta manera, este estudio consistió en una evaluación preliminar de un biosensor amperométrico con el fin de obtener un novedoso sistema bioanalítico portable y de respuesta rápida para la determinación de H2O2 en muestras reales de interés ambiental y biomédico.
Procedimiento experimental
Purificación de la peroxidasa de pasto guinea
Para la extracción de la peroxidasa de pasto guinea (Panicum maximum) se empleó un método similar al descrito por Sakharov et al. 4. Hojas de pasto guinea fueron cortadas en pequeños trozos obteniendo 100 g del triturado para luego ser homogeneizado con un buffer fosfato 100 mM pH 7,4 con agitación constante. El extracto se centrifugó a 5000 rpm durante 20 min y 4°C con el fin de eliminar los sólidos. Sobre el extracto crudo obtenido, se adicionaron lentamente, polietilenglicol (PEG, peso molecular 15.00020.000) al 14 %p/v y sulfato de amonio (NH4)2SO4 al 10 %p/v bajo constante agitación magnética hasta disolver todos los sólidos, y lograr la separación de la POD. La capa clara conteniendo la POD fue sometida a cromatografía por exclusión de tamaño empleando como fase estacionaria Sephadex S-75, y equilibrando la columna con un buffer TRISbásica de 3 mM a pH 8,3 con un flujo de 1ml/min, la elución se llevó a cabo con el mismo buffer de equilibrio. Finalmente, las fracciones conteniendo la POD fueron centrifugadas empleando Amicones® de 10 kDa durante 30 min a 5000 rpm. Se midió la actividad enzimática y el contenido de proteínas 19, la POD purificada fue almacenada a 4 °C para los experimentos electroquímicos.
Modificación del electrodo serigrafiado de puntos cuánticos con la peroxidasa de pasto guinea
Se utilizaron electrodos serigrafiados de carbono modificados con un núcleo de puntos cuánticos de CdSe incluyendo un electrodo de referencia de plata y un electrodo auxiliar de carbono. Fueron adquiridos comercialmente (110QD, Dropsens® Oviedo, España) y presentan las siguientes dimensiones: L33 x A10 x A 0,5 mm. Para la modificación de los ESPCs se depositaron 5 µL de la PPG sobre la superficie del electrodo y se almacenó a 4 °C durante 12 h. Posteriormente, la superficie del electrodo fue lavada cuidadosamente con buffer PBS pH 7,4 para eliminar la peroxidasa no adsorbida. En la figura 1, se puede observar un esquema del funcionamiento y los pasos seguidos para preparar el electrodo modificado.
Estudio electroquímico de los ESPCs sin modificar y modificados con la PPG
Por medio de voltamperometría cíclica (VC) se comparó el comportamiento redox del electrodo sin modificar y en presencia de la PPG en una celda acrílica de 7 mL de capacidad conteniendo una solución de PBS 10 mM, pH 7.4. Los VCs fueron medidos a una velocidad de barrido de 50 mV s-1. Todas las mediciones electroquímicas fueron llevadas a cabo en un potenciostato Autolab PGSTAT101 (Echo Chemie, Utrecht, The Netherlands) controlado por el software NOVA 1.10.1.9 (Metrohm, Filderstand, Germany).
Reducción bioelectrocatalítica del peróxido de hidrógeno por el ESPC-PPG
Electrodos sin modificar y modificados con la peroxidasa fueron sumergidos en la celda electroquímica conteniendo una solución de PBS 10 mM, pH 7,4 en presencia de una concentración 1 mM de H2O2. Por medio de varios VCs (velocidad de barrido de 50 mV s-1) se evaluó el comportamiento del ESPC-PPG en la reducción del H2O2.
Estudio del efecto de la velocidad de barrido
Se midieron diferentes VCs del electrodo ESPCPPG de una solución PBS 10 mM pH 7,4 a velocidades de barrido comprendidas entre 50 y 500 mV s-1.
Estudio de los parámetros analíticos Experimentos por cronoamperometría permitieron la construcción de curvas de calibración a diferentes concentraciones de H2O2 y se determinaron los siguientes parámetros analíticos: rango lineal del método, límite de detección y sensibilidad del método. Se trabajó a un potencial fijo de -645 mV y se usaron concentraciones de H2O2 en un rango entre 0,5 y 6 mM y un tiempo de medición de aproximadamente 10 min. Todas las mediciones fueron llevadas a cabo por triplicado mediante la fabricación de electrodos preparados bajo las mismas condiciones.
Resultados y discusión
En la tabla 1 se resumen las diferentes etapas en la purificación parcial de la PPG. Inicialmente, el extracto de la POD luego de la extracción con el PBS enriquecido en pigmentos coloreados mostró una actividad específica de 162 U mg-1 . Posteriormente, los pigmentos fueron removidos eficientemente mediante un sistema bifásico PEGsulfato de amonio y la capa clara con un volumen de 41 mL presentó un valor en la actividad específica de 304 U mg-1. Finalmente, la cromatografía de permeación en gel y la ultracentrifugación permitieron obtener la PPG con una actividad específica final de 602 U mg-1 .
Tabla 1 Etapas de la purificación parcial de la peroxidasa de asto guinea.
| Etapa | Volumen (mL) | Proteína (mg) | Actividad total (U) | Actividad específica (U mg-1) | Rendimiento (%) | Factor de purificación |
| Extracción | 150 | 83 | 13459 | 162 | 100 | 1 |
| Remoción de pigmentos | 70 | 41 | 12498 | 304 | 93 | 1,9 |
| Cromatografía de permeación en gel | 30 | 12 | 5456 | 454 | 26 | 4,5 |
| Ultracentrifugación | 15 | 5 | 3012 | 602 | 22 | 6,1 |
La figura 2 muestra los VCs (velocidad de barrido de 50 mV s-1) del electrodo de PCs sin modificar y modificado con la PPG en una solución PBS 100 mM, pH 7,8. El VC del electrodo modificado muestra una pareja de señales redox bien definidas a 17mV/-141mV las cuales corresponden al proceso redox Fe2+/Fe3+ del grupo hemo de la POD, estas señales están en concordancia con otros potenciales redox de la mayoría de PODs 20), (21), (22), (23), (24), (25. Por otro lado, el EPC sin modificar no muestra ninguna señal redox lo que confirma la adsorción de la PPG sobre la superficie de los electrodos de puntos cuánticos.
El potencial formal (promedio del valor del potencial catódico y anódico) de la PPG fue de aproximadamente 79 mV y está dentro de los valores reportados para otras PODs de plantas (25) indicando que los PCs ofrecen un microambiente favorable para la POD inmovilizada mejorando de esta forma la comunicación electrónica entre la superficie del electrodo y la enzima. Además, la separación de los picos catódico y anódico (∆Ep) es mayor que 56 mV lo que evidencia un proceso redox cuasi-reversible de transferencia de electrones entre la superficie del electrodo y la enzima 26.
Una manera de obtener información acerca de la reversibilidad del proceso redox es mediante el estudio de la dependencia de la corriente catódica con la raíz cuadrada de diferentes velocidades de barrido 18), (27.

Figura 2 Voltamperogramas cíclicos de ESPCs sin modificar y modificados con la PPG en una solución de buffer PBS 100 mM, pH 7,8 (velocidad de barrido 50 mV s-1).
La figura 3A muestra VCs a diferentes velocidades de barrido para el electrodo modificado con la PPG en una solución PBS 100 mM, pH 7,8, a partir de los valores de las señales de la corriente catódica y anódica se construyó la curva de la figura 3B.
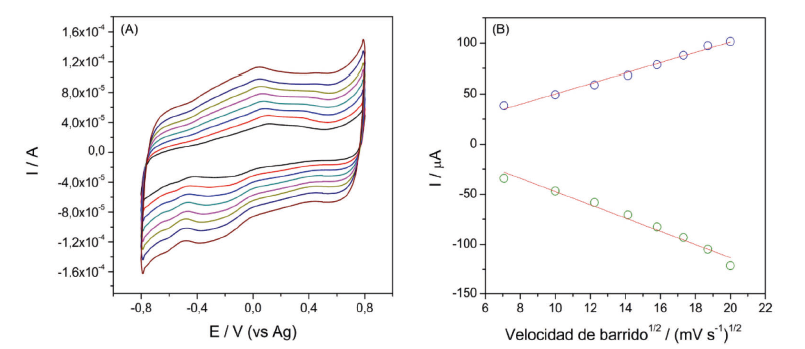
Figura 3 Voltamperogramas cíclicos (A) a diferentes velocidades de barrido (50, 100, 150, 200, 350, 400, 450,500 mV s-1); (B) curvas de intensidad de corriente vs la raíz cuadrada de la velocidad de barrido de ESPCs sinmodificar y modificados con la PPG en una solución de buffer PBS 100 mM, pH 7,8.
Como se puede apreciar existe una dependencia lineal entre la raíz cuadrada de la velocidad de barrido con las corrientes anódicas y catódicas, respectivamente. Las ecuaciones de regresión lineal fueron, Cpa = 5,09ν - 0,98 (R= 0,99) y Cpc = -6,60ν + 18,72 (R= 0,98), para la corriente del pico anódico y catódico, respectivamente. Esta linealidad sugiere un proceso cuasi-reversible controlado superficialmente por las especies electroactivas difundiéndose hacia el electrodo 17. La reducción electrocatalítica del H2O2 por parte de la enzima inmovilizada sobre la superficie del ESPC fue estudiada mediante VC. En la figura 4 se puede apreciar que no hubo ninguna actividad catalítica por parte del electrodo sin modificar, mientras que en el electrodo modificado con la PPG y en presencia de 1 mM de H2O2 adicionado a la celda electroquímica se pudo apreciar una corriente catódica a -645 mV, debido a la reducción bioelectrocatalítica del H2O2 por parte del grupo hemo de la PPG. Un comportamiento similar en la reducción del H2O2 por otros tipos de POD inmovilizado sobre diferentes tipos de electrodos fue observado por otros autores 28), (29), (30), (31.
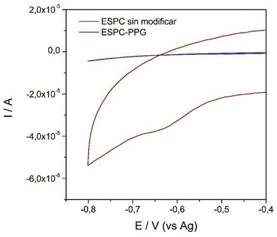
Figura 4 Voltamperograma cíclico de la reducción del H2O2 (1 mM) del electrodo no modificado y modificado con la peroxidasa de pasto guinea, velocidad de barrido 50 mV s-1.
Al igual que otras PODs de plantas y de acuerdo con estudios reportados anteriormente 1), (12), (32), (33), (34 el mecanismo por el cual la PPG inmovilizada sobre la superficie del electrodo de PCs reduce el H2O2 es descrito en el siguiente esquema:
Inicialmente, luego de reaccionar con el peróxido, el FeIII del grupo hemo de la PPG es oxidado al compuesto I ( Ecuación 1), que contienen el ion hierro (III) débilmente enlazado al catión radical protoporfirínico π. El compuesto I obtiene un electrón del electrodo para formar el compuesto II ( Ecuación 2). Finalmente, el compuesto II es reducido nuevamente a la forma nativa de la enzima por medio del electrón donado por el electrodo ( Ecuación 3).
Con el propósito de demostrar la detección del peróxido por la PPG inmovilizada sobre los electrodos de PC, experimentos de cronoamperometría para monitorear la respuesta amperométrica del electrodo luego de diferentes y sucesivas adiciones de H2O2 fueron llevados a cabo. Se escogió un potencial de trabajo de -645 mV (vs Ag) según la señal de potencial presentada en el VC de la figura 4. El ESPC-PPG mostró una corriente de reducción con valores estables posteriores a la adición de alícuotas de H2O2 a la solución buffer agitada magnéticamente (Fig. 5A), esto evidenció un proceso de transferencia rápida de electrones desde el centro redox de la PPG hacia la superficie del electrodo. Por otro lado, la curva de calibración de la Figura 5B mostró una dependencia lineal descrita por la ecuación: I = -23,50(H2O2) - 46,95, con un coeficiente de correlación de 0,993. El límite de detección (Ld= 3,3Sb/m) fue calculado siguiendo la definición dada por la Unión Internacional de Química Pura y Aplicada (IUPAC) donde Sb hace referencia a la desviación estándar del blanco y m es la pendiente de la curva de calibración. La sensibilidad se obtuvo a partir de la pendiente de la curva de calibración de la figura 5B. Por lo tanto, el valor obtenido para el Ld fue de 45,21 µM y la sensibilidad 23,50 µA/mM. Finalmente, en la tabla 2 se muestra una comparación del desempeño analítico de sistemas similares con los obtenidos en este estudio usando PODs para detección de H2O2.
De acuerdo con estos resultados, el biosensor obtenido a base de electrodos serigrafiados de puntos cuánticos y modificados con peroxidasa de pasto guinea podría ser potencialmente empleado en el análisis de muestras de interés ambiental y biomédico para la determinación de peróxido de hidrogeno.
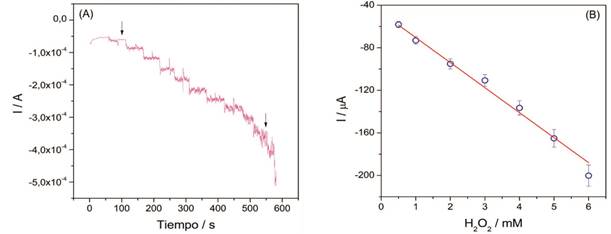
Figura 5 Cronoamperometría de la PPG (A) inmovilizada sobre ESPC en presencia de diferentes cantidades de H2O2 en 7 mL de PBS 100 mM, pH 7,8; potencial de trabajo -645 mV (vs Ag). Curva de calibración (B) de la corriente catódica vs concentración de H2O2.
Tabla 2 Comparación de parámetros analíticos de electrodos modificados con peroxidasas para determinación de H2O2.
| Electrodo modificado | Potencial redox (V) | Rango lineal (µM-mM) | Límite de detección (µM) | Ref. |
|---|---|---|---|---|
| PRP/AuNP/Au electrodo | -0,3 | 0,48-1,2 | 0,16 | (35) |
| PRP/GF/electrodo de carbono | -0,36 | 3,5-3,3 | 1,17 | (36) |
| PRP/ITO/dendrímero/QS/Au electrodo | -0,28 | 165-1,5 | 200 | (37) |
| PPR/QS-GLU/GF electrodo | -1 | 100-5 | 87 | (8) |
| PPG/GF electrodo | -0,65 | 100-4 | 150 | (5) |
| PPG/PCs electrodo | -0,64 | 500-6 | 45,21 | Este estudio |
PRP: peroxidasa de rábano picante; ITO: óxido de indio y estaño; QS: quitosano; PPR: peroxidasa de palma real; GF: grafeno; PPG: peroxidasa de pasto guinea; PCs: puntos cuánticos
Conclusiones
El biosensor amperométrico de ESPC-PPG obtenido en este estudio mostró una respuesta rápida y eficaz en la determinación del peróxido de hidrógeno. La caracterización electroquímica por VCs permitió evidenciar la inmovilización de la enzima sobre los electrodos de puntos cuánticos gracias a la presencia de la señal redox del Fe2+/Fe+3 típica de las peroxidasas y ubicada en potenciales 17 mV/ - 141 mV. El biosensor presentó una rápida respuesta en la determinación del peróxido, además de una alta sensibilidad y un bajo límite de detección. Finalmente, el biosensor fabricado en este estudio se convierte en una potencial herramienta bio-analítica para la detección de peróxido de hidrógeno en diferentes tipos de matrices biológicas o ambientales.
















