Introducción
La aparición de microorganismos resistentes a los desinfectantes comunes ha impulsado la búsqueda extensiva de nuevos productos que sean efectivos matando o inhibiendo el crecimiento de las bacterias, y a su vez sean inocuos al ser humano. Las nanopartículas de plata (Np Ag) son una posible respuesta de la nanotecnología a este reto, pues su alta superficie por unidad de volumen incrementan las ya conocidas propiedades antibacteriales de la plata [1].
Las Np Ag pueden ser sintetizadas por varios métodos, como reacción de reducción química, reacción fotoquímica, descomposición térmica, métodos asistidos por radiación, procesos electrotérmicos, sono-químicos y síntesis asistida por microondas [2]. Estos métodos producen nanopartículas de plata y de forma eficiente, sin embargo, frecuentemente estos métodos involucran el uso de sustancias químicas tóxicas y peligrosas, las cuales presentan varios efectos nocivos para el ambiente y la salud humana [3], además el producto final requiere varias etapas de purificación, en las cuales se usan agentes reductores que muchas veces son adsorbidos en la superficie de las nanopartículas, también es necesario el empleo de estabilizantes para evitar una aglomeración de las nanopartículas de plata [4].
Algunos extractos de plantas pueden actuar como agentes niveladores reductores en la síntesis de nanopartículas de plata. La reducción de los iones Ag+ por combinaciones de biomoléculas que se encuentran en estos extractos tales como enzimas/proteínas, aminoácidos, polisacáridos y vitaminas [5,6], son ambientalmente benignos, aunque químicamente complejos. Un extenso volumen de literatura reporta la síntesis exitosa de Np Ag utilizando compuestos provenientes de seres vivos biorgánicos; por ejemplo, se utilizó el extracto de algas verdes unicelulares Chlorella vulgaris para sintetizar nanoplacas cristalinas de Ag a temperatura ambiente [7]. Las proteínas en el extracto proporcionan doble función de reducción de Ag+ y un control de morfología en la síntesis de Np Ag. Donde surgieron los grupos carboxilo en los residuos de aspártico y glutamina y los grupos hidroxilo en los residuos de tirosina de las proteínas, como artífices de la reducción de iones de Ag+ [7], lo cual se confirma con la reducción de Ag por el tripéptido bifuncional simple Asp-Asp-Tyr-OMe. Este proceso de síntesis generó pequeñas nanoplacas de Ag con baja polidispersidad con buen rendimiento (55%) [8]. Varios microorganismos han sido utilizados para que crezcan nanopartículas de plata intracelularmente o extracelularmente [9,13]. Por ejemplo, Ag+ que contiene nanocristales de diferentes composiciones fue sintetizado por la bacteria Pseudomonas stutzeri (AG259) [9]. En el hongo Fusarium oxysporum, la reducción de los iones Ag+ fue atribuida a un proceso enzimático, en el que se involucra la reductasa NADH el cual se le atribuye dependencia de reductasa NADH [12]. El hongo de pudrición blanca, Phanerochaete chrysosporium, también redujo al ion Ag+ para formar nanopartículas; sugiriendo que una proteina de su metabolismo causó la reducción. Se sugirió una proteína para causar la reducción [13]; observando la posible participación de las proteínas en la síntesis de Np Ag en cianobacterias filamentosas, Plectonema boryanum (UTEX 485) [14]. Por otra parte, la reducción de Ag+ por sobrenadantes de cultivo de Klebsiella pneumoniae, Escherichia coli (E. coli), Enterobacter cloacae y Enterobaceteriacae produjeron formaciones de nanopartículas de plata [15].
En este trabajo fue empleada una de las metodologías para sintetizar nanopartículas de plata, considerada como parte del grupo de las síntesis verde, pues, en ésta se utilizó la microalga Chlorella sp. como un agente de formación de exopolímeros [16,17], el cual promueve la formación de dichas nanopartículas. Dichos exopolímeros son productos del metabolismo de la Chlorella sp. al usar glicerina como sustrato o al cultivarse en condiciones de estrés, y al estar compuestos de unidades monoméricas de azúcares (con gran cantidad de grupos hidroxilo) [18], tiene la capacidad de atraer con facilidad los iones plata de la solución de nitrato de plata, formando así Np Ag.
Metodología
Cultivo madre de la microalga Chlorella sp.
La cepa de Chlorella sp. fue donada por el laboratorio de Biotecnología de microalgas de la Universidad del Atlántico. El cultivo inició con 500 mL de un cultivo siembra de la microalga, el cual fue diluido con agua estéril hasta un volumen de 2000 mL, adicionándole 4,7 mL de una solución 2,14 M en nitrógeno total de Nutrifoliar® previamente esterilizado, para obtener una concentración final de nitrógeno de 5 mM. Los cultivos fueron realizados por duplicado y se le suministró aireación, alimentación e iluminación (2710 lm, tubos fluorescentes Philips TL 65W 25, luz blanca) y se incubó por un periodo de 20 días, con ciclos de luz/oscuridad de 12 horas, respectivamente, utilizando luz artificial y temperatura ambiente de 24 °C. Los cultivos fueron aforados a 2000 mL cada 15 días utilizando agua estéril y 5,8 mL de Nutrifoliar® a 2,14 M de nitrógeno total.
Biosíntesis de nanopartículas de plata
Para el estudio de la síntesis de agentes reductores producidos por las microalgas, bajo diferentes condiciones de cultivo y su efecto sobre la producción de Np Ag, utilizando un diseño factorial con dos variables independientes: condiciones de iluminación y temperatura, con tres niveles y concentración de glicerol, como fuente orgánica de carbono, con 5 niveles (0, 5, 10, 15 y 20 %) (Tabla 1).
Tabla 1 Factores y niveles experimentales.
| Factor experimental | Niveles |
|---|---|
| Temperatura ambiente con iluminación continua | |
| Condiciones de iluminación y temperatura | Temperatura ambiente con oscuridad continua |
| -18 °C con oscuridad continua | |
| 0 | |
| 5 | |
| Concentración de glicerol (% vol/vol) | 10 |
| 15 | |
| 20 |
Los cultivos fueron incubados durante tres días y posteriormente las células se separaron por centrifugación (10 min a 8000 rpm). La síntesis de Np Ag se realizó utilizando agente reductor, las soluciones de sobrenadante y precipitado por separado, con el fin de determinar si las microalgas participan activamente en la síntesis de las Np Ag o los responsables de la síntesis son solamente los productos metabólicos excretados.
El procedimiento de síntesis fue el siguiente: 2 mL de precipitado o sobrenadante, para cada una de las combinaciones experimentales, se transfirieron a tubos de cultivo de 10 mL y se le adicionaron 2 mL de nitrato de plata (AgNO3 J.T. Baker) con una concentración de 2 mM, para luego ser sometidos a un mezclado en vortex durante 2 min. El medio homogenizado se incubó nuevamente con luz artificial continua durante 3 días a temperatura ambiente. La variable de respuesta experimental fue el espectro UV - Visible de las muestras, el cual permite la identificación de la posible formación de nanopartículas de plata. Todos los ensayos fueron realizados por duplicado. Los espectros UV-Vis se obtuvieron en un espectofotómetro Genesys 60 s (Thermofisher) utilizando celdas de cuarzo con longitud de paso de 1 cm y un rango espectrométrico de 290 a 900 nm.
Microscopía electrónica de barrido (SEM)
El equipo utilizado para esta medición es un SEM modelo VEGA3 TESCAN. Antes de la medición fue necesario retirar la materia orgánica, a través de lavados sucesivos de las muestras usando una solución volátil de etanol al 95%, así: las muestras se centrifugaron durante 10 min a 8000 rpm, seguido a esto se descartó el sobrenadante, se agregaron 5 mL de etanol al 95% y se resuspendieron las Np Ag en ultrasonido dejando 10 min. Posteriormente, para el segundo paso, las Np Ag se centrifugaron a 10000 rpm, durante 10 min. El sobrenadante fue descartado y se resuspendió con 5 mL de 2-propanol en ultrasonido por 10 min. Este procedimiento fue repetido otras 12 veces más para garantizar la remoción de la materia orgánica. Las imágenes obtenidas fueron procesadas con el software ImageJ para determinar las formas y tamaños de las Np Ag.
Resultados y discusión
Espectros UV-Vis de soluciones blanco
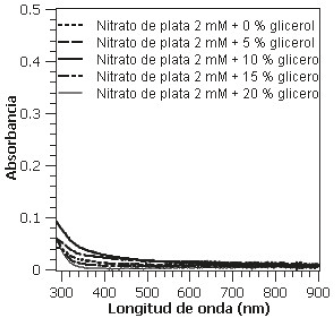
Los espectros UV-Vis obtenidos de las soluciones acuosas de nitrato de plata y diferentes concentraciones de glicerol (5%, 10%, 15% y 20%) muestran perfiles de absorción planos en la mayor parte del rango fotométrico analizado, con ligera absorción de luz a longitudes de ondas por debajo de 400 nm (Figura 1). Este comportamiento es característico de soluciones de plata no reducidas [19]. Estas soluciones fueron utilizadas como blancos en las medidas fotométricas de los subsiguientes ensayos realizados.
Efecto de las condiciones de cultivo sobre la producción de las nanopartículas de plata
En la Figura 2, se muestran los espectros de absorción UV-Vis de las soluciones de nitrato de plata y glicerol sometidas a cada uno de los tratamientos experimentales, utilizando el medio rico en metabolitos de excresión celular (sobrenadante, Figura 2A, 2B y 2C) y algunos tratamientos representativos utilizando las células de Chlorella sp. (precipitado, Figura 2D). Se observa que la mayoría de los tratamientos en los que se hizo la reducción de la plata utilizando el sobrenadante de los cultivos de Chlorella sp. cultivados a temperatura ambiente, muestran el pico de absorción característico del efecto plasmón en el rango de longitudes de onda comprendido en 400 nm y 500 nm (Figuras 2A y 2B), así como el característico cambio a un color marrón-rojizo [20,21]. En contraste, las muestras que se sometieron a reducción con el sobrenadante del cultivo obtenido en ausencia de luz y temperaturas bajas, así como en las que se usaron los precipitados, no presentan ningún pico de absorción entre 400 nm y 500 nm. Esto sugiere que los tratamientos experimentales en los que la reducción se hizo utilizando como agente reductor el sobrenadante de los cultivos de la microalga cultivada a temperatura ambiente y en condiciones de luz u oscuridad hubo formación de nanopartículas de plata, mientras que en los tratamientos en los que se usaron sobrenadantes de cultivos obtenidos a temperaturas bajas o el precipitado de cualquiera de las fermentaciones (células) no hubo reducción de este elemento.
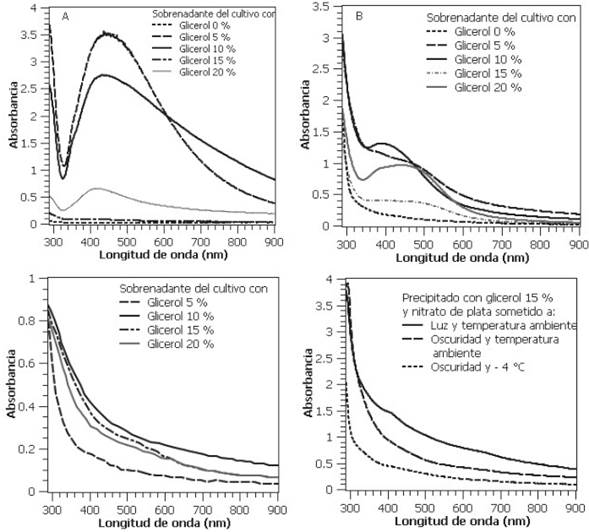
Figura 2 Espectro UV-Vis de las soluciones de nitrato de plata con diferentes concentraciones de glicerol. A) Sobrenadantes de cultivos realizados en presencia de luz a temperatura ambiente, B) Sobrenadantes de cultivos realizados en ausencia de luz a temperatura ambiente, C) Sobrenadantes de cultivos realizados en ausencia de luz a -18 °C, D) Precipitados obtenidos con cultivos de 15 % de glicerol y diferentes condiciones de cultivo.
En el caso de la reducción llevada a cabo con los sobrenadantes del cultivo realizado en presencia de luz a temperatura ambiente, se observa que la presencia de glicerol en el medio de cultivo estresa a la microalga (probablemente estrés osmótico) de tal forma que produce metabolitos de excresión que favorecen la reducción en presencia de luz, al menos hasta concentraciones de glicerol del 10%. Por encima de esta concentración de glicerol se observa una disminución de la intensidad del pico de absorción correspondiente al efecto plasmón, y por ende de la concentración de Np Ag, probablemente debido a que a altas concentraciones de glicerol, la microalga crece a menor velocidad y es probable que produzca menos metabolitos reductores [22,25]. Esta disminución de la intensidad del pico de absorción asociado al efecto plasmón a altas concentraciones indica también que el glicerol no es el agente reductor de la plata, sino los metabolitos extracelulares producidos durante el crecimiento de la microalga. Al comparar la reducción de plata con los sobrenadantes de los cultivos de microalga realizados en presencia y ausencia de luz a temperatura ambiente, se observa una menor intensidad del pico (menos del 50% en los casos en que hay evidencia de formación de Np Ag), asociado al efecto plasmón en las reducciones llevadas a cabo utilizando los sobrenadantes de los cultivos llevados a cabo en oscuridad, si se comparan con las curvas correspondientes a las mismas concentraciones de glicerol y cultivos en presencia de luz. Esto apunta a que se forman más metabolitos reductores durante el proceso de crecimiento de la microalga en condiciones mixotróficas, que en condiciones autótrofas (concentración de glicerol 0%) o heterótrofas (en ausencia de luz) [23]. Por otro lado, los resultados mostrados en la Figura 2C indican que en ausencia de crecimiento no se producen los metabolitos reductores de plata. Los resultados señalan que la presencia de glicerol durante el cultivo es determinante para la producción de metabolitos reductores y la formación de Np Ag e incluso estos metabolitos pueden producirse durante el crecimiento estrictamente heterótrofo usando como fuente de carbono glicerol. Sin embargo, el proceso de producción se ve favorecido en condiciones mixotróficas, probablamente debido a que en estas condiciones se presentan velocidades de crecimiento más elevadas.
Los resultados mostrados en las Figuras 2A y 2B sugieren que a concentraciones de 20 % de glicerol, el microorganismo también produce metabolitos extracelulares que reducen la plata produciendo nanopartículas. Sin embargo, el efecto es menos marcado que en el caso de las concentraciones de glicerol de 5% y 10%, particularmente en los ensayos con crecimiento en condiciones mixotróficas: para la concentración de 20% de glicerol, el pico del efecto plasmón superficial tiene 0,4 unidades de absorbancia en el espectro en ausencia de luz y 0,65 en presencia de luz, para una diferencia de 0,25 unidades de absorbancia, mientras que en el caso de los espectros de los sobrenadantes a concentraciones de 5% y 10% de glicerol, estas diferencias ascienden a 2,5 y 1,2 unidades de absorbancia, respecivamente. Se ha reportado que el crecimiento mixotrófico de Chlorella sp. genera mayor producción de exopolímeros que su crecimiento en condiciones heterótrofas y autótrofas [17]. Estos polímeros naturales están conformados por monómeros de azúcares, tanto reductores como no reductores [16,17]. Los azúcares se han reportado como agentes reductores de plata y producción de Np Ag [26,29], por lo cual sugerimos que son los exopolímeros producidos por la Chlorella sp. y que se encuentran en el sobrenadante, los responsables de la producción de Np Ag en las condiciones estudiadas en este trabajo. Se ha reportado el uso de sobrenadantes de cultivos de bacterias [15,30,31], hongos [32,33], y microalgas para la producción de Np Ag.
Caracterización de las nanopartículas de plata
Los ensayos que mostraron picos de mayor intensidad en el rango de longitudes de onda entre 400 nm y 500 nm, corresponden a las reducciones realizadas con los sobrenadantes de los cultivos realizados a temperatura ambiente y en presencia de luz y concentraciones iniciales de glicerol de 5% y 10%. Las nanopartículas obtenidas con estos ensayos fueron caracterizadas por microscopía electrónica de barrido, como se muestra en las Figuras 3 y 4. En el caso de las Np Ag obtenidas con el sobrenadante del cultivo a temperatura ambiente, en presencia de luz y glicerol al 5%, estas mostraron una forma predominantemente elipsoidal con dimensiones típicas de 108 nm x 156 nm y una desviación estándar de 27 nm para ambas dimensiones (Figura 3). Por otro lado, las Np Ag reducidas con el sobrenadante del cultivo llevado a cabo a temperatura ambiente, iluminación y glicerol al 10% mostraron formas elipsoidales y esféricas, con dimensiones promedio de 87 nm x 123 nm + 15 nm x 27 nm. En ambos casos, las Np Ag se encontraron agregadas sobre materia orgánica, a pesar de los extensivos lavados realizados a las muestras, posiblemente los mismos exopolímeros que ayudaron en su reducción. En un estudio similar, pero sin sobreexpresión de exopolímeros [33], por la presencia de glicerol, se obtuvieron nanopartículas de plata predominantemente esféricas y de menor tamaño, lo que sugiere que el uso de glicerol puede servir como factor de ecualización de las formas y tamaños de las nanopartículas producidas.

Figura 3 Imagen SEM de la nanopartículas de plata obtenidas con el sobrenadante del cultivo de Chlorella sp. realizado a temperatura ambiente y 5% de glicerol.
Conclusiones
Se sintetizaron exitosamente nanopartículas de plata utilizando los metabolitos excretados durante el cultivo mixotrófico de Chlorella sp. El uso de glicerol como fuente de carbono orgánico en el cultivo mixotrófico hasta concentraciones del 10% incrementa la altura del pico asociado al efecto plasmón, lo que sugiere un aumento también en la concentración de nanopartículas de plata al comparar con los resultados obtenidos con la reducción usando el sobrenadante del cultivo de Chlorella sp. obtenido bajo condiciones autótrofas. Las condiciones de cultivo que promovieron en mayor medida la producción de metabolitos reductores fueron el cultivo a temperatura ambiente y en condiciones mixotróficas con concentración inicial de glicerol de 5% y 10%. Las nanopartículas así obtenidas presentaron forma predominantemente elipsoidal con dimensiones de 108 nm x 156 nm, en el caso de las Np Ag obtenidas con el sobrenadante del cultivo a temperatura ambiente, en presencia de luz y glicerol al 5%; mientras que las Np Ag reducidas con el sobrenadante del cultivo llevado a cabo a temperatura ambiente, iluminación y glicerol al 10% mostraron dimensiones promedio de 87 nm x 123 nm.