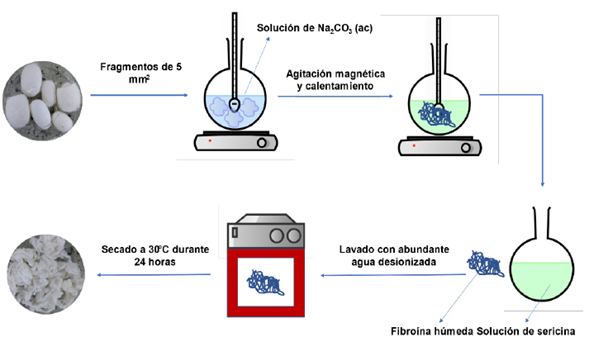
Introducción
La fibroína es una proteína secretada por varias especies de gusanos de seda de la familia Bobyx Mori para fabricar sus capullos, en este proceso, el gusano de seda produce dicha proteína desde su glándula posterior, luego, para mantener el capullo unido, el gusano de seda produce sericina desde su glándulas media y anterior [1]. En el capullo, la fibroína es el principal constituyente, y equivale a un porcentaje entre 70-80% de la masa del mismo, el resto de la masa del capullo corresponde a la sericina, la cual funciona como adhesivo en el capullo y mantiene unida toda su estructura [1,2].
La fibroína está compuesta principalmente por la secuencia de aminoácidos glicina-alanina-glicina- alanina-glicina-serina (Gly-Ala-Gly-Ala-Gly-Ser), siendo dichos aminoácidos aproximadamente el 85% del total de esta proteína [1]. Como material, la fibroína tiene diversas aplicaciones, las cuales pueden abarcar desde la industria textil [3], hasta las aplicaciones biomédicas [4-6], en las cuales se aprovechan las propiedades mecánicas y de biocompatibilidad para la construcción de plataformas de crecimiento celular [7-9], en la Ingeniería de Tejidos (IT) [10-12], como liberadores de medicamentos [13,14] y como materiales aptos para el contacto con sangre [15,16].
El proceso de extracción de fibroína, conocido como desgomado, utiliza soluciones básicas de carbonato de sodio (Na2CO3) a altas temperaturas para separar la fibroína de la sericina en los capullos, sin embargo, es común encontrar estudios en los que se reportan diversos parámetros de extracción, y variables como: el tiempo, la concentración de Na2CO3 y las temperaturas de trabajo; los cuales no están acompañados de una caracterización exacta del rendimiento del proceso de extracción [17-20]. De este modo, teniendo en cuenta que recientemente se ha encontrado que los parámetros utilizados en el proceso de extracción de la fibroína afectan las propiedades fisicoquímicas de ésta [21], resulta importante entender dicho proceso, y la combinación óptima de factores que lleve al producto que se desea, para ello, Kumar et al.[22], han estudiado mediante un diseño experimental de superficie de respuesta como optimizar todo el proceso desde la extracción hasta la solubilización de la fibroína en soluciones iónicas de bromuro de litio (LiBr), sin embargo, en algunas aplicaciones, solubilizar la fibroína no será siempre de interés, aquellos estudios que se enfocan en el proceso de extracción, se concentran en las consecuencias de este sobre la sericina y su degradación a altas temperaturas [23], por lo tanto, considerando que existen aplicaciones en las que se utiliza la fibroína en forma de seda para la fabricación de dispositivos como conductos vasculares [3,16], o en forma de solución para la fabricación de películas en usos biomédicos [24,25], optimizar el proceso de extracción dependerá de la aplicación final que se le quiera dar a esta proteína, por tal motivo, si se desea utilizar la fibroína en forma de solución, algunas aplicaciones no se limitarán por el estado de la fibroína luego del proceso de extracción, ya que esta proteína puede ser aprovechada a través de sus grupos amino terminales con el fin de inmovilizar sobre ésta algunas sustancias bioactivas como: ácido fólico para fabricar nanopartículas, trasportadores de medicamentos [26,27], o heparina en la fabricación de dispositivos para contacto con la sangre [28]. El propósito del presente estudio fue investigar como: la temperatura, la relación Na CO /Capullos y el tiempo de extracción afectan el rendimiento del proceso de extracción de fibroína del capullo de gusano de seda Bombyx Mori, para ello, se cuantificó la cantidad de fibroína extraída del capullo a diferentes condiciones y se escogió la combinación de factores que arrojó el mayor rendimiento para caracterizarlas por medio de Análisis Termo Gravimétrico y espectroscopía de Infrarrojo por Transformada de Fourier con el fin de determinar la temperatura de degradación y la estructura predominante del producto resultante a estas condiciones, con esto, el material obtenido servirá como base para la formulación de materiales en aplicaciones biomédicas que requieran de la inmovilización de moléculas bioactivas sobre la estructura de esta proteína [28,29].
Materiales y métodos
Extracción de fibroína
Para el proceso de extracción de fibroína desde los capullos del gusano de seda, se adquirieron capullos en la Corporación para el Desarrollo la Sericultura del Cauca (CORSEDA), y con ellos, se realizó la extracción de fibroína según el esquema mostrado en la Figura 1. Para lo cual, los capullos del gusano fueron cortados en fragmentos de aproximadamente 5 mm2, y tratados con una solución 0,01M de carbonato de sodio (Na2CO3, Carlo Erba, Anhidro), con el fin de que se mantuviera la relación Na2CO3/Capullos (g:g) entre 0,2 y 0,4, y la temperatura de extracción entre 60 y 80 ºC, este proceso se realizó en lapsos de tiempo entre 3 y 6 horas, una vez terminado, la fibroína fue removida de la solución resultante de sericina, lavada con abundante agua destilada y puesta a secar en estufa a 30 ºC durante 24 horas, finalmente se pesó la masa de fibroína obtenida y se reportó como porcentaje en masa respecto a la masa inicial del capullo.
Diseño experimental
El estudio del proceso de extracción consistió en el diseño 23 con 2 puntos centrales mostrado en la Tabla 1, con el cual se buscó estudiar la curvatura sobre la variable de respuesta entre los puntos extremos de cada uno de los factores del diseño. Todos los cálculos estadísticos y el esquema del diseño experimental fueron realizados en el software Statgraphics Centurion 17 ?. Cada combinación de factores y niveles fue realizada 3 veces, como resultado completo tuvo un total de 30 corridos, finalmente, el diseño experimental fue aleatorizado para evitar sesgo estadístico [30]. La significancia de los factores fue estudiada mediante análisis de varianza (ANOVA), de este modo, los parámetros con un valor p menor a 0,05 tuvieron significancia estadística con un 95% de confianza [31].
Análisis estructural por Espectroscopia Infrarroja con Transformada de Fourier (FTIR)
El análisis estructural, presencia de grupos funcionales y configuración de la fibroína extraída se realizó mediante espectroscopia infrarroja utilizando un equipo SHIMATZU IR-TRACER 100, para este propósito, se barrió́ el rango espectral entre 4000 cm-1 y 400 cm-1 durante 24 ciclos.
Resultados y discusión
Análisis estadístico
Los resultados obtenidos en este diseño experimental no se ajustan a una distribución normal, lo que impide realizar algunos análisis estadísticos que requieren dicha condición, por lo tanto, para realizar de forma correcta los análisis posteriores, los datos del porcentaje de fibroína extraída de los capullos del gusano de seda fueron transformados a una distribución normal [30], verificados por la prueba de Kolmogorov- Smirnov (p = 0,15811), de este modo, los valores correspondientes al porcentaje de fibroína extraída y su transformación se encuentran en las 2 últimas columnas de la Tabla 2.
Tabla 2 Porcentaje de fibroína extraída según el diseño experimental y datos transformados
| Temperatura (°C) | Na2CO3 /capullo (g/g) | Temperatura (°C) | Na2CO3 /capullo (g/g) | Temperatura (°C) |
|---|---|---|---|---|
| 60 | 0,2 | 3 | 35,233 ± 6,571 | 2,074 ± 0,831 |
| 60 | 0,2 | 6 | 72,286 ± 3,732 | 27,344 ± 6,238 |
| 60 | 0,4 | 3 | 31,479 ± 8,222 | 1,717 ± 0,708 |
| 60 | 0,4 | 6 | 75,540 ± 5,568 | 33,670 ± 10,944 |
| 80 | 0,2 | 3 | 73,796 ± 0,791 | 29,682 ± 1,422 |
| 80 | 0,2 | 6 | 73,852 ± 3,671 | 30,068 ± 6,631 |
| 80 | 0,4 | 3 | 72,990 ± 0,376 | 28,251 ± 0,650 |
| 80 | 0,4 | 6 | 73,668 ± 4,511 | 29,887 ± 8,084 |
| 70 | 0,3 | 4,5 | 74,320 ± 2,382 | 30,818 ± 4,539 |
La separación, y posterior extracción de fibroína trabajada en este diseño experimental, aprovecha la composición de las proteínas que forman el capullo del gusano de seda (fibroína y sericina). La sericina, debido a su composición de amino ácidos altamente polares (serina, treonina, ácido aspártico, asparagina, ácido glutámico y glutamina) [32], es una proteína que permite su disolución en medios acuosos a temperaturas moderadamente altas. Por otra parte, la fibroína está compuesta principalmente por glicina y alanina [33], los cuales son aminoácidos poco polares, lo que hace a esta fibra altamente hidrofóbica, y por lo tanto, fácilmente separable de la sericina una vez esta última haya sido separada del capullo a través de su disolución en soluciones calientes de Na2CO3. De acuerdo con los resultados del análisis de varianza mostrado en la Tabla 3, los factores que tienen significancia estadística sobre la variable de respuesta en los rangos trabajados a lo largo del diseño experimental son la temperatura (p = 0,0112), el tiempo de extracción (p = 0,009) y la interacción entre estos dos factores (p = 0,0103), por lo tanto, solo estos influyen en el porcentaje de fibroína extraída del capullo, particularmente, el efecto de estos factores de observa en el gráfico de contorno mostrado en la Figura 2, donde se representa el modelo ajustado a los resultados experimentales de porcentaje de fibroína extraída contra el tiempo de extracción y la temperatura, según dicho modelo, se pueden obtener porcentajes de extracción de fibroína superiores a un 70% independiente de la relación Na2CO3/Capullos que se trabaje, siempre y cuando, los valores de temperatura y tiempo de extracción seleccionados se encuentren en la zona blanca mostrada en la Figura 2, estos resultados muestran ser óptimos en términos de la eficiencia de la extracción teniendo en cuenta que el capullo de gusano de seda tiene aproximadamente un 75% en masa de fibroína como se ha reportado previamente por Khan et al.[1], además de esto, el modelo ajustado predice valores similares a los reportado por Kumar et al.[34], quienes encontraron rendimientos similares a temperaturas superiores a los 70 °C, sin embargo, en su estudio, los autores no hacen estudio alguno de los tiempos de extracción, por lo que el presente estudio complementa estos resultados.
Tabla 3 Análisis de varianza para los valores normalizados del porcentaje de proteína extraída del capullo.
| Variable | Suma de Cuadrados | Df | Estadístico F | P |
|---|---|---|---|---|
| A: Temperatura | 704,442 | 1 | 88,1 | 0,0112 |
| B: Na2CO3/Capullos | 4,74566 | 1 | 0,59 | 0,5216 |
| C: Tiempo | 877,518 | 1 | 109,74 | 0,009 |
| AB | 14,3634 | 1 | 1,8 | 0,3121 |
| AC | 761,775 | 1 | 95,27 | 0,0103 |
| BC | 15,7291 | 1 | 1,97 | 0,2958 |
| Prueba: Falta de ajuste | 375,336 | 10 | 4,69 | 0,1883 |
| Error | 15,9921 | 2 | ||
| Total | 2923,25 | 19 | ||
| R2= 86,6132% | ||||
| R2 ajustado= 78,8043% |
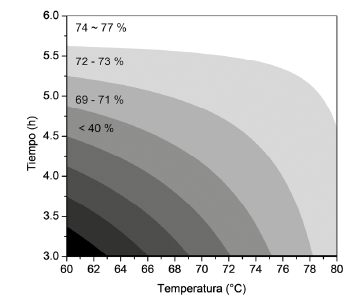
Figura 2 Contorno del efecto de la temperatura y el tiempo de extracción sobre el porcentaje de fibroína extraída a un valor constante de relación Na2CO3/capullos = 0,4.
Finalmente, de acuerdo con el modelo ajustado, los valores óptimos en los que se podrán obtener los máximos rendimientos de extracción se muestran en la Tabla 4, dicho resultado se verificó realizando una nueva extracción bajo estas condiciones, obteniéndose un porcentaje de fibroína extraída de 74,76 ± 4,16%, estos resultados concuerdan con los reportados en la literatura, donde se documenta que el capullo de gusano de seda tiene aproximadamente 75% de masa de fibroína [1], por lo tanto, se puede concluir que el proceso de optimización del proceso de extracción fue exitoso.
Espectroscopía Infrarroja por Transformada de Fourier
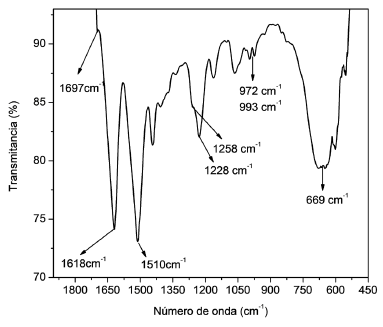
En la Figura 3 se presenta el espectro IR de una muestra fibroína extraída a 60 °C durante 6 horas, dicho espectro fue analizado en el rango de 1800 cm-1 hasta 500 cm-1 debido a que en esta región se puede observar la presencia de las cuatro bandas principales que identifican la configuración estructural de esta cadena proteica [35].
Basado en los resultados del espectro, la estructura molecular de la fibroína extraída corresponde mayoritariamente a la configuración de láminas-β, lo cual se puede evidenciar por la presencia de las bandas presentes en 1697 cm-1, 1618 cm-1, 1510 cm-1 y 1228 cm-1, las cuales pertenecen a las amidas I, II y III de su cadena proteica [38], y que son la clave para identificar la configuración de láminas-β que da a la fibroína su resistencia mecánica.
De estas bandas, las dos primeras corresponden a los balanceos en fase y desfase de las amidas de la configuración de láminas-β, y las dos siguientes corresponden al estiramiento C-C de los residuos de tirosina de la cadena molecular, además de esto, se observan un conjunto de bandas presentes en 1228 cm-1, 1258 cm-1, 972 cm-1 y 993 cm-1, las cuales corresponden a la presencia tanto de la configuración de láminas-β como de láminas-α, finalmente, la banda presente en 669 cm-1, corresponde a la torsión del grupo OCN que se da en la configuración conocida como random coil, la cual se presenta de forma natural en la fibroína hilada y puede ser transformada a configuración de láminas-β con tratamientos químicos o físicos según sea la necesidad de la aplicación [19].
Análisis termogravimétrico
La Figura 4 muestra el termograma de la fibroína extraída a 60 °C durante 6 horas, en ésta, se pueden apreciar tres regiones de interés en las que se observan pérdidas de masa a medida que la temperatura del sistema aumenta.
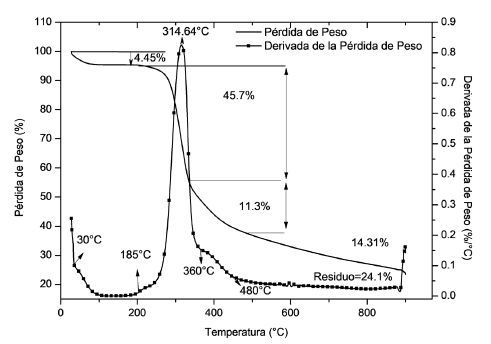
Figura 4 Termograma para la muestra de fibroína extraída: (-) Pérdida de peso (%), (-▪-) Derivada de la pérdida de peso (%/°C).
La primera región corresponde al rango de temperatura entre 30 y 185 °C, en el cual se pierde el 4,45% del peso de la muestra, y que se explica debido a la evaporación de agua que queda en la muestra debido a la humedad del ambiente. Las regiones dos y tres corresponden a los rangos de temperatura que van desde 200 hasta 360 °C y desde 360 hasta 480 °C respectivamente.
A diferencia de la primera, la región dos se caracteriza por un cambio abrupto de peso, el cual encuentra su punto de inflexión a 314,64 °C, en esta etapa, la cadena proteica de la fibroína comienza a romperse para formar los aminoácidos que componen su estructura principal [39], posterior a esto, dichos aminoácidos comienzan a descomponerse en la tercera etapa de degradación, dejando un residuo de aproximadamente 24,1% después de 500 °C como se ha encontrado en estudios previos [39].
Conclusiones
El proceso de obtención de fibroína a partir del capullo de gusano de seda Bombyx Mori, se realizó de forma exitosa siguiendo un diseño experimental 23 con dos puntos centrales en cual se estudiaron como factores del proceso de extracción las variables: temperatura, relación Na2CO3/Capullos y tiempo de extracción en los niveles mostrados en la Tabla 1. De acuerdo con los resultados estadísticos, los únicos factores que afectan el rendimiento de la extracción de fibroína en los niveles trabajados son la temperatura (p = 0,0112), el tiempo de extracción (p = 0,009) y la interacción entre estos dos factores (p = 0,0103), razón por la cual, cualquier valor para la relación Na2CO3/Capullos podrá ser trabajado sin alterar el rendimiento de la extracción.
El análisis por espectroscopía IR muestra que el extracto de fibroína posee mayoritariamente configuración de láminas-β, sin embargo, parte de dicha proteína se encuentra en una configuración de Random coil y láminas-α, estos resultados, junto con los resultados mostrados en el análisis termogravimétrico pueden ser usados como base para otros estudios en los que se requiera inmovilizar moléculas bioactivas sobre la estructura de la fibroína para funcionalizarla, ya que el éxito de dichas reacciones se suele confirmar comparando estas caracterizaciones con las de los compuestos funcionalizados.
Los resultados mostrados en el presente estudio prueban que el proceso de extracción de fibroína a partir del capullo de gusano de seda se puede optimizar a través de un diseño experimental factorial con puntos centrales, lo que ahorraría el número de corridos experimentales comparado con un diseño de superficie de respuesta y por lo tanto permitiría la optimización de los recursos disponibles para posteriores trabajos.