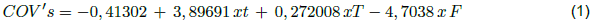Introducción
La calidad sensorial del cacao y sus productos derivados depende de factores genéticos, agroclimáticos y de las condiciones de las etapas del manejo poscosecha (fermentación, secado y tostado) que se emplean para la transformación de los granos frescos en los diferentes productos como cacao en grano seco, tostado o licor [1]. El licor de cacao es uno de los principales productos comerciales del cacao y consiste en granos de cacao fermentados, secos, tostados y molidos cuyo aroma es el resultado perceptible de una cadena larga de transformaciones físicas, químicas y bioquímicas que la almendra de cacao experimenta gracias a factores como la variedad, composición del suelo, clima, altura de cultivo y modo de recolección del fruto, además de condiciones como el tiempo de fermentación, las temperaturas de secado y tueste, todas estas condiciones son determinantes en el desarrollo de la composición química volátil, específicamente contribuyen a la formación de compuestos orgánicos volátiles (COV´s), los cuales generan el aroma característico del cacao [2].
La genética y los factores agroclimáticos influyen en el aroma de manera determinante, de acuerdo a la variedad, tipo o a la región donde sea cultivado el cacao se han identificado diferentes características organolépticas, ya que estos aspectos definen los precursores químicos del aroma [3]. Una etapa determinante en el desarrollo de la fracción volátil durante la poscosecha es la fermentación. En este proceso, gracias a la actividad de las levaduras, se producen COV´s importantes como alcoholes, ésteres y ácidos carboxílicos, siendo el más importante el ácido acético, ya que además de aportar al aroma contribuye a que ocurran muchas reacciones químicas que generan otros COV´s importantes como los ésteres [4]. En la etapa de secado, prosigue el desarrollo de la fracción volátil, además de ácidos y alcoholes, también se evidencia la presencia de ésteres, aldehídos, cetonas, hidrocarburos, pirazinas y furanos; finalmente, siguen en menor cantidad pirroles, terpenos, fenoles y oxazoles, algunos de los compuestos más representativos que se forman en esta etapa son el 2-metilbutanoato de etilo, 2-metilpropanoato de etilo, 2-feniletanol y 2-heptanol, los cuales producen notas aromáticas frutales, florales y cítricas [5]. Por otra parte, en la etapa de tueste el cacao termina de adoptar las propiedades organolépticas más importantes, es aquí donde compuestos orgánicos volátiles como pirazinas específicas que generan notas aromáticas a chocolate, tostado, nuez y madera, se incorporan a las diferentes familias orgánicas que determinan el aroma final. Compuestos de gran importancia en esta etapa son la tetrametilpirazina, trimetilpirazina, benzaldehído, 2-fenilacetaldehído y el linalool [6].
Debido a la importancia que tiene el conocimiento de la composición de los compuestos volátiles en el licor de cacao como indicadores de calidad y su generación o estabilidad durante los procesos de fermentación, secado y tostado de las semillas de cacao, se han adelantado diferentes investigaciones acerca del desarrollo o implementación de métodos analíticos para la extracción y análisis de los COV´s. Entre algunos métodos desarrollados para la extracción se encuentra la destilación-extracción simultánea, la extracción con solventes, la destilación al vacío y la extracción con fluidos supercríticos [7,8], los cuales han sido ampliamente utilizados en diferentes tipos de muestras de cacao, por ejemplo, cacao fresco, seco, tostado y licor de cacao [9,10]. Sin embargo, algunos de estos métodos demandan prolongados tiempos de extracción, calentamiento a elevadas temperaturas y varios pasos previos en la preparación de las muestras, lo cual puede provocar pérdida, degradación o reacciones de analitos con otros componentes de la matriz como lípidos, ácidos grasos o polifenoles, que además pueden convertir a los extractos en incompatibles con técnicas como la cromatografía de gases (CG) o la cromatografía líquida (LC). De igual manera, el calentamiento intensivo de las muestras, puede generar cantidades adicionales de alquipirazinas por interacción entre los sustratos de la reacción de Maillard presentes en la matriz, llevando a falsos positivos y errores en la identificación y cuantificación de los COV´s [8].
Como una solución a lo descrito anteriormente, la microextracción en fase sólida con espacio de cabeza (HS-SPME), la cual utiliza una fibra de sílice fundida recubierta de un material sorbente, adsorbe los COV´s en determinadas condiciones para luego ser desorbidos en el puerto de inyección de un equipo de cromatografía, se ha convertido en una técnica de gran uso por su versatilidad, reproducibilidad y su característica de ser una técnica verde de extracción que no requiere usar solventes orgánicos nocivos para la salud o el medio ambiente [11]. Con esta técnica se eliminan interferencias en el análisis, asociadas a la estabilidad química, térmica y la generación de artefactos indeseables en el análisis de chocolate y cacao [7]. Sin embargo, debido a que se trata de un método indirecto se deben establecer las condiciones óptimas de extracción, principalmente de factores como la temperatura de extracción, el tiempo de extracción y el tipo de fibra a utilizar [9,12]. Respecto a las condiciones de extracción, existen varias investigaciones que emplean diferentes tipos de fibra, tiempos y temperaturas para la extracción de los COV, los cuales son identificados por técnicas cromatográficas, por ejemplo, cromatografía de gases acoplada a espectrometría de masas (GC-MS). Estudios realizados por Millares-García [11] determinaron el uso de una fibra PDMS/DVB/CAR, 15 min de extracción y 60 °C como valores óptimos para identificar una mayor cantidad de COV´s por GC-MS, identificando pirazinas, aldehídos, ésteres y ácido acético como principales compuestos de influencia en el aroma característico del cacao. Ducki et al.[7], evaluaron los efectos de tiempo y temperatura de extracción de muestras de cacao del oeste del África, en esta investigación, determinaron tiempos de extracción de 15 min a 60 °C de calentamiento de muestra y el uso de una fibra PDMS/DVB/CAR, identificando un total de 42 compuestos. Van Durme et al.[13] determinaron la composición volátil de semillas de cacao mediante HS-SPME usando una fibra PDMS/DVB/CAR, con un tiempo de extracción de 25 min a 60 °C, el análisis de COV´s se realizó por GC-MS identificando 30 compuestos entre alcoholes, ésteres, pirazinas y ácidos orgánicos. Rodríguez et al.[14] investigaron la composición de COV´s en semillas de cacao de variedad forastero, de la provincia de Tabasco-México, usando una fibra DVB/CAR/PDMS, 30 min de extracción a 60 °C para identificar un total de 58 compuestos por GC-MS. En semillas de cacao trinitario, criollo y forastero, fueron identificados 53 compuestos en el trabajo realizado por Qin et al.[15], determinando principalmente alcohol furfurílico, 3-careno, 2-pentanol, 1-pentanol, 2,3-butanediol, 2-heptanol y bencill acetato en variedad trinitario; α-limoneno, β-cariofileno, β-mirceno, β-linalool y ácido acético en la variedad criollo, finalmente ácido 3-metilbutanoico, 2-(2-butoxietoxi) etanol, anetol y 2,4-pentanedio, la extracción se realizó por HS-SPME con una fibra de DVB-CAR-PDMS, con un tiempo de exposición de la fibra de 30 min a 60 °C. En el trabajo realizado por Tan et al.[16] determinaron por HS-SPME y con el uso de nariz electrónica, 23 COV´s, las condiciones utilizadas ueron: fibra PDMS-DVB, 30 min de adsorción a 60 °C. Las condiciones de extracción influyen en la composición y cantidad de COV´s extraídos, reportando en las investigaciones temperaturas entre los 24 a 60 °C, rango en el cual es posible evitar pérdidas o degradación de los compuestos más volátiles o termolábiles. Respecto al tiempo de extracción, estos están entre los 15 a 60 min para la extracción de COV´s, y hasta 75 min para la extracción de compuestos menos volátiles como pirazinas. Los tiempos de extracción son mucho menores a los de otras técnicas, más aún si se tiene en cuenta que una vez se haya pasado este tiempo, la fibra pasa directamente al equipo cromatográfico sin pasos intermedios de concentración o extracción líquido-líquido. Para el caso de los COV´s, el tiempo de equilibrio es muy importante, debido a que un tiempo corto no será suficiente para extraer los compuestos, y si el tiempo es demasiado largo, los analitos más volátiles se pueden degradar. En relación a las fibras, se puede inferir que recubrimientos que mezclen el PDMS, el carboxen y el DVB serían los más adecuados, ya que permiten extraer compuestos de carácter apolar como polares [5,6,12,17,18].
Teniendo en cuenta la diferencia en las condiciones de extracción reportadas y la importancia de determinar las mismas para identificar los COV´s en licor de cacao del Departamento de Nariño, como parte del estudio para el mejoramiento de la productividad y calidad sensorial de este importante producto, se desarrolló el presente trabajo, cuyo objetivo fue la optimización de las condiciones de extracción HS-SPME de los COV´s para su identificación por GC-MS, en licor de cacao regional de una asociación productora del municipio de Tumaco del Departamento de Nariño-Colombia. El material utilizado de cacao correspondió al clon CCN51, originario del Ecuador, el cual se caracteriza por ser un cultivo precoz, pues inicia su producción a los 24 meses de edad, no necesita de polinización cruzada para su adecuada fructificación tal como la mayoría de los clones y es tolerante a la “Escoba de Bruja”, enfermedad que ataca a la mayoría de variedades de cacao destruyendo su producción. Entre las principales características de este clon se encuentran: excelente índice de mazorca (8 mazorcas/libra de cacao seco); excelente índice de semillas (1,45 g/semilla seca y fermentada). Además, es reconocido por su adaptabilidad a casi todas las zonas tropicales y por tener un alto porcentaje de manteca (54 %), lo que lo hace cotizado por las industrias. Sus mazorcas son de color rojo-anaranjado en estado de madurez. Respecto a las notas del catador se ha establecido que este cacao presenta alta acidez y amargor y bajo sabor a chocolate [19,20].
En esta investigación, se utilizó un diseño experimental tipo factorial, usando la metodología de superficie de respuesta para identificar el tipo de fibra, la temperatura y el tiempo de extracción óptimos como factores influyentes en el análisis de los COV´s responsables del aroma [7,11,12,14,17], las cuales se utilizarán para estudiar posteriormente los efectos del manejo poscosecha en la calidad del cacao producido en el Departamento de Nariño-Colombia.
Metodología Materiales y equipos
Las muestras de licor de cacao fueron proporcionadas por la Asociación Cortepaz con sede en la vereda San Luis Robles en el Municipio de Tumaco, Departamento de Nariño del Suroccidente de Colombia. El licor de cacao se preparó a partir de semillas de cacao fermentadas, secas, tostadas y molidas del clon CCN51 según las técnicas y condiciones culturales definidas por la asociación. La muestra se consideró como material de referencia debido a que se preparó con un solo tipo de material (CCN51) en las condiciones con las que se ha obtenido licor a partir de clones regionales y que ha sido premiado en eventos internacionales.
Se evaluaron tres tipos de recubrimientos de las fibras SPME: DVB/CAR-PDMS, CAR/PDMS y DVB/PDMS (Supelco, Bellefonte-USA) instaladas en un Holder manual (Supelco, Bellefonte USA). En relación a la composición de las fases estacionarias de las fibras, estas se catalogan de acuerdo a la polaridad como bipolares y fueron seleccionadas por ser las más empleadas según la revisión bibliográfica [5,7,11,17,18].
Optimización de las condiciones de extracción por HS-SPME
Las condiciones de extracción de las muestras de cacao regional se determinaron mediante la aplicación de un diseño experimental tipo factorial 33, usando la metodología de superficie de respuesta para determinar los factores que maximizan la variable de respuesta, la cual se expresó como número de COV´s extraídos. Se consideraron los factores de: tipo de fibra SPME, temperatura y tiempo de extracción, evaluados en tres niveles según las consultadas en publicaciones de varios autores [11,12,14,17,18,21]. Para la extracción se tomaron 5,0 g de la muestra de licor de cacao CCN51 en un vial ámbar con septa PFTE de 40 mL (Restek, Bellefonte-USA) bajo agitación, usando una barra de agitación cubierta de teflón y una plancha de agitación Heildoph con control de temperatura y agitación [14]. Las muestras se sometieron a las condiciones de extracción acordes al diseño experimental descritas en la Tabla 1. El análisis estadístico se ejecutó con el paquete estadístico STATGRAPHIC Centurion XVI.
Tabla 1 Factores y niveles del diseño experimental.
| Niveles | Descripción | |||
|---|---|---|---|---|
| Factores | Bajo | Medio | Alto | |
| Tipo de fibraa | -1 | 0 | 1 | DVB/CAR-PDMS (1), CAR/PDMS (0) y DVB/PDMS (-1). |
| Temperatura °C | 25 | 40 | 60 | Temperatura del sistema de extracción. |
| Tiempo (min) | 15 | 30 | 60 | Tiempo de extracción necesario para alcanzar en mayor número de COV´s. |
aLos niveles en el tipo de fibra hacen referencia a las características del recubrimiento de las fibras. La codificación del nivel se realizó aleatoriamente.
En todas las combinaciones del diseño experimental se consideraron 15 min de pre-acondicionamiento de acuerdo a lo recomendado por Rodríguez et al.[14]. Los compuestos extraídos en las fibras para cada muestra del diseño se analizaron por GC y se confirmó la identidad por GC-MS con las condiciones descritas a continuación.
Cromatografía de gases (GC)
El análisis de los compuestos volátiles extraídos por HS-SPME para la optimización del método se realizó por GC-FID de acuerdo a lo reportado por Millares-García [11] con algunas modificaciones, usando una columna Zebron ZB-5 (30 m x 0,25 mm y tamaño de película de 0,25 µm, Phenomenex, USA). La desorción se realizó en el puerto de inyección a 250 °C durante 2 min en modo splitless. El flujo de gas carrier Helio UAP (Linde-Colombia) fue de 1,0 ml.min-1. Las temperaturas de puerto de inyección y detector fueron 250 y 280 °C respectivamente. La programación de temperatura fue de 40 °C durante 2 min, luego se incrementó a razón de 10 °C.min-1 hasta 280 °C y se mantuvo a esta última durante 5 min hasta terminar la separación [7,11,14,18,19]. El cálculo de índices de retención lineal (IRL) se realizó mediante la inyección de una serie homóloga de n-alcanos (Restek, Bellefonte-USA) analizados bajo las mismas condiciones operacionales. Los análisis se realizaron en el Laboratorio de Cromatografía de la Universidad de Nariño.
Cromatografía de gases/espectrometría de ma- sas (GC-MS)
La identificación de los COV´s extraídos en las condiciones óptimas se realizó por GC-MS. Las condiciones instrumentales fueron similares a las usadas en GC-FID (columna, rampa de calentamiento, temperatura y tiempo de inyección, flujo de helio). Los espectros de masas se obtuvieron en el modo full scan, la energía de ionización empleada fue de 70 eV (EI) con un barrido de 1.8 scans/s y con un rango de m/z 35- 400 umas. La línea de transferencia se mantuvo a 280 °C, fuente de iones a 230 °C [11,17,18, 21,22]. Los criterios de identificación de los compuestos se establecieron por comparación de los índices de retención lineal (IRLs) y espectros de masa de cada compuesto en las muestras usando como referencia las bases de datos Wiley 275 L y NIST.
Precisión del método de extracción HS-SPME
Determinados los valores óptimos para la extracción por HS-SPME, se estimó como figura de mérito analítico la precisión del método de extracción, para este fin se determinó la repetibilidad del método analítico en las condiciones óptimas de extracción establecidas, extrayendo y analizando una muestra de licor de cacao CCN51 triplicado. Además, se calculó la reproducibilidad intermedia del método utilizando los resultados cromatográficos de una muestra de licor de cacao CCN51 extraída y analizada tres días diferentes por el mismo analista [5,6,12,23,24].
Resultados y discusión Optimización del método
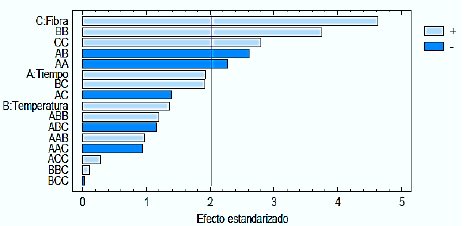
Para la optimización, la metodología de superficie de respuesta (MSR) que se utilizó para optimizar el método permitió el modelado y el análisis de los datos, en los que la extracción de COV´s se ve influenciada por los factores experimentales analizados (fibra/tiempo/temperatura), los cuales pueden incrementar o disminuir la cantidad y concentración de compuestos orgánicos volátiles (COV´s) adsorbidos en la fibra. La variable de respuesta se estableció de acuerdo al número de COV´s total extraídos, cuyas áreas cromatográficas sean mayores a 100 cuentas (µV*seg). Como se puede apreciar en el diagrama de Pareto (Figura 1), el tipo de fibra empleada fue el factor más determinante en la extracción de los COV´s. Estadísticamente, tiene una influencia significativa y positiva en relación a la variable de respuesta estudiada, esto se debe principalmente a que el tipo de absorbente del que está recubierta la fibra es determinante para extraer una mayor cantidad de compuestos de acuerdo a su polaridad [11,12,25]. De la misma manera, se observó que las interacciones cuadráticas tipo de fibra, temperatura y tiempo, junto con la interacción tiempo-temperatura (BB, CC, AA, y AB) presentan un efecto estadísticamente significativo en la extracción de COV´s, expresados en número de COV´s extraídos.
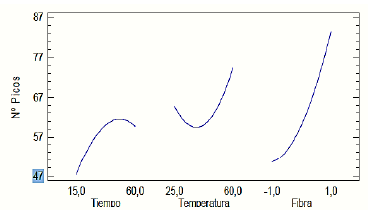
Con respecto al factor tipo de fibra, la DVB/CAR- PDMS mostró ser la más adecuada para extraer un mayor número de COV´s, gracias a que tiene mayor afinidad a compuestos de polaridad relativamente baja, volátiles y semivolátiles (Figura 2), la combinación de las fases estacionarias de esta fibra, juega un rol importante para una mayor eficiencia en la extracción, con una mayor resolución de los cromatogramas en comparación con las fases estacionarias de las otras fibras [5], ya que el licor de cacao se puede considerar como una matriz compleja que tiende a tener diferentes tipos de compuestos [6,11,12,25]. En la Figura 2 se puede apreciar que respecto al factor temperatura un nivel alto (60 °C) favorece la extracción de COV´s, lo cual concuerda con algunas investigaciones previas, sin embargo, se debe tener en cuenta que temperaturas superiores pueden causar degradación de los analitos más termolábiles [5,7,11,26,27]. En cuanto al tiempo, se observa que la extracción se favorece a 50 min y no al tiempo máximo de 60 min, esto se debe a que la fibra a tiempos superiores a 50 min en las condiciones estudiadas, alcanza estados de saturación, por lo que a tiempos mayores ocurre un proceso de desorción de los COV´s. Además, el tiempo afecta la transferencia de masa de los analitos en la fibra, requiriendo un tiempo óptimo de 50 min para que la fibra pueda alcanzar su equilibrio. Por su parte, la temperatura afecta directamente la rapidez con que se alcanza el equilibrio, favoreciendo la difusión de los compuestos y ejerce una influencia en la composición de la fase volátil, aumentando la relación de compuestos con baja presión de vapor (semivolátiles) [28].
Mediante la optimización del diseño experimental (análisis multivariable) se estableció los valores óptimos, que presentan la mayor deseabilidad en la extracción de un mayor número de COV´s en las muestras de licor de cacao. El proceso de determinación de la máxima deseabilidad, permitió establecer parámetros teóricos óptimos para el proceso de extracción de COV´s, basados en la determinación de la deseabilidad global óptima. Los valores determinados para la extracción fueron: tipo de fibra DVB/CAR-PDMS, temperatura de extracción 60 °C y tiempo de 50 min.
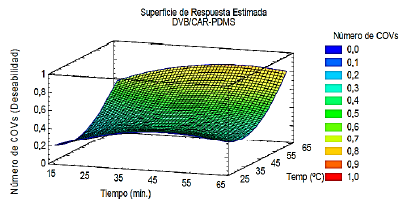
En la Figura 3 se puede apreciar el comportamiento estimado en la combinación de dos factores (tiempo y temperatura) manteniendo constante el tipo de fibra DVB/CAR-PDMS, lo que permitió establecer los niveles óptimos de extracción de COV´s, mediante la interacción de los tres factores experimentales principales [18], este resultado indica que un aumento de temperatura favorece el alcance de equilibrio entre los tres factores presentes en la extracción de COV´s por la técnica de HS-SPME [5,17,18]. La ecuación 1 representa la relación entre el número de compuestos extraídos y las condiciones de extracción.
Donde t= tiempo; T = temperatura y F= tipo de fibra.
Precisión del método HS-SPME
Para estimar la precisión del método de extracción optimizados, se determinaron parámetros estadísticos de desviación estándar (s) y coeficiente de variación (CV %) a los resultados de las áreas cromatográficas de cada compuesto en los experimentos de repetibilidad y reproducibilidad de la extracción HS-SPME (Tabla 2). Para el caso de la repetibilidad de las áreas de 39 compuestos mayoritarios identificados se encontraron valores entre 0,59 y 11,39 de CV %, mientras que para la reproducibilidad entre 4,29 y 12,93 de CV %. El coeficiente de variación para extracciones HS- SPME permite valores hasta del 12 % [14], por lo tanto, se puede afirmar que el método optimizado es preciso para el análisis de COV´s presentes en licor de cacao.
Tabla 2 Precisión de la extracción HS-SPME COV´s en licor de cacao.
| No de Compuestos Identificados | Parámetro Precisión | |
|---|---|---|
| Repetibilidad (n=3)a Rango de CV % | Reproducibilidad b (n=3) Rango de CV % | |
| 39 | 0,59 - 11,39 | 4,29 -12,93 |
a: tres análisis en un día. b: tres análisis en tres días diferentes.
Identificación por GC-MS de COV´s encontrados en licor de cacao CCN51
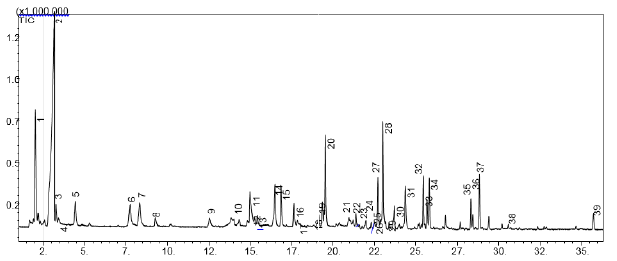
Se identificaron un total de 39 COV´s mayoritarios en el licor de cacao CCN51 (Figura 4) al utilizar las condiciones óptimas de extracción (fibra: DVB/ CAR-PDMS, temperatura: 60 °C, tiempo: 50 min). Los 39 compuestos se pueden clasificar en 8 grupos o tipos de compuestos según su grupo funcional de la siguiente manera: 8 aldehídos, 5 cetonas, 6 alcoholes, 10 pirazinas, 7 éteres, un terpeno, un ácido y una lactona. En la Tabla 3 se presentan los resultados de la identificación de cada compuesto, así como su área cromatográfica, tiempos de retención, índices de retención y la nota aromática que producen según los reportes de las investigaciones realizadas en el tema.
Tabla 3 Identificación COV´s cacao CCN51 HS-SPME
| tRa | Área | |||||||
|---|---|---|---|---|---|---|---|---|
| Tipo | N° | min | (µV*seg) | % Relativo | Compuesto | Nota producida [1,29\ | IR Eb | IR Tc |
| Aldehídos | 3 | 3,274 | 481238 | 1,62 | 3- metil butanal | caramelo-chocolate | NC | 655 |
| 4 | 3,418 | 64410 | 0,22 | 2-metil butanal | rancio-chocolate-malta fermentada | NC | 641 | |
| 16 | 17,632 | 366276 | 1,23 | Benzaldehído | dulce-cereza-almendra amarga | 976 | 960 | |
| 17 | 17,846 | 338851 | 1,14 | 5-metil-furfural | picante- caramelo- arce | 981 | 964 | |
| 22 | 21,384 | 128713 | 0,43 | Bencen acetaldehído | dulce-floral-clavo-miel- cacao-jacinto | 1064 | 1042 | |
| 30 | 23,695 | 600442 | 2,02 | 2-isopropil-5- metil-2-hexenal | uva | 1125 | 1097 | |
| 37 | 28,847 | 925022 | 3,11 | 2-fenil-2-butenal | chocolate tostado | 1302 | 1279 | |
| 39 | 35,735 | 274835 | 0,93 | 5-metil-2-fenil-2- | chocolate-amargoalmendra | 1528 | 1482 | |
| Cetonas | 2 | 4,445 | 564419 | 1,90 | 3-hidroxi-2- butanona | dulce-mantequilla-crema | 719 | 721 |
| 25 | 22,303 | 674374 | 2,27 | Acetofenona | dulce- acre-almendra - acacia | 1087 | 1065 | |
| 29 | 23,385 | 294540 | 0,99 | 2-nonanona | coco-herbal-dulce-frutalqueso | 1116 | 1096 | |
| 32 | 25,463 | 572948 | 1,93 | transisomentona | menta fresca-menta dulce | 1176 | 1124 | |
| 34 | 25,816 | 662013 | 2,23 | cis-isomentona | menta fresca-menta dulce | 1187 | 1132 | |
| Alcoholes | 1 | 2,034 | 2661704 | 8,96 | 2-propanol | alcohol-leñoso-almizcle | NC | 515 |
| 5 | 7,746 | 709482 | 2,39 | 2,3-butanediol | frutal-cebolla | 809 | 789 | |
| 6 | 8,321 | 514198 | 1,73 | 1,3-butanediol | inodoro | 818 | NR | |
| 9 | 12,546 | 150143 | 0,51 | 2-furanmetanol | alcohol-rancio-dulcecaramelo | 882 | 865 | |
| 10 | 14,831 | 138762 | 0,47 | 2-heptanol | Fresco-herbal-dulce-floral | 921 | 906 | |
| 31 | 24,368 | 667710 | 2,25 | Bencenoetanol | floral-rosas-seco-agua de rosas | 1144 | 1113 | |
| Pirazinas | 7 | 9,261 | 616900 | 2,08 | 2-metil-pirazina | nuez-chocolate tostado | 832 | 826 |
| 11 | 14,990 | 813341 | 2,74 | 2,5-dimetilpirazina | café | 925 | 912 | |
| 13 | 15,429 | 98232 | 0,33 | 2,3-dimetilpirazina | caramelo-chocolate | 933 | 920 | |
| 18 | 19,360 | 463492 | 1,56 | 2-etil-6-metilpirazina | patata asada | 1013 | 991 | |
| 19 | 19,462 | 546055 | 1,84 | 2-etil-5-metilpirazina | tostado | 1016 | 994 | |
| 20 | 19,541 | 880051 | 2,96 | Trimetil pirazina | nuez-cacahuate | 1018 | 1000 | |
| 27 | 22,704 | 1377789 | 4,64 | 3-etil-2,5- dimetil-pirazina | patata-cacao-nuez tostada | 1097 | 1063 | |
| 28 | 23,011 | 757005 | 2,55 | Tetrametil pirazina | chocolate | 1105 | 1086 | |
| 33 | 25,674 | 409863 | 1,38 | 2,3,5-trimetil-6- etil-pirazina | caramelo | 1182 | 1163 | |
| 38 | 30,577 | 215555 | 0,73 | 3-isopentil-2,5- dimetil-pirazina | alcanfor-tomillo-herbalpino- agrio | 925 | 912 | |
| Ésteres | 14 | 16,501 | 766774 | 2,58 | Butanoato de etilo | frutal-piña-coñac | 954 | 804 |
| 15 | 16,865 | 788831 | 2,66 | Acetato de etilo | etereo- dulce-frutasmaleza verde | 961 | 806 | |
| 21 | 21,201 | 88082 | 0,30 | Acetato de secbutilo | solvente-banana | 1059 | NR | |
| 24 | 21,995 | 335573 | 1,13 | Meso-diacetato de 2,3-butandiol | NR | 1079 | 1054 | |
| 26 | 22,500 | 116178 | 0,39 | D,l-diacetato de 2,3-butandiol | NR | 1091 | 1064 | |
| 35 | 26,791 | 295984 | 1,00 | Caprilato de etilo | piña | 1217 | 1197 | |
| 26 | 28,334 | 516806 | 1,74 | Fenil acetato de etilo | floral-miel-Rosabalsámico- cacao | 1270 | 1243 | |
| Terpeno | 23 | 21,574 | 75137 | 0,25 | β-Ocimeno (E) | cítrico-tropical-terpénicoleñoso | 1068 | 1050 |
| Ácidos | 2 | 3,178 | 13705248 | 46,15 | Ácido acético | vinagre | NC | 625 |
| Lactonas | 12 | 15,266 | 79817 | 0,27 | γ-butirolactona | crema-aceite-caramelopan- café | 930 | 908 |
aTiempo de retención, bíndice de retención experimental, cíndice de retención teórico consultado en bases de datos (NIST, Flavornet),
NC: no calculado, NR: no reportado. N°: referencia al número de pico del cromatograma de la Figura 4.
Al comparar el número total de compuestos identificados por grupo funcional (Figura 5A) se puede apreciar que las pirazinas aportan el mayor número de COV´s al total extraído del licor de cacao, estos compuestos son importantes debido a que aportan positivamente al aroma y definen el aroma de la muestra a cacao, chocolate, tostado y nueces, por lo cual se esperaría que la muestra tenga un aroma agradable a chocolate [1,8,30,31], sin embargo, al comparar el área cromatográfica total por cada grupo, se puede apreciar que los ácidos se encuentran en mayor cantidad (área cromatográfica mayor al de todas las pirazinas juntas) siendo el ácido acético el único encontrado en la muestra, el cual si bien es indispensable para la generación de todos los COV´s durante el proceso de fermentación, es poco deseado al final del proceso en el aroma, debido a que aporta notas a vinagre o rancias haciendo que la muestra se considere de mala calidad [1,4,30], esto último destaca la importancia de identificar la mayoría de los COV´s involucrados en el aroma, su cantidad y el tipo de aroma que aporta a la muestra [1,5]. En la Figura 6 podemos apreciar una comparación del área de cada uno de los COV´s por grupo funcional, los aldehído (Figura 6A) son compuestos que aportan aromas tipo herbal y frutal, en la muestra del licor de cacao el más abundante fue el 2-fenil-2-butenal, que aporta notas aromáticas a chocolate, en el caso de las cetonas (Figura 6B) el COV más abundante fue la acetofenona, este compuesto es producido durante la fermentación, Portillo et al.[30] reporta que la acetofenona es generada al cuarto día de fermentación y produce en el aroma notas florales y dulces. Los alcoholes por su parte tienden a aportar notas aromáticas alcohólicas, herbales y a maderada como por ejemplo a brandy, en el caso de la muestra analizada se encontró que el 2-propanol fue el mayoritario el cual le aporta notas a alcohol, leña y almizcle [1,7,29].
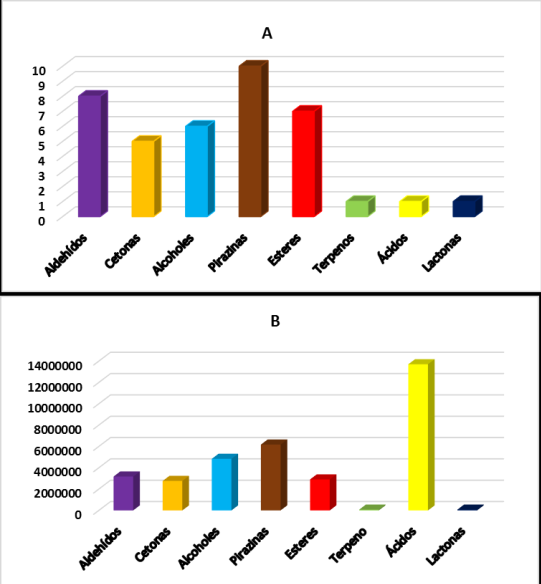
Figura 5 Gráficas del total de COV´s identificados por HS-SPME y GC-MS. A. Número total por grupo funcional. B. Área total por grupo funcional.
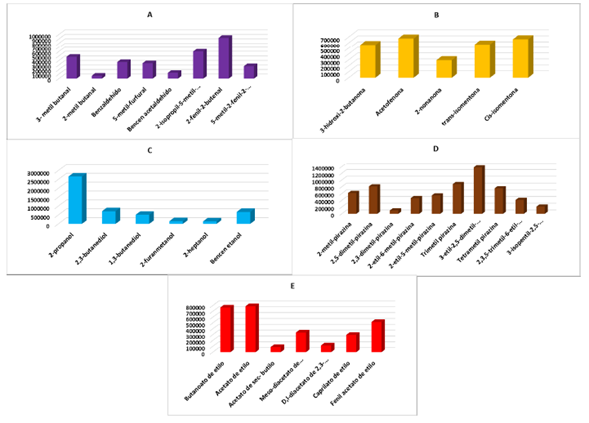
Figura 6 Gráficas COV´S vs Área por grupo funcional. A. Aldehídos. B.Cetonas. C. Alcoholes. D. Pirazinas. E. Ésteres.
La 3-etil-2,5-dimetil-pirazina fue la más abundante encontrada del grupo de las pirazinas, como la mayoría de compuestos de esta familia se origina por medio de la reacción de Maillard y son los principales COV´s responsables del aroma característico del cacao y sus productos derivados, en el caso de muestras de licor se ha reportado que aporta notas a cacao y nuez tostada. Por su parte, el acetato de etilo fue el compuesto mayoritario de la familia de ésteres, este se origina durante las últimas etapas de fermentación y produce notas frutales verdes y dulces. De los terpenos las lactonas y los ácidos solo se encontró un compuesto, el β-Ocimeno -(E) reconocido por aportar aromas cítricos, la γ- butirolactona que aporta notas a café y cremosos y finalmente el ácido acético que como se mencionó anteriormente, a pesar de su importancia en los procesos de formación de los COV´s es poco deseado por su aroma a vinagre [22,28,30,31]. El ácido acético es el más abundante de todos los COV´s identificados con un área de 13 705 248 µV*seg, casi 7 veces más que el que le sigue en abundancia que es el 2-propanol con un área de 2 661 704 µV*seg, incluso si se suma el área de los 10 compuestos siguientes al ácido acético se obtiene un área menor (11 177 037 µV*seg), no obstante, el licor de cacao producido por la asociación está catalogado como fino y de aroma posiblemente por que la suma de los compuestos que aportan positivamente al aroma prevalece sobre el efecto negativo del ácido acético.
Conclusiones
La extracción de COV´s en granos de cacao regional de Nariño por HS-SPME demostró ser una herramienta analítica de gran valor. Los factores estudiados en este trabajo: tipo de fibra, temperatura y tiempo de extracción presentaron influencia estadística en el número de COV´s extraídos y posteriormente analizados por GC- MS, encontrando que, a un tiempo de 50 min de extracción, temperatura de 60 °C y la fibra DVB/ CAR-PDMS como las condiciones de mayor eficiencia en la extracción de COV´s de la matriz de estudio. Además, el método de extracción presentó una adecuada precisión en términos de repetibilidad y reproducibilidad, lo que convierte a HS-SPME en un método de extracción confiable y de gran versatilidad para el análisis de calidad en muestras de la agroindustria del cacao y que debe ser probado en otros tipos de matrices como cacao en grano seco, tostado y chocolates.
En las muestras analizadas de licor del clon de cacao CCN51, los principales tipos de compuestos identificados son aldehídos, cetonas, alcoholes, pirazinas, ésteres, terpenos, ácidos y lactonas, siendo el ácido acético, el 2-propanol y la 3-etil-2,5-dimetil-pirazina los compuestos mayoritarios identificados. Si bien el mayor número de compuestos es del tipo pirazina (ocho compuestos), las cuales aportan al aroma del licor de cacao de manera positiva, el ácido acético fue el compuesto mayoritario, el cual se ha reportado que aporta negativamente al aroma y se encontró en un área (13 705 248 µV*seg) que es superior incluso a la sumatoria de los 10 compuestos mayoritarios que le preceden en área y que aportan positivamente (11177 037 µV*seg), sin embargo, el licor producido ha sido premiado en varias ocasiones por su calidad aromática. Esto sugiere que existe una competencia entre el número de compuestos, su identidad, su cantidad, así como el tipo y la descripción del aroma de cada compuesto para definir una calidad aromática específica, posiblemente la buena calidad del aroma de las muestras se debe a la interacción y la sinergia de los compuestos que aportan positivamente al aroma, prevalecen sobre la gran cantidad de ácido acético que aporta negativamente a la calidad, lo cual sugiere profundizar en la identificación y cuantificación de los COV´s, así como su formación durante el manejo pos cosecha realizado tradicionalmente.