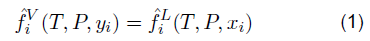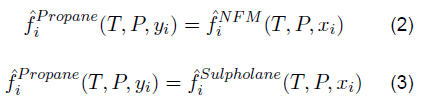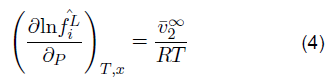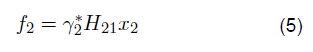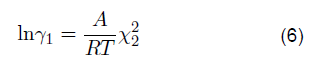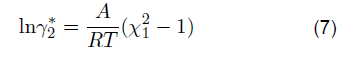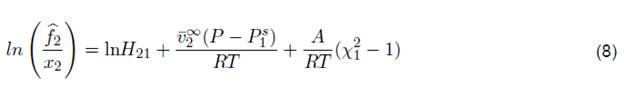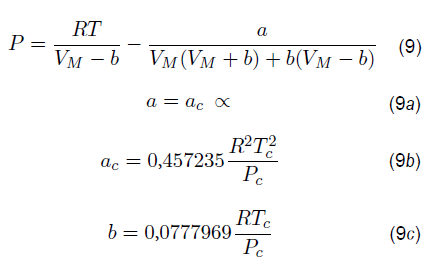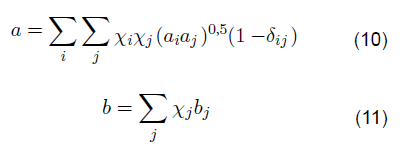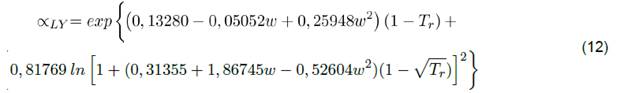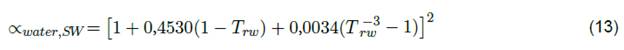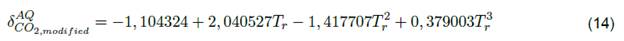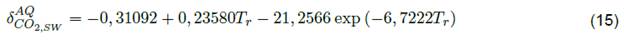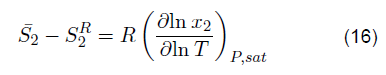Introducción
La solubilidad de los gases es una propiedad física de amplio estudio, sin embargo, cuando se trata de hidrocarburos suele ser de gran interés [1]. La familia de los hidrocarburos es muy compleja, por lo que a nivel mundial su uso genera una alta demanda siendo este uno de los mercados más fuertes. Este artículo de reflexión se enfoca en la solubilidad del propano o gas licuado de petróleo (GLP), teniendo en cuenta las condiciones de presión y temperatura; cabe señalar que el propano ha sido uno de los gases con mayores aplicaciones como agente refrigerante [2], por lo que a nivel mundial su uso ha sido muy variado. El propano pertenece a la familia de los alcanos o parafinas, cuya estructura química (Figura 1) se caracteriza por contener enlaces sencillos de carbono.
Es claro afirmar que los solventes orgánicos son sustancias que se derivan del petróleo, para este caso la N-formil morfolina (NFM) y el sulfolano forman parte del segundo componente de este sistema. Cuando se habla de la solubilidad de un compuesto gaseoso sobre un líquido, el equilibrio líquido-vapor puede formularse mediante la igualdad de fugacidades; como es el siguiente caso:
El NFM y el sulfolano son disolventes orgánicos polares apróticos que se utilizan para eliminar las corrientes ácidas. De acuerdo con la ecuación 1 los solventes ajustados a condiciones de presión y temperatura en equilibrio se reflejarían como:
Las ecuaciones 2 y 3 reflejan un balance de componentes según presión, temperatura y composición. La solubilidad del propano es una variable termodinámica, es decir, si la presión y la temperatura aumentan, la solubilidad lo hará. Con base en la solubilidad del propano, algunas investigaciones han informado que el propano también se considera soluble en solventes orgánicos no polares a diferentes rangos de temperatura [3]. La presión y la temperatura se consideran factores cuantitativos. Estos factores afectan significativamente la solubilidad del propano; por lo tanto, esta reflexión analiza los aspectos fisicoquímicos evaluados a la solubilidad del propano en NFM y sulfolano. Aunque estos solventes se derivan del petróleo, el propano como GLP no solo es soluble en ellos, sino que puede solubilizarse en soluciones acuosas de sulfato. [4]. La solubilidad del propano en NFM y sulfolano es determinado en ciertos rangos de temperatura teniendo en cuenta la influencia de parámetros de interacción binaria o parámetros de interacción molecular a los que se crea un equilibrio termodinámico de fases, como se demuestra en investigaciones sobre estos casos [5,6,7]. A medida que un gas se disuelve en un solvente polar, la constante de Henry a menudo también se ve afectada en este comportamiento [8]. Para las parafinas, la constante de Henry suele ser mayor cuanto menor sea el número de carbonos [9]; si a 273,15 K entre el etano y el butano se analiza esta constante, se espera que aumente para el etano. Los estudios de solubilidad de gases en líquidos dependen en gran medida de los enlaces de la molécula. Un solvente polar puede ser prótico o aprótico, en este caso NFM y sulfolano son altamente solubles en hidrocarburos y agua. El sulfolano es un solvente orgánico con una masa molecular más alta que el NFM, de hecho, se han reportado datos para el sulfolano por su buena solubilidad en solventes orgánicos no polares como 1-heptiene, tetrahidrofurano, benceno y ciclohexano en los rangos de 250-301 K [10]; en el caso de NFM, la constante de Henry tiene menor interacción debido a que este solvente opta con una masa molecular más baja que el sulfolano. Hasta cierto punto, este comportamiento de la masa molecular no siempre ocurre; como es el caso de la solubilidad del propano en algunos éteres [11], donde la constante de Henry presenta un comportamiento variado independientemente de la masa molecular del solvente. Con relación a los solventes orgánicos, la estructura química de la NFM (izquierda-Figura 2) presenta un grupo funcional originado de la formamida, mientras que el sulfolano (derecha-Figura 2) a pesar de ser un solvente de mayor masa es clasificado como una solfona. Ambos solventes son empleados en la industria para destilaciones extractivas, debido a su polaridad y naturaleza química.
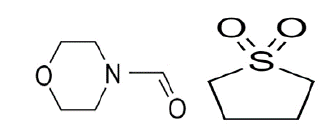
Figura 2 Estructura química de los disolventes orgánicos. N-formil morfolina (izquierda) y sulfolano (derecha).
El propano es un hidrocarburo altamente soluble en solventes polares. Sin embargo, cuando se trata de hidrocarburos gaseosos como el etano, estos también pueden solubilizarse en solventes como NFM y N-metilpirrolidinona (NMP) en ciertas condiciones de presión y diferentes rangos de temperatura [12]. El metano como hidrocarburo también se considera altamente soluble en NFM y otras sustancias inorgánicas [13]; aunque la idea general es estudiar su solubilidad, sus datos experimentales serán correlacionados por PR. La ecuación PR es fundamental cuando se habla de la presión que ejerce un gas a altas presiones [14]. Por eso esta expresión representa la mejor correlación de los datos experimentales entre 298,15-343,15 K a altas presiones. Por otro lado, cuando se determina la solubilidad del propano en cualquiera de estos dos solventes, los parámetros de Krichevsky-Ilinskaya determinan la actividad química de las especies que participan en el sistema, por ejemplo, las correlaciones termodinámicas de solubilidad de gases propuestas por Prausnitz y Shair [15]. Estas correlaciones modelan el comportamiento de la solubilidad y transitoriedad en gases polares y solventes.
Factores que afectan la solubilidad
En el caso de un gas como el propano, la presión será el factor clave cuando exista un sistema binario entre propano (2) + NFM (1) o el sistema propano (2) + sulfolano (1). Los estudios fisicoquímicos no solo son aplicables a la diversidad de hidrocarburos, sino a medicamentos como Eudragit [16], donde se evalúa un estudio fisicoquímico en base al pH de los solventes. Algunas investigaciones indican que los hidrocarburos tienen parámetros de solubilidad ajustados a la presión y temperatura [17]; tales parámetros son comunes para los hidrocarburos en estado líquido. Los parámetros de solubilidad se estudiaron teniendo en cuenta la temperatura crítica [18]. La temperatura crítica de los hidrocarburos, al igual que la presión de vapor, aumenta la constante de Henry a medida que aumenta la presión del sistema.
Presión
La solubilidad de un gas depende teóricamente de la presión. Es por eso que en los sistemas binarios propano (2) + sulfolano (1) y propano (2) + NFM (1) las presiones son altas, estos datos de solubilidad son evaluados por la ecuación PR. La presión de un gas es significativa debido al grado de interacción gas-disolvente; sin embargo, la constante de Henry estudia este comportamiento a ciertas temperaturas en el rango de 298,15343,15 K. A medida que aumenta la temperatura del propano disuelto en sulfolano, aumenta la constante de Henry. Este comportamiento también ocurre para NFM. El sistema de propano (2) + NFM (1) se estudió a una presión de 20,15 MPa, mientras que en el segundo sistema la presión fue de hasta 17,6 MPa.
La presión es el factor cuantitativo más importante, concretamente cuando se trata de estudiar la solubilidad de un gas en un líquido. Los estudios sobre casos de solubilidad de hidrocarburos en fase gaseosa son altamente reconocidos; por ejemplo, el propano no solo es una base para comprender la solubilidad del gas en líquidos, sino que también se han publicado estudios de solubilidad del propileno en isodecano y tolueno [19]. La polaridad de un solvente es fundamental cuando se busca entender qué tan soluble puede ser un gas en un líquido, especialmente si se trata de solventes orgánicos [20,21].
Temperatura
La temperatura es un factor cuantitativo clave para los sistemas binarios mencionados anteriormente; propano (2) + NFM (1) y propano (2) + sulfolano (1) son sistemas en los que se estudió su solubilidad a temperaturas de 298,15, 313,15 y 343,15 K. La ecuación de PR es una expresión cúbica con respecto al volumen, por lo tanto, este modelo depende de la temperatura del sistema para correlacionar los datos de solubilidad. Este factor se considera importante porque aumenta la energía cinética del gas, y se considera una de las propiedades más representativas de los gases en conjunto y la difusividad [22], aunque en los líquidos la temperatura representa un efecto mayor cuando se busca solubilizar un líquido en otro líquido.
La Figura 3 muestra el comportamiento del sistema propano (2) + NFM (1), indicando el aumento de presión según la fracción molar del soluto. El soluto corresponde al gas propano, en el cual, las partículas del gas se aceleran en NFM de acuerdo con el aumento de presión. La actividad química en NFM y sulfolano depende en gran medida del efecto de la temperatura, y por otro lado de las fuerzas intermoleculares entre el propano y cualquiera de los solventes mencionados anteriormente.
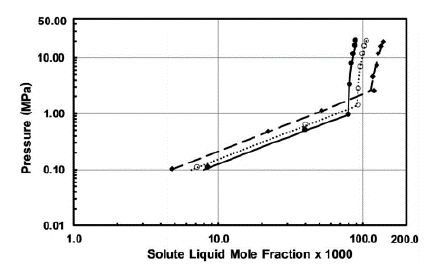
Figura 3 Datos experimentales para propano (2) + NFM (1) comparados con los valores correlativos de la ecuación PR. •, 298,15 K; °, 313,15K; ♦ 343,15 K [5]
La temperatura inicial que se muestra en la Figura 3 es de 298,15 K. A esta temperatura, la presión inicial fue de 0,110 MPa cuando la fracción molar del soluto permaneció en 0,00853. Efectivamente, la presión de propano en NFM fue aumentando hasta obtener una presión elevada de 20,15 MPa a 298,15 K. Teniendo en cuenta la Figura 3, los cambios de pendientes de propano en NFM ocurren a presiones mayores a 0,95 MPa. Esto es debido a que en estos puntos el propano en vapor es rico en NFM, y la NFM es rica en líquido respectivamente, es decir, se presenta la denominada región líquido-líquido. Cabe mencionar que en el estudio realizado por Jou [5] la temperatura máxima de estudio para este sistema binario fue de 343,15 K, por lo tanto, a esta temperatura la actividad química del sistema es mucho mayor. Cabe resaltar que la constante de Henry determina el grado de interacción entre el propano y cualquiera de estos solventes orgánicos según la temperatura y la presión. La temperatura y la presión se consideran los principales factores cuantitativos importantes al estudiar la solubilidad. Ahora, ¿qué pasa con los aspectos fisicoquímicos de este estudio? Los aspectos de la solubilidad de un hidrocarburo gaseoso en uno o más solventes estarán vinculados a la energía libre de Gibbs, la entalpía, la entropía y el coeficiente de actividad. La Figura 4 muestra el comportamiento de la solubilidad del propano en sulfolano con respecto a la presión y su fracción. De acuerdo con la Figura 4, para el propano en sulfolano también se evidencian significativos cambios de pendiente. A 298,15 K, el propano pasa a la región líquido-líquido a una presión de 0,95 MPa. Estos cambios de pendientes denotan un cambio de fase en el hidrocarburo debido a la presión por la ecuación de PR, existiendo un punto de tres fases, vapor rico en sulfolano y sulfolano rico en líquido. Este el mismo comportamiento de la Figura 3 con el sistema propano-NFM. Por un lado, en la Figura 4 se presentan dos temperaturas diferentes a las estudiadas, fondo blanco cuadrado, 373,15 K; triángulo en negrita, 403,15 K. Schmidt estudió estas temperaturas con el fin de analizar el comportamiento del propano en sulfolano [6]. Los resultados de la Figura 4 concluyen que a medida que aumenta la presión, también aumenta la fracción molar. No obstante, si la temperatura del propano en el sulfolano es mayor, la constante de Henry será mayor, haciendo que el parámetro de Margules también disminuya según la expresión de Krichevsky-Ilinskaya (KI).
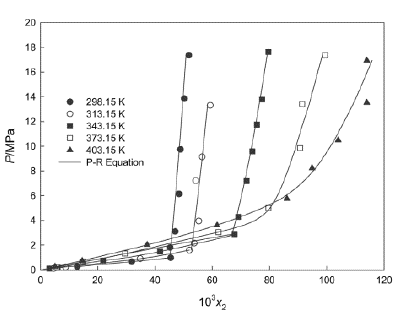
Figura 4 Datos experimentales del sistema sulfolano (1) + propano (2) comparados con valores correlacionados por la ecuación de Peng-Robinson [6].
Parámetros de la ecuación de Krichevsky-Ilinskaya (KI)
La ecuación KI consta de parámetros importantes como el volumen molar parcial infinito
Como la fugacidad debe ser función de H 2 entonces se tiene que
Siendo γ* 2 el coeficiente de actividad para el componente líquido. Ahora bien, el coeficiente de fugacidad para el solvente sea NFM o sulfolano respecto al propano viene dado por
De la ecuación 6 se deduce el parámetro de Margules para los sistemas propano-NFM y propano-sulfolano, luego, para el propano en base a la ecuación de Gibbs-Duhem se puede establecer el producto del cociente
La ecuación de KI nace de la fugacidad de los componentes de la mezcla incluyendo la constante de Henry y el parámetro de Margules que interacciona el nivel de actividad en las especies químicas de la mezcla. Finalmente, KI se denota como,
Según el estudio de solubilidad, la ecuación 8 se utilizó para estudiar el coeficiente de fugacidad para cada sistema a altas presiones. Los parámetros de KI se utilizan ampliamente para correlacionar la solubilidad de los sistemas binarios [23]. Aunque la expresión denota una dependencia de la fugacidad del gas, no se puede omitir el comportamiento de la fracción molar y la temperatura del sistema. Desafortunadamente, la ecuación KI posee la clara limitación de que es útil para sistemas binarios [24]. Sin embargo, en el propano se usa para determinar la actividad química entre la constante de Henry y la fugacidad del gas en NFM o sulfolano.
Los valores reportados en las Tablas 1 y 2 corresponden a los parametros de KI, obtenidos para cada sistema binario desde 298,15 a 343,15 K a presiones elevadas [5,6]. Las especificaciones que se muestran en la Tabla 1 son los parámetros correspondientes de la ecuación de Krichevsky-Ilinskaya (KI) ajustada a propano (2) + NFM (1).
Tabla 1 Parámetros de la ecuación de Krichevsky-Ilinskaya para el sistema (2) + NFM (1).
| T/K | H21/MPa | V2 ∞/cm3 mol1 | A/RT |
|---|---|---|---|
| 298,15 | 12,80 | 68,2 | 1,642 |
| 313,15 | 15,53 | 69,5 | 1,566 |
| 343,15 | 21,34 | 72,2 | 1,439 |
Tabla 2 Parámetros de la ecuación de Krichevsky-Ilinskaya para el sistema (2) + sulfolano (1).
| T/K | H21/MPa | V2 ∞/cm3 mol1 | A/RT |
|---|---|---|---|
| 298,15 | 20,7 | 66,5 | 1,97 |
| 313,15 | 24,8 | 67,5 | 1,87 |
| 343,15 | 33,2 | 69,3 | 1,71 |
A medida que aumentaba la temperatura del propano en NFM, la constante de Henry alcanzó un valor máximo de 21,34 MPa; claramente el grado de interacción es mayor hacia la constante porque la energía libre de Gibbs tiene que verse afectada por la alteración del sistema. El volumen molar parcial de dilución es un parámetro clave de esta ecuación.
A 298,15 K el volumen fue de 68,2 cm3.mol-1 para el primer sistema; sin embargo, este volumen es proporcional a la temperatura y corresponde al propano que es susceptible a la temperatura. Un parámetro Anal es el parámetro de Margules A en J/mol. El comportamiento del parámetro de Margules es opuesto al volumen molar constante y parcial de Henry. Este parámetro expresa la energía libre de Gibbs, según la actividad química de la mezcla, en efecto, el parámetro de Margules está planteado por la ecuación de KI debido a que este indica la actividad química en las especies planteadas, respecto a los cambios de temperatura en los sistemas. De cierta manera, los resultados reportados por las Tablas 1 y 2, demuestran que el parámetro disminuye cuando la solubilidad de la mezcla es mayor; precisamente, el parámetro de Margules se acercará más a la unidad mientras en estos casos, ya que habrá mayor actividad química en los componentes de la mezcla haciendo que el volumen molar infinito aumente significativamente. Cuando se habla de parafina, se entiende que el propano tiene características de adsorción y difusión como lo reportan ciertas investigaciones. La difusión junto con la energía cinética son pilares fundamentales para el parámetro de Margules [25,26]; por lo tanto, a 343,15 K el parámetro tiende a disminuir, debido a que la actividad química entre especies es mayor en términos de concentración, presión y entalpía.
La Tabla 2 corresponde al sistema binario propano (2) + sulfolano (1) modelado bajo la ecuación 4, cuyos datos son reportados por Schmidt KA [6]. Las constantes de Henry para este caso son más altas en comparación con NFM, lo que indica que existe una mayor actividad química en el sulfolano. El sulfolano es un disolvente para eliminar corrientes ácidas, aunque químicamente esta molécula tiene un peso molecular mayor que el NFM, el grado de interacción en la constante de Henry será mayor. Para ambos sistemas a 298,15 K la constante de Henry toma un valor de 12,80 MPa en NFM y 20,7 MPa en sulfolano. El volumen molar parcial también aumenta según la temperatura en este sistema, y luego se presenta el parámetro de Margules. En la Tabla 2 los parámetros de Margules son mayores que en NFM, objetivamente, el comportamiento de la energía libre de Gibbs junto con la entalpía aumenta el potencial químico de este sistema binario.
Comportamientos de la constante de Henry
La solubilidad de un gas se modela a través de la ley de Henry. La constante de Henry denota cómo será el comportamiento de propano disuelto en cualquiera de estos disolventes a diferentes temperaturas. En efecto, esta constante indica en qué disolvente el gas se disolverá más rápido a temperatura constante. En este caso, el propano soluble en NFM o en sulfolano se somete a altas presiones. Según la investigación de Jou y Schmidt [5,6] la solubilidad del propano en NFM es más eficiente que la del sulfolano debido a que este primer solvente es más liviano en términos moleculares. Ambos estudios se realizaron a 298,15, 313,15 y 343,15 K con altas presiones, donde el comportamiento de la constante de Henry es evidente ante estas condiciones.
Las Figuras 5 y 6 muestran el comportamiento de la solubilidad del propano en el mismo rango de temperatura. Por ejemplo, la Figura 5 indica claramente las variaciones que ocurren en la constante de Henry sobre NFM; se puede observar que el dióxido de carbono y el sulfuro de hidrógeno son gases más solubles que el propano, aunque estos gases se consideran ácidos debido a su alto poder corrosivo, no se puede pasar por alto su solubilidad en NFM, que es un disolvente menos pesado que el sulfolano. En comparación con la Figura 6, la constante de Henry se considera para tres parafinas ligeras; el metano tiene un valor numérico más alto en términos de las constantes de Henry, lo que significa que se requiere más actividad química para disolver el metano en sulfolano.
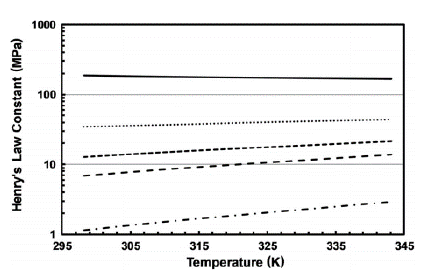
Figura 5 Comparación de la constante de Henry en NFM (298,15-343,15 K). Línea negra sólida, metano; punto redondo negro, etano; línea de puntos cuadrada negra, propano; línea negra discontinua, dióxido de carbono; guion de punto negro, sulfuro de hidrógeno [13,34].
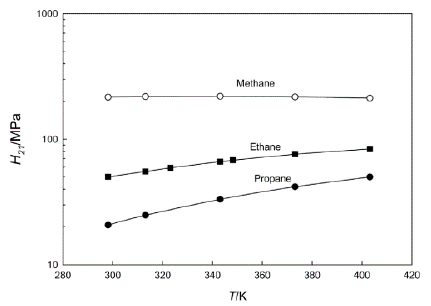
Figura 6 Comparación de la constante de Henry en sulfolano (298,15-343,15 K). Punto redondo blanco, metano; cuadrado lleno de negro, etano; punto redondo negro; propano [6].
El NFM y el sulfolano son disolventes que se han mezclado con propano a presiones de 20,15 MPa y 17,6 MPa. La Figura 5 y 6 indicaron el comportamiento en la constante de Henry en un rango de temperatura entre 298,15 y 343,15 K; sin embargo, los estudios de Jou concluyeron que es más eficiente y rápido disolver propano en NFM que en sulfolano [5]. Aunque estos estudios de solubilidad se realizaron a la misma variación de temperatura y presión, la actividad química que existe en las especies menos pesadas resultó ser menor en términos de las consideraciones entrópica, entálpica y energética del primer sistema. El sistema propano (2) + sulfolano (1) registró los valores más altos en la constante de Margules y Henry. Es evidente que las propiedades fisicoquímicas del sulfolano requieren un mayor gasto energético que las del NFM [26].
Ecuación de Peng-Robinson y solubilidad
La solubilidad de los gases en líquidos se puede modelar utilizando la ecuación de PR, como es el caso de la solubilidad mutua del CO2 y el agua [27]. Investigaciones previas muestran la modificación del parámetro de interacción binaria (BIP) incluyendo una nueva función alfa, a la cual se determinó que la precisión para la presión de vapor del líquido es mayor [28,29]. La constante de Henry tiene el objetivo de determinar la solubilidad del propano en la fase acuosa, por ello, la ecuación de PR es implementada para caracterizaciones de la fase no acuosa en el sistema binario. La ecuación cubica de PR no es un modelo que se encuentra en función a , por lo cual, se puede determinar la solubilidad del componente por medio de modificaciones en sus parámetros de interacción binaria (BIP). Es importante aclarar que los datos de solubilidad entre propano (2) + NFM (1) y propano (2) + sulfolano (1) fueron correlacionados por PR sin modificación alguna en sus parámetros; sin embargo, si se realiza esta modificación a estos sistemas, se espera que la presión de vapor de NFM y sulfolano sea mayor en el rango completo de temperatura de 298,15 a 343,5 K.
La ecuación de PR se expresa como
Donde P es la presión en megapascales (MPa), T es la temperatura en Kelvin (K), V M es el volumen molar en metros cúbicos por kilomol (m3/kmol), R es la constante de los gases, función alfa ∝ que es modificada para la solubilidad segun diversos autores.
En la regla de mezcla se tienen en cuenta las fracciones molares y las constantes de Van der Waals según las siguientes expresiones:
Donde x i y x j corresponden a las composiciones de los componentes, y δ ij ., es el BIP entre x i y x j componentes La solubilidad mutua se estudia principalmente en gases hacia líquidos, y se recurre a la necesidad de una ecuación de estado [30] como lo es la solubilidad mutua del agua en los hidrocarburos, que, a su vez, sus datos son correlacionados por la ecuación de estado de estado cubica.
La función alfa modificada
Para solventes, alfa de PR depende del factor acéntrico. Es importante mencionar que esta función ha sufrido algunas modificaciones para algunas sustancias como el agua, CO2, Ar, CH4, C2H6 y algunos alcanos pesados; según Li y Yang [31] la función alfa podría aumentar con mayor precisión la presión de vapor del solvente. Esta función tiene la forma:
La ecuación 10 se usa para determinar el parámetro de la ecuación 5a; es decir, únicamente para las sustancias puras. Esta función se puede calcular para propano, NFM y sulfolano respectivamente a partir de PR [14]. Otros autores como Søreide y Whitson [29], también se atrevieron a modificar la función alfa para sustancias puras, con el objetivo de predecir la presión de vapor del agua con una precisión inferior al 0,5 % en rangos de temperatura de 288,15 a 598,15 K.
La ecuación 13 corresponde a la modificación de Søreidee y Whitson de la función alfa. Sin embargo, al tratarse de estudios de solubilidad mediante PR, el BIP también se modifica en función de la temperatura reducida Tr. Ahora bien, la solubilidad del propano depende totalmente de la presión, por lo que la ecuación de PR junto a la ecuación de KI son los modelos más apropiados en estos estudios. La PR ayuda a ajustar los datos de solubilidad teniendo en cuenta la presión, mientras que la ecuación de KI expresa el grado de actividad del gas en el líquido gracias a la transitoriedad y al parámetro de Margules.
Otro caso similar es la solubilidad del propano en 1,2 etanodiol (EG) a presiones elevadas de 20,3 MPa [32]. Los datos de presión y composición se modelaron mediante PR para el estudio de su solubilidad, por lo que también se obtuvo BIP en ese caso sin sufrir ninguna modificación estructural. El BIP es un factor clave en este estudio, ya que más allá de ser una función de la temperatura, mide el nivel de actividad química en ambas especies como el propano y el sulfolano o NFM. Hay algunas modificaciones para el BIP desde PR [29]. Esta modificación es aplicable para los hidrocarburos, teniendo en cuenta el factor acéntrico y la temperatura reducida de cada especie.
Parámetro de interacción binaria (BIP)
Las modificaciones del BIP se basan en la temperatura reducida, de las cuales ambas deben ser función de esta variable [27,33]. Estas modificaciones se desarrollaron para gases como el CO2 [31], sin embargo, BIP se puede aplicar a estudios de solubilidad de propano en solventes orgánicos. Este parámetro tiene una modificación de la siguiente manera:
De hecho, la ecuación 12 es una modificación más, de hecho, esta expresión no se ha utilizado para el caso de propano (2) + NFM (1) y propano (2) + sulfolano (1) [5,6]; sin embargo, los datos de solubilidad para los sistemas binarios descritos anteriormente pueden presentar una mayor precisión en la presión de vapor de sulfolano o NFM. Aunque este no es el caso principal, es importante señalar que PR siempre será la expresión adecuada debido a las altas presiones de los hidrocarburos y los rangos de temperatura. Por otro lado, Søreidee y Whitson además de modificar la función alfa, también elaboraron un ajuste al BIP de PR. Esta enmienda toma la siguiente forma:
BIP es un factor clave en la ecuación de estado que se ha estudiado en este caso. La ecuación 15 es una modificación del BIP correspondiente a PR y se utiliza para el sistema CH4-agua, sin embargo, se hace aplicable para predecir la solubilidad de gases en líquidos. Gracias a esto, se puede elegir una idea del comportamiento de solubilidad entre un hidrocarburo y un solvente orgánico. Aunque Søreidee y Whitson modificaron el BIP, una nueva función alfa también ajusta estos cambios en el parámetro de interacción.
Solubilidad de gases en líquidos
Los efectos de la solubilidad de gases en líquidos fueron estudiados por Hildebrand [35], incluyendo el análisis de la entropía de estos casos. Sin embargo, la solubilidad desde el punto de vista termodinámico está muy relacionada con la energía libre de Gibbs, la entropía y la entalpía de los componentes. En el caso de la solubilidad de gases en líquidos, se desarrolló una expresión matemática que obedece a la ley de Henry que relaciona la entropía. Claramente, las diferencias entrópicas son iguales a una variación de temperatura y composición a presión constante; esta presión puede ser baja o alta, sin embargo, para modelos como PR la presión debe considerarse alta si se va a correlacionar la solubilidad de un hidrocarburo en un solvente polar o apolar.
La ecuación 16 considera las diferencias entrópicas
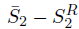 , el cociente de la primera derivada de las fracciones molares, entre la variación de la temperatura, siendo multiplicada por la constante de los gases a presión de saturación constante
, el cociente de la primera derivada de las fracciones molares, entre la variación de la temperatura, siendo multiplicada por la constante de los gases a presión de saturación constante
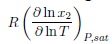 [35]. Este es un proceso a presión constante de acuerdo con la ecuación anterior. La entropía de la ecuación 16 relaciona el equilibrio existente de los sistemas binarios en términos de fuerzas intermoleculares. Sin embargo, que la NFM o sulfolano se mantengan unidos al gas depende en gran medida de la polaridad como se mencionó anteriormente.
[35]. Este es un proceso a presión constante de acuerdo con la ecuación anterior. La entropía de la ecuación 16 relaciona el equilibrio existente de los sistemas binarios en términos de fuerzas intermoleculares. Sin embargo, que la NFM o sulfolano se mantengan unidos al gas depende en gran medida de la polaridad como se mencionó anteriormente.
Conclusiones
En el siguiente artículo de reflexión se pudo comprender la importancia de la solubilidad de los sistemas binarios propano (2) + NFM (1) y propano (2) + sulfolano (1) en los rangos de temperatura 298,15-343,15 K a presiones de 20,15 MPa y 17,6 MPa. Se consideró el efecto fisicoquímico de los factores cuantitativos de presión y temperatura que interfieren con la solubilidad de los sistemas. Aunque los solventes orgánicos utilizados para la mezcla tenían una polaridad aprótica, NFM resultó ser el solvente más óptimo para que el propano presentara una solubilidad mucho más rápida en comparación con el sistema de sulfolano. Se consideraron los parámetros de la ecuación KI para cada sistema, demostrando el efecto del parámetro de Margules en cada solvente. La constante de Margules disminuyó a medida que aumentó la temperatura, lo que significa que el exceso de energía libre de Gibbs en NFM fue menor que en sulfolano debido a la actividad química entre los componentes de la mezcla. Finalmente, se estudió la ecuación de PR como el modelo óptimo para predecir la solubilidad del sistema. La función alfa y el BIP de PR se modificaron matemáticamente para predecir un comportamiento más preciso de la sobrepresión del gas ejercida sobre un solvente. Aunque estas modificaciones no se utilizaron para el sistema binario propuesto, se deduce que la presión de vapor de sulfolano o NFM tiende a reproducirse con mayor precisión en el rango de 298,15-343,15 K a altas presiones.