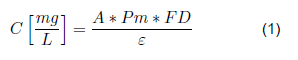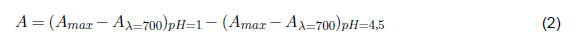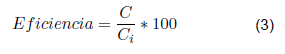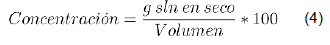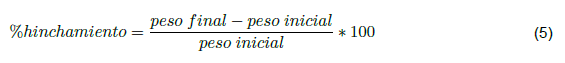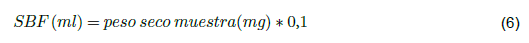Introducción
Sobre la piel existe un complejo fisicoquímico conocido como manto ácido, formado por el manto aéreo y la emulsión epicutánea, los cuales son los encargados de mantener la estabilidad del pH natural de la piel, cuyo valor se encuentra alrededor de 6,5 [1]; mantener este valor es esencial para evitar el desequilibrio de la flora cutánea y, a su vez, la proliferación de organismos patógenos [2]. Cuando un tejido epitelial se ve afectado por heridas, úlceras o traumas existe una acidificación en él, lo que induce un cambio en el pH que dificulta un microambiente adecuado, para que pueda existir un proceso de cicatrización exitoso. Por ello, es imprescindible y conveniente mantener el control de acidez epitelial en un tejido con patologías, ya que conociendo el pH de la zona afectada se puede tener claridad sobre el diagnóstico y tratamiento adecuado para cada paciente, lo que garantiza que la cicatrización del tejido se dé bajo un ambiente con las mejores condiciones posibles [2]. Actualmente, existen técnicas para el tratamiento de heridas cutáneas, tales como el uso de apósitos, fármacos e hidrogeles, siendo este último de mucho interés de estudio y más aún si se integra la fema de indicadores, debido a que es un método novedoso y poco explorado. La fabricación de membranas a partir de diferentes biopolímeros ha ganado importancia en el tema de tratamiento de heridas cutáneas, debido a la gran biocompatibilidad, flexibilidad y excelente capacidad de absorción y desorción de fármacos, a la vez que facilitan la humectación de la herida. Sin embargo, el control de pH en los tratamientos dérmicos se sigue realizando por separado, dado a que hasta el momento no se reporta el uso de hidrogeles o membranas indicadoras de pH [3]. Es bien sabido que las antocianinas como pigmentos hidrosolubles se pueden encontrar en las vacuolas de las células vegetales, y que son ellas quienes les otorgan a algunas frutas, hortalizas y vegetales una gama de colores que van desde el rojo hasta el azul, por lo cual se encuentran en diversas fuentes de frutos y vegetales de color rojo y púrpura. Actualmente, el interés en ellas se ha intensificado, debido a que son flavonoides que, además de poseer propiedades farmacológicas y terapéuticas [4], también presentan una alta sensibilidad a la temperatura, al pH y a la luz. Además, cuando las antocianinas se encuentran sometidas a un medio ácido, su forma predominante es la del ion flavilio, el cual le otorga el color rojo, mientras que cuando es sometida a pH básico o alcalino, el ion flavilio es susceptible al ataque nucleofílico por parte del agua, y como consecuencia ocurre un fenómeno conocido como efecto hipsocrómico, haciendo que cambie de color, por lo cual se pueden aprovechar como indicadores de pH [5,6]. Por lo anterior, en este trabajo se planteó la obtención de membranas de diferentes biopolímeros con la adición de antocianinas, con el fin de evaluar el potencial de estas como liberadoras de fármacos con indicador de pH, una vez sean aplicados sobre la herida de la piel que se encuentre acidificada, y una vez liberen la sustancia absorbida basifiquen la zona afectada y den evidencia del cambio de pH mediante el cambio de color. Para lograrlo, se mezclaron diferentes biopolímeros con propiedades benéficas para fabricar películas, como el quitosano, la fibroína, el colágeno y el polivinil alcohol, y se prepararon membranas con las mezclas de estos, para determinar su comportamiento, mediante la evaluación de hinchamiento y la respuesta a los cambios de pH. El quitosano y el colágeno son reconocidos por su efecto cicatricial, al igual que la fibroína, en tanto el PVA se ha reconocido por ser un polímero coadyuvador en el entrecruzamiento de los anteriores, y mejorador de las propiedades mecánicas en la fabricación de membranas, de ahí la selección de estos biopolímeros.
Materiales y métodos
Extracción de antocianinas
Las antocianinas fueron extraídas por vía química desde el repollo morado (Brassica oleracea) con base en un estudio previo, en el cual las antocianinas obtenidas desde esta fuente presentaron un mejor rendimiento de extracción y respuesta al pH, en comparación con las obtenidas desde mora (Rubus ulmifolius), ciruela (Prunus domestica), remolacha (Beta vulgaris) y berenjena (Solanum melongena), también evaluadas [7]. Las hojas del repollo fueron cortadas en trozos de 5 x 5 mm y, posteriormente, mezclados con agua destilada en una relación 2:1 S/L, para Analmente ser llevados a un baño maría durante 30 min a una temperatura de 70 °C, siguiendo el protocolo previamente establecido por las autoras en estudios previos del Grupo de Biomateriales de la Universidad de Antioquia [7].
Caracterización de las antocianinas
La solución de antocianinas fue caracterizada por espectroscopía de luz ultravioleta (UV), empleando un espectrómetro BioTek Synergy H1 Hybrid Multi-Mode Reader. El espectro fue tomado a la solución en un pH=1, debido a que en este pH se logran observar fácilmente las estructuras del catión flavilio responsable de la estabilidad de las antocianinas; para lo cual la solución tuvo que ser diluida en una relación de 1/20 v/v con agua destilada, con el fin de abarcar el rango espectral entregado por el equipo.
La concentración de la solución de antocianinas se determinó por el método de pH diferencial; el cual resulta bastante útil, ya que la antocianina presenta una transformación debida a los cambios de pH, lo cual se traduce en un cambio llamativo en el nivel de absorbancia. La forma oxomiun predomina a un valor de pH 1, mientras que la forma hemiacetal predomina a valores de pH 4,5. Para ello, se hace relación a la ecuación 1.
Donde Pm es el peso molecular de las antocianinas, FD es el factor de dilución y ε se define como el coeficiente de extinción molar.
A se define como la absortividad y está dada por la ecuación 2 [7].
Donde A max es la lectura del pico más alto a pH=1 y pH=4,5, y A==700 es la lectura de absorbancia a 700 nm.
Los valores utilizados para realizar el cálculo de la concentración en la ecuación 1 fueron: Pm = 449,6 g/L, FD = 180, ε=26 900
La eficiencia se determinó empleando la ecuación 3.
Donde C es la concentración de la solución en
Finalmente, se determinó la concentración Anal de la antocianina empleando la ecuación 4 [12].
Respuesta de las antocianinas al cambio de pH
La respuesta de las antocianinas al cambio de pH fue evaluada empleando la preparación de cuatro medios acuosos con variaciones en su pH (pH=3, 5, 7 y 9), cabe anotar que los demás valores de pH no fueron tomados en cuenta, ya que este es el rango de pH máximo alcanzado por la piel bajo diferentes condiciones.
Los medios con diferentes valores de pH se prepararon mezclando soluciones de hidróxido de (2) sodio (NaOH) al 99 % y ácido clorhídrico (HCl) al 37 % en diferentes proporciones, y posteriormente 2 ml de la solución de antocianina obtenida fueron vertidos en cada uno de los medios preparados y se tomaron espectros de irradiancia absoluta a cada uno, con el objetivo de cuantificar los cambios presentes en las soluciones.
Extracción y preparación de biopolímeros
Los biopolímeros utilizados para la fabricación de las membranas en este estudio fueron: fibroína (Fib), quitosano (Qno), colágeno (Col) y Polivinil Alcohol (PVA); dichos biopolímeros se eligieron por su biocompatibilidad, biodegradabilidad y la capacidad de entrecruzarse y formar películas con propiedades mecánicas adecuadas para aplicaciones biomédicas [8-10]. Para la extracción de la fibroína (F) se dispuso de una porción de capullos de Bombyx Mori fraccionados en trozos de 5 x 5 mm, paralelamente se preparó una solución al 0,2M de carbonato de sodio (Na2CO3), a la cual se agregaron los trozos de capullo de Bombyx Mori en una relación 5:2 p/v, y la mezcla se mantuvo bajo agitación magnética durante 1 hora a 80 °C. Una vez completado el tiempo de reacción, se retiró la Abra cruda resultante del proceso, se eliminó el excedente de agua y se dejó secando durante 48 h a temperatura ambiente; este proceso de secado se realizó para garantizar que no se afecte la concentración de la solución de fibroína por la presencia de humedad [11].
Para la solubilización de la Abra se realizó una solución de cloruro de calcio (CaCl 2 ), agua destilada y etanol (C2H6O) en relación 1:8:2 molar teniendo como base el peso de la fibra, la cual fue sumergida en dicha solución y se mantuvo en agitación magnética a 55 °C hasta solubilizar por completo. La solución obtenida fue Analmente llevada a un proceso de diálisis en una bolsa de celulosa que contenía la solución, la cual se sumergió en agua destilada, esta fue cambiada periódicamente durante 72 h. Finalmente, la caracterización de la fibroína obtenida se realizó por espectroscopía UV, empleando un espectrofotómetro BioTek Synergy H1 Hybrid Multi-Mode Reader. Para la preparación de la solución de quitosano (Qno) se partió de polvo de quitosano comercial (%DD >75 %), se preparó una solución al 1 % de ácido acético (C2H4O2), a la cual se le adicionó el polvo de quitosano en relación 1:100, y se llevó a agitación magnética a temperatura ambiente durante 3 h hasta la solubilización completa del quitosano.
Debido a que el quitosano y la fibroína son polímeros que requieren ser disueltos en medios con pH modificados y el PVA no, se decidió utilizar la solución de antocianinas preparada como el medio acuoso para la preparación del PVA, de esta manera, es posible obtener películas sin modificar la cantidad de agua de estas, la concentración y el color respectivo de las antocianinas empleadas en ellas. Para ello, se preparó una solución al 5 % de PVA partiendo de polvo de PVA 98 % hidrolizado, el cual se disolvió en la solución de antocianinas obtenida y se llevó a agitación magnética por 2 h a una temperatura de 70 °C.
Fabricación de las membranas
Se fabricaron membranas con la combinación de tres de los biopolímeros, mediante la técnica de vapor casting, partiendo de la combinación de los biopolímeros y las proporciones de PVA encontradas en la literatura. Dada la buena respuesta de entrecruzamiento generada entre el quitosano y el PVA [12], elevada fragilidad de la fibroína, esta se mezcló con quitosano y con colágeno para intentar plastificar un poco lo membrana y mejorar las propiedades mecánicas de las mismas.
Quitosano-PVA
La preparación de la solución de quitosano-PVA consistió en mezclar las soluciones obtenidas previamente de quitosano con la de PVA/ antocianinas en relación 70/30 respectivamente por 30 min bajo agitación constante, y posteriormente fue vaciada a una caja Petri y llevada a secado en horno a 30 °C durante 72 h.
Fibroína-Quitosano-PVA
En el proceso de formación de esta matriz con la mezcla de los tres biopolímeros se mantuvo una relación 50/30/20 de las soluciones de fibroína-quitosano-PVA/antocianinas, la cual se mezcló por 30 min bajo agitación constante, y posteriormente fue vaciada a una caja Petri para Analmente secarla en horno a 30 °C durante 72 h.
Fibroína-Colágeno-PVA
El polvo de colágeno se adicionó a la solución de PVA/antocianinas previamente obtenidas, y a dicha mezcla se le adicionó la solución de fibroína, manteniendo una relación de 70/30 fibroína-PVA/ antocianinas/colágeno, la cual se agitó por 30 min y luego se vació en una caja Petri y se llevó a secado en horno a una temperatura de 30 °C durante 48 h.
Evaluación de propiedades de las membranas
Las membranas fueron evaluadas en espesor, flexibilidad, color, capacidad de hinchamiento, solubilidad y respuesta al cambio de color con la variación en el pH.
El espesor de las membranas se midió con un micrómetro analógico marca Mitutoyo Quantu Mike, haciendo mediciones en los extremos y el centro de la membrana, cubriendo así 5 puntos, y se reportó el valor promedio de los datos obtenidos. Para las pruebas de hinchamiento, solubilidad y respuesta al cambio de pH, se preparó una solución de fluido corporal simulado y se ajustó el pH a las condiciones necesarias. Se tomaron muestras de las membranas preparadas con dimensiones de 1 x 1 cm y cada ensayo se realizó por triplicado. La capacidad de hinchamiento de las membranas se determinó sumergiendo cada muestra en agua destilada y se fijó un intervalo de tiempo de 1 h. Transcurrido dicho tiempo se tomó el peso y área a cada una de las muestras, y se repitió el proceso hasta que el peso fue constante y en ese momento, se asumió que su capacidad de hinchamiento llegó al máximo, lo que permite calcular el porcentaje de hinchamiento a partir de la ecuación 5 [13].
Para las pruebas de solubilización, se sumergieron las muestras en una solución de fluido corporal simulado (SBF), cuya cantidad por muestra se calculó mediante la ecuación 6 [14].
El pH de la solución del Fluido Corporal Simulado (SBF) fue ajustado a 7,4 utilizando una Solución Buffer y se sumergieron las membranas para luego llevarlas a incubación por 96 h a 37 °C, con evaluación periódica cada hora a fin de identificar los cambios presentes en ellas como color, forma y tamaño. Por otra parte, la respuesta a los cambios de pH se realizó depositando las muestras en medios con diferentes pH en el rango de 3 a 9, y luego a dichas muestras se les realizó pruebas de irradiancia absoluta, con el fin de cuantificar los cambios de color obtenidos, para lo cual se empleó un espectrómetro USB650 Red Tide (Ocean Optics, Florisa-USA) en conjunto con la interfaz Ocean View con un rango entre 350 - 1000 nm.
Resultados y discusión
Extracción de antocianinas
Según lo arrojado por las ecuaciones 3 y 4, la solución de antocianinas obtenida tiene una concentración de 5 550
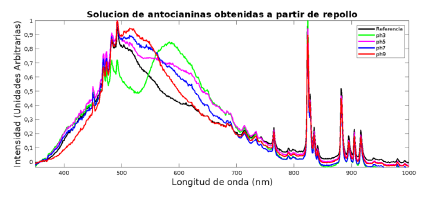
El resultado de la caracterización por Espectroscopía UV de la solución de antocianinas obtenida se muestra en la Figura 1. En ella se puede observar que el máximo de absorbancia se encuentra alrededor de los 520 nm coincidiendo con la longitud de onda característica de las antocianinas, verificando así la presencia de estas en la solución obtenida [15]. La evaluación de respuesta al pH de la solución de antocianinas obtenida se llevó a cabo en los medios preparados, donde fue posible observar tonalidades de color que abarcan desde el rojo hasta tonalidades azules, estos cambios y las pruebas de irradiancia realizadas para cuantificar el color se muestran en la Figura 2. En la figura se observan atenuaciones en el rango del espectro visible (350 - 700 nm) correspondientes a los cambios de color de las antocianinas por acción del pH, donde se evidencia que a pH básicos es mayor la intensidad en el rango de los azules, la cual aumenta a medida que aumenta el pH, mientras que a pH ácidos el pico sobresaliente se encuentra en las longitudes de onda propias de los rojos y se observa una atenuación importante en los tonos verde-azules.
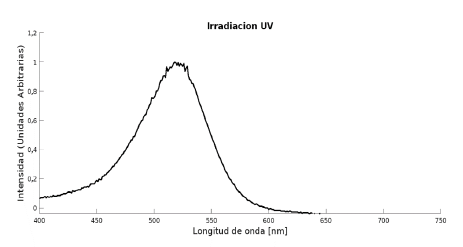
Figura 1 Espectroscopía UV para la solución de antocianinas extraídas de repollo morado (Brassica oleracea).
Evaluación de las membranas
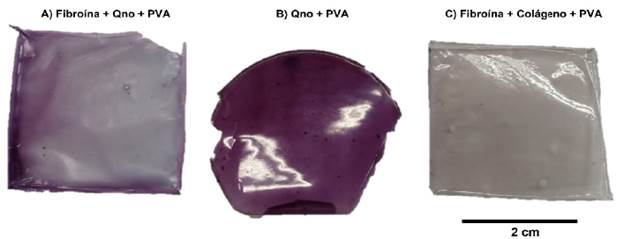
Se logró la fabricación de las membranas con los diferentes biopolímeros mezclados. En la Figura 3 se presentan las membranas obtenidas con dimensiones de aproximadamente 3 cm de lado. En términos de espesor, la membrana compuesta por fibroína-quitosano-PVA (A), fue la que registró el menor espesor (0,3 mm) mientras que la compuesta por quitosano-PVA (B), obtuvo un espesor de 0,5 mm y la de fibroína-colágeno-PVA (C), obtuvo espesor de 0,9 mm; aunque la técnica para preparar las membranas fue la misma, se puede atribuir a la evaporación de los solventes con que fueron disueltos los biopolímeros durante el secado.
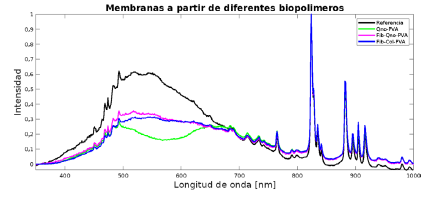
La flexibilidad de las muestras fue variable, obviamente esta propiedad depende del espesor alcanzado. Mientras la membrana de menor espesor fue la más flexible, la de mayor espesor se tornó más rígida, pero ninguna de ellas se tornó quebradiza, evidenciando que el PVA incorporado logró plastificar los compuestos, sobre todo en las membranas que contenían fibroína que se conoce es bastante rígida y requiere de plastificantes. La Figura 3 deja ver claramente la coloración de las membranas, esta se debe a la relación de los biopolímeros empleados. La mayor coloración se observó en la membrana de Qno-PVA (B), ya que esta contiene una mayor cantidad de antocianinas gracias a la composición (Fib-Qno-PVA: 50/30/20, Qno-PVA: 70/30 y Fib-Col-PVA: 70/30), y que esta se ve disminuida en las otras muestras por la adición de fibroína que es el biopolímero principal. Sin embargo, para cuantificar los cambios en coloración, se realizaron pruebas de irradiancia absoluta, cuyos resultados son mostrados en la Figura 4.
De la figura se observa que la membrana de quitosano-PVA presenta una reducción de intensidad en el rango entre 550 - 650 nm que corresponde a las longitudes de onda pertenecientes a los colores amarillo-verde, mientras que en las longitudes de onda alrededor de 700 nm presenta una contribución mayor que las demás membranas, lo que significa que, al ser iluminada con una luz blanca, tiene una buena transmitancia en los tonos azules y rojos y absorbe los colores amarillos y verdes. En los demás casos se hace más difícil observar dicho fenómeno debido a la opacidad generada por la fibroína. Después de evaluar en los diferentes medios de pH cada una de las membranas fabricadas, fue posible verificar que en todos los casos se logró evidenciar el efecto indicador de las antocianinas, tal y como se muestra en la Figura 5.
En las imágenes de las membranas sumergidas en los diferentes pH, se logra observar que hay un evidente cambio de coloración en todos los casos ocasionada por los valores de pH a los que fueron sometidas las membranas, sin embargo, se presentan diferencias de intensidad entre cada tipo de coloración, esto es debido a la cantidad de antocianinas presentes en ellas. Se hace evidente que todas las membranas fabricadas presentan cambios importantes de color al estar inmersas en medios de diferentes pH, esta característica es producida por la adición de antocianinas en la matriz de cada una de ellas. Como era de esperarse, mientras los pH se hacen más ácidos se presenta el proceso batocrómico que hace que las antocianinas muestren un corrimiento hacia el color rojo, mientras que para valores de pH básicos el proceso ocurrido es el hipsocrómico, dándose el corrimiento hacia el azul, acorde con lo reportado por Faraldos y colaboradores [15].
Para intentar cuantificar los cambios de coloración obtenidos en las membranas sumergidas en los diferentes pH, se realizaron pruebas de irradiancia absoluta a cada una de las muestras sometidas a las diferentes soluciones con variación de pH, y los resultados son presentados en la Figura 6. De las curvas presentadas en la Figura 6 es posible observar el cambio en la longitud de onda cuando hay cambio de color en cada una de las membranas expuestas a los diferentes pH. En todos los casos, las lecturas de transmitancia de las membranas que contenían fibroína en su estructura son poco claras, esto se debe a la opacidad obtenida en la membrana con la adición de fibroína, sin embargo, en la que contiene solo quitosano-PVA se logran observar los cambios de intensidad esperados a cada longitud de onda. En la figura de la membrana sometida a pH 3 se puede ver como la curva perteneciente a la muestra de quitosano-PVA presenta poca intensidad en la transmitancia en el rango de longitudes de onda pertenecientes al color verde, pero tiene un pico importante en el rango de las longitudes de onda correspondientes al rojo. Sin embargo, la intensidad de los verdes aumenta a medida que el pH se torna más básico, como se observa en las figuras de las membranas a pH entre 5 y 9, debido a que la membrana va tomando coloraciones hacia el verde, sufriendo un proceso hipsocrómico típico en las antocianinas bajo dichas condiciones de pH.
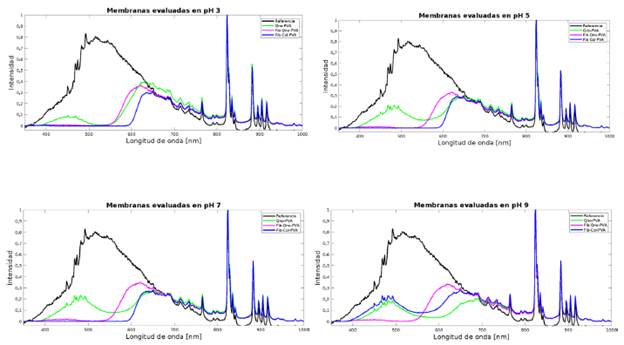
Figura 6 Espectro de irradiancia para las membranas obtenidas a partir de diferentes biopolímeros en pH=3.
La muestra de fibroína-colágeno-PVA no presenta intensidad en la transmitancia en el rango de longitudes de onda para el color verde para pH de 3, 5 y 7, pero cambia significativamente cuando el pH llega a 9 (curva azul), resultado que puede ser atribuido al intenso color obtenido por esta membrana en este valor de pH, como se mostró en la Figura 5, razón por la cual, aunque existe dispersión por las fibras de fibroína es posible observar los picos de irradiancia esperados para este caso. El colágeno parece estar influyendo bastante en este comportamiento, pues para la membrana de fibroína y PVA sin colágeno, no presenta intensidad en la transmitancia en el rango de longitudes de onda del color verde. En tanto que la membrana de quitosano-fibroína PVA fue la que mejor se comportó ante todos los cambios de pH.
Por su parte, los resultados de las pruebas de hinchamiento se presentan en la Tabla 1.
Tabla 1 Porcentaje de hinchamiento de las membranas obtenidas de los biopolímeros.
| Hidrogel | % de hinchamiento |
|---|---|
| Qno-PVA | 262,73 |
| Fib-Col-PVA | 407,14 |
| Fib-Qno-PVA | 107,98 |
De la tabla se puede observar que la muestra que presentó mayor porcentaje de hinchamiento fue la compuesta de fibroína-colágeno-PVA, esto se debe a que el colágeno es altamente hidrofílico y se combina fácilmente con los enlaces de hidrógeno de las moléculas de agua para formar nuevos enlaces, además de esto, tiene la capacidad de formar poros de mayor tamaño en las membranas aumentando así su capacidad de absorción [16]. Mientras que la muestra de fibroína-quitosano-PVA obtuvo el menor porcentaje de hinchamiento debido a que es la que contiene menos cantidad de PVA, que es el agente que otorga la característica de macroporosidad en este tipo de compuestos poliméricos, por lo cual su capacidad absortiva se ve disminuida [17], además, también se podría atribuir a la disminución del entrecruzamiento del quitosano con el PVA por interacción de los enlaces de la fibroína, inhibiendo la capacidad de absorber agua.
Por su parte, todas las muestras presentan porcentajes de hinchamiento aceptables para la aplicación deseada. Cabe anotar que existen dos factores muy importantes al hablar de hinchamiento y capacidad de solubilización en los hidrogeles, los cuales son la hidrofilia de las cadenas poliméricas de la matriz y el grado de entrecruzamiento logrado entre los polímeros.
Es bien sabido que el entrecruzamiento involucra la formación de enlaces covalentes entre las cadenas de los biopolímeros con las moléculas del PVA, dando lugar a una matriz entrecruzada que contiene cadenas distribuidas aleatoriamente, capaz de hincharse aumentando varias veces su peso en seco.
En este caso, al tener la membrana seca (xerogel) las cadenas poliméricas se encuentran sin estirar, pero en presencia de agua las cadenas que conforman la red se estiran y el biomaterial se expande hasta alcanzar el hinchamiento, este es el resultado de un balance entre las fuerzas osmóticas que causan que el disolvente haya penetrado entre las cadenas del polímero hidrofílico y las fuerzas cohesivas existentes entre estas cadenas que oponen resistencia a la expansión
El porcentaje de hinchamiento en cada una de las membranas evaluadas presenta una relación inversa con el grado de entrecruzamiento de éstas, lo que se conoce como efecto Clusters, razón por la cual se puede asegurar que la membrana compuesta por fibroína-colágeno-PVA es la que presenta menor grado de entrecruzamiento [18], ya que a mayor cantidad de agente entrecruzante incorporado en el formulado, mayor es el entrecruzamiento, dando lugar a estructuras más compactas que suelen ser más rígidas y con menor grado de hinchamiento, acorde a lo reportado por García [19].
Por otro lado, la Figura 7 muestra los resultados obtenidos en el proceso de evaluación de la solubilidad de las membranas en fluido corporal simulado (SBF).
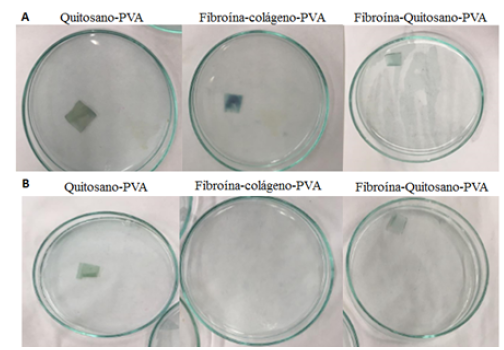
Figura 7 Solubilización de las membranas creadas a partir de diferentes biopolímeros (A: en tiempo cero, B: luego de tres horas de exposición en SBF).
En la figura se puede observar que la muestra de fibroína-colágeno-PVA, es la que menos perdura en el tiempo, ya que luego de 3 h de exposición había perdido su estructura solubilizándose por completo, aunque esta es la membrana que más volumen absorbió y más tiempo demoró en llegar a su estado de máximo hinchamiento (según la Tabla 1), se puede concluir que esta no generó el grado de entrecruzamiento necesario para darle estabilidad en la solución fisiológica.
Por su parte, las membranas de quitosano-PVA y fibroína-quitosano-PVA presentan un tiempo de solubilización mayor al tiempo de exposición al fluido corporal simulado, efecto no encontrado en las muestras de fibroína-colágeno-PVA lo cual se atribuye a que hay un mayor grado de entrecruzamiento del quitosano con el PVA, dado que los enlaces de los grupos amina reaccionaron formando enlaces con los grupos OH- del PVA, tal y como lo reportaron Escobar y Perea [12]. El tiempo de solubilización de las membranas permitiría evaluar este tipo de compuestos para posibles aplicaciones cutáneas como objetivo de realizar este estudio.
El aumento en la velocidad de solubilización de la membrana compuesta de fibroína-colágeno-PVA se debe a que el gran tamaño de poro otorgado por el colágeno, quien hace que la densidad del material sea menor, y las paredes intersticiales del mismo sean mucho más delgadas, por lo cual al entrar en contacto con sales como las del fluido corporal simulado (SBF), estas paredes se logran solubilizar con mayor rapidez.
Conclusiones
Se logró la obtención y caracterización de una solución de antocianinas extraída a partir de repollo morado (brassica oleracea), la cual mostró un buen efecto indicador de pH, a la vez que fue posible embeberla en membranas con diferentes composiciones de biopolímeros. Se logró la fabricación de membranas que presentan características acordes a las deseadas para su posible uso en el tratamiento de heridas cutáneas, los cuales presentan buenas propiedades indicadoras en el rango de pH alcanzado por la piel, adecuados porcentajes de hinchamiento y un tiempo de solubilización superior a las 96 h. Aunque todas las membranas presentaron buen comportamiento antes las evaluaciones realizadas, se podría decir que la compuesta por quitosano, fibroína y PVA sería de gran utilidad para contacto con la piel, no sólo por la biocompatibilidad de sus compuestos sino por el efecto terapéutico de los flavonoides a ella integrados.