Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Medica Colombiana
versão impressa ISSN 0120-2448
Acta Med Colomb v.30 n.1 Bogotá out./dez. 2005
Dr. César A. Restrepo Valencia: Internista Nefrólogo de las Universidades de Caldas y Antioquia, Director Científico del Servicio de Terapia Renal de Caldas, Hospital Santa Sofía, Profesor Asistente de la Universidad de Caldas. Manizales.
Correspondencia a Dr. César A Restrepo V. Servicio de Terapia Renal de Caldas, Dirección: Carrera 28B No. 71-56 Edificio Los Olivos tercer piso. Teléfonos: 8891022 y 8892211, Fax: 8876692. Manizales. E-Mail: carvel@telesat.com.co
Recibido: 09/09/2005 Aceptado: 23/11/2005
Resumen
Objetivos: determinar si en pacientes evaluados por hiperpotasemia en un servicio de nefrología la combinación IECA (inhibidores de enzima convertidora de angiotensina II) o ARA II (antagonistas del receptor de angiotensina II) con espironolactona estaba presente y qué consecuencias tuvo sobre el grupo de pacientes identificados.
Diseño: estudio de tipo observacional, descriptivo retrospectivo y prospectivo.
Lugar: unidad renal STR (Servicio de Terapia Renal) de Caldas, Hospital Santa Sofía, Manizales.
Pacientes o participantes: todos los pacientes interconsultados al STR de Caldas por presentar hiperpotasemia.
Mediciones: se revisaron las historias clínicas de los pacientes interconsultados al STR de Caldas inicialmente retrospectivamente y luego prospectivamente por presentar hiperpotasemia, posteriormente se procedió a descartar aquellos pacientes que presentaran enfermedad renal crónica estadio 4 y 5, a continuación se identificaron aquellos que venían recibiendo la combinación IECA o ARA II con espironolactona, y en ellos se estableció su evolución, complicaciones y factores desencadenantes.
Resultados: 17 pacientes cumplieron con los requisitos exigidos para este trabajo, ocho del sexo masculino y nueve sexo femenino, edad media 65 años, siete presentaban diabetes mellitus y diez eran hipertensos esenciales, en 12 pacientes se encontró enfermedad cardiaca de algún tipo, dos con nefropatia de base (diabética e hipertensiva), tres con enfermedad reumatológica y uno con cirrosis, entre los factores que predisponen a hiperpotasemia se detecto: disminución aguda de la perfusion renal en cinco, infección activa en tres, nefropatía obstructiva aguda en uno, e inicio reciente de un medicamento que afectara la secreción renal de potasio en dos.
Diez pacientes requirieron hospitalización en la unidad de cuidados intensivos, el tiempo promedio de hospitalización fue de siete días, 12 pacientes requirieron hemodiálisis y cinco fallecieron dentro de las primeras 24 horas por shock refractario a terapias vasoconstrictoras e inotrópicas. La utilización concomitante de medicamentos que inhibían el eje renina-angiotensina-aldosterona fue muy frecuente.
Conclusiones: la combinación IECA o ARA II con espironolactona no es segura de utilizar en forma indiscriminada, tiene indicaciones precisas tanto en cardiología como en nefrología; en todo paciente antes que se inicie es imprescindible determinar su función renal, estado de la falla cardiaca, enfermedad de base y medicamentos que recibe. Se debe estar atento a detectar cualquier factor que afecte la perfusion renal o la eliminación renal de potasio, en cuyo caso se debe de ajustar la dosis de estos medicamentos.
Palabras clave: hiperpotasemia, IECA, ARA II, espironolactona.
Abstract
Objectives: To determine if in patients evaluated by hyperkalemia in a nephrology service the combination ACE inhibitors or angiotensin receptor blocker with spironolactone was present and what consequences it had on the group of identified patients.
Design: Study of retrospective, prospective, observational and descriptive type.
Place: Renal Unit STR (Service of Renal Therapy) of Caldas, Hospital Santa Sofia, Manizales.
Population: All the patients interconsulted to the Service of Renal Therapy of Caldas to present hyperkalemia.
Materials: The clinical histories of the patients interconsulted to the STR of Caldas were revised initially retrospectively and then prospectively because they present hyperkalemia, the next step was to proceed to discard those patients that presented illness renal chronic stadium 4 and 5, next the ones that had been receiving the combination ACE inhibitors or angiotensin receptor blocker with spironolactone were identified, their evolution, complications and predisposition factors were established.
Results: 17 patients fulfilled the requirements for this work, 8 males and 9 females, mean age 65 years, 7 presented diabetes mellitus and 10 presented essential hypertension, 12 patients had cardiac illness of some type, 2 with base nephropathy (diabetic and hypertensive), 3 with rheumatologic disease and 1 with cirrhosis, among the factors that predispose to hyperkalemia, the following were detected: sharp decrease of renal perfusion in 5, active infection in 3, sharp obstructive nephropathy in one, and a new medication that affected renal secretion of potassium in two.
Ten patients required hospitalization in the intensive care unit, with an average time of hospitalization of 7 days. 12 patients required hemodialysis and 5 died in the first 24 hours due to refractory shock because of therapies with vasoconstrictors and inotropic drugs. The concomitant use of medications that inhibited the Renin-Angiotensin-Aldosterone axis was very frequent.
Conclusions: The indiscriminate use of the combination of ACE inhibitors or angiotensin receptor blocker with spironolactone is not safe; it has precise indications in cardiology and nephrology; in all patients it is indispensable to determine their renal function, heart failure's state, base illness and medications that they receive, before starting with the treatment. It is necessary to be attentive in detecting any factor that affects the renal perfusion or the renal elimination of potassium, in which case you should adjust the dose of these medications.
Key words:hyperkalemia, ACE inhibitors, angiotensin receptor blocker, spironolactone.
Introducción
Con el ingreso de los inhibidores de la enzima convertidora de angiotensina (IECA) al manejo de la insuficiencia cardiaca, se logró una notable modificación en la sobrevida y tasa de hospitalización de esta población de pacientes (1-3), resultados semejantes se han descrito también con la utilización de antagonistas del receptor AT I de la angiotensina II (ARA II) (4, 5), lo cual refleja la importancia de la activación del eje renina-angiotensina-aldosterona en esta patología. Pero los anteriores fármacos no lograban una completa inhibición del eje, lo cual estimuló a otros grupos de investigadores a introducir nuevas alternativas que obtuvieran un bloqueo más eficiente del sistema, entre ellas está la combinación de IECAS con ARA II (6), y la adición de antagonistas de aldosterona del tipo no se selectivo como la espironolactona o selectivo como el eplerenone (7). Los resultados se reflejaron en el estudio RALES (del inglés randomized aldactone evaluation study) (8), en el cual la combinación de IECA, espironolactona, digital y diurético de ASA generó un menor número de hospitalizaciones y una menor mortalidad que en los pacientes que recibieron placebo, sin que la incidencia de hiperpotasemia fuera estadísticamente diferente.
Pero desde la aparición de este artículo el número de reportes de pacientes atendidos por hiperpotasemia ha sido progresivo (9-18), reflejando el uso indiscriminado de la combinación IECA o ARAII con espironolactona. A este fenómeno no estamos ajenos en Colombia, lo cual me estimuló a revisar inicialmente retrospectivamente y prospectivamente la incidencia de tal complicación en el departamento de Caldas.
Material y métodos
Durante un periodo de 46 meses (octubre de 2001 a Julio de 2005) se identificaron en el Servicio de Terapia Renal de Caldas (Hospital Santa Sofía-Manizales-Caldas-Colombia-Sur América) aquellos pacientes que fueron interconsultados por presentar hiperpotasemia (potasio serico mayor a 5.5 mg/100cc); se excluyeron los pacientes en los cuales se confirmó enfermedad renal crónica estadio 4 y 5 (por ecografía renal, evolución de azoados o biopsia renal) o que no recibieran medicamentos relacionados con el estudio. Se incluyeron por lo tanto pacientes con hiperpotasemia quienes recibieran IECA o ARA II o su combinación asociados con espironolactona, en ellos se determinó en lo posible su edad, sexo, enfermedad de base, enfermedades asociadas, factores que pudieron desencadenar la hiperpotasemia, sitio de hospitalización, dosis de medicamentos recibidos en el momento del diagnóstico, ingesta de otros medicamentos que pudiesen generar hiperpotasemia, tratamiento recibido farmacológico y dialítico, porcentaje de pacientes fallecidos y finalmente la evolución de paraclínicos.
Resultados
Un total de 17 pacientes cumplieron con los requisitos exigidos para formar parte de este estudio observacional y descriptivo, la edad promedio fue 65 años, ocho hombres y nueve mujeres, como enfermedad de base presentaron diabetes mellitus siete pacientes, hipertensión arterial 10 pacientes. Enfermedad asociada identificada: cardiopatía isquémica en cinco, cardiopatía hipertensiva en cuatro, cardiomiopatía dilatada en uno, nefropatía diabética en tres, cor pulmonar en dos, nefropatia obstructiva en uno, artritis reumatoidea en dos, osteoartritis en uno, cirrosis en uno y nefropatiía hipertensiva en uno. Entre los factores que predisponen a desarrollar hiperpotasemia se encontraron síndrome diarreico en cuatro pacientes, infección pulmonar en dos, nefropatía obstructiva aguda en uno, arritmia cardiaca (fibrilación auricular) en uno, infección urinaria en uno, toma reciente de un medicamento que afectara la eliminación de potasio en dos (AINE en uno y ARA II en un paciente que ya recibía IECA); 10 pacientes requirieron hospitalización en la unidad de cuidados intensivos, el tiempo promedio de hospitalización fue de siete días, el medicamento ingerido y la dosis promedia recibida fue para IECA: captopril en ocho pacientes 50 mg por día, enalapril cinco pacientes 26 mg por día, ramipril un paciente 2.5 mg por día; para ARA II: valsartan en dos pacientes 80 mg por día, losartan dos pacientes 50 mg por día, un paciente recibió enalapril asociado a valsartan; para la espironolactona la dosis media recibida en los 17 pacientes fue de 58.8 mg por día.
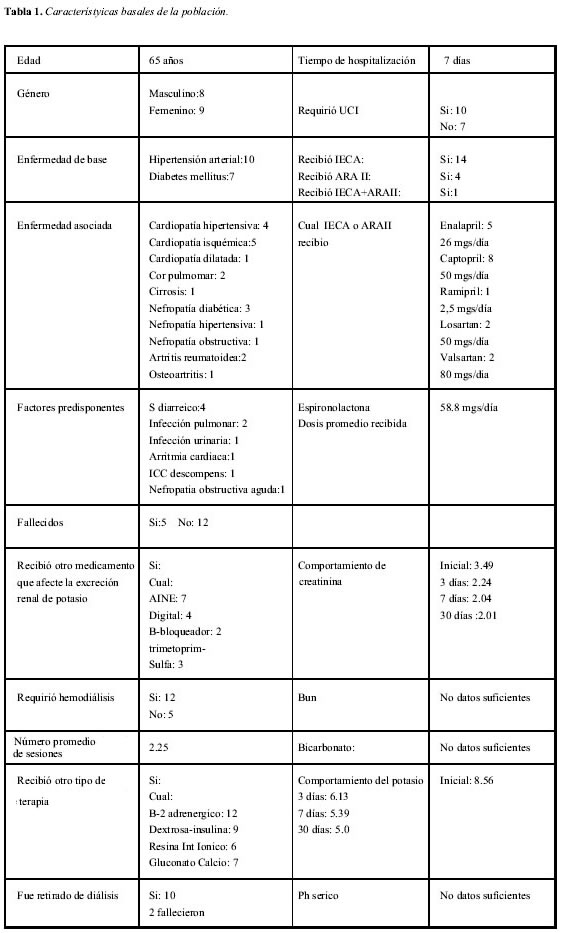
En lo que respecta a otros medicamentos recibidos que pudiesen generar hiperpotasemia se observó que fueron recibidos digital en cuatro, AINES en siete, B-bloqueadores en dos y trimetoprim-sulfa en tres. El tratamiento instaurado en los servicios de hospitalización y urgencias incluyo B2- inhalados en 12 pacientes, gluconato de calcio en siete, resina de intercambio iónico (sulfonato de poliestirene calcico) en seis, infusión de dextrosa-insulina en nueve; 12 pacientes requirieron la práctica de hemodiálisis, el número promedio de sesiones practicada fue de 2.25, 10 pacientes fueron retirados de hemodiálisis y dos pacientes que requirieron hemodiálisis fallecieron. Del total de pacientes identificados cinco fallecieron (29%), todos dentro de las primeras 24 horas de su hospitalización por choque refractario a terapias vasoconstrictoras e inotrópicas. La evolución de los paraclínicos fue posible seguirla adecuadamente sólo para el potasio y la creatinina, no se contó con datos suficientes para determinar la evolución del nitrógeno uréico sanguíneo (BUN) y gases arteriales; la creatinina plasmática inicial fue en promedio de 3.49 mg/100cc, a los tres días 2.24, siete días 2.04 y 30 días 2.01; el potasio inicial fue en promedio 8.56, a los tres días 6.13, siete días 5.39 y 30 días 5.0 (Tabla 1).
Discusión
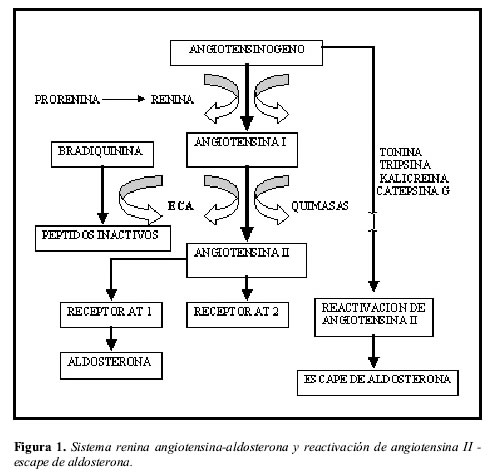
El bloqueo del sistema renina-angiotensina-aldosterona es una herramienta terapéutica importante para el tratamiento de diversas patologías en la cuales este sistema se encuentra activado, entre ellas tenemos a manera de ejemplo la insuficiencia cardiaca, enfermedad renal crónica, nefropatía diabética y proteinuria mayor a 1 gramo (1-8, 19-21). Los IECA por mucho tiempo fueron los medicamentos ideales para tal inhibición, logrando en forma significativa modificar el curso natural de estas enfermedades, pero investigaciones adicionales demostraron que la inhibición lograda por ellos era parcial, y que el organismo lograba la generación de angiotensina II y aldosterona por rutas diferentes a la enzima convertidora de angiotensina, bien sea a partir del angiotensinógeno por los sistemas enzimáticos tonina, tripsina, kalicreína y catepsina G o a partir de la angiotensina I por el sistema enzimático de las quimasas. Este proceso conocido como reactivación de la angiotensina II permite continuar la síntesis de aldosterona (escape de aldosterona) en las glándulas suprarrenales, generando esta última efectos colaterales importantes principalmente a nivel cardiaco independientes de sus efectos renales retenedores de sodio y agua (Figura 1). Un aspecto importante además por resaltar es el hecho de que en algunos tejidos como el corazón humano el principal sistema enzimático involucrado en la síntesis de angiotensina II es el de las quimasas, lo cual le quita fuerza a los IECA como medicamento útil para tratar sus patologías (22-26).
Entre los efectos cardiacos más notorios atribuibles a la aldosterona se cita la estimulación en la síntesis del inhibidor del activador del plasminógeno tisular y del factor de crecimiento transformador B1, aumento en la generación de especies reactivas de oxígeno y en la expresión de receptores AT1, factores promotores de la necrosis y fibrosis miocárdica, lo cual estimuló a obtener un mejor bloqueo del eje con el fin de lograr mayor beneficios terapéuticos. Las maniobras utilizadas para tal fin fueron: 1) el uso de altas dosis de IECA, con las cuales sus resultados fueron dudosos (27, 28), 2) sustituir el IECA por ARA II con la esperanza que el bloqueo del receptor AT1 de la angiotensina II lograra un mayor beneficio, pero hasta la fecha no ha sido posible demostrar que en este aspecto sean mejor los ARA II que los IECA (4), 3) combinar IECA con ARA II obteniéndose el doble beneficio de bloquear el receptor AT1 y aumentar la vida media de la bradiquinina la cual es degradada por la enzima convertidora de angiotensina (ECA), combinación que ha logrado beneficios terapéuticos como lo demuestra un reciente meta análisis en pacientes con insuficiencia cardiaca en la cual logran disminuir la morbi-mortalidad, y en pacientes con nefropatías en las que logran reducir la proteinuria y la curva de caída de la tasa de filtración glomerular (29, 30), 4) evitar los efectos de la aldosterona por inhibición competitiva de su receptor con antagonistas no selectivos como la espironolactona o selectivos como el eplerenone, acción terapéutica que demostró beneficios al disminuir la morbi-mortalidad cardiovascular y reducir la proteinuria en pacientes con síndrome nefrótico (7, 8, 19-21).
Pero la inhibición del sistema renina-angiotensina-aldosterona no es carente de efectos colaterales, y si bien la incidencia reportada de hiperpotasemia en los estudios iniciales en la cual se utilizó la combinación IECA con espironolactona o con eplerenone fue muy baja, ello fue el resultado de seleccionar muy bien la población por tratar, eligiéndose aquéllos con falla cardiaca clase III y IV (NYHA) y excluyéndose pacientes que tuviesen una creatinina plasmática mayor a 2.5 mg/100cc, potasio sérico mayor a 5 meq/litro, evitando los suplementos de potasio oral y continuando con la toma diaria del diurético de ASA el cual genera importantes pérdidas renales de potasio (8).
Infortunadamente y como lo demuestra un número importante de publicaciones (9-18) los médicos después del reporte del estudio RALES se lanzaron a la formulación indiscriminada de la combinación de IECA o ARA II con espironolactona principalmente en pacientes con insuficiencia cardiaca sin tener en cuenta su función ventricular izquierda, estado de la falla cardiaca y función renal de base, factores importantes que podrían presentar los pacientes, y que en alguna forma pudiesen alterar la excreción renal del potasio.
En el actual trabajo se reafirman tales conceptos y se resalta la importancia de estar alerta ante la presencia de cualquier factor que pueda afectar la filtración glomerular o inhibir adicionalmente el sistema renina-angiotensina-aldosterona, o alterar la secreción tubular de potasio. Se puede concluir con base en este trabajo que la población de alto riesgo para desarrollar hiperpotasemia por el consumo de IECA o ARA II con espironolactona son los pacientes ancianos, diabéticos con o sin compromiso renal, enfermedades asociadas como insuficiencia cardiaca severa con muy baja fracción de eyección, arritmias cardiacas, EPOC (enfermedad pulmonar obstructiva crónica) , cirrosis , deshidratación e inestabilidad hemodinámica de cualquier clase, las cuales afectan la perfusion renal, bronquitis aguda e infección urinaria principalmente tratadas con trimetoprim sulfa (medicamento retenedor de potasio), enfermedades reumáticas asociadas al consumo de AINES, medicamentos con efectos colaterales cardiacos y renales. También se debe de estar alerta cuando se adicione un medicamento del cual en ocasiones nos olvidamos que pueda inhibir la secreción de renina como los B-bloqueadores o inhibir la bomba de Na,K ATP-asa necesaria para lograr el ingreso de potasio al intracelular con disminución de sus niveles séricos (ejemplo: digital). Aunque es obvio, no sobra anotar el evaluar siempre la función ventricular izquierda, estado de la falla cardiaca (la espironolactona sólo está recomendada por la ACC/AHA en pacientes con estado C de falla cardiaca) (31) y función renal de todo paciente que vaya a recibir la combinación o que la esté recibiendo, y descontinuar o evitar su uso si la tasa de filtración glomerular es menor a 60 ml/minuto (creatinina plasmática mayor de 2 mg/100cc, aunque su valor no siempre es un exacto indicador de la tasa de filtración glomerular principalmente en ancianos e individuos con baja masa muscular), iniciar el tratamiento siempre con bajas dosis (12.5 mg), sin superar la dosis de 50 mg por día, evitar la triple combinación IECA- ARA II- espironolactona, suplementos de potasio y monitorizar los niveles de potasio sericos y azoados a los tres y siete días de su inicio y posteriormente cada mes por lo menos los tres primeros meses.
Agradecimientos
A todo el personal que labora en la unidad renal del Servicio de Terapia Renal de Caldas, quienes colaboraron en la obtención y revisión de las historias clínicas.
Referencias
1. The SOLVD Investigators. Effect of enalapril on mortality and the development of heart failure in asymptomatic patients with reduced left ventricular ejection fractions. N Engl J Med 1992; 327: 685. [ Links ]
2. The SOLVD Investigators. Effect of enalapril on survival in patients with reduced left ventricular fractions and congestive heart failure. N Engl J Med 1991; 325: 293. [ Links ]
3. The CONSENSUS Trial Study Group. Effect of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med 1987; 316: 1429. [ Links ]
4. Pitt B, Poole W, Segal R. Effect of losartan compared with captopril on mortality in patients with symptomatic heart failure: randomized trial- the Losartan Heart Failure Survival Study ELITE II. Lancet 2000; 355:1582. [ Links ]
5. Jong P, Demers C, McKelvie RS and Liu PP. Angiotensin receptor blocker in heart failure: Meta-analysis of randomized controlled trials. J Am Coll Cardiol 2002; 39:463. [ Links ]
6. Carson PE. Rationale for the use of combination angiotensin-converting enzyme inhibitor / angiotensin II receptor blocker Therapy in Heart failure. Am Heart J 2000; 140:361-6. [ Links ]
7. Pitt B, Remme W, Zannad F, Neaton J, Martinez F, Roniker B et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003; 348: 1309-132. [ Links ]
8. Pitt B, Zannad F, Remme WJ, Cody R, Castaigne A, Perez A, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. N Engl J Med 1999;341:709-17. [ Links ]
9. Cruz CS, Cruz AA and Marcílio de Souza CA. Hyperkalemia in congestive Heart failure patients using ACE inhibitors and spironolactone. Nephrol Dial Transplant 2003; 18: 1814-1819. [ Links ]
10. Svensson M, Gustafsson F, Galatius S, Hildebrandt PR and Atar D. Hyperkalaemia and impaired renal function in patients taking spironolactone for congestive heart failure: retrospective study. BMJ 2003;327:1141-2. [ Links ]
11. Wrenger E, Müller R, Moesenthin M, Welte T, Frölich JC and Neumann KH. Interaction of spironolactone with ACE inhibitors or angiotensin receptor blockers: analysis of 44 cases. BMJ 2003;327:147-9. [ Links ]
12. Anton C, Cox AR, Watson RDS and Ferner RE. The safety of spironolactone treatment in patients with heart failure. J Clin Pharm Ther 2003 28, 285-287. [ Links ]
13. Berry C, McMurray JJV. Serious adverse events experienced by patients with chronic heart failure taking spironolactone. Heart 2001;85:e8. [ Links ]
14. Schepkens H, Vanholder R, Billiouw JM and Lameire N. Life-threatening Hyperkalemia during Combined Therapy with Angiotensin-converting Enzyme Inhibitors and Spironolactone: An Analysis of 25 Cases. Am J Med 2001; 110:438-441. [ Links ]
15. Jourlink DN, Mamdani MM, Lee DS, Kopp A, Austin PC, Laupacis A and Redelmeir DA. Rates of Hyperkalemia after publication of the Randomized Aldactone Evaluation Study. N Engl J Med 2004; 351:543-51. [ Links ]
16. Bozkurt B, Agoston I and Knowlton AA. Complications of Inappropriate Use of Spironolactone in Heart Failure: When an Old Medicine Spirals Out of New Guidelines. J Am Coll Cardiol 2003; 41:211-4. [ Links ]
17. Vanpee D, Swine CH. Elderly heart failure patients with drug-induced serious hiperkalemia. Aging (Milano). 2000; 12:315-9.1. [ Links ]
18. Svensson M, Gustafsson F, Galatius S, Hildebrandt PR and Atar D. How prevalent is hyperkalemia and renal dysfunction during treatment with spironolactone in patients with congestive heart failure. J Cardiac Fail 2004; 10: 297-303. [ Links ]
19. Rachmani R, Slavachevsky I, Amit M, Levi Z, Kedar Y, Berla M and Ravid M. The effect of spironolactone, cilazapril and their combination on albuminuria in patients with hypertensión and diabetic nephropathy is independent of blood pressure reduction: a randomized controlled study. Diabet Med 2004; 21: 471-475. [ Links ]
20. Rossing K, Schjoedt KJ, Smidt U, Boomsma F and Parving HH. Beneficial effects of adding spironolactone to recommended antihypertensive treatment in diabetic nephropathy. Diabetes Care 2005; 28: 2106-2112. [ Links ]
21. Nitta K, Uchida K and Niheri H. Spironolactone and angiotensin receptor blocker in nondiabetic renal diseases. Am J Med 2004; 117: 444-445 [ Links ]
22. Hollenberg NK, Fisher NDL and Price DA. Pathways for Angiotensin II Generation in Intact Human Tissue. Evidence from Comparative Pharmacological Interruption of the Renin System. Hypertension 1998; 32:387-392. [ Links ])
23. Akasu M, Urata H, Kinoshita A, Sasaguri M, Ideishi M and Arakawa K. Differences in Tissue Angiotensin II-Forming Pathways by Species and Organs In Vitro. Hypertension 1998; 32:514-520. [ Links ]
24. Kokkonen JO, Lindstedt KA and Kovanen PT. Role for Chymase in Heart Failure. Angiotensin II-Dependent or Independent Mechanisms?. Circulation 2003;107:2522-2524. [ Links ]
25. MacFadyen RJ, Lee AFC, Morton JJ, Pringle SD and Struthers AD. How often are angiotensin II and aldosterone concentrations raised during chronic ACE inhibitor treatment in cardiac failure? Heart 1999; 82:57-61. [ Links ]
26. Juillerat L, Nussberger Jür, Ménard J, Mooser V, Christen Y, Waeber B, Graf P and Brunner HR. Determinants of Angiotensin II Generation During Converting Enzyme Inhibition. Hypertension 1990:16:564-572. [ Links ]
27. Delahaye F and de Gevigney G. Is the optimal dose of angiotensin-converting enzyme inhibitors in patients with congestive heart failure definitely established?. J Am Coll Cardiol 2000; 36: 2096. [ Links ]
28. Packer M, Poole-Wilson PA, Armstrong PW. Comparative effects of low and high doses of angiotensin-converting enzyme inhibitor, lisinopril, on morbidity and mortality in chronic heart failure. Circulation 1999; 100:2312. [ Links ]
29. Dimopoulos K, Salukhe TV, Coats AJS, Mayet J, Piepoli M and Francis DP. Meta-analyses of mortality and morbidity effects of an angiotensin receptor blocker in patients with chronic heart failure already receiving an ACE inhibitor (alone or with a B-blocker). International Journal of Cardiology 2004, 93: 105-111. [ Links ]
30. Wolf G and Ritz E. Combination therapy with ACE inhibitors and angiotensin II receptor blockers to halt progression of chronic renal disease: pathophysiology and indications. Kidney Int 2005; 67: 799-812. [ Links ]
31. Hunt SA, Abraham WT, Chin NH, Feldman AM, Francisli S, et al. ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult. 2005. [ Links ]














