Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Medica Colombiana
versão impressa ISSN 0120-2448
Acta Med Colomb v.31 n.3 Bogotá jul./set. 2006
Jorge Ernesto Andrés Díaz Ruiz: Coordinador Médico, Servicio de Terapia Renal, Hospital Universitario Clínica San Rafael, Bogotá D.C.
Correspondencia: Dr. Jorge de Jesús Cantillo Turbay, Calle 114 A No 56-34 AP 601, Telefax: (57)-1-2535019, Bogotá D.C., Colombia E-mail: md_cantillo@yahoo.com y md_cantillo@hotmail.com
Recibido: 12/07/06 Aprobado: 06/09/06
Resumen
La artritis reumatoide (AR) es una enfermedad inflamatoria crónica de etiología desconocida caracterizada, ante todo, por poliartritis simétrica. Aunque la AR es definida frecuentemente por la presencia de complejos inmunes circulantes y factores reumatoides, el compromiso renal no es reconocido comúnmente. Dos categorías claras de desórdenes renales pueden ser distinguidos en AR: lesiones que ocurren como resultado de efectos secundarios de agentes terapéuticos y lesiones causadas por la enfermedad per se. Lesiones renales clínicamente relevantes en AR no son comunes. Más a menudo, el compromiso renal está relacionado con complicaciones de la terapia que con la enfermedad en sí misma. Las formas más frecuentes de enfermedad renal primaria en AR son la glomerulopatía membranosa (GM) y la glomerulonefritis proliferativa mesangial pura. Informamos el caso de un hombre de 40 años con antecedente de AR que desarrolló síndrome nefrótico (SN) y nefritis intersticial aguda en presencia de una GM.
Palabras clave: artritis reumatoide, glomerulopatía membranosa, síndrome nefrótico.
Abstract
Rheumatoid arthritis (RA) is a chronic inflammatory disease of unknown etiology characterized primarily by symmetric polyarthritis. Although RA is often characterized by the presence of rheumatoid factors and circulating immune complexes, renal involvement is not commonly recognized. Two broad categories of renal disorders can be distinguished in RA: lesions occurring as a result of side-effects of therapeutic agents and lesions caused by the disease itself. Clinically relevant renal lesions in RA are not common. More often renal involvement is related to complications of therapy than the disease itself. The most common forms of primary renal disease in RA are Membranous Glomerulopathy (MG) and a pure mesangial proliferative glomerulonephritis. This article reports the case of a 40 year old man who developed Nephrotic Syndrome and interstitial nephritis in presence of a Membranous Glomerulopathy.
Key words: rheumatoid arthritis, membranous glomerulopathy, nephrotic syndrome.
Introducción
La AR es una enfermedad inflamatoria crónica de carácter sistémico y de etiología desconocida que afecta principalmente a las articulaciones, pero que también puede conducir a manifestaciones orgánicas extraarticulares. El compromiso renal no es frecuente, pero el empeoramiento de la función renal es generalmente leve; la falla renal terminal es considerada inusual. Sin embargo, en la mayoría de los estudios, los pacientes con AR tienen una alta tasa de mortalidad, la cual ha sido atribuida a falla renal causada por amiloidosis y nefritis crónica (1).
Es difícil determinar si una nefropatía en pacientes con AR es causada por la enfermedad subyacente y sus complicaciones o por medicación nefrotóxica. Cualquier terapia que implique el uso de drogas antirreumáticas modificadoras de la enfermedad, puede causar una GM, lo cual a su vez, puede causar proteinuria patológica (2). El tratamiento con drogas antiinflamatorias no esteroideas (AINE) puede producir nefritis intersticial, mientras que la mezcla de analgésicos puede llevar a nefropatía por analgésicos (3). La amiloidosis sistémica es la causa más frecuente de proteinuria nefrótica y falla renal en pacientes con AR. La vasculitis reumatoide como una complicación de la AR puede también conducir a falla renal (4, 5). Si la glomerulonefritis reumatoide en AR representa una entidad separada es aún materia de controversia (6). Informes recientes describen pacientes con AR quienes no recibieron oro, ni penicilamina pero aún así, desarrollaron una glomerulonefritis (7, 8). La incidencia de nefropatía en pacientes con AR es desconocida, aunque los pacientes con AR frecuentemente muestran disfunción renal subclínica (9, 10). Reportamos el caso de un paciente con antecedente de AR quien fue admitido por SN.
El caso
Hombre de 40 años de edad quien desde una semana previa a su admisión aqueja edema de extremidades inferiores y posteriormente palpebrales, cuatro días antes del ingreso dolor en pierna derecha y eritema, fiebre y disminución de volúmenes urinarios.
Antecedentes
Artritis reumatoide de 20 años de evolución. Farmacológicos: metotrexate, prednisona y ácido fólico. Hospitalización previa: erisipela en miembro inferior derecho.
Examen físico
Regulares condiciones generales, alerta, afebril, sin signos de dificultad respiratoria, mucosa oral semiseca. T°C: 36.4°C, FC: 68 x min, FR: 18 x min., TA: 158/98 mmHg. No ingurgitación yugular a 30. Conjuntivas normocrómicas. Cardiopulmonar: normal. Abdomen: panículo adiposo aumentado. Edema GII de miembros inferiores. Eritema confluente no pruriginoso de cara anterior y lateral de pierna derecha asociado a rubor, calor y dolor. Sinovitis residual en manos y muñecas en forma simétrica.
Estudios paraclínicos
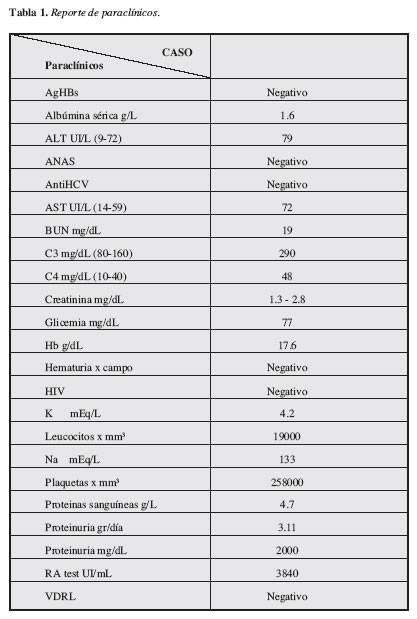
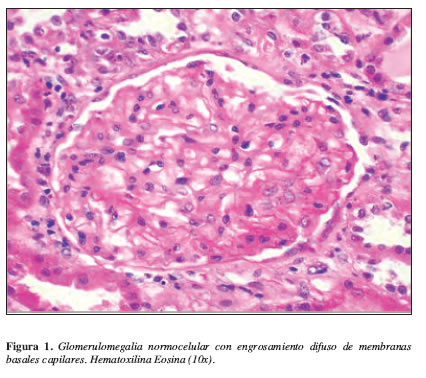
La Tabla 1 resume la química sanguínea general. Ecografía renal: aumento de la ecogenicidad, tamaño y relación corticomedular conservados. Con diagnósticos de trabajo de síndrome nefrótico, artritis reumatoide y erisipela del miembro inferior derecho, se inicia tratamiento intrahospitalario con oxacilina 4 g i.v/día, furosemida 80 mg/día y enalapril 40 mg/día. Evoluciona clínicamente hacia la mejoría con reducción importante de los signos inflamatorios en la pierna derecha y de los edemas periféricos. El informe del estudio anatomopatológico del espécimen renal evidenció: número de glomérulos: 23, esclerosis global: 0, esclerosis segmentaria: 0; membranas basales capilares (MBC): rngrosamiento ++, proyecciones espiculares +, amiloide: no (rojo congo-negativo); túbulo-intersticio: nefritis intersticial: ++mononuclear, polimorfonuclear, con presencia focal de eosinófilos. Inmunofluorescencia: IgG +++ en MBC, C3 +++ en MBC. Estudio ultraestructural: ligero engrosamiento de la MBC, presencia de numerosos depósitos de complejos inmunes de localización subepitelial. Llama la atención que algunos depósitos son de tamaño muy grande dejando las jorobas identificadas en las glomerulonefritis posinfecciosa (Figuras 1 y 2).
Análisis
Hombre de 40 años con antecedente de artritis reumatoide, síndrome nefrótico, glomerulopatía membranosa y erisipela que responde adecuadamente al tratamiento antibiótico. Se ofrece tratamiento ambulatorio con inhibidores de la ECA, diuréticos, prednisolona, metotrexate, cefalosporinas orales, restricción hidrosalina y profilaxis tromboembólica.
Evolución
Veinte días después del egreso hay reaparición de edemas periféricos y se decide dar un ciclo corto de esteroides a dosis altas (80 mg/día). Ocho días después requiere nueva hospitalización por aparición de signos de erisipela en el miembro inferior izquierdo y persistencia de edemas periféricos. Se ordena suspensión de metotrexate y dosis decrecientes de glucocorticoides. Ante la persistencia y reaparición de edemas periféricos, se replantea el tratamiento inmunosupresor para dejarlo con glucocorticoi des+clorambucilo (ciclos cortos alternantes) que inició un mes después de este segundo egreso. Tres semanas después de iniciar primer ciclo de clorambucilo persistía con importantes edemas de genitales y extremidades inferiores, hipoalbuminémico y proteinurias nefróticas (síndrome nefrótico persistente). Una semana más tarde es nuevamente hospitalizado por deterioro de su clase funcional, sepsis severa (sepsis de tejidos blandos y bacteremia por Gram negativos), shock distributivo, agudización de su falla renal y falla orgánica múltiple. Es trasladado a la UCI donde posteriormente fallece.
Discusión
Este es el primer caso de AR y GM asociada que se publica en Colombia. La incidencia de glomerulonefritis (GN) en AR es desconocida, pero los datos disponibles sugieren una incidencia más alta que en la población general (11).
La edad del paciente es concordante con la población afecta por AR, ya que el 80% de todos los pacientes contrae la enfermedad entre los 35 y los 50 años de edad (12, 13).
En cuanto al sexo, las mujeres se afectan aproximadamente con una frecuencia tres veces superior a la de los varones (12, 13).
Teniendo en cuenta que el paciente se presenta con proteinuria nefrótica, hipoalbuminemia y edemas (síndrome nefrótico), estas manifestaciones corresponden a la consecuencia clínica del aumento de la permeabilidad de la pared capilar glomerular (células endoteliales, la membrana basal glomerular y las células epiteliales viscerales) y la consiguiente pérdida de proteínas por orina. El resto de las alteraciones que se describen en el SN son consecuencia directa de esta proteinuria masiva. Es, por tanto, una manifestación de enfermedad glomerular renal (14).
La hipertensión arterial no es un rasgo común de la GM. Se ha descrito hasta en un 30% de los casos, y se asocia frecuentemente a grados variables de insuficiencia renal (15). Los factores predisponentes a la hipertensión arterial no se conocen con claridad, pudiendo estar relacionados con la retención de sodio y agua, o con la pérdida urinaria de sustancias antihipertensivas (14).
El paciente en mención presentó oliguria y elevación de la creatinina sérica desde 1.3 mg/dL a 2.8 mg/dL en cuatro días, desde el momento de su admisión. Estos hallazgos suelen ser la expresión de un fracaso renal agudo, que en el contexto del caso en discusión, podría tener como etiología, a la nefritis intersticial aguda o a la hipersensibilidad medicamentosa, porque la falla renal aguda no es un evento frecuente en el SN por GM. Cuando un paciente con GM desarrolla un compromiso agudo de la función renal, otras posibilidades etiológicas incluyen: la trombosis aguda de la vena renal, la superposición de glomerulonefritis extracapilar y la hipovolemia grave secundaria al SN (15).
En la evaluación clínica inicial se debe intentar filiar la causa del SN para poder iniciar un tratamiento específico, porque cuanto más tiempo se prolongue el SN, mayores son las posibilidades de que haya complicaciones derivadas del mismo. También se pretende conocer la gravedad y las repercusiones del SN con el propósito de poder abordarlas en forma efectiva. Si tras la evaluación inicial no se descubre la causa del SN, estaría indicada la biopsia renal, por las implicaciones tanto pronósticas como terapéuticas que representa. En nuestro caso, el paciente tenía antecedente de una enfermedad sistémica (AR) y concomitantemente presentaba signos de enfermedad glomerular, de este modo, la indicación (biopsia renal) para la valoración de la afectación renal estaba plenamente justificada (14, 16).
Las enfermedades glomerulares son un grupo heterogéneo de entidades. La mayoría de las GN primarias son de origen inmunológico. Sin embargo, es más frecuente el daño glomerular secundario, en el seno de una enfermedad sistémica, como la diabetes o la hipertensión (17).
La GM es una enfermedad glomerular mediada inmunológicamente, y su nombre deriva de los hallazgos histológicos en la microscopía óptica, que consisten en el engrosamiento difuso de la pared capilar glomerular, con escasa o nula proliferación y/o infiltración celular. La microscopía electrónica revela la presencia de depósitos densoelectrónicos a nivel subepitelial de la membrana basal glomerular (MBG), y la naturaleza inmune de estos depósitos es confirmada por la inmunofluorescencia que revela la presencia predominante de IgG y complemento (15).
La inmunidad desempeña un papel fundamental en el desencadenamiento de muchos tipos de lesiones glomerulares (17).
Se han detectado depósitos locales de anticuerpos en varias GN y se ha comprobado que la transferencia pasiva de anticuerpos desencadena la lesión glomerular. Multitud de antígenos pueden causar una respuesta inmune nefritogénica (17).
Los anticuerpos pueden reaccionar con antígenos fijos de la matriz extracelular o de las células glomerulares. Los anticuerpos causantes de la GM experimental de Heymann se unen a una proteína de la membrana del podocito (gp 330, megalina) y el inmunocomplejo resultante se deposita en el exterior de la célula. Los anticuerpos frente a antígenos intrínsecos del glomérulo pueden ocasionar daño renal por interferencia con la función del antígeno (por ejemplo, activación o antagonismo de receptores) o por fijación de complemento que active la liberación de mediadores de la inflamación o la muerte celular (17).
La activación del complemento a nivel subepitelial parece desempeñar un papel en las alteraciones de la permeabilidad y selectividad glomerular. Sin embargo, los valores séricos de C3 y otros componentes del complemento son casi siempre normales, y la presencia de hipocomplementemia debe sugerir algún tipo de GM secundaria. Alternativamente, se podría conocer la actividad inmunológica en la biopsia renal, mediante la detección de C3c, fragmento que deriva del componente activo del complemento C3b (15).
Tanto en la GM primaria como en la secundaria se produce activación del complemento a nivel subepitelial y ello parece estar más relacionado con la aparición de proteinuria, que con el desarrollo de la lesión morfológica. En la nefritis de Heymann se ha observado que la proteinuria es dependiente del complemento, y atribuible del complejo de ataque de membrana (C5b-C9). Pese a que en esta glomerulopatía se produce activación del sistema del complemento y se generan componentes quimiotácticos, no se observa infiltrado celular inflamatorio. La activación del sistema del complemento por fuera de la pared del capilar glomerular, por una parte, y el flujo unidireccional que ocurre a este nivel, por otra, impiden que la generación de componentes quimiotácticos a nivel subepitelial puedan ingresar al torrente circulatorio y puedan generar una respuesta inflamatoria (15). El daño glomerular mediado por C5b-C9 induce una proteinuria no selectiva a través de la pérdida de la barrera de tamaño y de carga selectiva de la pared capilar glomerular (15).
Hay varios factores que condicionan una elevada susceptibilidad a las infecciones en los pacientes nefróticos, incluyendo déficit de IgG (por disminución de su síntesis y aumento de las pérdidas por filtración y catabolismo renales ), opsonización inadecuada por disminución en el factor B del complemento, así como trastornos en la inmunidad celular favorecidos por el déficit de vitamina D, la malnutrición y las carencias de transferrina y zinc, ambos esenciales para la adecuada función linfocitaria (14).
La GM habitualmente es idiopática (62% a 86% en diferentes series) y podría representar la presencia de autoanticuerpos contra antígenos presentes en la célula epitelial glomerular. También puede ser inducida por una serie de causas identificables y/o estar asociada con otras afecciones (por ejemplo, AR) (15).
La incidencia de cualquier tipo de anormalidad renal en AR no es conocida precisamente y depende, en parte, de la población de pacientes estudiada y de las fuentes de datos. Por ejemplo, la mayoría de los reportes de compromiso glomerular son derivados de estudios y registros de biopsias, de este modo enfatiza un tipo de lesión sin necesariamente indicar el grupo de pacientes con AR que fueron seleccionados para biopsia. Alternativamente, no es conocido si hallazgos patológicos renales significantes puedan ser clínicamente silentes o triviales, así posiblemente haciendo estudios clínicos no representativos o subestimando la verdadera frecuencia de cualquier daño renal. Sin embargo, más de 50% de pacientes con AR, independiente del tratamiento, son estimados a tener compromiso renal en la forma ya sea de hallazgos urinarios anormales y/o filtración glomerular disminuida (18).
En pacientes con AR, la incidencia de GM puede alcanzar hasta un 7% cuando son tratados con penicilamina, y hasta un 3%, en aquellos tratados con oro parenteral. En ausencia de dichas drogas, la GM también ocurre con mayor frecuencia en estos pacientes (15).
En la terapia no específica de la GM, una de las medidas empleadas para la prevención secundaria de progresión de la enfermedad en todos los pacientes, es el control de la hipertensión arterial y de la proteinuria. El uso de fármacos que disminuyan tanto la hipertensión sistémica, como intraglomerular, son de particular importancia (inhibidores de la enzima convertidora de angiotensina-IECA o antagonistas del receptor de angiotensina II-ARA II). Estos agentes reducen la proteinuria independiente de sus efectos sobre la reducción de la presión arterial. Su efecto benéfico es causado al evitar las acciones de la angiotensina II sobre el glomérulo. A nivel vascular, relajan la arteriola eferente, produciendo una disminución de la presión intraglomerular, con el consecuente beneficio sobre el endotelio y la barrera de filtración, disminuyendo el paso de macromoléculas a través de ésta. A nivel tisular se evitan los efectos proliferativos asociados al estímulo del receptor AT I, evitando a largo plazo la fibrosis glomerular e intersticial y disminuyendo así la progresión de la enfermedad renal (15).
La combinación de datos clínicos y morfológicos ayuda a determinar el pronóstico y la posible respuesta al tratamiento. Para el caso que nos compete, había datos que indicaban mal pronóstico: la presencia de proteinuria persistente, la elevación de la creatinina sérica y el compromiso túbulo-intersticial en el momento del diagnóstico son los factores predictivos más significativos. El sexo masculino y la presencia de hipertensión arterial también tienen significado pronóstico (19).
Tal vez ninguna otra entidad en Nefrología ha despertado tanta controversia desde el punto de vista terapéutico como la GM; se ha observado, por ejemplo, que la historia natural de la GM idiopática no tratada es muy variable. En adultos, la frecuencia de remisión espontánea completa es variable según las diferentes series, pero, en promedio, es de un 25%. Se observa remisión parcial (proteinuria < 2,0 g/día, con función renal estable en el tiempo) en un 20%-35%. La incidencia de insuficiencia renal crónica terminal alcanza aproximadamente un 14% a los cinco años y un 35% a los 10 años (15).
Debido al evidente protagonismo del sistema inmunológico en la patogénesis de la GM, las medicaciones inmunosupresoras hacen parte integral en el tratamiento de esta entidad; sin embargo, las indicaciones y agentes por utilizar no están del todo definidos. Dado el variable curso clínico de la entidad, no se recomienda ofrecer tratamiento inmunosupresor a todos los pacientes afectados. Debido a los potenciales efectos colaterales de la terapia inmunosupresora, el tratamiento solamente está indicado en los pacientes que desde el punto de vista epidemiológico tengan un riesgo alto, o que durante el seguimiento demuestren progresión de la insuficiencia renal (15).
Extrapolando datos obtenidos en pacientes con SN secundario a GM idiopática y teniendo en cuenta que nuestro paciente tenía varios factores de mal pronóstico y por sugerencia (vía e-mail) del Dr. Claudio Ponticelli (una de las autoridades en el tema), decidimos adicionar clorambucilo como tratamiento específico de la enfermedad (20- 22).
En conclusión, en ausencia de una historia farmacológica relevante, la GM puede representar una forma distinta de nefropatía primaria relacionada a AR.
Agradecimientos
Por la toma y facilitación de microfografías de los especímenes renales (estudios de Microscopía Óptica) al Dr. Rafael E. Andrade P. M.D., Jefe del Departamento de Patología y Laboratorios del Hospital Universitario Fundación Santa Fe de Bogotá, Colombia.
Referencias
1. Myllykangas-Luosujärvi RA, Aho K., Isomäki HA. Mortality in rheumatoid arthritis. Semin Arthritis Rheum 1995; 25: 193-202. [ Links ]
2. Glassock R.J. Secondary membranous glomerulonephritis. Nephrol Dial Transplant 1992; 7(suppl. 1): 64-71. [ Links ]
3. Kleinknecht D. Interstitial nephritis, the nephrotic syndrome, and chronic renal failure secondary to nonsteroidal anti-inflammatory drugs. Semin Nephrol 1995; 15: 228-35. [ Links ]
4. Boers M, Croonen AM, Dijkmans BA, Breedveld FC, Eulderink F, Cats A, et al. Renal findings in rheumatoid arthritis : clinical aspects of 132 necropsies. Ann Rheum Dis 1987; 46: 658-63. [ Links ]
5. Harper S, Cockwell P, Howie AJ, Michael J, Richards NT, Savage CO, et al. Focal segmental necrotizing glomerulonephritis in rheumatoid arthritis. QJM 1997; 20; 125-32. [ Links ]
6. Albert FW. Gibt es eine rheumatoide Glomerulonephritis? Nieren Hochdruck 1990; 12: 536-8. [ Links ]
7. Adu D, Berisa F, Howie AJ, Emery P, Bacon PA, McConkey B, et al. Glomerulonephritis in rheumatoid arthritis. Br J Rheumatol 1993; 32: 1008-11. [ Links ]
8. Pollet S, Depner T, Moore P, Olander H, Robbins D. Mesangial glomerulopathy and IgM rheumatoid factor in rheumatoid arthritis. Nephron 1989; 51: 107-11. [ Links ]
9. Boers M, Dijkmans BAC, Breedveld FC, Camps JA, Chanq PC, Van Brummelen P, et al. Subclinical renal dysfunction in rheumatoid arthritis.. Arthritis Rheum 1990; 33: 95-101. [ Links ]
10. Pedersen LM, Nordin H, Svensson B, Bliddal H. Microalbuminuria in patients with rheumatoid arthritis. Ann Rheum Dis 1995; 54: 189-92. [ Links ]
11. Boers M. Renal disorders in rheumatoid arthritis. Arthritis Rheum 1990; 20: 57-68. [ Links ]
12. Venables PJW, Maini RN. Clinical features of rheumatoid arthritis. En: Rose Bd (ed). Up to date. Wellesley, MA, 2003. [ Links ]
13. Lipsky PE. Artritis Reumatoide. En: Braunwald E, Fauci AS, Kasper DL, Hauser SL, Longo DL, Jameson JL (Editores). Principios de Medicina Interna. Harrison 15 edición. Editorial Mc Graw Hill, S.A. 2002.p. 2255-65. [ Links ]
14. Alcázar R., Egido J. Síndrome nefrótico: fisiopatología y tratamiento general. En: Avendaño LH, Aljama García M, Arias Rodríguez M, Caramelo Díaz C, Egido de los Ríos JE, Lamas Peláez S (Editores). Nefrología Clínica. Madrid. Editorial Médica Panamericana, S.A., 2003.p. 277-88. [ Links ]
15. Mezzano S. Nefropatía Membranosa. En: Avendaño LH, Aljama García M, Arias Rodríguez M, Caramelo Díaz C, Egido de los Ríos JE, Lamas Peláez S (Editores). Nefrología Clínica. Madrid. Editorial Médica Panamericana, S.A, 2003.p. 277-88. [ Links ]
16. Arias M., Ruiz JC. Técnica e indicaciones de la biopsia renal. En: Avendaño LH, Aljama García M, Arias Rodríguez M, Caramelo Díaz C, Egido de los Ríos JE, Lamas Peláez S (Editores). Nefrología Clínica. Madrid. Editorial Médica Panamericana S.A., 2003. p. 145-8. [ Links ]
17. Ortiz A. Etiopatogenia de las enfermedades glomerulares. En: Avendaño LH, Aljama García M, Arias Rodríguez M, Caramelo Díaz C, Egido de los Ríos JE, Lamas Peláez S (Editores). Nefrología Clínica. Madrid. Editorial Médica Panamericana S.A., 2003.p. 255-67. [ Links ]
18. Cohen AH. Rheumatoid Arthritis and Rheumatic Fever. En: p. 790-792. [ Links ]
19. Reichert LJM, Koene RAP, Wetzels JFM. Prognostic factors in idiopathic membranous nephropathy. Am J Kidney Dis 1998; 31:1-11. [ Links ]
20. Ponticelli C, Zuchelli P, Passerini P, Cesana B. Methylprednisolone plus chlorambucil as compared with methylprednisolone alone for the treatment of idiopathic membranous nephropathy. The Italian Idiopathic Membranous Nephropathy Treatment Study Group. N Engl J Med 1992; 327: 599-603. [ Links ]
21. Ponticelli C, Zucchelli P, Passerini P, Cesana B, Locatelli F, Pasquali S, et al. A 10-year follow-up of a randomized study with methylprednisolone and chlorambucil in membranous nephropathy. Kidney Int 1995: 48: 1600-4. [ Links ]
22. Ponticelli C, Altieri P, Scolari F, Passerini P, Rocatello D, Cesana B, et al. A randomized study comparing methylprednisolone plus chlorambucil versus methylprednisolone plus cyclophosphamide in idiopathic membranous nephropathy. J Am Soc Nephol 1998; 9: 444-50. [ Links ]














