Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Acta Medica Colombiana
versión impresa ISSN 0120-2448
Acta Med Colomb v.33 n.1 Bogotá ene./mar. 2008
(1) Residentes de Medicina Interna, Universidad de Antioquia. Medellín, Colombia;
(2)Internista Nefrólogo, Jefe Nefrología Universidad de Antioquia. Medellín (Antioquia), Colombia.
Correspondencia: Dra. Janneth Liliana Jaramillo Ortega, Calle 29 A Nº42-97 C 156 Urbanización Escocia, Teléfono: 373 0758, Celular: 300 601 03 29. Itagüí, Antioquia. E-mail: anylili@yahoo.com
Recibido: 15/VIII/07 Aceptado: 6/II/08
Resumen
El síndrome hepatorrenal es una causa funcional reversible de falla renal que ocurre en la cirrosis avanzada, asociada con hipertensión portal. Dentro de la etiología se ha involucrado un trastorno en el balance de múltiples sustancias endógenas vasoconstrictoras o vasodilatadoras que afectan tanto al lecho vascular renal como sistémico. Se está evaluando en estudios clínicos diversas medidas que pudieren prevenirlo, como es el caso de la pentoxifilina en cirrosis alcohólica, mientras se lleva el paciente a trasplante, así como la asociación de albúmina y noradrenalina, octreotido o terlipresin, entre otros.
El tratamiento de elección para estos pacientes es el trasplante hepático, pero si el paciente no es elegible para trasplante se sugiere como estrategia conservadora la paracentesis frecuente u otras medidas como el uso de derivación portosistémica.
Palabras clave: síndrome hepatorrenal, cirrosis, hipertensión portal, ascitis, falla renal.
Abstract
Hepatorenal syndrome is a functional and reversible cause of renal failure that can occur in patients with chronic liver disease and portal hypertension; some factors have been related on his etiology like the alteration in the balance of multiple vasoconstrictor or vasodilator endogenous substances that affect the renal vascular bed and systemic circulation. There are pharmacological strategies that can prevent the hepatorenal syndrome before transplantation in alcoholic cirrhosis. Some clinical studies had evaluated the effectiveness of Pentoxifiline, albumin and noradrenalin, Octreotide or Terlipressin. Although the treatment of election for these patients is the hepatic transplantation, but if the patient is not eligible for transplant there is still an option of a preservative strategy by the use of portosistemic shunts or sequential paracentesis.
Key words: hepatorenal syndrome, cirrhosis, portal hypertension, ascites, renal failure.
Introducción
El síndrome hepatorrenal (SHR) es una causa funcional reversible de falla renal que ocurre principalmente en el escenario de cirrosis avanzada asociada a hipertensión portal. Aunque también ha sido descrito en otros tipos de enfermedad hepática tales como hepatitis alcohólica o falla hepática aguda. Su ocurrencia no es rara. La presencia de azoemia aguda en un paciente con enfermedad hepática no debe automáticamente denominarse SHR, debido a que otras alteraciones de la función renal pueden tener manifestaciones similares, por tanto el diagnóstico de este síndrome debe excluir causas no funcionales de falla renal. Nuestro propósito es describir la fisiopatología, características clínicas, acercamiento diagnóstico y las terapias propuestas como puente para el trasplante hepático, el cual es el tratamiento de elección para los pacientes elegibles.
Historia
La ocurrencia de falla renal oligúrica en enfermedad hepática avanzada fue descrita inicialmente en 1863 por el doctor Austin Flint, quien después de analizar concluyó que la enfermedad hepática relacionada con el alcohol era la causa de ascitis en la mayoría de los pacientes y notó la presencia de oliguria en ausencia de albuminuria (1). Posteriormente describió que en cinco de once autopsias de sus pacientes, los riñones se consideraron como normales al análisis histopatológico, subrayando así la naturaleza funcional de esta entidad. En la década de los sesenta, en el siglo XX, por medio de ensayos experimentales se demostró que los riñones trasplantados de pacientes con SHR eran capaces de asumir la función normal en el receptor y que el trasplante hepático en estos pacientes permitía el restablecimiento de la función renal, confirmando así, luego de un siglo las descripciones del Dr Austin Flint (2).
En 1932 se usó por primera vez el término SHR para los pacientes en posoperatorio de corrección de obstrucción de la vía biliar que presentaban insuficiencia renal aguda, sin embargo la existencia de esta entidad sólo fue reconocida hacia 1950 cuando Hecker y Sherloc presentaron una serie de 39 casos con este síndrome (1, 2).
Se conoce que hasta el 50% de los pacientes con cirrosis desarrollarán ascitis en un periodo de 10 años, por tanto un porcentaje sustancial desarrollaría SHR, éste se puede presentar hasta en 39% de los pacientes con ascitis (3-5). El hallazgo de SHR conlleva mal pronóstico, la resolución espontánea ocurre sólo en 3,5% la mortalidad puede alcanzar hasta 90% en 10 semanas dando una media de supervivencia de 1,7 semanas, por tanto, la falla renal en la cirrosis avanzada es un importante determinante del desenlace clínico ya que los pacientes en quienes la función renal mejora después de la terapia sobreviven por más tiempo con respecto en quienes no (3).
Han sido definidos originalmente dos tipos de SHR por el Internacional Ascitis Club (1); el tipo 1 se presenta como insuficiencia renal aguda rápidamente progresiva y tiene muy mal pronóstico. El tipo 2 se presenta como falla renal que se desarrolla lentamente en varias semanas y tiene mayor supervivencia (Tabla 1) (6, 7).

Fisiopatología
A pesar del intenso estudio de SHR sólo se han dilucidado algunos componentes de su fisiopatología. La vasoconstricción renal es la característica principal y se ha confirmado por estudios como los realizados por Ebstein M, quien por técnicas de arteriografía selectiva se demostró la reducción significativa del flujo sanguíneo cortical renal que revertía en las angiografías post mortem, demostrando la naturaleza funcional de esta entidad (1, 2). El SHR ocurre tardíamente en la historia natural de la cirrosis y es el producto final de diferentes procesos subyacentes que alteran la circulación arterial sistémica, incrementan la presión portal y modulan la circulación renal llevando a disfunción renal sin daño histológico de los riñones.
Estudios de histopatología han evidenciado algunos cambios en la estructura renal como expansión mesangial, adelgazamiento de la pared glomerular, depósito de material electrodenso en la pared capilar y reflujo tubuloglomerular, pero estos hallazgos no son específicos del síndrome y se han descrito en hipotensión e isquemia (1).
El principal factor responsable de las alteraciones hemodinámicas en la cirrosis, es la hipertensión portal, la cual está asociada a vasodilatación en la circulación esplácnica debido a la liberación local de óxido nítrico (NO) y otros vasodilatadores (péptido relacionado con el gen de la calcitonina, endocanabinoides, entre otros), dado por el estrés endotelial y posiblemente por la translocación bacteriana (6). Estos cambios generan disminución de la resistencia vascular en este sitio, la cual inicialmente es compensada por el desarrollo de circulación hiperdinámica; sin embargo, la habilidad para mantener el volumen efectivo se pierde y habrá una hipovolemia arterial renal relativa que va a ser censada por los barorreceptores que estimulan el sistema renina angiotensina aldosterona, lo cual produce incremento de la retención de sodio y agua y posteriormente ascitis, todo esto también estimula al sistema nervioso simpático incrementando la presión arterial a niveles cerca de lo normal; adicionalmente en fases tardías se estimula el sistema arginina vasopresina lo que lleva retención de agua y por tanto hiponatremia dilucional (8, 9).
Otros estudios soportan la existencia de reflejo hepatorrenal, ya que al inducir hipertensión portal se disminuye el flujo sanguíneo renal en relación proporcional con el incremento en las concentraciones de endotelina 1, la cual actúa como vasoconstrictor renal por activación de receptores de adenosina. Por estudios experimentales, al generar denervación hepática o usar antagonistas de adenosina, se previene el incremento en la retención de sodio y agua y la disminución del flujo renal (3, 4).
Como se anotó previamente hay altos niveles de NO en la circulación esplácnica por tanto el efecto vasopresor de la angiotensina II, noradrenalina y vasopresina es anulado en esta área, pero en el riñón, la piel y el cerebro se ha demostrado gran vasoconstricción al cuantificar la resistencia vascular; lo cual refleja el efecto de los vasoconstrictores. Esto es potenciado por la disminución de los vasodilatadores locales como lo evidencian los bajos niveles urinarios de prostaglandina (PG) E2, 6 ceto PG F1a (metabolito de PGI2) y kalicreínas. Adicionalmente se ha identificado aumento en vasoconstrictores locales como los leucotrienos e isoprostanos, la interacción de todos estos mecanismos lleva a una intensa vasoconstricción renal que en última medida se ve expresada en el incremento de los nitrogenados en la sangre (7, 13, 14).
Recientes estudios han encontrado disfunción adrenal en los pacientes con SHR, más frecuentemente vistos en asocio con un proceso infeccioso, ya que la función adrenal normal es esencial para una adecuada respuesta de la circulación arterial a los vasoconstrictores endógenos, la insuficiencia adrenal podría contribuir a la disfunción circulatoria presente en estos pacientes. Se cree que esta alteración también sea explicada por el bajo flujo secundario a la vasoconstricción local aunque se sabe que las citoquinas liberadas en sepsis pueden disminuir los niveles de cortisol (7, 19).
La medida inicial como respuesta a las bajas resistencias, es la circulación hiperdinámica, es decir, se incrementa la frecuencia y el gasto cardiaco, pero en pacientes con cirrosis se ha identificado una cardiomiopatía específica en la cual hay una respuesta sistodiastólica atenuada en presencia de estrés y se considera que es secundaria al compromiso del retorno venoso, ya que esta alteración mejora luego de la infusión de albúmina la cual incrementa el retorno venoso cardiaco; por tanto el SHR se desarrolla en presencia de la combinación de vasodilatación arterial esplácnica, hipovolemia central, disfunción cardiaca y vasoconstricción renal (4).
Cuadro clínico
Hay dos tipos de SHR. La forma aguda o tipo 1, se caracteriza por aparición de insuficiencia renal rápidamente progresiva, aunque en estos pacientes el SHR se puede presentar en forma espontánea, puede ocurrir relacionada con un factor precipitante.
En esta forma evidenciaríamos signos clínicos propios de enfermedad hepática crónica e hipertensión portal como: eritema palmar, telangiectasias en araña, circulación venosa abdominal y ascitis, entre otros (9). Este grupo tiende a presentar coagulopatía e ictericia intensa, además de los hallazgos de encefalopatía hepática, la cual puede preceder el inicio de la azoemia. La presentación clínica del SHR tipo 1 es como falla renal oligoanúrica, es decir, con gasto urinario menor de 500 mililitros/día. Una característica para resaltar es que estos pacientes no tienen elevaciones de la creatinina tan intensas como las observadas en otras causas de falla renal debido a su menor masa muscular (12). Usualmente su descompensación renal viene precedida por un evento desencadenante, es así como el SHR se ha descrito en cerca de 20% de los pacientes con peritonitis bacteriana espontánea, hasta en 15% de pacientes en quienes se han realizado grandes paracentesis (mayores de 5 l) sin reposición de albúmina, en 10% de los pacientes con sangrado gastrointestinal y secundario a diuresis intensa (14, 15). En estos pacientes la supervivencia media es de dos semanas si no se instaura tratamiento.
El SHR tipo 2 es una forma más estable que se desarrolla lentamente en varias semanas y tiene una mejor supervivencia. Los pacientes presentan igualmente los signos de enfermedad hepática crónica, pero en ellos la ictericia es menos intensa y el deterioro de la función renal es lento. Una de las características principales es la ascitis refractaria (1, 12, 18). Los pacientes con SHR 2 están predispuestos a desarrollar SHR 1 luego de infecciones o factores precipitantes (6). La media de supervivencia de estos pacientes es de 4-6 meses, lo cual es peor que para los pacientes cirróticos con ascitis y sin falla renal.
Abordaje diagnóstico
Debido a que no existe un test específico para el SHR, su diagnóstico debe hacerse luego de la exclusión de otros desórdenes que pueden causar falla renal en cirrosis. Por la historia clínica y el examen físico se deben evaluar posibles pérdidas de líquidos tanto de origen gastrointestinal como renal. Si la falla renal es secundaria a depleción de volumen, la función renal mejorará rápidamente luego de la expansión de volumen, lo cual no sucedería en el SHR. La presencia de choque antes del inicio de la falla renal excluye al SHR como causa y debe considerarse la necrosis tubular aguda. El diagnóstico de choque séptico es difícil debido a la baja presión que usualmente manejan, razón por la cual la infección siempre debe tenerse en la cuenta en este escenario y el diagnóstico de SHR sólo debe realizarse en este tipo de pacientes si la infección está totalmente resuelta. Adicionalmente se debe descartar si la falla renal está en relación con el uso de nefrotóxicos como aminoglicósidos, antiinflamatorios no esteroideos (AINES) y radiocontraste. Finalmente, los pacientes con cirrosis pueden desarrollar falla renal debido a compromiso parenquimatoso renal, particularmente glomerulonefritis en la presencia de hepatitis B o C o alcoholismo crónico, en este caso aparece proteinuria, hematuria o ambas y el diagnóstico puede ser confirmado por biopsia renal (11, 13, 26).
En el diagnóstico de SHR se debe demostrar la existencia de falla renal, el mejor marcador para determinarla es la tasa de filtración glomerular ya que el nitrógeno ureico sanguíneo puede encontrarse alterado, por ejemplo en malnutrición, sangrado gastrointestinal y consumo de proteínas, entre otros y la creatinina es menor de la esperada. Adicionalmente encontramos hiponatremia dilucional (Na sérico <130 mEq/l) la cual es consecuencia del incremento de la retención de líquidos libres de solutos por acción de la vasopresina. Cabe anotar que la hiperkalemia espontánea en ellos es poco frecuente, aunque se podría presentar en aquellos tratados con grandes dosis de espironolactona. La acidosis grave y el edema pulmonar que son complicaciones frecuentes en la insuficiencia renal aguda sin enfermedad hepática, son observados raramente en estos pacientes (5).
Diagnóstico diferencial
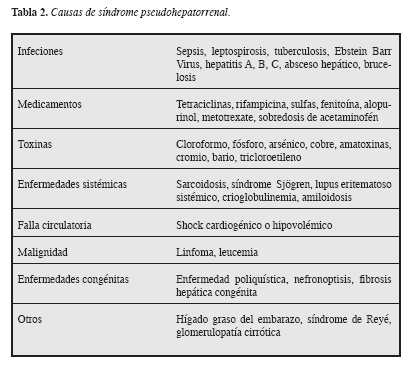
Es importante enfatizar que el concepto de SHR debe excluir la presencia de otras causas de falla renal que podríamos denominar como síndrome pseudohepatorrenal como: la falla prerrenal por depleción de volumen, necrosis tubular aguda por choque, falla renal inducida por medicamentos (aminoglicósidos, AINES) y glomerulopatías en el cirrótico como las causadas por el alcohol o virus hepatotropos (6) que están descritas en la Tabla 2 (2), Figura 1.

Tratamiento
Actualmente el tratamiento de elección es el trasplante hepático, pero infortunadamente no siempre está disponible o el paciente está en muy malas condiciones; por tanto inicialmente se requiere la estabilización del paciente previo al trasplante si es un individuo elegible. Estos pacientes son candidatos prioritarios para trasplante de hígado. Inicialmente debemos evaluar en dónde se debe realizar el tratamiento, un paciente con SHR 1 requiere evaluación y estrecho monitoreo intrahospitalario idealmente en unidad de cuidados intensivos, en tanto que un paciente con SHR 2 puede ser manejado en forma ambulatoria (5, 11).
El uso de soporte hepático extracorpóreo o hígado artificial {Prometheus® o Mars® (molecular adsorbent recirculating system)}, sólo son de utilidad transitoria como soporte para el paciente en estado crítico con este síndrome mientras se pueda realizar el trasplante renal.
Con la prevención podría evitarse este desenlace, por tanto es importante eliminar factores desencadenante en un paciente cirrótico, tales como el uso de nefrotóxicos, uso excesivo de diuréticos, infecciones y sangrado gastrointestinal (6, 13).
Adicionalmente a la prevención de eventos desencadenantes, hay dos formas en las cuales el manejo farmacológico preventivo pudiese tener efecto y es en la peritonitis bacteriana espontánea (PBE) y en la hepatitis alcohólica. En el estudio de Sort P. y Cols. (27) se demostró que en estos pacientes el uso de albúmina 1.5g/kg en el momento del diagnóstico y 1g/kg 48h después, disminuyó el desarrollo de SHR de 33% a 10% de los pacientes sin albúmina versus (vs) a los que se les administró ésta respectivamente. Además de disminuir la mortalidad hospitalaria, en otro estudio la profilaxis primaria para PBE con norfloxacina redujo la probabilidad de PBE y SHR tipo 1. En los pacientes con hepatitis alcohólica un estudio (28) encontró que el uso de pentoxifilina, un agente que actúa como inhibidor del factor de necrosis tumoral (400 mg tres veces/día por un mes), redujo la incidencia (8% pentoxifilina vs 35% placebo) y la mortalidad (24% vs 46% respectivamente) del SHR, no hay otros estudios que confirmen estos hallazgos, por tanto no es posible recomendar su uso pero se deben seguir estudiando estas posibilidades (3, 4, 6).
La meta más importante en el tratamiento es el mejoramiento de la perfusión renal y la tasa de filtración glomerular, es así como la terapia ideal para este síndrome debería incluir mecanismos que bloquean la vasodilatación esplácnica y que incrementen el flujo renal efectivo, hasta hoy no hay un medicamento que reúna estas características, razón por la cual se han intentado diferentes medidas como el uso de infusión local de misoprostol (análogo sintético de PGE2), infusión de PG E2 pero esto no cambió la TFG ni la excreción de sodio. Se ha usado la teofilina por su efecto antagonista de la adenosina, lo cual incrementa la perfusión renal y teóricamente pudiera aminorar la vasoconstricción renal. Reportes preliminares de estudios con antagonistas del receptor de endotelina demostraron incremento del flujo sanguíneo renal y la TFG en tres pacientes con SHR lo hace promisorio (3, 5-7, 20).
Fuera de éstos se ha usado la dopamina en dosis bajas, pero debido a que disminuye la presión arterial e incrementa la presión portal su uso no es recomendado para el manejo de SHR (14).
Los vasoconstrictores asociados a expansores plasmáticos son probablemente la mejor terapia por ahora, ya que en estudios no controlados se ha confirmado su papel benéfico en los pacientes con SHR, por tanto se utiliza la albúmina como expansor del volumen plasmático asociado a vasoconstrictores tipo análogos de la vasopresina como la ornipresina, administrada en 4h a 61U/h. Con esta terapia se logra incremento de la resistencia vascular sistémica, reducción de los niveles plasmáticos de norepinefrina y de la actividad de la renina plasmática, incremento en la TFG, el flujo sanguíneo renal y el gasto urinario, pero su uso se ha limitado por sus efectos adversos serios como la vasoconstricción coronaria. Esto ha llevado al desarrollo de análogos sintéticos con mejor perfil de seguridad como el terlipressin el cual actúa sobre el receptor V1 de la vasopresina produciendo vasoconstricción del lecho esplácnico, mejorando los parámetros hemodinámicos y de funcionamiento renal (disminución de la creatinina en 75% de los pacientes con SHR 1) (5, 7, 16).
Otros vasoconstrictores usados son los agonistas alfa adrenérgicos tipo midrodine, el cual en asocio con octreótide, un inhibidor de la liberación de glucagón y el péptido intestinal vasoactivo, en dos estudios con 19 pacientes demostraron que mejoraban la función renal en SHR (13). Otro estudio que evaluó el efecto de la noradrenalina con albúmina evidenció mejoramiento de la función renal en un grupo de doce pacientes con SHR (18). En algunas revisiones sobre el tema algunos grupos recomiendan esquemas como los descritos en la Figura 2, y en nuestro medio donde no disponemos de algunos de los vasoconstrictores descritos, se usa la asociación norepinefrina-albúmina, para llegar a la meta que es la reducción en el nivel de creatinina por debajo de 1,5 mg/dL.

Adicional a la terapia farmacológica se han usado otras medidas como las derivaciones portocava intrahepáticas transyugulares (TIPS) en pacientes no elegibles para trasplante o con ascitis refractaria. Los estudios que excluyeron aquellos pacientes con encefalopatía, bilirrubina total > 15 mg/dL o Child Pugh <12 evidenciaron reversión del SHR en algunos pacientes lo cual sugiere que este procedimiento podría ser un tratamiento alternativo, pero se describen complicaciones relacionadas con la inserción del dispositivo, además al evaluarse en comparación con las paracentesis mas reposición con albúmina, no hay mayor beneficio y sí mayores efectos adversos y costos (5, 21). Se ha estudiado el uso de diálisis de albúmina extracorpórea como los sistemas MARS y Prometheus (22-24); con este método se vio disminución de la creatinina además de mejoría de la encefalopatía y de la supervivencia, pero se requiere mayor evidencia para recomendar su uso.
El tratamiento del SHR tipo 2 está basado en la restricción del consumo de sodio (restricción 40-80 mmol /día de sodio), disminución de la rata de formación de ascitis ya que la excreción de sodio está alterada y estos pacientes no responden a los diuréticos. Las paracentesis repetidas y la reposición con albúmina es probablemente el método de elección para el tratamiento de la gran ascitis de estos pacientes, adicionalmente si se presenta hiponatremia dilucional se debe restringir el consumo de líquidos a 1.000 cc/día (11, 25).
Es claro que el tratamiento de elección para SHR es el trasplante hepático. Inmediatamente después del trasplante la TFG puede estar alterada y hasta el 35% de los pacientes pueden requerir hemodiálisis. Tener presente que el tacrolimus y ciclosporina pueden contribuir a la alteración de la función renal, por tanto se ha sugerido diferir la administración de estos fármacos hasta notar la recuperación de la función renal la cual usualmente se presenta entre 48-72 h después del trasplante, aunque ésta puede persistir durante el seguimiento, hay una mejoría entre 30 a 40 ml/min en los primeros dos meses del trasplante hepático, las alteraciones hemodinámicas desaparecen generalmente luego del primer mes ya que se recupera la capacidad de excretar sodio y agua (7, 13).
En conclusión el SHR es una causa funcional de falla renal aguda en pacientes con hepatopatía avanzada, dentro de su fisiopatología se resalta la vasodilatación del lecho esplácnico, la circulación hiperdinámica y la vasoconstricción renal dada, por sustancias vasoactivas. Sin tratamiento, la mortalidad es del 100%. En el diagnóstico se deben excluir y manejar otras causas reversibles de falla renal, ya que para este síndrome, la única terapia útil a largo plazo es el trasplante hepático, adicionalmente, algunas medidas podrían disminuir la frecuencia de esta complicación, lo que hace imperativo evaluar medidas que retarden su presentación; en nuestro medio la mejor alternativa con los medicamentos disponibles la constituye el uso de albúmina asociado a noradrenalina en la forma descrita en la Figura 2.
Agradecimientos
Los autores agradecen al doctor Ignacio Tabón por su ayuda en la revisión del texto.
Referencias
1. Ignatiopius K.P, Felix F.K. Hepatorenal Syndrome. En: Feehally J, Floege J, Johnson R, eds. Comprehensive in Clinical Nephrology. Spain: Mosby; 2007.p.803-12. [ Links ]
2. Epstein M. Hepatorenal Syndrome. En: Epstein M, ed. The kidney in Liver Disease. Baltimore: Williams & Wilkins; 1988.p.89-116. [ Links ]
3. Barada K. Hepatorenal syndrome: pathogenesis and novel pharmacological targets. Curr Opin Pharmacol 2004; 4: 189-97. [ Links ]
4. Moller S, Henriksen J. Review article: pathogenesis and pathophysiology of hepatorenal syndrome - is there scope for prevention?. Aliment Pharmacol Ther 2004; 20 Suppl 3: 31-41. [ Links ]
5. Cárdenas A, Ginés P. Therapy Insight: management of hepatorenal syndrome. Nat Clin Pract Gastroenterol Hepatol 2006; 3: 338-48. [ Links ]
6. Cárdenas A, Ginès P. Hepatorenal syndrome. Clin Liver Dis 2006; 10: 371-85. [ Links ]
7. Sanyal AJ. Hepatorenal syndrome. J Gastroenterol Hepatol 2002; 17 Suppl 3: 248-52. [ Links ]
8. Arroyo V, Terra C, Ginès P. Advances in the pathogenesis and treatment of type-1 and type-2 hepatorenal syndrome. J Hepatol 2007; 46: 935-46. [ Links ]
9. Montero O, Carvajal J. Síndrome hepatorrenal. En: Velez H, Rojas W, Borrero J, Restrepo J, eds. Fundamentos de Medicina Nefrologia. Medellín: Corporación para Investigaciones Biológicas; 2003.p.476-83. [ Links ]
10. Chung R, Podolsky D. Cirrhosis and its Complications. In: Kasper D, Fauci A, longo D, Braunwald E, Hauser S, Jameson J, eds. Harrison’s principles of internal medicine. New York: McGraw Hill; 2005.p.1858-69. [ Links ]
11. Ginès P, Guevara M, Arroyo V, Rodés J. Hepatorenal Syndrome. Lancet 2003; 362: 1819-27. [ Links ]
12. Brenner BM, Lazarus JM. Acute renal failure associated with hepatobiliary disease. En: Brenner BM, Lazarus JM, eds. Acute Renal Failure. Broadway New York: Churchill Livingstone Inc; 1983.p.556-69. [ Links ]
13. Cárdenas A. Hepatorenal syndrome: A Dreaded Complication of end-stage Liver Disease. Am J Gastroenterol 2005; 100: 460-7. [ Links ]
14. Moreau R. Hepatorenal syndrome in patients with cirrhosis. J Gastroenterol Hepatol 2002; 17: 739-47. [ Links ]
15. Sandhu B, Sanyal A. Management of Ascites in Cirrhosis. Clin Liver Dis 2005; 9: 715–32. [ Links ]
16. Solanki P, Chawla A, Garg R, Gupta R, Jain M, Sarin SK. Beneficial effects of terlipressin in hepatorenal syndrome: a prospective, randomized placebo-controlled clinical trial. J Gastroenterol Hepatol 2003; 18: 152-6. [ Links ]
17. Esrailian E, Pantangco ER, Kyulo NL, Hu KQ, Runyon BA. Octreotide/Midodrine therapy significantly improves renal function and 30-day survival in patients with type 1 hepatorenal syndrome. Dig Dis Sci 2007; 52: 742–8. [ Links ]
18. Duvoux C, Zanditenas D, Hezode C, Chauvat A, MoninJ, Roudot-Thoraval F, et al. Effects of Noradrenalin and Albumin in Patients With Type I Hepatorenal Syndrome: A Pilot Study. Hepatology 2002; 36: 374-80. [ Links ]
19. Fernández J, Escorsell A, Zabalza M, Felipe V, Navasa M, Mas A, et al. Adrenal insufficiency in patients with cirrhosis and septic shock: Effect of treatment with hydrocortisone on survival. Hepatology 2006; 44: 1288-95. [ Links ]
20. Gerbes AL, Gulberg V. Progress in treatment of massive ascites and hepatorenal syndrome. World J Gastroenterol 2006; 12: 516-9. [ Links ]
21. Ginès P, Uriz J, Calahorra B, Garcia-Tsao G, Kamath PS, Del Arbol LR, et al. Transjugular intrahepatic portosystemic shunting versus paracentesis plus albumin for refractory ascites in cirrhosis. Gastroenterology 2002; 123: 1839-47. [ Links ]
22. Di Campli C, Zileri Dal Verme L, Andrisani MC, Armuzzi A, Candelli M, Gaspari R, et al. Advances in extracorporeal detoxification by MARS dialysis in patients with liver failure. Curr Med Chem 2003; 10: 341-8. [ Links ]
23. Sen S, Mookerjee RP, Davies NA, Williams R, Jalan R. Review article: the molecular adsorbents recirculating system (MARS) in liver failure. Aliment Pharmacol Ther 2002; 16: 32-8. [ Links ]
24. Rifai K, Ernst T, Kretschmer U, Bahr MJ, Schneider A, Hafer C, et al. Prometheus -- a new extracorporeal system for the treatment of liver failure. J Hepatol 2003; 39: 984-90. [ Links ]
25. Cardenas A, Ginès P. Management of complications of cirrhosis in patients awaiting liver transplantation. J Hepatol 2005; 42 Suppl(1): 124-33. [ Links ]
26. Moreau R, Lebrec D. Diagnosis and treatment of acute renal failure in patients with cirrhosis. Best Pract Res Clin Gastroenterol 2007; 21: 111-23. [ Links ]
27. Sort P, Navasa M, Arroyo V, Aldeguer X, Planas R, Ruiz-del-Arbol L. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med 1999; 5: 403–9. [ Links ]
28. Akriviadis E, Botla R, Briggs W, Han S, Reynolds T, Shakil O. Pentoxifylline improves short-term survival in severe acute alcoholic hepatitis: a double-blind, placebo-controlled trial. Gastroenterology 2000; 119: 1637-48. [ Links ]














