Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Medica Colombiana
Print version ISSN 0120-2448
Acta Med Colomb vol.33 no.2 Bogotá Apr./June 2008
(1) Bacterióloga. MSc. Microbiología. Especialista Microbiología Médica. Profesora Asociada. Departamento de Salud Pública. Universidad Nacional de Colombia. Bogotá, Colombia. E-mail: mclopezp@unal.edu.co;
(2) Estudiante X Semestre de Medicina. Facultad de Medicina, Universidad Nacional de Colombia. Bogotá, Colombia. E-mail: daquirozr@unal.edu.co;
(3) MD. Especialista en Medicina Interna. Diabetóloga. MSc. Educación con Énfasis en Docencia Universitaria. Especialista Evaluación y Construcción de Indicadores de Gestión para la Educación Superior. Profesora Asociada. Departamento de Medicina. Facultad de Medicina, Universidad Nacional de Colombia. Bogotá, Colombia. E-mail: aepinillar@unal.edu.co
Correspondencia: Dra. Análida Pinilla: Departamento de Medicina. Facultad de Medicina, Universidad Nacional de Colombia. E-mail: aepinillar@unal.edu.co
Recibido: 12/XI/07 Aceptado: 09/IV/08
Resumen
Objetivo: realizar una revisión de la literatura nacional e internacional desde el siglo XX hasta nuestros días con el fin de actualizar los avances para el diagnóstico del complejo Entamoeba histolytica / Entamoeba dispar y de la amebiasis intestinal y extraintestinal que le sea útil a la comunidad científica. Así como para unificar los criterios de diagnóstico de esta parasitosis reconocida como problema de salud pública y en consecuencia optimizar la calidad de atención a la población.
Fuente de datos: se inició la búsqueda sistemática de la literatura científica publicada en español y en inglés desde 1960 hasta la actualidad, esta selección se inició en el primer semestre de 2006 hasta 2007, en el desarrollo de la línea de profundización de amebiasis intestinal y extraintestinal de la Facultad de Medicina de la Universidad Nacional de Colombia.
Se hizo un proceso de búsqueda retrospectiva, al revisar sistemáticamente los artículos de mayor relevancia y los productos de esta línea de investigación. En el momento de decidir la construcción de este artículo se continuó la búsqueda en diferentes bases de datos como Medline, SciELO y otras bases de la biblioteca de la Universidad Nacional de Colombia, además de la revisión de libros clásicos sobre el tema. Para tal fin se emplearon los términos amebiasis, Entamoeba histolytica, Entamoeba dispar, diagnosis, epidemiology, dysentery, liver abscess amebic.
Selección de estudios: se revisaron los títulos y resúmenes para seleccionar las publicaciones originales y las más representativas para el tópico de este artículo.
Extracción de datos: los artículos se clasificaron de acuerdo con el tema, la cronología, los autores de acuerdo al aporte científico para el avance de este problema.
Síntesis de datos: se inició un análisis crítico en primer lugar cronológico para ir ordenando y sintetizando los avances del diagnóstico hasta precisar los acuerdos de los expertos en amebiasis a nivel mundial.
Conclusión: este artículo recapitula lo transcurrido durante el siglo XX y los comienzos del siglo XXI en la actualización del diagnóstico de la amebiaisis y la aceptación de la hipótesis del complejo Entamoeba histolytica / Entamoeba dispar propuesta por Brumpt en 1925. En Colombia, dado el avance de las técnicas diagnósticas, como la determinación de la Gal/GalNAc lectina en materia fecal se ha informado prevalencia de E. histolytica entre 0,6%-1,4%. Sin embargo, para el diagnóstico de amebiasis intestinal se sigue utilizando el examen directo sin poder precisar la especie.
De otra parte, el cuadro clínico más importante de amebiasis extraintestinal es el absceso hepático, para hacer este diagnóstico se analiza en contexto la historia clínica, los aspectos epidemiológicos, la imaginología y la determinación de anticuerpos IgG contra E. histolytica. La histopatología, de las lesiones del colon, sigue siendo válida para el diagnóstico diferencial con otras etiologías. El advenimiento de las pruebas de biología molecular, que se están adaptando en nuestro medio, servirá como ayuda diagnóstica en esta patología.
Palabras clave: amebiasis, Entamoeba histolytica, Entamoeba dispar, diagnóstico, epidemiología, disentería, absceso hepático amebiano.
Abstract
Objective: to carry out a review of the national and international literature as of the XXth century in order to update the advances for the diagnosis of complex odd Entamoeba histolytica / Entamoeba dispar and that of intestinal and extra intestinal amebiasis that may be of use to the scientific community. As well as to unify the diagnostic criteria of this parasitosis known as a public health problem, and as a consequence of that, optimize the quality of population care.
Data source: there was a systematic search for the scientific literature Publisher in Spanish and English since 1960 until today, this selection started on the first semester of 2006 until 2007, in the development of the line on intestinal and extra-intestinal amebiasis of the Medical School of the National University of Colombia.
A retrospective search process was carried out, systematically reviewing the most relevant articles as well as the products of this research line. In deciding how to make this article, there was a continuous search in different data bases such as Medline, SciELO and other bases in the library of the National University of Colombia, as well as other classical books related to the subject. For that purpose the terms amebiasis, odd Entamoeba histolytica, Entamoeba, diagnosis, epidemiology, dysentery, amebic liver abscess, were used.
Studies selection: titles and abstracts were reviewed to select the original publications and the most representative ones related to this article’s subject.
Data extraction: the articles were classified according to the subject, the chronology and the authors according to the scientific contribution to solve the problem.
Synthesis of the data: in the first instance, a chronological critical analysis was carried out to order and synthesize the progress made in the diagnosis until confirmation of the experts’ agreements in the field of amebiasis was obtained throughout the world.
Conclusion: this article summarizes what has taken place during the XXth and the beginning of the XXIst century in updating the diagnosis of amebiasis and accepting the hypothesis of the complex Entamoeba histolytica / Entamoeba dispar proposed by Brumpt in 1925. In Colombia, given the progress made in the diagnostic techniques, as well as the determination of Gal/GalNAc lectine in the feces, the prevalence of E. histolytica between 0.6%-1.4%. However, for the diagnosis of intestinal amebiasis direct test without being able to define the species.
On the other hand, the most important clinical picture of extra-intestinal amebiasis is liver abscess; to make that diagnosis the clinical history the context is analyzed, including the clinical history, epidemiological aspects, imaging studies and IgG antibodies against histolytica. The histopathology of the colon lesions continues to be valid for the differential diagnosis with other etiologies. The advent of the new molecular biology tests, will be a helpful diagnosis tool in this pathology.
Key words: amebiasis, Entamoeba histolytica, Entamoeba dispar, diagnosis, epidemiology, dysentery, amebic liver abscess.
Introducción
La E. histolytica es un protozoo de distribución mundial, que afecta en particular a países en vía de desarrollo, infecta alrededor de 500 millones de personas anualmente, 110.000 mueren por complicaciones; así, la amebiasis es considerada la tercera parasitosis causante de mortalidad mundial después de la malaria y la esquistosomiasis. Las personas infectadas se dividen en dos grupos de acuerdo con sus manifestaciones clínicas: 90% son asintomáticos (portadores sanos) y 10% son sintomáticos principalmente a nivel intestinal (disentería amebiana, rectocolitis aguda, colitis no disentérica crónica, ameboma) y extraintestinal (absceso hepático amebiano -AHA-, absceso cerebral, enfermedad genitourinaria y cutánea). Sin embargo, el 1% de las personas infectadas pueden desarrollar patologías potencialmente fatales como colitis amebiana fulminante o AHA (1, 2).
A lo largo de la historia de la infección por E. histolytica ha pasado por diversas etapas, desde el establecimiento de un consenso frente a aspectos taxonómicos del parásito (complejo E. histolytica/ E. dispar) hasta el desarrollo de técnicas diagnósticas cada vez más efectivas, ha llevado a la creación de un panorama cada vez más claro y real de la situación de esta entidad en el mundo.
A medida que los procesos diagnósticos se han vuelto más específicos, las tasas de prevalencia tienden a disminuir; en Colombia, esta situación se vio reflejada en varios estudios, en la Encuesta Nacional de Morbilidad de 1965 reveló una prevalencia de 24,5%; sin embargo, en dicho estudio no se logró diferenciar E. histolytica de E. hartmanni; luego la Encuesta Nacional de Morbilidad de 1980 mostró que aproximadamente 3’025.000 colombianos eran portadores asintomáticos de E. histolytica y 1’075.000 habían sufrido algún tipo de enfermedad amebiana intestinal o extraintestinal, además se reportó una frecuencia de amebiasis intestinal 12,1% y seroprevalencia del 6% (3), pero en el estudio no se estableció diferencia alguna entre E. histolytica y E. dispar. Más recientemente, en estudios puntuales realizados por Guzmán et al (4) y por Gallego et al (5) reportaron prevalencias de E. histolytica del orden de 1,4% y 0,6% respectivamente. Además, en diversos lugares del mundo suceden situaciones similares. Un estudio realizado en Ecuador en niños en edad escolar,mostró que la prevalencia se reduce al emplear técnicas con mayor especificidad (detección de antígeno, cultivo y estudios isoenzimáticos) frente al examen directo (6).
Recuento histórico
A principios del siglo XX, Shaudinn en 1903 propuso el nombre de Entamoeba histolytica, para designar a la especie patógena. Planteó la diferenciación entre las especies de E. histolytica y E. hartmanni teniendo controversia con Von Prowazek y otros investigadores. La diferenciación entre estas especies radica en su tamaño, siendo mayor de 10µ la primera patógena y la segunda no patógena menor de 10µ, aunque son morfológicamente idénticas (7).
Posteriormente, surgieron teorías que trataban de explicar por qué pacientes asintomáticos presentaban trofozoítos y quistes. Así surgió la hipótesis de Emile Brumpt en 1925, quien basado en observaciones clínicas y epidemiológicas y estudios experimentales en gatos, señaló la existencia de dos especies Entamoeba dispar y Entamoeba dysenteriae, morfológicamente idénticas, pero con la particularidad de que la primera actuaba únicamente como comensal en el intestino humano y la segunda con potencial patógeno, sin embargo este planteamiento fue rechazado por la comunidad científica internacional en esa época (8).
Luego, en 1928 la Comisión Internacional de Nomenclatura Zoológica dictaminó que Entamoeba fuese sinónimo de Endamoeba. Hacia la década del cincuenta, esta comisión revocó el dictamen de 1928, en diciembre de 1954 legitimó el uso de Entamoeba como nombre genérico suprimiendo el de Endamoeba (7).
A partir de los años sesenta, Louis Diamond et al, desarrollaron medio de cultivo axénico para E. histolytica. Luego en 1968, este autor introdujo el medio monofásico TPS-1 que comenzó a tener amplio uso pero fue remplazado por el TYI-S-33 aún en uso (9). El medio bifásico de Robinson, quien lo describió en 1968, es un medio mixto para el cultivo de amibas (10).
Sargeaunt y Williams en 1978, luego de varios años de investigación, lograron por primera vez diferenciar por medio de estudios electroforéticos de isoenzimas, cepas de E. histolytica aisladas de pacientes con manifestaciones clínicas de amebiasis y portadores asintomáticos, confirmándose que la E. histolytica está constituida por cepas patógenas y no patógenas (11).
Diamond y Clark, en 1993, redescriben la hipótesis de Brumpt de 1925, a la luz de estudios bioquímicos, inmunológicos y genéticos para concluir la evidencia de que existen dos especies morfológicamente idénticas, una patógena y otra no patógena que correspondían a E. histolytica y E. dispar respectivamente (12).
Pero sólo hasta 1997, la OMS aceptó esta hipótesis a través del comité de expertos, reunidos en Ciudad de México, reglamentó que es un complejo de dos especies, E. histolytica/E. dispar, morfológicamente idénticas pero sólo diferenciables mediante patrones isoenzimáticos y por determinación de adhesina en materia fecal o técnicas moleculares. Se recomendó reportar en exámenes por microscopia de luz la presencia de quistes como complejo E. histolytica/E. dispar; y la presencia de trofozoítos con glóbulos rojos en el citoplasma, en pacientes sintomáticos, indican la presencia de E. histolytica y por tanto requieren inicio de tratamiento (13, 14). Así, Haque et al sugieren tratar los pacientes sintomáticos con medicamento de acción sistémica seguido de intraluminal y los asintomáticos con amebicidas de acción intraluminal (15).
Estudios de laboratorio
Siempre debe analizarse el resultado de laboratorio en el contexto de la historia clínica y los aspectos epidemiológicos.
Para el diagnóstico de la amebiasis intestinal se pueden realizar exámenes con microscopía de luz que se basan en la identificación de los estadios del parásito (prequistes, quistes y trofozoítos) del complejo E. histolytica/E. dispar en heces (16). Además, la especie patógena puede visualizarse en tejidos invadidos por el proceso infeccioso. También a partir de cultivo in vitro identificar por isoenzimas cepas patógenas y no patógenas, determinación de componentes antigénicos (adhesina) y por pruebas de biología molecular diferenciar el complejo E. histolytica/E. dispar.
Como herramienta para el diagnóstico de amebiasis extraintestinal hay de diversas alternativas; los estudios imaginológicos como la radiografía de tórax, ecografía hepática y de vías biliares, la tomografía computarizada (TAC) y la resonancia magnética (RM). Así mismo, la determinación de anticuerpos en diferentes fluidos corporales como suero o saliva y de antígeno en el fluido del drenaje percutáneo del absceso hepático.
Además, están los estudios endoscópicos, como la rectosigmoidoscopia para visualizar las úlceras en botón de camisa de donde se debe tomar la biopsia para la búsqueda de los trofozoítos para hacer el diagnóstico diferencial con otras patologías del colon especialmente cuando la diarrea persiste a pesar del diagnóstico y tratamiento adecuado y en pacientes inmunocomprometidos por el riesgo de infección oportunista (16-19).
Adicionalmente, a todo paciente con cuadro clínico sugestivo de amebiasis extraintestinal se debe solicitar un cuadro hemático que puede revelar leucocitosis con neutrofilia y elevación de velocidad de sedimentación globular (VSG); las enzimas hepáticas (alanina-aminotransferasa, aspartato aminotransferasa, fosfatasa alcalina y tiempo de protrombina pueden estar aumentados con disminución de la albúmina sérica pero no permiten discriminar la etiología (17).
A continuación se detallan las pruebas diagnósticas:
Microscopía y pruebas bioquímicas
A través del tiempo el examen directo con solución salina y lugol, azul de metileno amortiguado ha sido la primera línea para la visualización del parásito, tanto de trofozoítos como quistes. También, se han utilizado otras técnicas de concentración y de fijación para tinciones especiales (hematoxilina férrica y tricrómica) con el fin de precisar características morfológicas específicas como el núcleo (cromatina uniforme y cariosoma central) y cuerpos cromatoidales en forma de tabaco (18).
En el examen directo de heces, el análisis morfológico de estructuras, inclusiones citoplasmáticas y elementos fagocitados como eritrocitos, junto con la movilidad del parásito son fuertes indicadores del potencial patogénico, pero requieren de gran experiencia del profesional. También, es prioritario examinar el espécimen entre 20 y 30 minutos después de la recolección de la muestra puesto que los trofozoítos se destruyen llevando a falsos negativos (20).
Existe dificultad para diferenciar entre un trofozoíto inmóvil de un leucocito, macrófago y células tisulares. La calidad de la muestra depende de que el recipiente sea limpio, seco y libre de orina y agua, pueden interferir (laxante, antibióticos como tetracicilna sulfonamidas, antiácidos, catárticos como sulfato de magnesio, antidiarreico como caolín, bismuto o enemas). Así mismo, se recomienda muestras seriadas de al menos tres para mejorar la sensibilidad; el uso de fijadores como el de Shaudinn, entre otros, sirve para transporte de la muestra a centros de referencia. Por otra parte, la fijación permite diferenciar el complejo E. histolytica/ E. dispar de otras como E. moshkovskii, E. coli y E. hartmanni; no obstante esta técnica es poco útil como ayuda diagnóstica porque requiere de varios días (21).
En el caso del portador asintomático elimina principalmente quistes más que trofozoítos en materia fecal, por tanto es muy importante desde el punto de vista epidemiológico (22); sin embargo, no se puede diferenciar al microscopio de luz la E. histolytica de la E. dispar, por tanto se requiere de otras pruebas para confirmar la especie. La infección puede ser causada por estas dos especies, pero la enfermedad o amebiasis propiamente dicha es causada por E. histolytica.
Cultivo y patrones isoenzimáticos
Estas técnicas constituyen la “prueba de oro” para la identificación del parásito, tienen alta sensibilidad y especificidad para el diagnóstico de esta entidad (21). Para el montaje de un cultivo es necesario una muestra del complejo E. histolytica/E. dispar, la cual se siembra en medios especiales con suplementos nutritivos, que contiene un agregado de cepas de Escherichia coli u otras bacterias que son nutrientes para el parásito y el cultivo axénico, sin bacterias, contiene colonias de parásitos con complementos multivitamínicos esenciales (9, 10, 23).
Los perfiles isoenzimáticos se basan en patrones electroforéticos de lisados provenientes de colonias en cultivos. Los sistemas enzimáticos ayudan a la determinación de zimodemas, los cuales son específicos de cada población, se determinan por el patrón electroforético que presentan ciertas enzimas que de acuerdo con las manifestaciones clínicas del paciente se catalogan en patrones patógenos y no patógenos. Estos estudios utilizan el perfil electroforético de al menos cuatro grupos enzimáticos: enzima málica (ME), glucosa fosfato isomerasa (GPI), hexokinasa (HK) y la fosfoglucomutasa (PGM). Mediante el análisis de las bandas descritas en el gel de electroforesis se determina la presencia de patrones específicos de banda b en ausencia de banda a con la enzima PGM para determinar si es una cepa patógena o no patógena (24-27). A pesar de los beneficios de estas dos técnicas no compensan sus altos costos, requerimientos técnicos y de infraestructura, sumados a la necesidad para su elaboración de periodos prolongados de tiempo, en comparación con otras técnicas (28). En consecuencia, no se emplean en la práctica clínica cotidiana.
Inmunodiagnóstico
Determinación del antígeno lectina en materia fecal y en drenaje de absceso hepático
El antígeno lectina de adhesión celular de galactosa o N-Acetil-D- galactosamina llamada adhesina de galactosa es una molécula compuesta por un heterodímero entre una cadena pesada (170 kDa) y una liviana (35/31 kDa), la cual es uno de los mecanismos patógenos más importantes, dado que si es bloqueado, el trofozoíto pierde su capacidad invasora. Esta prueba puede diferenciar E. histolytica de E. dispar al utilizar anticuerpos monoclonales específicos contra Gal/GalNAc lectina, con sensibilidad y especificidad mayores a 90% y en áreas endémicas permiten diferenciar infección reciente de pasada (18).
En resumen, se detecta el antígeno de adhesina en materia fecal y en el material del drenaje percutáneo. En Colombia estas pruebas se realizan sólo en algunos laboratorios de referencia (29-33).
Determinación de antígeno lectina (adhesina) y anticuerpos antilectina en suero
Dado que las características clínicas, imaginológicas (ecografía y TAC) y de laboratorio general (cuadro hemático, VSG, función hepática) del AHA y del AHNA no permiten hacer el diagnóstico diferencial y además la visualización del parásito en el drenaje del absceso es tan poco sensible por encontrarse muy adherido a la pared interna de la cavidad, se hacen necesarias pruebas no invasivas que permitan aproximarse con mayor certeza al diagnóstico etiológico del absceso; de otra parte, la presencia de quistes del complejo E. histolytica/E. dispar en materia fecal en caso de AHA es rara y este hallazgo no ayuda al diagnóstico etiológico.
Por lo anterior, Haque et al han desarrollado un método para detección de la Gal/GalNAc lectina de la E. histolytica y del anticuerpo contra la lectina en pacientes con AH en suero para el diagnóstico de AHA (18, 33). Es muy importante precisar que el paciente no haya recibido tratamiento, porque el porcentaje de detección del antígeno de lectina o el anticuerpo de lectina desciende como fue reportado por Haque et al en el año 2000. Sin embargo, en nuestro medio no se dispone estos métodos para el diagnóstico cotidiano (Tabla 1).
Pruebas serológicas
Existen otras técnicas que se desarrollaron a partir de los avances en inmunología del siglo pasado, la detección de anticuerpos y antígenos surgió como una alternativa económica frente a los cultivos y análisis de isoenzimas (21).
Los procedimientos serológicos más empleados para la determinación de amebiasis extraintestinal son: inmunodifusión (ID), contrainmunoelectroforesis (CIE), hemoaglutinación indirecta (HAI) y ELISA.
La ID es una reacción de antígeno (E. histolytica)-anticuerpo, se considerará como positiva la presencia de una banda de precipitación (34). La CIE fue una prueba empleada desde la década de los años setenta, antes del advenimiento de la ELISA. La HAI con especificidad alrededor de 99% y sensibilidad cercana a 93%, tiene la particularidad de ser rápida y económica, lo que la ha convertido, al igual que la técnica de ELISA, en candidata para ser utilizada como método rutinario (35-37).
Enzyme - Linked Immunosorbent Assay (ELISA) para anticuerpos IgG: es una reacción antígeno (E. histolytica)-anticuerpo. Se puede realizar determinación de diferentes tipos de anticuerpos específicos IgG, IgM e IgA.
La prueba de ELISA IgG contra E. histolytica para el diagnóstico de AHA es la prueba de referencia hasta el momento, estandarizada en Colombia en 1994, de fácil ejecución, bajo costo y disponible en algunas capitales y centros de referencia del país. Se consideran valores positivos de absorbancia mayores o iguales a 0,34, con sensibilidad del 95,7% y especificidad del 100% (36). Por tanto, se logra el diagnóstico diferencial de absceso hepático entre AHA y AHNA cuando la ELISA IgG contra E. histolytica es negativa, en tal caso es necesaria la punción del drenaje para precisar la etiología bacteriana, micótica y por otros parásitos (37-39).
Sin embargo, los hallazgos y limitaciones de las pruebas serológicas en nuestro medio continúan en discusión, los sueros de pacientes con colitis amebiana y AHA han mostrado valores altos de anticuerpos. Dada la persistencia de títulos positivos en áreas endémicas por años, en el momento es necesario correlacionar el cuadro clínico con el resultado de esta prueba; por lo tanto, el resultado de la prueba ELISA IgG contra E. histolytica sola sin el contexto de la historia clínica, no permite diferenciar una infección aguda de una pasada, como fue reportado en un caso clínico en el que se hizo seguimiento de la cinética de anticuerpos por Pinilla et al (40). Así, frente a un resultado positivo por ELISA en un paciente con absceso hepático (AH) que no mejora al tratamiento con metronidazol, al menos después de 72 horas, se debe realizar punción hepática dirigida por ecografía y proceder a realizar todos los exámenes descritos en la Figura 1 (17, 37, 38).
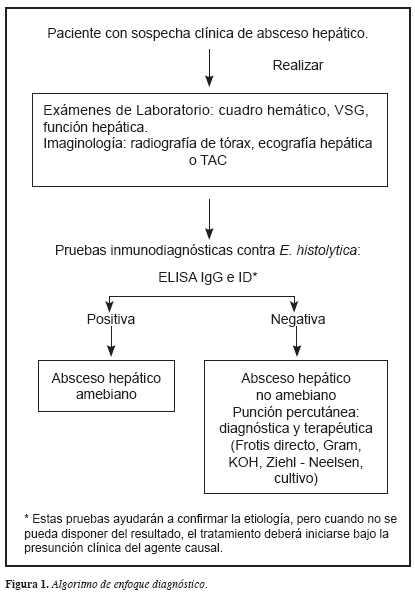
Pruebas moleculares
Por último, las pruebas de biología molecular como la reacción en cadena de polimerasa (PCR) se han usado esencialmente para el diagnóstico de amebiasis intestinal (18), pero en nuestro medio no son de uso clínico cotidiano.
Reacción en cadena de la polimerasa (PCR)
En la actualidad la sensibilidad y especificidad de la PCR son comparables con el cultivo de isoenzimas. En estudios comparativos de PCR con de detección de antígenos en heces mediante ELISA, reportaron valores discrepantes que correspondían a reacciones erradas con sustancias presentes en las heces, artificios del manejo de la muestra o muestras demasiado viejas, hecho que redujo considerablemente su sensibilidad y especificidad por lo que los autores recomiendan la estandarización de los procedimientos de laboratorio y manejo de muestras para garantizar resultados más confiables. Además se puede realizar la PCR en muestras del drenaje percutáneo del AH, pero no se indica de uso rutinario en la práctica clínica por requerir un procedimiento invasivo (41-44).
En la Facultad de Medicina de la Universidad Nacional de Colombia en este momento se está adaptando la PCR en materia fecal y en aislamientos de cultivos mixtos para la diferenciación del complejo E. histolytica/E dispar. Los resultados de este proceso de investigación serán relevantes y quizá podrán precisar la situación de prevalencia en Colombia de cada una de las especies del complejo. Lo anterior, dado que reportes como el de Stanley que informa la situación de pacientes asintomáticos en diversos países, en 2003, la mayor prevalencia fue de E. dispar (45).
Imaginología
Con el advenimiento de las diversas técnicas imaginológicas, a partir de la década de los ochenta, se agregó un componente crucial en el diagnóstico de esta entidad. Así, la ecografía (US), TAC y RM proporcionan evidencia clara de la lesión del parénquima hepático, las imágenes muestran una lesión circunscrita, relativamente bien definida, que contiene un material amorfo de baja densidad, virtualmente homogéneo. De otra parte, en las radiografías de tórax se puede observar la elevación del hemidiafragma derecho, derrame pleural de magnitud variable, condensación pulmonar o alteración de los arcos de la silueta cardiaca en caso de derrame pericárdico (47-49).
La TAC y la RM son dos de las técnicas imaginológicas más modernas; sin embargo, el avance en definición de imágenes, no compensan su alto costo, por esto el US ha permanecido como la prueba imaginológica de elección para el diagnóstico del AH por diversas razones como: bajo costo, fácil acceso, poco requerimiento técnico-profesional, calidad de la imagen, no requerir uso de medio de contraste u otro procedimiento invasivo, seguridad por no emitir ningún tipo de radiación, lo que permite utilizarlo en mujeres gestantes; pero debe ser realizada por un radiólogo con experiencia dado que la ecogenicidad varía de acuerdo con la evolución del absceso. Por todo lo anterior, la TAC se encuentra indicada en casos donde el US resulta dudoso y aún persiste la sospecha clínica por la persistencia de los signos y síntomas; con ésta se logran imágenes de mejor resolución facilitando la identificación de lesiones en el rango de milímetros, con la posibilidad de mejorar aun más la calidad de la imagen con el uso de material de contraste; también permite diferenciar lesiones hepáticas como absceso, hemangioma, quiste o tumor (17) (Figuras 2 y 3).
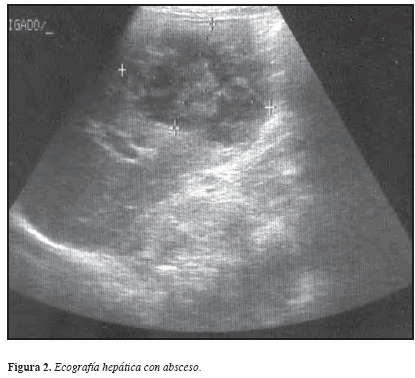
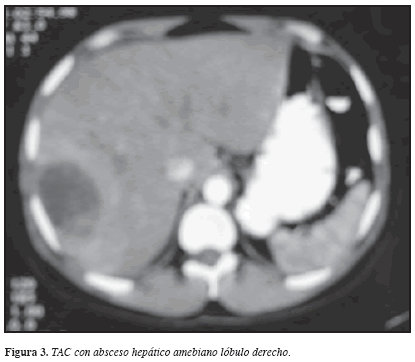
Sin embargo, a pesar de la alta sensibilidad y especificidad del US y la TAC para detectar patología hepática estas ayudas imaginológicas no permiten diferenciar la etiología de la lesión (amebiana, piógena o neoplásica) como ha sido reportado por Haque et al en 2003 (15). En el seguimiento de casos clínicos desde los comienzos de los años noventa en esta línea de profundización e investigación sobre amebiasis, se han encontrado pacientes con lesión única de origen amebiano como bacteriano, el absceso piógeno suele verse en racimo, el AHA puede presentarse desde una hasta 3-4 lesiones de predominio en lóbulo derecho por la anatomía funcional del drenaje de la porta (17).
Drenaje percutáneo
Dadas las inexactitudes de las técnicas imaginológicas se han intentado resolver mediante el análisis de los especímenes quirúrgicos o por drenaje percutáneo. El drenaje de la lesión fue utilizado en primera instancia, pero esta práctica fue abandonada al contrastar los resultados obtenidos frente a las implicaciones en la morbilidad del paciente y riesgos que implica todo procedimiento invasivo. En la actualidad el aspirado con aguja fina guiado por US permite un abordaje más preciso del área comprometida.
El material aspirado es viscoso, espeso y de una coloración marrón oscura que se denomina de “salsa de anchoas” ha sido usado como criterio diagnóstico para esta entidad; el análisis microscópico del aspirado con sensibilidad baja contiene detritus celulares, células de la respuesta inflamatoria, es estéril cuando no hay infección concomitante y rara vez se observan trofozoítos, en el tejido necrótico del centro de la lesión, pueden observarse en los tejidos vecinos a la pared del absceso (15-17).
No obstante, la punción evacuadora cada vez tiene menos indicaciones puesto que el inmunodiagnóstico ayuda a precisar la etiología amebiana, se reserva para abscesos localizados en el lóbulo izquierdo que tengan vecindad al pericardio, al peritoneo o a la cava inferior; anticuerpos para E. histolytica negativos, evolución tórpida al menos luego de 72 horas de haber iniciado el nitroimidazol como terapia específica de AHA; el criterio aislado del tamaño mayor a 5-10 cm no es indicativo para puncionar, como lo afirman algunos autores, debe ser analizado en el contexto específico de cada paciente, ni tampoco el hecho de estar localizado en el lóbulo izquierdo (15, 17, 47-49).
Igualmente, la utilidad del cultivo del drenaje es escasa, la sensibilidad es baja debido a que la presencia de parásitos vivos en la muestra de aspirado es casi nula. De igual forma, el análisis de las heces usualmente es infructuoso, porque generalmente el AHA no cursa con colitis amibiana concomitante (18, 49) (Tabla 1).
Histopatología
Ante la presencia de cuadros clínicos de difícil diagnóstico como son las formas exóticas de amebiasis, absceso cerebral, genitourinaria y cutánea, es necesario realizar biopsia para estudio histopatológico que permita precisar la etiología, es así como se han reportado casos de compromiso extraintestinal sin sintomatología clara.
Sharma et al publicaron un caso de una paciente con una masa renal de origen desconocido, sin antecedentes de compromiso infeccioso de origen urinario u otros síntomas constitucionales, el análisis del espécimen obtenido por aspiración mostró la presencia de E. histolytica (50). Calore et al reportaron una paciente con hidrosalpinx, al examen histológico se observó infiltrado inflamatorio con trofozoítos de E. histolytica (51).
En Colombia hay reportes de compromiso pericárdico, genitourinario, entre otros. Calvache et al reportaron un caso de cervicitis amebiana (48, 52).
Conclusiones
- La amebiasis intestinal y extraintestinal sigue siendo un problema de salud pública en Colombia y en países de área tropical; debe ser tenida en cuenta para cuadros clínicos abdominales, en particular ante la presencia de absceso hepático.
- En nuestro medio la etiología más frecuente de absceso hepático sigue siendo la amebiana.
- Debe analizarse los resultados de laboratorio en el contexto de la historia clínica y los aspectos epidemiológicos.
- En nuestro medio para el diagnóstico de amebiasis intestinal se realiza mediante la microscopia de luz que no diferencia las especias del complejo E .histolytica/ E. dispar, por lo cual se utiliza la prueba de adhesina que hace esta diferenciación. La estudios de endoscopia de vías digestivas bajas se emplean para visualizar la lesión y hacer el diagnóstico diferencias con otras patologías del colon como la colitis ulcerativa mediante el estudio histopatológico. Para la amebiasis extraintestinal, el cuadro clínico más frecuente es el absceso hepático para el cual se parte del cuadro clínico, seguido por la ecografía hepática y el inmunodiagnóstico (ID, ELISA IgG contra E. histolytica); la TAC queda reservada cuando la ecografía hepática plantea dudas diagnósticas. La radiografía del tórax permite precisar el compromiso pleural, pulmonar o pericárdico.
- La OMS recomienda reportar en exámenes por microscopía la presencia de quistes como complejo E. histolytica/E. dispar.
- Las pruebas de biología molecular como la PCR aún están en fase de adaptación en nuestro medio; en los resultados preliminares se observa que la frecuencia de E. dispar es superior como lo encontrado en otros países.
Agradecimiento
A la Universidad Nacional de Colombia por el apoyo a la línea de profundización sobre amebiasis intestinal y extraintestinal y sus complicaciones que se realiza con estudiantes de pregrado y posgrado desde 1995; además por la financiación del Proyecto DIB 8009028.
Referencias
1. Walsh JA, Warren KS. Selective primary health care: an interin strategy for disease control in developing countries. N Eng J Med 1979; 301: 967-74. [ Links ]
2. WHO Meeting. Amoebiasis and its control. Bull WHO 1985; 63: 417-26. [ Links ]
3. Cáceres E, Castaño de Romero L, Estupiñán D, López MC, Páez S, Pinilla CA, Santacruz MM. Parasitismo intestinal. En: Corredor A, Arciniegas E, Hernández CA, eds. Parasitismo intestinal. Ministerio de Salud, Instituto Nacional de Salud. Bogotá: Instituto Nacional de Salud; 2000 p.67-68. [ Links ]
4. Guzmán C, López MC, Reyes P, Gómez J, Corredor A, Agudelo CA. Diferenciación de Entamoeba histolytica y Entamoeba dispar en muestras de materia fecal por detección de adhesina de E. histolytica mediante ELISA. Biomédica 2001; 21: 167-71. [ Links ]
5. Gallego Ml, Gómez JE, Torres E, Lora F. Prevalencia de E. histolytica en asentamientos temporales post terremoto de la ciudad de Armenia. Infectio 2003; 7: 190-94. [ Links ]
6. Gatti S, Swierczynski G, Robinson F, Anselmi M, Corrales J, Moreira J, et al. Amebic Infections due to the Entamoeba histolytica-Entamoeba dispar Complex: a study of the incidence in a remote rural area of Ecuador. Am J Trop Med Hyg 2002; 67: 123–27. [ Links ]
7. Faust E C, Rusell PF, Jung RD, Craig Y. Faust Parasitologia Clínica. 1a ed. México DF: Salvat Editores; 1974.p.135. [ Links ]
8. Brumpt E. Étude sommaire de l’ Entamoeba dispar n. sp. Amibe à kystes quadrinucléés, parasite de l’homme. Bull Acad Méd (Paris) 1925; 94: 943-52. [ Links ]
9. Diamond LS. Axenic cultivation of Entamoeba histolytica. Science 1961; 134: 336-37. [ Links ]
10. Robinson GL. The laboratory diagnosis of human parasitic amoebae. Trans R Soc Trop Med Hyg 1968; 62: 285-94. [ Links ]
11. Sargeaunt PG, Williams JE. The differentiation of invasive and noninvasive Entamoeba histolytica by isoenzyme electrophoresis. Trans R Soc Trop Med Hyg 1978; 72: 519–21. [ Links ]
12. Diamond LS, Clark CG. A redescription of Entamoeba histolytica Shaudinn, 1903 (Emended Walker, 1911) separating it from Entamoeba dispar Brumpt, 1925. J Eukaryot Microbiol 1993; 40: 340–4. [ Links ]
13. WHO/PAHO/UNESCO report. A consultation with experts on amoebiasis. Mexico city, Mexico 28-29 January 1997. Epidemiol Bull 1997; 18: 13-4. [ Links ]
14. WORLD HEALTH ORGANIZATION. Amoebiasis. Wkly Epidemiol Rec 1997; 72: 97-99. [ Links ]
15. Haque R, Huston CD, Hughes M, Houpt E, Petri WA Jr. Amebiasis. N Engl J Med 2003; 348: 1565-73. [ Links ]
16. López MC, Corredor A, Nicholls RS, Agudelo CA, Alvarez CA, Cáceres E, et al. Atlas de parasitología. 1a ed. Bogotá: Manual Moderno. Universidad Nacional de Colombia; 2006.p.49. [ Links ]
17. Pinilla AE, López MC, Castillo B, Murcia M, Nicholls RS, Duque S, et al. Enfoque clínico y diagnóstico del absceso hepático. Rev Med Chil 2003; 131: 1411 – 20. [ Links ]
18. Tanyukselm M, Petri WA Jr. Laboratory diagnosis of amebiasis. Clin Microbiol Rev 2003; 16: 713-29. [ Links ]
19. Rivera MM. Diarrea aguda. En: Murgueitio R, Prada GD, Archila PE, Pinzón A, Pinilla AE, Londoño N, eds. Métodos diagnósticos en Medicina Clínica. Enfoque práctico. Primera edición. Bogotá, Editorial Médica Celsus; 2007. p. 191-8. [ Links ]
20. Gonzalez-Ruiz A, Haque R, Aguirre A, Castañon G, Hall A, Guhl F, et al. Value of microscopy in the diagnosis of dysentery associated with invasive Entamoeba histolytica. J Clin Pathol 1994; 47: 236–39. [ Links ]
21. Stauffer W, Ravdin JI. Entamoeba histolytica: an update. Curr Opin Infect Dis 2003; 16: 479–85. [ Links ]
22. Botero D, Restrepo M. Amibiasis intestinal. En: Botero D, Restrepo M, eds. Parasitosis Humanas. 4a. Ed. Medellín: Corporación para Investigaciones Biológicas; 2007.p.30-62. [ Links ]
23. Clark CG, Diamond LS. Entamoeba histolytica: a method for isolate identification. Exp Parasitol 1993; 77: 450-55. [ Links ]
24. Sargeaunt PG. Identification of stocks of non-pathogenic “Entamoeba histolytica”. Bull Soc Pathol Exot Filiales 1983; 16: 588-91. [ Links ]
25. Sargeaunt PG, Williams JE, Grene JD. The differentiation of invasive and noninvasive Entamoeba histolytica by isoenzyme electrophoresis. Trans R Soc Trop Med Hyg 1978; 72: 519–21. [ Links ]
26. Sargeunt PG, Williams JE, Bhojnani R, Kumate J, Jiménez E. A review of isoenzyme caracterization of Entamoeba histolytica with particular reference to pathogenic and non-pathogenic stocks isolated in Mexico. Arch Invest Med Mex 1982; 13 suppl 3: 89-94. [ Links ]
27. Sargeaunt PG. Zymodemes expressing posible genetic exchange in Entamoeba histolytica. Trans Roy Soc Med Hyg 1985; 79: 86-9. [ Links ]
28. Bruckner DA. Amebiasis. Clin Microbiol Rev 1992; 4: 356-69. [ Links ]
29. Abd-Alla MD, Jackson TF, Gathiram V, el-Hawey AM, Ravdin JI. Differentiation of pathogenic Entamoeba histolytica infections from non-pathogenic infections by detection of galactose-inhibitable adherence protein antigen in sera and feces. J Clin Microbiol 1993; 31: 2845-50. [ Links ]
30. Haque R, Kress K, Wood S, Jackson T, Lyerly D, Wilkins T, et al. Diagnosis of pathogenic Entamoeba histolytica infection using a stool ELISA based on monoclonal antibodies to the galactose specific adhesin. J Infect Dis 1993; 167: 247-9. [ Links ]
31. Haque R, Neville L, Hahn P, Petri WA Jr. Rapid diagnosis of Entamoeba infection by using Entamoeba and Entamoeba histolytica stool antigen detection kits. J Clin Microbiol 1995; 33: 2558-61. [ Links ]
32. Karki BM, Parija SC. Co-agglutination test for the detection of circulating antigen in amebic liver abscess. Am J Trop Med Hyg 1999; 60: 498-501. [ Links ]
33. Haque R, Mollah NU, Ali LK, Alam K, Eubanks A, Lyerly, et al. Diagnosis of amebic liver abscess and intestinal infection with the TechLab Entamoeba histolytica II antigen detection and antibody tests. J Clin Microbiol 2000; 38: 3235-9. [ Links ]
34. Ouchterlony O. In vitro method for testing the toxin producing capacity of Diphteria bacteria. Acta Pathol Microbiol Scand 1949; 26: 516-24. [ Links ]
35. Restrepo MI, Restrepo Z, Villarreal E, López C, Aguirre A, Restrepo M. Diagnostic tests for amoebic liver abscess: comparison of enzyme-linked immunosorbent assay (ELISA) and counterimmunoelectrophoresis (CIE). Rev Soc Bras Med Trop 1996; 29: 27–32. [ Links ]
36. Nicholls R, Restrepo M, Duque S, López MC, Corredor A. Standardization and evaluation of ELISA for the serodiagnosis of amoebic liver abscess. Mem Inst Oswaldo Cruz 1994; 89: 53-8. [ Links ]
37. Pinilla AE, López MC, Ricaurte O, Castillo B, Murcia MI, Nicholls RS, et al. Liver abscess caused by Ascaris lumbricoides: Case report. Rev Inst Med Trop Sao Paulo 2001; 43: 343-6. [ Links ]
38. Pinilla AE, López MC. Differential diagnosis of hepatic abscess through Entamoeba histolytica IgG ELISA antibodies. Trop Med Int Health 2007; 12:148. [ Links ]
39. Van Doorn HR, Hofwegen H, Koelewijn R, Gilis H, Peek R, Wetsteyn JC, et al. Use of rapid dipstick and latex agglutination tests and enzyme-linked immunosorbent assay for serodiagnosis of amebic liver abscess, amebic colitis, and Entamoeba histolytica cyst passage. J Clin Microbiol 2005; 43: 4801-6. [ Links ]
40. Pinilla AE, López MC, Viasus DF. Inmunoglobulina G en paciente con absceso hepático amebiano. Rev Fac Med Univ Nac Colomb 2006; 54: 117-23. [ Links ]
41. Acuña-Soto R, Samuelson J, De Girolami P, Zarate L, Millan-Velasco F, Schoolnick G, et al. Application of the polymerase chain reaction to the epidemiology of pathogenic and nonpathogenic Entamoeba histolytica. Am J Trop Med Hyg 1993; 48: 58-70. [ Links ]
42. Furrows SJ, Moody AH, Chiodini PL. Comparison of PCR and antigen detection methods for diagnosis of Entamoeba histolytica infection. J Clin Pathol 2004; 57: 1264–6. [ Links ]
43. Roy S, Kabir M, Mondal D, Ali IK, Petri WA Jr, Haque R. Real-time-PCR assay for diagnosis of Entamoeba histolytica Infection. J Clin Microbiol 2005; 43: 2168–72. [ Links ]
44. Hamzah Z, Petmitr S, Mungthin M, Leelayoova S, Chavalitshewinkoon-Petmitr P. Differential detection of Entamoeba histolytica, Entamoeba dispar, and Entamoeba moshkovskii by a single-round PCR assay. J Clin Microbiol 2006; 44: 3196–200. [ Links ]
45. Stanley SL. Amoebiasis. Lancet 2003; 361:1025-34. [ Links ]
46. Gómez JC, Cortés JA, Cuervo SI, López MC. Amebiasis intestinal. Infectio 2007; 11: 36- 45. [ Links ]
47. Stoopen ME, Kimura K. Absceso hepático amebiano, piógeno y fúngico. En: Stoopen ME, Kimura K y Ros PR, eds. Abdomen: hígado, bazo, vías biliares, páncreas y peritoneo, Tomo II. 1a ed. Philadelphia: Lippincott Williams & Wilkins; 1999.p.29-45. [ Links ]
48. Marín E, Pinilla AE, López MC. Absceso hepático amebiano. Revisión de 100 años de esta patología en Colombia. Acta Med Colomb 2000; 25: 218 - 26. [ Links ]
49. Fonte L. Amebas y amebiasis: aspectos conceptuales e históricos. En: Galindo LF, ed. Amebiasis: enfoques actuales sobre su diagnóstico, tratamiento y control. La Habana: Elfos Scientiae; 2000.p.114-45. [ Links ]
50. Sharma A, Chandel UK, Gupta Ml, Sharma V, Sharma RK. Amoebic renal cyst: a case report. Braz J Infect Dis 2005; 9: 266- 8. [ Links ]
51. Calore EE., Calore NMP, Cavaliere MJ. Salpingitis due to Entamoeba histolytica. Braz J Infect Dis 2002; 6: 97-9. [ Links ]
52. Calvache JA, Vásquez LR, González FE, Gómez C. Amebiasis extraintestinal: un caso de cervicitis amebiana. En: Memorias del XI Congreso Colombiano de Parasitología y Medicina Tropical. Biomedica 2003; 23 suppl 1: 93. [ Links ]














