Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Medica Colombiana
Print version ISSN 0120-2448
Acta Med Colomb vol.33 no.2 Bogotá Apr./June 2008
A propósito de dos nuevos casos en Colombia
Regarding two new cases in Colombia
(1) Coordinador Médico, Servicio de Nefrología y Diálisis, Hospital El Tunal E.S.E. Servicio de Terapia Renal, Hospital Universitario Clínica San Rafael, Bogotá, Colombia.
(2) Jefe Departamento de Patología y Laboratorios, Hospital, Universitario Fundación Santa Fe, Docente Facultades de Medicina, Universidad Nacional de Colombia y Universidad de los Andes, Bogotá, Colombia.
Correspondencia: Dr. Jorge de Jesús Cantillo Turbay, Calle 114 A Nº 56-34 AP 601, Teléfonos: (571) 7144372 – 5602009 – 5603284 - 5602464, Bogotá, D.C. E-mail: md_cantillo@yahoo.com y md_cantillo@hotmail.com
Recibido: 20/I/08 Aceptado: 14/V/08
Resumen
La poliangeítis microscópica (PAM) consiste en una vasculitis sistémica necrosante pauci-inmune que afecta a vasos muy pequeños, principalmente arteriolas de pequeño calibre, capilares y vénulas, fundamentalmente capilares glomerulares y, en ocasiones, capilares pulmonares. Causa disfunción renal predominantemente por una inflamación glomerular severa y falla renal. La PAM es una vasculitis primaria de etiología desconocida y comúnmente asociada a anticuerpos anticitoplasma del neutrófilo (ANCA). El diagnóstico está basado en las manifestaciones clínicas, el resultado de biopsias de lesiones relacionadas, la positividad de títulos de ANCA y justificado si un paciente con vasculitis sistémica de pequeños vasos pauci-inmunes no tiene evidencia de inflamación granulomatosa necrosante o asma. La gran mayoría de pacientes con vasculitis asociada a ANCA alcanzan el control temporáneo de la enfermedad con la terapia inmunosupresora actualmente disponible. Informamos dos nuevos casos de PAM en Colombia.
Palabras clave: poliangeítis microscópica, anticuerpos anticitoplasma del neutrófilo (ANCA), vasculitis de pequeños vasos asociadas a ANCA, glomerulonefritis.
Abstract
Microscopic polyangiitis (MPA) is a systemic pauci-inmune, necrotizing small-vessel vasculitis which affects very small blood vessels, principally small caliber pulmonary arteries, veins, and capillaries. It most often affects glomerular capillaries, but occasionally affects pulmonary capillaries. It can cause renal dysfunction or renal failure primarily by severe glomerular inflammation. MPA’s etiology is unknown, but it is commonly associated with antineutrophil cytoplasmic antibodies (ANCA). Diagnosis of MPA is based on clinical manifestations, results of biopsies, positive tests for ANCA, and the absence of clinical or pathological evidence of necrotizing granulomatous inflammation or asthma. A large majority of MPA patients achieve temporary control of the illness through immnosuppressant therapies currently available. We report on two new cases of MPA in Colombia.
Key words: microscopic polyangiitis, antineutrophil cytoplasmic antibodies (ANCA), small-vessel vasculitides associated with ANCA, glomerulonephritis.
Introducción
El término vasculitis comprende un número de entidades clinicopatológicas distintas y en las cuales cada una está caracterizada patológicamente por inflamación celular y destrucción de las paredes de los vasos sanguíneos y clínicamente por los tipos y sitios de los vasos afectados. Aunque múltiples esquemas de clasificación han sido propuestos para categorizar y simplificar la aproximación a estas enfermedades, recientemente su diagnóstico se basa en la identificación de manifestaciones particulares de patrones clínicos, radiológicos, de laboratorio y patológicos (1).
Las vasculitis pueden ser divididas en formas primarias, para lo cual la etiología es desconocida, y formas secundarias que resultan de una u otra forma de condiciones sistémicas tales como una enfermedad autoinmune o una infección conocida (2).
Las vasculitis de pequeños vasos asociadas a ANCA comprenden un grupo de desórdenes caracterizados por vasculitis necrosante con escasez de depósitos inmunes (pauci-inmune) en conjunto con autoanticuerpos dirigidos contra constituyentes del citoplasma de los neutrófilos, en particular proteinasa 3 (PR3) y mieloperoxidasa (MPO). Es común la glomerulonefritis (GN) con necrosis fibrinoide y formación de semilunas (3).
Las vasculitis asociadas a ANCA incluye la granulomatosis de Wegener (GW), la PAM y su forma renal limitada (GN extracapliar y necrosante idiopática pauci-inmune) y el síndrome de Churg-Strauss (SCS) (3-5). Varios estudios han sugerido que la incidencia de estas enfermedades es creciente (6); más de 20 casos/millón de habitantes están afectados. El diagnóstico rápido es esencial para reducir el daño permanente causado por vasculitis y muerte por hemorragia pulmonar y falla renal. Si estas condiciones no son tratadas, tienen una mortalidad de 80% a los dos años.
La supervivencia de estas condiciones es de 70-80% a los cinco años. La mortalidad temprana frecuentemente resulta por infecciones oportunistas. Los indicadores de mal pronóstico incluyen la edad avanzada, hemorragia pulmonar y enfermedad renal severa. La enfermedad renal en estadio final ocurre en 20-25% de los pacientes (4).
La PAM define una vasculitis necrosante con mínimos o ausencia de depósitos inmunes que afecta a vasos muy pequeños, principalmente arteriolas de pequeño calibre, capilares y vénulas, característicamente el capilar glomerular, y en ocasiones el capilar pulmonar. Causa disfunción renal predominantemente por una inflamación glomerular severa y falla renal (7-9). Los hallazgos anatomopatológicos en el riñón están determinados por el tiempo entre el inicio del compromiso, el diagnóstico y la biopsia renal. Tempranamente existe una lesión necrosante focal y segmentaria que evoluciona a una glomerulonefritis proliferativa extracapilar difusa con formación de semilunas. El grado de disfunción renal igualmente está relacionado con el tiempo que se tarda en hacer el diagnóstico, y es así, que no es rara la presentación inicial cuando ya existe una insuficiencia renal avanzada. Debido a esto, es primordial tener siempre un alto grado de sospecha de este tipo de enfermedad cuando se presente cualquier caso de insuficiencia renal aguda de tipo renal glomerular (8, 9).
Caso 1
Hombre de 56 años de edad quien desde cinco meses previos a su admisión refirió malestar general, hiporexia, astenia, adinamia, artromialgias, dorsolumbalgia, palidez progresiva, pérdida de peso (15 kg) y fiebre ocasional no cuantificada. Revisión por sistemas: cefalea bifrontal ocasional de predominio vesperal. Sin antecedentes de importancia. Examen físico: regulares condiciones generales, T: 37°C; PA: 140/90 mmHg; FR 18 x min.; FC 78 x min. Como únicos hallazgos positivos: acrodermatitis ocre izquierda y anodoncia parcial del maxilar superior e inferior. Los paraclínicos se resumen en la Tabla 1, los estudios de imagen mostraron ecografía renal normal y TAC de senos paranasales y de tórax sin signos de lesiones granulomatosas.
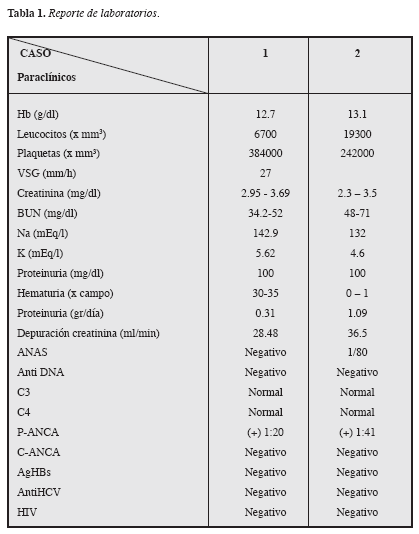
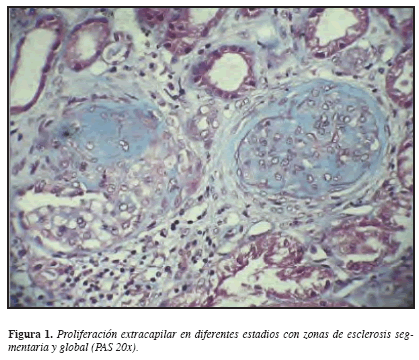
Considerando los hallazgos descritos, se practicó biopsia renal percutánea que demostró a la ML (microscopía de luz): glomerulomegalia: +, proliferación celular mesangial/endocapilar: ++ focal, proliferación extracapilar: ++ en siete glomérulos, tres fibrocelulares y tres celulares. Túbulo-intersticio: fibrosis +; nefritis intersticial: +++ mononuclear; cilindros hemáticos: +; atrofia tubular: +. Vasculares: arterias y arteriolas: esclerosis ++; IFI (inmunofluorescencia indirecta): negativa. ME (microscopía electrónica): no hay depósitos inmunes en ninguna localización, ni presencia de otros depósitos como amiloide, crioglobulinas, etc. Diagnóstico anatomopatológico: glomerulonefritis proliferativa extracapilar necrosante y segmentaria tipo III pauci-inmune. (Figura 1 y 2). Análisis: hombre de 56 años con síndrome constitucional de cinco meses de evolución, microhematuria, proteinuria leve aislada, anemia leve, VSG elevada, pANCA(+), glomerulonefritis proliferativa extracapilar pauci-inmune, compromiso de la función renal de origen glomerular, ausencia de asma y eosinofilia y la no demostración de lesiones granulomatosas. Se concluyó que el diagnóstico correspondía a una vasculitis sistémica primaria de pequeños vasos con criterios clasificatorios para poliangeítis microscópica. Se inicia terapia de inducción de la remisión (primeros tres meses) con prednisona oral 1 mg/k/día más ciclofosfamida oral 2 mg/k/día previa desparasitación, gastroprotección, calcio carbonato, calcitriol, inhibidores de la ECA e hipolipemiantes. Evolución: al tercer mes de tratamiento está en mejores condiciones generales, ganancia de peso, reducción de la creatinemia, mejoría del apetito, elevación de la Hb y desaparición del dolor lumbar, astenia y adinamia. Una vez alcanzó la remisión, iniciamos una fase de mantenimiento en la que continuamos con prednisona y cambiamos la ciclofosfamida por azatioprina.
Caso 2
Hombre de 56 años de edad quien desde dos meses previos a la admisión refirió malestar general, fiebre intermitente y pérdida importante de peso (12 kg). Un mes antes del ingreso, astenia, adinamia y hallazgo paraclínico de elevación de azoados (BUN 30 mg/dL y creatinina sérica de 2,3 mg/dL y al ingreso de 3,5 mg/dL) y uroanálisis con proteinuria y hematuria. Revisión por sistemas: disestesias ocasionales en miembros inferiores, precordialgia ocasional y disuria al final de la micción. Antecedentes: hipertensión arterial diagnosticada cinco meses antes y madre y hermanos hipertensos. Examen físico: buenas condiciones generales. T°C 37; PA 130/60 mmHg; FR 18 x min; FC 57 x min. Examen físico normal. Los paraclínicos se resumen en la Tabla 1, la ecografía renal evidenció aumento difuso de la ecogenicidad de parénquimas renales con siluetas de tamaño y forma normal. Los otros estudios imagenológicos no demostraron lesiones sugestivas de granulomas. Dada la emergencia renal, se inicia tratamiento así: metilprednisolona endovenosa 15 mg/k/día por tres días consecutivos y continuando posteriormente con prednisona oral 1 mg/k/día más ciclofosfamida 2 mg/k/día vía oral previa desparasitación.
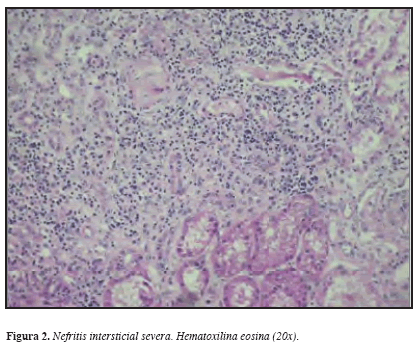
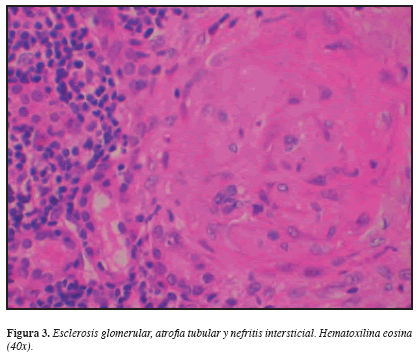
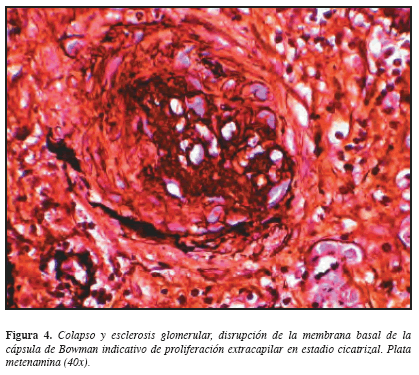
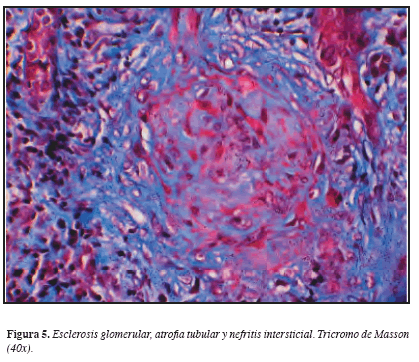
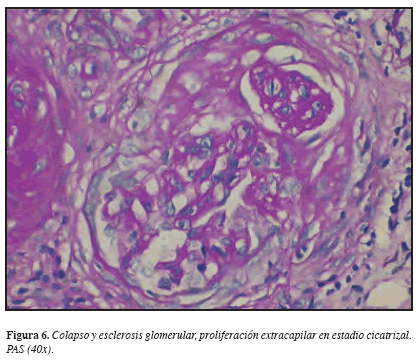
Considerando los hallazgos descritos, se practicó biopsia renal percutánea que demostró en la ML: 22 glomérulos con esclerosis global, 3 glomérulos con esclerosis extracapilar y sólo 3 normales. Glomerulomegalia +, hipoperfusión glomerular +, proliferación extracapilar ++; Túbulointersticio: edema intersticial +, fibrosis +, nefritis intersticial +++ mononuclear, cilindros hemáticos +, atrofia tubular +; Vasculares: arterias, esclerosis subintimal. IF: negativa. ME: no hay depósitos de complejos inmunes en ninguna localización. Diagnóstico anatomopatológico: Glomerulonefritis proliferativa extracapilar tipo III (pauci-inmune) en estadio avanzado. Nefritis tubulointersticial crónica severa. (Figuras 3, 4, 5 y 6). Análisis: hombre de 56 años con síndrome constitucional de dos meses de evolución, proteinuria no nefrótica, pANCA (+), glomerulonefritis proliferativa extracapilar pauci-inmune, compromiso de la función renal de origen glomerular, ausencia de asma y eosinofilia y la no demostración de lesiones granulomatosas. Se concluyó que el diagnóstico correspondía a una vasculitis sistémica de pequeños vasos con criterios clasificatorios para poliangeítis microscópica. Por mejoría clínica y paraclínica y una vez completados los primeros tres meses de tratamiento, iniciamos terapia de mantenimiento con azatioprina y glucocorticoides.
Discusión
El presente artículo de casos clínicos de PAM es el décimo que se publica en Colombia para completar un total de 18 casos informados en 63 años de historia de las vasculitis primarias en nuestro país y el caso 11 (once) publicado por Cantillo y cols (10, 11).
La incidencia de la PAM es aproximadamente de 1:100.000 por año, con una leve predominancia en hombres y un promedio de edad de inicio en la quinta década de la vida. (9, 12, 13). En esta serie, la distribución por edad fue similar, ambos pacientes tenían 56 años. Esta edad al momento de la presentación fue similar a otras publicaciones (9, 12, 13). La edad ha demostrado desempeñar un papel importante en el pronóstico de la PAM en pacientes de mayor edad comparados con pacientes jóvenes (9, 13-15).
En cuanto al sexo, hubo predominio del sexo masculino. Los hombres se afectan más que las mujeres en esta patología (9, 12, 13). No es sorprendente entonces, el predominio del sexo masculino a pesar de ser una serie pequeña.
La publicación en 1994 de la Conferencia de Consenso de Chapel Hill sobre la nomenclatura de las vasculitis sistémicas, presentó una definición operativa de la PAM así: “Vasculitis necrosante con mínimos o ausencia de depósitos inmunes que afecta a vasos pequeños, por ejemplo, capilares, vénulas o arteriolas. La glomerulonefritis es común. Los capilares pulmonares ocasionalmente están comprometidos”. (5, 9). Sin embargo, hoy día se sabe que la PAM es reconocida como una enfermedad sistémica altamente polimorfa que puede afectar cualquier órgano (15-18).
En esta serie, el promedio de duración de la enfermedad prodrómica fue de 14 semanas, lo cual es muy lejano a otros informes (19). La ocurrencia de enfermedad prodrómica de duración significante, indica en la mayoría de los casos, necesidad y oportunidad de diagnósticos más tempranos, y la adopción de pruebas serológicas adecuadas desarrolladas en un contexto clínico apropiado que ayudará a precisar los diagnósticos (19). El grado de disfunción renal, evaluado por el nivel de creatinina sérica, está en concordancia con valores citados por otras series (19).
Ambos pacientes tenían un síndrome constitucional severo en el momento de la presentación. Clínicamente, la PAM frecuentemente inicia con una prolongada fase prodromal caracterizada por síntomas constitucionales importantes (1, 20). Agard et al encontraron que los síntomas clínicos más comunes de presentación atribuibles a vasculitis en 36 pacientes con PAM eran síntomas generales (fiebre, pérdida de peso, astenia) (61%), seguido de mialgias (43%) y artralgias (29%) (21).
Teniendo en cuenta que ambos pacientes se presentan con falla renal aguda de origen glomerular y riñones de tamaño conservado en la ecografía (glomerulonefritis rápidamente progresiva-GNRP), existía el contexto clínico adecuado (escenario clínico sugestivo de vasculitis) para solicitar ANCA (22, 23), y dado que en esta condición, y en ausencia de tratamiento, alrededor de 85% de los pacientes alcanzan la insuficiencia renal terminal en algunos días, semanas o meses (24), se inició tratamiento con base en glucocorticoides y ciclofosfamida (CFM) (24). Además, durante fases de actividad de su enfermedad, los pacientes con vasculitis asociadas a ANCA deben recibir glucocorticoides y CFM hasta lograr la remisión (inducción de la remisión) (25).
A ambos pacientes de nuestra serie se les documentó p-ANCA (patrón de tinción perinuclear con o sin extensión nuclear). Los ANCA son predominantemente autoanticuerpos IgG dirigidos contra constituyentes de los gránulos primarios de neutrófilos y monocitos. Aunque varios blancos antigénicos han sido identificados, los ANCA dirigidos contra proteinasa 3 (PR3) o mieloperoxidasa (MPO) son clínicamente relevantes, mientras que la importancia de los otros ANCA permanece desconocida. Ambos están fuertemente asociados con vasculitis de pequeños vasos (26).
Cuando resultados positivos de inmunofluorescencia indirecta (IFI) y ELISA son combinados, la especificidad para vasculitis asociada a ANCA es de 99% y la sensibilidad para granulomatosis de Wegener (GW) y PAM es de 73% y 67%, respectivamente. Sin embargo, las pruebas de medición de ANCA por ambos métodos es altamente útil para excluir GN extracapilar y necrosante pauci-inmune con baja probabilidad pretest (valor predictivo negativo 99%); cuando hay alta sospecha clínica, la determinación de ANCA es más valioso para soportar tal diagnóstico (valor predictivo positivo 95%). Cerca de 60% de pacientes con PAM tienen MPO-ANCA y 30% tienen PR3-ANCA (26).
Los dos pacientes de nuestra serie desarrollaron GNRP en algún momento de su historia natural y como componente de la vasculitis sistémica de pequeños vasos pauci-inmune. La lesión renal más representativa de las vasculitis de pequeños vasos asociadas a ANCA es la glomerulonefritis proliferativa extracapilar pauci-inmune (escasez de reactividad inmune a la fluorescencia por las diferentes inmunoglobulinas y fracciones del complemento y la ausencia de depósitos electrodensos en la ultraestructura en número significativo) con formación de semilunas. Las lesiones granulomatosas son raras en el riñón (24, 27). Las GN con proliferación extracapilar se caracterizan por la existencia de un acúmulo de células en forma de “semilunas” que desplazan y ocupan las estructuras normales del ovillo glomerular. Las glomerulonefritis extracapilares asociadas a ANCA son de tipo III, es decir, que en la inmunofluorescencia hay un mínimo o no hay depósitos de material inmune en el ovillo glomerular. En el estudio con microscopio óptico aparecen zonas de necrosis segmentaria por lo que se denomina GN proliferativa extracapilar necrosante pauci-inmune. Se considera que este tipo III constituye una forma de vasculitis limitada al riñón (24).
Las tres principales categorías de vasculitis sistémica de pequeños vasos pauci-inmune son la PAM, la GW y el síndrome de Churg-Strauss (SCS). Estas patologías comparten una vasculitis necrosante histológicamente idéntica que puede afectar arterias, arteriolas, vénulas, y capilares, especialmente capilares glomerulares. La lesión glomerular de las GN pauci-inmunes asociadas a ANCA comienza con una necrosis fibrinoide segmentaria que rápidamente evoluciona a formación extracapilar. Al momento de la biopsia renal, aproximadamente 90% de los pacientes con GN extracapilar pauci-inmune tienen algún grado de necrosis glomerular y formación de semilunas, aunque esto puede comprometer menos de 50% de los glomérulos. Arteritis, arteriolitis y angeítis medular son vistos en menos de 20% de los especímenes de biopsia renal.
Las manifestaciones renales de las vasculitis de pequeños vasos son variadas. La mayor parte de los pacientes se presentan con GNRP (ambos casos), hematuria (Caso 1), proteinuria (ambos casos), y elevación de la creatinina sérica en el curso de días a semanas (ambos casos). Esta presentación clínica está asociada con los hallazgos patológicos de necrosis glomerular y formación de semilunas. Invariablemente, la inflamación intersticial resulta en fibrosis intersticial.
La proteinuria en la GN asociada a ANCA es usualmente debido a esclerosis glomerular o GN extracapilar y necrosante severa. En la mayoría de los casos de nefritis aguda o GNRP, la cantidad de proteinuria está por el orden de los 500 a 3.000 mg en 24 h. Ciertamente, hay casos de proteinuria en rango nefrótico típicamente asociada a glomeruloesclerosis difusa (9).
Ambos pacientes de nuestra serie fueron admitidos con vasculitis “generalizada-forma severa”, es decir, con manifestaciones de vasculitis que amenazaron la función de órganos vitales (GNRP) (1, 28, 29). En este contexto, se consideró (al momento de la presentación) que tenían una fase severa de la enfermedad, por tanto, ambos recibieron terapia agresiva de inducción de remisión (primeros tres meses) con base en glucocorticoides y CFM. Ambos casos alcanzaron la remisión e iniciaron una fase de mantenimiento (terapia menos agresiva) con glucocorticoides y azatioprina (AZT). En vista de la considerable toxicidad de la CFM, estrategias para limitar su exposición han sido evaluadas recientemente. El reemplazo de CFM por AZT después de exitosa inducción de la remisión ha sido demostrado que no incrementa la tasa de recaídas comparado con la continuación de la CFM (estudio Cicazarem) (28-30).
Dada la alta toxicidad acumulativa de la CFM, el tratamiento debe ser cambiado a agentes menos tóxicos como el metotrexate (MTX), AZT o mofetil micofenolato (MMF) una vez que la remisión es alcanzada (28-30).
Para finalizar, la combinación de datos clínicos y morfológicos ayuda a determinar el pronóstico y la posible respuesta al tratamiento. Para el Caso 1, había datos de mal pronóstico: sexo masculino, proliferación extracapilar fibrocelular en 3 glomérulos, fibrosis intersticial +, nefritis intersticial mononuclear +++, atrofia tubular + y arterioloesclerosis ++. Para el Caso 2: sexo masculino, esclerosis global en 22 glomérulos, fibrosis intersticial +, edema intersticial +, nefritis intersticial mononuclear +++, atrofia tubular + y arterioloesclerosis subintimal (14, 31, 32).
Referencias
1. Frankel SK, Cosgrove GP, Fischer A, Meehan RT, Brown KK. Update in the Diagnosis and Management of Pulmonary Vasculitis. Chest 2006; 129: 452-65. [ Links ]
2. Rodriguez-Pla A, Stone JH. Vasculitis and systemic infections. Curr Opin Rheumatol 2006; 18: 39-47. [ Links ]
3. Kallenberg C.G.M. Antineutrophil cytoplasmic autoantibody-associated small-vessel vasculitis. Curr Opin Rheumatol 2007; 19: 17-24. [ Links ]
4. Harper L, Weidanz F. Small vessel vasculitides. Medicine 2006; 34: 456-63. [ Links ]
5. Bosch X, Guilabert A, Font J. Antineutrophil cytoplasmic antibodies. The Lancet 2006; 368: 404-18. [ Links ]
6. Watts RA, Scott DG. Epidemiology of the vasculitides. Curr Opin Rheumatol 2003; 15: 11-6. [ Links ]
7. Jennette JC, Falk RJ. The pathology of vasculitis involving the kidney. Am J Kidney Dis 1994; 24: 130-41. [ Links ]
8. Mirapeix E. Vasculitis y riñón. En: Avendaño LH, Aljama García M, Arias Rodríguez M, Caramelo Díaz C, Egido de los Ríos JE, Lamas Peláez S, eds. Nefrología Clínica. Madrid: Editorial Médica Panamericana S.A.; 2003.p.405-16. [ Links ]
9. Nachman PH, Jennette JC, Falk RJ. Vasculitic diseases of the kidney. En: Schrier RJ, ed. Diseases of the kidney & urinary tract. Philadelphia: Lippincott Williams & Wilkins; 2007.p.1748-75. [ Links ]
10. Cantillo J, Restrepo JF, Coral P, Alvarez F, Rondón F, Sánchez A, et al. Vasculitis primarias: 62 años de historia en Colombia. Rev Colomb Reumatol 2006; 13: 288-305. [ Links ]
11. Olmos CE, Pinilla DR, Rojas LA, Mantilla RD, Iglesias A. Poliangeítis microscópica y respuesta a la terapia Anti-CD 20. Rev Colomb Reumatol 2007; 2 suppl 1: 41. [ Links ]
12. Collins CE, Quismorio FP Jr. Pulmonary involvement in microscopic polyangiitis. Curr Opin Pulm Med 2005; 11: 447-51. [ Links ]
13. Samarkos M, Loizou S, Vaiopoulos G, Davies KA. The clinical spectrum of primary renal vasculitis. Semin Arthritis Rheum 2005; 35: 95-111. [ Links ]
14. Uezono S, Sato Y, Hara S, Hisanaga S, Fukudome K, Fujimoto S, et al. Outcome of ANCA-associated primary renal vasculitis in Miyazaki Prefecture. Intern Med 2007; 12: 815-22. [ Links ]
15. Shiboski CH, Regezi JA, Sanchez HC, Silverman S Jr. Oral lesions as the first clinical sign of microscopic polyangiitis: A case report. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2002; 6: 707-11. [ Links ]
16. Komanduri S, Jakate S, Keshavarzian A. Focal rectal capillaritis: microscopic polyangiitis presenting as painless rectal bleeding. J Clin Gastroenterol 2002; 2: 159. [ Links ]
17. Cantillo J. de J, Andrade RE. Glomerulonefritis Rápidamente Progresiva y perforación intestinal por Poliangeítis Microscópica. Acta Med Colomb 2006; 3: 125-30. [ Links ]
18. Klisovic DD, Foster CS. Microscopic polyangiitis and ocular disease. Contemporary Ophthalmology 2006: 1-7. [ Links ]
19. Gallagher H, Kwan JT, Jayne DR. Pulmonary renal syndrome a 4-year, single-center experience. Am J Kidney Dis 2002; 39 : 42-7. [ Links ]
20. Segelmark M, Selga D. The challenge of managing patients with polyarteritis nodosa. Curr Opin Rheumatol 2007; 19: 33-8. [ Links ]
21. Agard C, Mouthon L, Mahr A, Guillevin L. Microscopic polyangiitis and polyarteritis nodosa: how and when do they start?. Arthritis Rheum 2003; 49: 709-15. [ Links ]
22. Schmitt WH, van der Woude FJ. Clinical applications of antineutrophil cytoplasmic antibody testing. Curr Opin Rheumatol 2004; 16: 9-17. [ Links ]
23. Savige J, Pollock W, Trevisin M. What do antineutrophil cytoplasmic antibodies (ANCA) tell us?. Best Pract Res Clin Rheumatol 2005; 2: 263-76. [ Links ]
24. Mirapeix E. Glomeruronefritis extracapilares. En: Avendaño LH, Aljama García M, Arias Rodríguez M, Caramelo Díaz C, Egido de los Ríos JE, Lamas Peláez S. eds. Nefrología Clínica. Madrid: Editorial Médica Panamericana, S.A.; 2003.p.315-321. [ Links ]
25. Crispín JC, Díaz-Jouanen E. Vasculitis generalizadas: tratamiento convencional y nuevas perspectivas. Rev Mex Reumat 2004; 5: 325-33. [ Links ]
26. Bosch X, Guilabert A, Font J. Antineutrophil cytoplasmic antibodies. Lancet 2006; 368: 404-18. [ Links ]
27. Merkel PA, Choi HK, Niles JL. Evaluation and treatment of vasculitis in the critically ill patient. Crit Care Clin 2002; 18: 321-44. [ Links ]
28. Goek ON, Stone JH. Randomized controlled trials in vasculitis associated with anti-neutrophil cytoplasmic antibodies. Curr Opin Rheumatol 2005; 17: 257-64. [ Links ]
29. Ozaki S. ANCA-associated vasculitis: diagnostic and therapeutic strategy. Allergol Int 2007; 56: 87-96. [ Links ]
30. Kallenberg C GM, Heeringa P, Stegeman CA. Mechanisms of Disease: pathogenesis and treatment of ANCA-associated vasculitides 2006. Nat Clin Pract Rheumatol 2006; 2: 661-70. [ Links ]
31. Hauer HA, Bajema IM, Hagen EC, Noël LH, Ferrario F, Waldherr R, et al. Long-term renal injury in ANCA-associated vasculitis: an analysis of 31 patients with follow-up biopsies. Nephrol Dial Transplant 2002; 17: 587-96. [ Links ]
32. Neumann I, Kain R, Regele H, Soleiman A, Kandutsch, Meisl FT. Histological and clinical predictors of early and late renal outcome in ANCA-associated vasculitis. Nephrol Dial Transplant 2005; 20: 96-104. [ Links ]














