Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Medica Colombiana
Print version ISSN 0120-2448
Acta Med Colomb vol.33 no.4 Bogotá Oct./Dec. 2008
(1)Internistas Hepatólogos, Unidad Hepatología y Trasplante Hepático. Hospital Pablo Tobón Uribe (HPTU), Profesores Asociados. Medellín, Colombia;
(2)Epidemiólogo Unidad de Investigaciones HPTU. Profesor Asociado. Medellín, Colombia;
(3)Jóvenes Investigadores. Estudiantes Medicina General, Universidad de Antioquia. Medellín, Colombia;
(4)Patólogo, Profesor Asociado, Universidad de Antioquia. Medellín, Colombia;
(5)Pediatras Gastroenterólogas, Unidad Hepatología y Trasplante Hepático. Hospital Pablo Tobón Uribe (HPTU), Profesoras Asociadas. Facultad de Medicina y Grupo de Gastrohepatología. Universidad de Antioquia. Medellín, Colombia.
Correspondencia: al Dr. Juan-Carlos Restrepo, E-mail: jcrestrepo@hptu.org.co
Recibido: 13/VI/08 Aceptado: 03/IX/08
Resumen
El hígado es el principal órgano que sirve de primer paso en la biotransformación de la mayoría de los medicamentos, los cuales en algunos casos pueden conllevar a toxicidad hepática, debido a la acción tóxica directa y/o factores idiosincráticos. El diagnóstico suele ser difícil y por ello se han establecido escalas para evaluar daño hepático inducido por medicamentos. El objetivo de nuestro estudio consiste en describir las características clínicas, bioquímicas y epidemiológicas de los casos de hepatotoxicidad medicamentosa documentadas en las historias clínicas de los pacientes evaluados por la unidad de hepatología de un hospital de cuarto nivel en la ciudad de Medellín, Hospital Pablo Tobón Uribe (HPTU), entre enero 2001 y enero 2008.
Se presenta un análisis estadístico de 42 casos de hepatotoxicidad medicamentosa atribuida a fármacos como los antibióticos, inmunosupresores, anticonvulsivantes, analgésicos, entre otros. Todos fueron evaluados por la escala de daño hepático inducida por medicamentos y tuvieron desenlaces como hepatitis aguda, falla hepática, trasplante, etc.
Palabras clave: hepatotoxicidad, reacciones hepatotóxicas por drogas, injuria hepática.
Abstract
The liver is the main first-step organ involved in the metabolism of most medications. Therefore it is vulnerable to drug toxicity in some cases, due to direct toxic action and/or to idiosyncratic factors. The diagnosis is usually difficult; therefore there are some scales whose purpose is to assess hepatic damage induced by drugs. The objective of our study is to describe the clinical, biochemical and epidemiological characteristics of cases of hepatotoxicity documented in the case histories of patients evaluated by the hepatology unit of a fourth-level hospital in the city of Medellin, Hospital Pablo Tobón Uribe (HPTU), between January 2001 and January 2008.
A statistical analysis is presented of 42 cases of liver toxicity ascribed to drugs such as antibiotics, immunosuppressants, antiepileptics, and analgesics, among others. All were evaluated using the scale of hepatic damage induced by medications, and they had outcomes like acute hepatitis, hepatic failure, transplant, etc.
Key words: hepatotoxicity, hepatotoxic drug reactions, hepatic injury.
Introducción
Cuando se habla de los medicamentos prescritos como de los no prescritos, el hígado es el principal órgano que sirve de primer paso en la biotransformación de estos fármacos luego de su absorción intestinal. Éstos atraviesan las membranas celulares y son absorbidos, luego son sometidos a un proceso bioquímico donde se convierten en sustancias hidrofílicas para ser filtradas y excretadas por el riñón o en la bilis (1). Aquí el hígado desempeña un papel central a través de complejos sistemas enzimáticos encargados de la oxidación y conjugación con glucorónido, glutatión o sulfato. Y aunque se conocen todas estas vías metabólicas, en especial el sistema citocromo P450 (2-4), la toxicidad de estas sustancias cuando se usan con fines terapéuticos depende de múltiples factores denominados idiosincráticos (5), sin desconocer el efecto tóxico directo, dosis dependiente, de algunos medicamentos como por ejemplo el acetaminofén (6, 7).
Algunos factores individuales prevenibles y no prevenibles, como el consumo de alcohol, la edad avanzada, factores genéticos (polimorfismos, variantes en las isoenzimas de CYP450, acetiladores lentos), género (las mujeres acetilan mas lento), dieta, embarazo, índice de masa corporal (IMC), enfermedad hepática y enfermedades que intervienen con la farmacodinamia de los medicamentos como las renales, hacen al paciente más susceptible a la toxicidad por medicamentos (3, 8).
Además de los factores individuales, existen factores de riesgo externos como el uso concomitante de varios medicamentos, la prescripción inadecuada, información insuficiente sobre la farmacocinética y la farmacodinamia, la automedicación y el uso de sustancias con fines no terapéuticos, entre otros (9).
La injuria hepática
La toxicidad hepática por medicamentos consiste en un daño citolítico o citotóxico, daño canalicular o la combinación de ambos. Tal agresión al hepatocito ocurre por seis mecanismos, no necesariamente todos presentes, como: pérdida en la homeostasis del calcio intracelular, interrupción sobre procesos como la bomba transportadora MRP3, respuesta inmunológica frente a la unión covalente entre enzima-droga, inhibición de la beta oxidación en la mitocondria y apoptosis a través de la vía de las caspasas (10).
El daño inducido puede dar lugar a diferentes patrones de presentación clínica, que a partir de los valores de bilirrubina total (BT), bilirrubina directa (BD), aspartato aminotransferasa (AST), alanino aminotransferasa (ALT), fosfatasa alcalina (FA) y gammaglutamil transferasa (GGT); pueden ser definidos como: citolítico, colestásico, mixto o infiltrativo (11). La lesión citolítica se caracteriza por elevación de la ALT mayor de dos veces el límite superior de lo normal, o una relación ALT/FA mayor o igual a cinco; mientras que la colestásica se presenta con elevación de la FA más de dos veces y una relación ALT/FA menor o igual a dos (12, 13).
Así entonces, estos hallazgos del perfil hepático son sugestivos de un posible episodio hepatotóxico y la conducta esperada en la mayoría de los casos será suspender la administración del medicamento. Además, el médico ha de tener en cuenta que en la actualidad no existe un tratamiento efectivo para los casos de hepatotoxicidad ya instaurados, a excepción de la sobredosificación con acetaminofén, tratada con N-acetilcisteína y la injuria mitocondrial inducida por el ácido valproico, la cual es tratada con carnitina intravenosa (14).
Por otra parte, los pacientes deberán tener un estricto monitoreo en espera de los diferentes desenlaces sobre el hígado, como la hepatitis aguda, la colestasis crónica o hepatitis crónica (15), y en especial, en espera de un cuadro de falla hepática que por reacciones de idiosincrasia producen la muerte en por lo menos un 80% de los casos (16).
El diagnóstico suele ser difícil, no sólo porque la relación temporal entre la ingesta de la droga y la toxicidad no siempre es clara, sino también porque los pacientes pueden consumir varios posibles agresores a la vez o padecer enfermedades hepáticas que se sobreponen con la injuria por tóxicos, como es el caso de la esteatohepatitis no alcohólica (NASH), una patología de alta prevalencia. De tal manera, se debe sospechar lesión tóxica en todo paciente con disfunción hepática (10).
Con el propósito de aclarar este diagnóstico, se han desarrollado varias escalas de causalidad de toxicidad por drogas, como las utilizadas en el Council for International Organizations of Medical Sciences Scale (CIOMS), y la escala clínica de María & Victorino (M & V); sin embargo, son poco conocidas y de mínimo uso por el clínico (17-21).
A pesar de que existen diversas escalas y el criterio clínico ha permitido la detección de la injuria hepática por medicamentos, la prevalencia de hepatotoxicidad por medicamentos es desconocida. Solamente en Francia, un estudio poblacional encontró una incidencia anual de 13,9 por 100.000 habitantes (22).
Por lo anterior, y la necesidad del uso clínico de múltiples medicamentos con efectos adversos sobre el hepatocito, y la falta de estudios sobre toxicidad hepática inducida por fármacos de parte de las instituciones tratantes a nivel nacional, el objetivo de nuestro estudio es describir las características clínicas, bioquímicas, y epidemiológicas de los casos de hepatotoxicidad medicamentosa documentadas en las historias clínicas de los pacientes evaluados por la unidad de hepatología de un hospital de cuarto nivel de la ciudad de Medellín, Hospital Pablo Tobón Uribe (HPTU), entre enero 2001 y enero 2008.
Para tal finalidad, los objetivos específicos planteados fueron: 1) describir los factores de riesgo asociados, prevenibles y no prevenibles, 2) descripción del perfil bioquímico, 3) describir su presentación clínica y desenlace, 4) tipo de sustancia asociada a hepatotoxicidad y 5) clasificar el grado de daño hepático según la escala establecida.
Material y métodos
En función de los objetivos propuestos, se recolectaron las historias clínicas de los pacientes con diagnóstico de hepatotoxicidad medicamentosa evaluados en los servicios de consulta externa y hospitalización del HPTU por la unidad de hepatología. Se aplicó el criterio de inclusión a todos los pacientes evaluados en el HPTU desde el 1o. de enero de 2001 hasta el 1o. de enero de 2008, con diagnóstico de ingreso, egreso o secundario, de hepatotoxicidad medicamentosa. Entendiendo hepatotoxicidad medicamentosa como: la alteración del perfil bioquímico o del patrón histológico hepático que no sea explicado por otra patología y que tenga relación cronológica con el uso de algún hepatotóxico. Sumado a este criterio, se tuvo en cuenta que el investigador tuviera acceso a la información de la mayoría de las variables contempladas para la evaluación de los objetivos propuestos.
Las variables tenidas en cuenta para los objetivos y que fueron recolectadas para cada caso en una base de datos diseñada en Excel fueron las siguientes:
- Factores de riesgo: edad, género, talla, peso, consumo de alcohol, polimedicación, automedicación, embarazo, antecedente de enfermedad hepática, antecedente de enfermedad renal y hospitalización al ingreso.
- Laboratorio Clínico: BT, BD, AST, ALT, FA, GGT, albúmina, TP, creatinina, BUN, recuento de leucocitos, porcentaje de eosinófilos, positividad del antígeno superficie (HBsAg), positividad de anticuerpos contra la hepatitis C (anti-VHC) y anticuerpos antinucleares (ANAS).
- Clínica: fatiga, ictericia, fiebre, rash, linfadenopatía, hepatomegalia, prurito, adinamia, ascitis y encefalopatía.
- Desenlaces (observados por diagnóstico de egreso): hepatitis aguda, hepatitis crónica, falla hepática, cirrosis, trasplante, muerte y resolución.
- Medicamentos: fármaco(s) asociado(s) a episodio de hepatotoxicidad a criterio del médico tratante, dosis y variables necesarias para la aplicación de la escala de daño hepático inducido por drogas como: tiempo desde ingesta hasta inicio de primera manifestación clínica o de laboratorio, tiempo de suspensión de la droga hasta inicio de manifestaciones clínicas, reporte de otras enfermedades hepáticas concomitantes, reporte de manifestaciones extrahepáticas (artralgias, citopenias, etc.), reporte de reexposición al medicamento. Información que permitió la aplicación de la escala para clasificar el cuadro clínico como definitivo, probable, posible, improbable o excluido para daño hepático por un medicamento. De aquí, se consideró a su vez como criterio de exclusión, para el análisis estadístico, aquellos pacientes con un cuadro improbable o excluido de hepatotoxicidad por el puntaje de la escala.
Para el análisis de la base de datos se utilizó el programa SPSS 13.0 en el cual se utilizó la prueba de Kolmogorov-Smirnov.
Ya en el análisis, para efecto de clasificación del daño hepático como hepatocelular, se definió como incremento tres veces el valor AST y/o ALT por encima del valor superior normal de referencia. Colestásico definido como aumento tres veces el valor referencia superior normal de BT y BD, sin incremento mayor tres veces AST o ALT. Mixto establecido como el incremento tres veces el valor superior normal de referencia de AST y/o ALT, BT y BD. Finalmente, el patrón infiltrativo se determinó como el valor tres por encima del valor superior normal de FA y GGT.
Resultados
Dentro del tiempo establecido se hallaron 56 historias clínicas de pacientes con diagnóstico de hepatotoxicidad, de las cuales se analizaron 42. Fueron descartados 12 pacientes debido a falta de acceso a la información solicitada por el protocolo de investigación, y dos casos por clasificar como excluidos en la escalda de daño hepático.
Factores de riesgo asociados (Tabla 1)
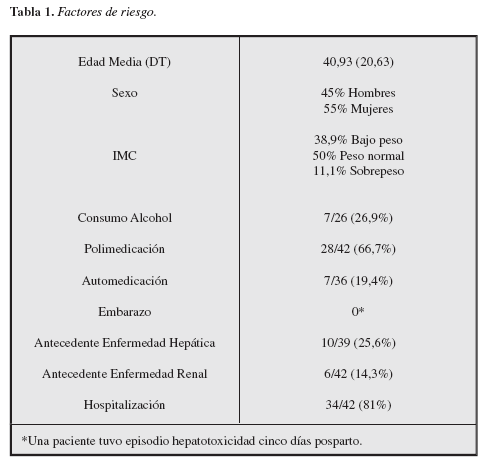
Dentro de los factores de riesgo considerados se obtuvo como resultado: una edad media de 40,9 años, siendo los extremos de la población cinco meses y 67 años de edad; 55% fueron mujeres y 45% hombres. Cifras de IMC que ubican 38,9% de los pacientes con bajo peso al momento del diagnóstico, 50% con peso normal y 11,1% con sobrepeso.
Por otro lado, el consumo de alcohol se halló en un 26,9% de los casos, polimedicación en el 66,7% y automedicación 19,4%.
Por su parte, el porcentaje de embarazos fue de 0% al momento del episodio tóxico, aunque se dio el caso de una paciente con hepatotoxicidad cinco días posparto atribuida al consumo de seis cápsulas de amoxicilina de 500 mg.
Los antecedentes de enfermedad hepática y renal dentro del total de casos fueron 30,8% y 14,3%, respectivamente. Mientras que el 81% de los pacientes estuvo hospitalizado al momento del diagnóstico de hepatotoxicidad medicamentosa.
Perfil bioquímico (Tabla 2)
Al observar los parámetros de laboratorio se encontró una media de BT de 13,4 mg/dL y BD de 8,9 mg/dL. Los marcadores de daño hepatocelular, como son la AST y ALT, tuvieron un valor de mediana de 170 UI/L y 138,5 UI/L respectivamente; al igual que para la FA de 218 UI/L y GGT 255 UI/L. Y con relación a las pruebas de función hepática, la media de albúmina se ubicó en 3,5 g/L y el TP una mediana de 14 segundos. Las pruebas de función renal por su parte, mostraron una mediana de creatinina de 0,65 y el BUN una media de 20,4.
Finalmente, dentro del hemograma se observó el recuento de leucocitos con una media de 9002 y el porcentaje de eosinófilos una mediana de 0. No obstante, se deben rescatar tres casos donde el porcentaje se ubicó superior al 9% causados por ácido valproico, antimoniato de meglutina e isoniazida.
Presentación clínica y desenlaces
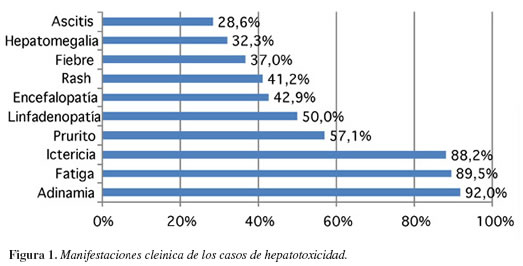
De las diez manifestaciones clínicas contempladas, se obtuvieron tres sobresalientes dentro del grupo: la adinamia, presentada en 92% de los casos, fatiga 89,5% e ictericia en 88,2%. Seguidas de las demás manifestaciones de forma descendente así: 57,1% pacientes presentaron prurito, 50% adenopatías, 42,9% encefalopatía, 41,2% rash, 37% fiebre, 32,3% hepatomegalia y 28,6% ascitis (Figura 1).
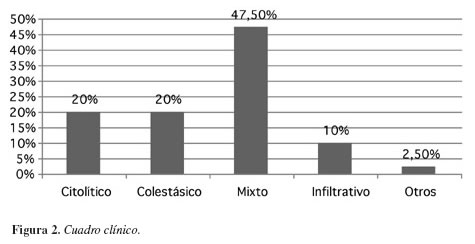
El patrón clínico de presentación resultó ser en su mayoría de tipo mixto con un 47,5%, seguido de un 20% colestásico, 20% hepatocelular, 10% infiltrativo y 2,5% de otro tipo, donde se encuentra un caso reportado de hiperbilirrubinemia a expensas de la indirecta postrasplante hepático, en reacción probable a la ciclosporina a una dosis 200 mg/día (Figura 2).
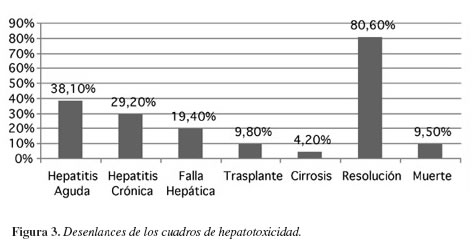
Con relación a los desenlaces de los múltiples casos se observó lo siguiente: hepatitis aguda como la más común con 38,1%, después la hepatitis crónica con 29,8%, falla hepática fulminante 19,4%, trasplante 9,8% y cirrosis 4,2%. Y aunque al final la resolución de los casos se dio en un 80,6%, la mortalidad fue del 9,5% de los 42 pacientes (Figura 3).
Tipo de sustancia
Al observar los casos por grupos de fármacos (Figura 4), se muestra que los medicamentos que más reportaron casos de hepatotoxicidad, fueron los antibióticos con un 35,8% de los casos, seguido de los anticonvulsivantes con el 11,9%, inmunosupresores con el 9,5%, los analgésicos y antiinflamatorios 7,2%, antirreumáticos 7,2%, hipolipemiantes 7,2%, antiprotozoarios 4,8, hormonas e inhibidores gonadales 4,8%, anestésicos 2,4%, antihipertensivos 2,4%, antitiroideos 2,4%, retinoides 2,4% y otros 2,4%, donde se incluyeron aquellos medicamentos sin reporte en la literatura médica.
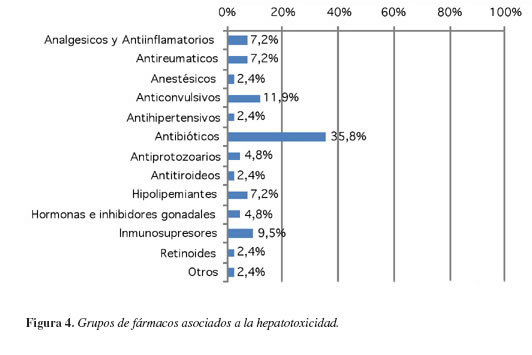
Los medicamentos incluidos entre los diferentes grupos fueron los siguientes:
Antibióticos: amoxicilina, imipenem-cilastatina, ciprofloxacina, isoniazida, isoniazida-rifampicina, trimetroprim-sulfa.
Inmunosupresores: ciclosporina y azatriopina.
Antiprotozoarios: antimoniato de meglutina y metronidazol.
Antihipertensivos: captopril.
Anticonvulsivos: ácido valproico y carbamazepina.
Analgésicos y antiinflamatorios: acetaminofén y AINES.
Antirreumáticos: metrotrexate y sales de oro.
Hipolipemiantes: lovastatina y simvastatina.
Antitiroideos: metimazol.
Anestésicos: halotano.
Retinoides: isotretinoína.
Hormonas e inhibidores gonadales: danazol y levonorgestrel y etinilestradiol.
Otros: anamú (medicamento utilizado en medicina alternativa según historia clínica).
De los 42 casos de hepatotoxicidad medicamentosa que se evaluaron mediante la escala de daño hepático por medicamentos, se encontró un caso definitivo, 25 probables y 16 posibles. Es de anotar que el caso hallado como definitivo, se debió a una nueva exposición al medicamento de tipo accidental ya que ninguno de los pacientes fue sometido en el score de la escalada de daño hepático a un test de segundo reto intencional.
Además, del total de casos, la dosis utilizada de los medicamentos en un 89,5% fue terapéutica y un 10,5% una dosis tóxica, entre los que se encuentran dos casos por acetaminofén (5 g/día por seis días y 13 g/día en dosis única), uno por metronidazol (40 tabletas de 500 mg en dosis única) y uno por sales de oro (500 mg dosis única).
Adicionalmente, cabe mencionar otras variables importantes encontradas dentro de los cuadros de hepatotoxicidad, como el tipo de antecedente de enfermedad hepática donde en los 12 casos con antecedente previo se observó lo siguiente: 7,7% casos tuvieron un episodio previo de hepatitis tóxica, 7,7% de coledocolitiasis, 5,1% hepatitis A, 2,6% hepatitis B y 2,6% hepatitis alcohólica.
Discusión
El estudio actual representa un registro amplio reportado en la literatura colombiana de hepatotoxicidad medicamentosa, bajo la revisión de la unidad de hepatología de un hospital de cuarto nivel, donde los 42 casos de pacientes con diagnóstico de toxicidad hepática, fueron corroborados mediante la escala de daño hepático inducida por drogas (21).
En éste, los pacientes incluidos tuvieron un registro demográfico acorde con el protocolo propuesto, que conllevó a la identificación de un porcentaje considerable de automedicación acompañada del consumo de dosis tóxicas del medicamento, y también de pacientes polimedicados quienes a dosis terapéuticas de una medicación con potencial hepatotóxico desarrollaron el cuadro clínico y/o patrón sugestivo de injuria por laboratorio. Igualmente, los antecedentes de enfermedad hepática, a pesar de no tener una asociación alta dentro del número de casos, en estudios con un mayor registro, se sigue describiendo como factor de riesgo (23).
A su vez, el consumo de alcohol en nuestra experiencia se presentó en tan sólo 26,9% de los casos, dato apreciable teniendo en cuenta que es un factor que depende de la frecuencia y cantidad de ingesta como lo muestra un estudio de Faha, M Ali, et al 2008, donde se establece un mayor riesgo estimado de hepatotoxicidad por sobredosis de acetaminofén en pacientes alcohólicos y no alcohólicos; siendo la concentración requerida de fármaco para generar toxicidad por encima de 150 mg/mL en el primer grupo y 104 mg/mL como base para el segundo (24).
Por otro lado, en los datos de laboratorio encontrados se evidencia la importancia del uso de BT, BD, ALT, AST, FA y GGT como marcadores de daño hepático que se hallan disponibles en nuestro medio. Aunque en la actualidad se está trabajando en el diseño de nuevos marcadores como la proteína F, la enzima glutamato deshidrogenasa, sorbitol deshidrogenasa, entre otras (25). Así pues, con los parámetros de laboratorio utilizados, fue posible establecer los diferentes patrones de daño hepático (hepatocelular, colestásico, mixto e infiltrativo) para los diferentes medicamentos.
Así entonces, según el tipo de sustancia, en nuestro estudio los antibióticos fueron el grupo de fármacos más relacionados con hepatotoxicidad, y de ellos el uso de la isoniazida y rifampicina fueron los esquemas tratamiento antituberculoso, que a dosis terapéuticas, se correlacionó con el daño hepatocelular, mixto o de tipo infiltrativo de los pacientes. Cuadro similar al encontrado en el estudio de M. Dossing, J et al 1996 donde tras una revisión de 11 años de 752 historias, se tomaron 61 pacientes que antes de iniciar la terapia no tuvieron ninguna alteración de las pruebas hepáticas y posterior a la administración del tratamiento presentaron un patrón hepatocelular o mixto, sin ningún reporte de tipo colestásico, tal y como se dio en nuestro grupo de 10 pacientes (26).
En el caso toxicidad originado por consumo de ciprofloxacina (dosis 1500 mg/día) con menos de 15 días de consumo, con patrón mixto de presentación, sin antecedentes de enfermedad hepática previa, manifiesto con síntomas de ictericia, adinamia y fatiga; para 2004 Annette Zimpfer mostró un registro de 14 pacientes con una evolución similar a una dosis terapéutica entre 500-1500 mg/día, de los cuales dos terminaron en falla hepática fulminante y murieron; a diferencia del paciente de nuestro estudio quien recibió trasplante hepático (27).
Cabe mencionar que la toxicidad por amoxicilina, aunque ha sido reportada por muchos estudios prospectivos en asocio con clavulanato (28), nuestro estudio reportó una paciente polimedicada quién venía en tratamiento penicilina benzatínica y se automedicó amoxicilina (dosis 3.000 mg/dosis única) al quinto día posparto.
El siguiente grupo de fármacos, los anticonvulsivantes tipo ácido valproico, se presentó en dos casos: el de un niño de 24 meses de edad con patrón hepatocelular y una hipersensibilidad al ácido valproico de fiebre, rash y eosinofilia 30%, quién terminó en falla hepática y trasplante hepático; en contraste, con el segundo caso, una mujer 62 años con cirrosis de base, quien desarrolló patrón colestásico y progresión de su estado cirrótico. Una dualidad que aparece descrita por Konig SA et al.1999, donde se muestra que los pacientes menores de dos años de edad son más propensos a reacciones idiosincráticas que pueden llevar a una falla hepática fulminante y es poco probable entre los adultos (29).
Ahora bien, partiendo de la necesidad del uso de inmunosupresores para muchas condiciones clínicas incluyendo el trasplante hepático, es necesario evaluar los casos asociados a su uso, en total cuatro. Estos casos, en comparación con un estudio publicado por Marc I. Sorber 1987, realizado con una muestra de 466 pacientes postrasplante renal con esquema a base de ciclosporina, se encontró que el 49% de los pacientes desarrolló algún tipo de daño hepatocelular con la elevación leve de BT y FA (23). Así como en el nuestro, dos de los casos de toxicidad por esta droga mostraron un patrón colestásico acompañados de una elevación leve de AST, ALT y FA; sumado a que el cuadro clínico de estos 228 pacientes se desarrolló en un periodo inferior a 30 días después del inicio de la terapia, otro dato que comparte con nuestros pacientes.
Ya para el tercer caso de hepatotoxicidad atribuido a ciclosporina, se encontró un paciente trasplantado de hígado con un patrón de daño diferente a los ya descritos al presentar hiperbilirrubinemia a expensas de la indirecta, tipo Síndrome de Gilbert en reacción a este inmunosupresor (dosis 200 mg/día), hallazgo ya visto en un estudio publicado por Peter L. M. Cansen 1997 donde se reveló el desarrollo de este síndrome en dos pacientes trasplantados de hígado, a quienes se les comprobó una variante en la secuencia de la caja TATAA de la región promotora UGT1A de la bilirrubina. Sin embargo, se desconoce un estudio que plantee la ciclosporina como desencadenante de la hiperbirrubinemia indirecta en pacientes como el nuestro (30).
En términos prácticos, los hallazgos de nuestro estudio son comparables con los que se han presentado comúnmente en las revisiones que hace la literatura para todos los medicamentos con potencial hepatotóxico. A excepción del grupo que denominamos otros, donde se incluyó el medicamento anamú, el cual no tiene reporte en la literatura, deja en entredicho la necesidad del control en la prescripción de medicamentos que no tienen sustento basado en la evidencia de sus efectos colaterales.
Por otra parte, los múltiples desenlaces que pueden ocurrir tras el uso de estos fármacos, llevan a tener presente el uso racional de medicación con potencial tóxico sobre el hígado y que además es impredecible por las características propias de cada paciente, o mejor llamadas, de idiosincrasia. Por esto, el control de los parámetros de laboratorio ya mencionados puede definir una conducta de retiro o reducción en dosis de la medicación, para así evitarse complicaciones. Y en aquellos casos que lo ameriten a criterio médico, se emplee el ácido ursodexocicólico, utilizado en injuria hepática colestásica por algunos autores (31); y el recurso del trasplante hepático como opción cuando la vida se encuentra comprometida, que sin un reporte en la literatura asociado a hepatotoxicidad, reduce aproximadamente en un 50% la mortalidad causada por hepatotoxicidad inducida por medicamentos, establecido en ese estudio.
Agradecimientos
Este proyecto fue financiado por el CODI (Comité Operativo de Investigaciones). Universidad de Antioquia.
Referencias
1. Weinshilboum R. Inheritance and drug response. N Engl J Med 2003; 348: 529-37. [ Links ]
2. Guengerich FP. Human cytochrome P-450 enzymes. Life Sci 1992; 50: 1471-8. [ Links ]
3. Guengerich FP. Common and uncommon cytochrome P450 reactions related to metabolism and chemical toxicity. Chem Res Toxicol 2001; 14: 611-50. [ Links ]
4. Murray M. P450 enzymes. Inhibition mechanisms, genetic regulation and effects of liver disease. Clin Pharmacokinet 1992; 23: 132-46. [ Links ]
5. Larrey D. Epidemiology and individual susceptibility to adverse drug reactions affecting the liver. Semin Liver Dis 2002; 22: 145-55. [ Links ]
6. Ayonrinde OT, Phelps GJ, Hurley JC, Ayonrinde OA. Paracetamol overdose and hepatotoxicity at a regional Australian hospital: a 4-year experience. Intern Med J 2005; 35: 655-60. [ Links ]
7. Mahdevan S, Mckiernan P, Davies P, Kelly DA. Paracetamol induced hepatotoxicity. Arch Dis Child 2006; 91: 598-603. [ Links ]
8. Hurt C, Westerkam W, Strave GM. Effect of age and gender on the activity of human hepatic CYP3A. Biochem Pharmacol 1992; 44: 275-83. [ Links ]
9. Zimmerman HJ. Hepatotoxicity. The adverse effects of drugs and other chemicals on the liver. 2nd ed. Philadelphia: Lippincott Williams & Wilkins; 1999. [ Links ]
10. Lee W. Drug induced hepatotoxicity. N Engl J Med 2003; 349: 474-83. [ Links ]
11. Bissell D, Gores G, Laskin D, Hoofnagle J. Drug-induced liver injury: mechanisms and test systems. Hepatology 2001; 33: 1009. [ Links ]
12 Limdi JK, Hyde GM. Evaluation of abnormal liver function tests. Postgrad Med J 2003; 79: 307-12. [ Links ]
13. Burke MD. Liver function:test selection & interpretation of results. Clin Lab Med 2002; 22:377-90 [ Links ]
14. Bohan TP, Helton E, McDonald I, König S, Gazitt S, Sugimoto T, et al. Effect of L-carnitine treatment for valproate-induced hepatotoxicity. Neurology 2001; 41: 1405-9. [ Links ]
15. Andrade RJ, Lucena MI, Kaplowitz N, García-Munoz B, Borraz Y, Pachkoria K, et al. Outcome of Acute Idiosyncratic Drug-Induced Liver Injury: Long-Term Follow-up in a Hepatotoxicity Registry. Hepatology 2006 Dec; 44: 1581-8. [ Links ]
16. Ostapowicz G, Fontana R, Schiodt F, et al. Results of a prospective study of acute liver failure at 17 tertiary care centers in the United States. Ann Intern Med 2002; 137: 947. [ Links ]
17. Anan G, Benichou C. Causality assessment of adverse reactions to drugs. A novel method based on the conclusions of international consensus meetings: application to drug-induced liver injuries. J Clin Epidemiol 1993; 46: 1323. [ Links ]
18. Guruprasad P, Aithal MD, Rawlins and Christopher R Day. Clinical diagnostic scale: a useful tool in the evaluation of suspected hepatotoxic adverse drug reactions. Hepatology 2000; 33: 949-52. [ Links ]
19. Lee W. Assessing causality in drug-induced liver injury. J Hepatol 2000; 33:1003. [ Links ]
20. Lucena MI, Camargo R, Andrade RJ, Perez-Sanchez CJ, Sanchez De La Cuesta F. Comparison of two clinical scales for causality assessment in hepatotoxicity. Hepatology 2001; 33: 123. [ Links ]
21. Maria VAJ, Victorino R. Development and validation of a clinical scale for the diagnosis of drug-induced hepatitis. Hepatology 1997; 26: 664. [ Links ]
22. Sgro C, Clinard F, Ouazir K, Chanay H, Allard C, Guilleminet C, et al. Incidence of drug-induced hepatic injuries: A French population-based study. Hepatology 2008; 36: 451. [ Links ]
23. Lorber M, Van Buren CT, Flechner SM, Williams C, Kahan BD. complications of cyclosporine therapy in 466 renal transplant recipients. Transplantation 1987; 43: 35-40. [ Links ]
24. Ali FM, Boyer EW, Bird SB. Estimated risk of hepatotoxicity after an acute acetaminophen overdose in alcoholics. Alcohol 2008; 42: 213-8. [ Links ]
25. Ozer J, Ratner M, Shaw M, Bailey W, Schomaker S. The current state of serum biomarkers of hepatotoxicity. Toxicology 2008; 245: 194-205. [ Links ]
26. Dossing M, Wilcke T, Askgaard D, Nybo B. Liver injury during antituberculosis treatment: an 11-year study. Tubercle and Lung Disease 1996; 77: 335-40. [ Links ]
27. Zimpfer A, Propst A, Mikuz G, et al. Ciprofloxacin-induced acute liver injury: case report and review of literature. Virchows Arch 2004; 444: 87-9. [ Links ]
28. Lucena M, Andrade RJ, Fernández M, Pachkoria K, et al. Determinants of the clinical expression of Amoxicillin-Clavulanate Hepatotoxicity: A Prospective Series From Spain. Hepatology 2006; 44: 850-6. [ Links ]
29. König SA, Schenk M, Sick C, Holm E, Heubner C, Weiss A, et al. Fatal liver failure associated with valproate therapy in a patient with friedreich’s disease: review of valproate hepatotoxicity in adults. Epilepsia 1999; 40:1036-40. [ Links ]
30. Jansen PL, Bosma PJ, Bakker C, Lems SP, Slooff MJ, Haagsma EB. Persistent unconjugated hyperbilirubinemia after liver transplantation due to an abnormal bilirubin UDP-glucuronosykransferase gene promotor sequence in the donor. J Hepatol 1997; 27: 1-5. [ Links ]
31. Paumgarrrtner G, Beuers U. Ursodeoxiccholic acid in cholestatic liver disease: mechanisms of action an therapeutic use revisited. J Hepatol 2002; 36: 525-31. [ Links ]














