Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Medica Colombiana
Print version ISSN 0120-2448
Acta Med Colomb vol.33 no.4 Bogotá Oct./Dec. 2008
Visión histórica y aplicación
Historical view and application
(1)Biol. MSc. Profesora Principal. Universidad del Rosario. Facultad de Medicina. Bogotá, Colombia.
(2)Biol.MSc. Profesora Asistente. Universidad del Rosario. Facultad de Medicina. Bogotá, Colombia.
(3)Biol.MSc. Profesora Principal. Universidad del Rosario. Facultad de Medicina. Instituto de Ciencias Básicas. Unidad de Genética. Bogotá, Colombia.
Correspodencia: Claudia Tamar Silva. Cra 24 N° 63C-69. 3101275. Bogotá. E-mail: ctsilva@urosario.edu.co
Recibido: 15/VII/08 Aceptado: 27/VIII/08
Resumen
La citogenética es el estudio de los cromosomas tanto en número como en estructura, los primeros pasos en la citogenética humana se dieron a finales del siglo XIX con la publicación de Flemming en 1882 de las primeras ilustraciones del cromosoma humano a partir de observaciones al microscopio, y concluyó con Tjio y Levan en 1953 cuando se determina el número real de cromosomas humanos por célula diploide. La citogenética convencional es una herramienta de gran importancia que permite realizar el diagnóstico cromosómico de pacientes con indicación clínica de cromosomopatía, lo cual les va a permitir asesorar a las familias respecto de dicha enfermedad, su pronóstico y riesgo de recurrencia. El propósito de esta revisión es documentar a los médicos, pediatras, ginecólogos y en general al personal de la salud, de la importancia de los estudios citogenéticos en aquellos casos en que se enfrenten a un paciente con una cromosomopatía o síndrome dismórfico.
Palabras claves: cariotipo, citogenética, cromosomopatía, síndrome dismórfico, diagnóstico.
Abstract
Cytogenetics is the study of chromosomes and their numerical and structural abnormalities. In the late 1800´s Flemming published his first illustrations of human chromosomes based on his observations on a microscope. In 1953 Tijo and Levan determined the number of chromosomes in a human somatic cell. From then on, conventional cytogenetics became an important tool for physicians in the diagnosis of patients with chromosomal anomalies through the use of the karyotype. The karyotype thus becomes a means to diagnose patients and provide them genetic counseling. The purpose of this review is to enlighten family doctors, pediatricians and gynecologists and other health practitioners of the importance of cytogenetics when challenged with patients with an abnormal karyotype or dysmorphic syndrome.
Key words: karyotype, cytogenetics, chromosomal anomaly, dysmorphic syndrome, diagnosis.
Introducción
Con el advenimiento de la biología molecular y de la citogenética molecular, la citogenética convencional es una herramienta que muchos médicos han dejado de lado o por el contrario, el cariotipo se ha constituido en un examen que se ordena para reforzar diagnósticos de enfermedades que no están relacionadas con alteraciones cromosómicas. El uso actual de la citogenética convencional sigue siendo amplio y constituye una herramienta importante en varios campos de la medicina como pediatría, endocrinología o ginecoobstetricia; por ello, esta revisión pretende resaltar la utilidad del análisis cromosómico e informar a los profesionales de la salud los aportes que puede ofrecer a un diagnóstico clínico.
Hechos históricos
La citogenética es el estudio de los cromosomas tanto en número como en estructura. Los primeros pasos en la citogenética humana se dieron a finales del siglo XIX con la publicación de Flemming en 1882 de las primeras ilustraciones del cromosoma humano a partir de observaciones al microscopio (1); algunos años más tarde, Waldeyer introdujo el término cromosoma, que significa cuerpo coloreado (2). Estas primeras descripciones llevaron a la generación de algunas preguntas como cuál era el número total de cromosomas del cariotipo humano, y si existían variantes en dicho número dependiendo de la raza y el sexo, entre otros factores, ya que algunos investigadores habían sugerido tales diferencias entre descendientes africanos y caucásicos y entre hombres y mujeres (3). En 1921 Painter demostró la presencia del cromosoma Y en preparaciones obtenidas a partir de testículo, e indicó que el número total de cromosomas era 48; a raíz de estos hallazgos, surge un nuevo interrogante: si el sexo en los humanos era determinado mediante X0 o XY (4). Pero el gran desarrollo de la citogenética se dio con la determinación del número de cromosomas en el cariotipo humano por Tjio y Levan en 1956 y confirmada en el mismo año por Ford y Hamerton (5, 6). El número cromosómico humano 2n=46, fue confirmado en por lo menos 74 individuos hacia 1958. Los cromosomas mitóticos mostraron características morfológicas claras, tales como longitud de los brazos, lo cual permitió a los investigadores situarlos dentro de siete grupos: 1-3, 4-5, 6-12 + X, 13-15, 16-18, 19-20 y 21-22 + Y. Una nomenclatura estándar para el cariotipo, fue propuesta en Denver por los siete grupos que habían publicado artículos sobre el cariotipo normal a principios de 1960; estos siete grupos fueron denominados con letras de la A a la G como fue propuesto por Patau en 1960 (7, 8). Esta nomenclatura fue universalmente aceptada y usada con mínimas modificaciones por cerca de 10 años. Los citogenetistas organizaron a los cromosomas en 23 pares, criterio que fue aceptado en la conferencia de Londres y en la reunión de Chicago (7, 8).
El gran interrogante que surge en ese momento, es el papel de la citogenética en la medicina comenzando por la relación entre algunas enfermedades genéticas y el número cromosómico.
Por esta época Jerôme Lejeune, un médico de la clínica des Maladies Infantiles del Hôpital Necker-Enfants Malades de París, atraído por la homogeneidad en los rasgos fenotípicos en niños con síndrome de Down descrito previamente por Seguin y posteriormente por Langdon-Down estableció el origen cromosómico del síndrome de Down, con base en la hipótesis de Waardenburg de que el síndrome estaba determinado probablemente por una aberración cromosómica, estableciendo así por primera vez el origen cromosómico de una enfermedad humana (9-11) (Figura 1). La presencia de múltiples malformaciones que involucraban varios órganos y sistemas en los individuos trisómicos para el cromosoma 21, llevaron a la idea que la trisomía para otros cromosomas podrían causar síndromes de malformación, tal como ocurría en el síndrome de Down.
Dentro de otras anormalidades cromosómicas numéricas descritas en la época, estuvieron aquellas relacionadas con desórdenes de la diferenciación sexual. Se determinó que la ausencia de un cromosoma X, era el responsable del fenotipo en las pacientes con síndrome Turner (45,X); mientras que un cromosoma X adicional, se correlacionaba con las alteraciones fenotípicas en los pacientes con síndrome Klinefelter (47,XXY) (12,13). El descubrimiento de individuos con complementos sexuales inusuales, dieron la clave del entendimiento de la diferenciación sexual en mamíferos, ya que al ser los individuos 45,X femeninos y los 47,XXY masculinos, se indicaba que el cromosoma Y era el determinante masculino. Aún más, la presencia de 3 o 4 cromosomas X en el complemento humano indicó no tener ningún efecto sobre una única copia de cromosoma Y en la determinación sexual. El desarrollo intersexual fue por primera vez observado cuando un porcentaje de células contenían cromosoma Y, como el caso de un mosaico 45,X/46,XY o una quimera 46,XX/46,XY (14, 15). En 1960, Klaus Patau, determinó que los recién nacidos con un cromosoma 13 adicional, tenían múltiples anomalías congénitas y finalmente se determinaron los hallazgos de la última de las alteraciones numéricas que se pueden hallar en nacidos vivos, la trisomía del cromosoma 18 o síndrome Edwards (16, 17). Los hallazgos del momento indicaban que los fenómenos de generación de trisomías y monosomías que se reconoció como no disyunción, ocurría en un grupo de cromosomas en particular, y dado que no existía una explicación a que el fenómeno ocurriera en pocos de los cromosomas autosómicos, se indicó por primera vez, que muchos de esos desbalances eran tan severos que tenían efectos letales en el desarrollo embrionario o fetal. Así, David Carr en el año 1963 realiza un extenso estudio de embriones y fetos abortados y encuentra que el 40% de ellos fueron cromosómicamente anormales. Debido a que 15% de los embarazos son espontáneamente abortados, se podría indicar que cerca de 3% de las gestaciones corresponden a embriones trisómicos, 1% triploides y 1% monosómicos, casi todos letales, descubriéndose así las graves consecuencias generadas por errores en los procesos meióticos (18, 19).
En la década de los cincuenta Sajiro Makino, Albert Levan y George Klein demostraron que algunas líneas celulares cancerígenas tendían a ser mitóticamente inestables y mostraban números cromosómicos altamente variables. La primera evidencia definitiva de una asociación entre un cambio cromosómico específico y un tipo de cáncer particular, que a la postre corresponde a la primera alteración cromosómica estructural descrita, fue la observación de un cromosoma parcialmente delecionado, más tarde descrito como translocación (9:22) en la leucemia mieloide crónica. Novell y Hungerford interpretaron este daño cromosómico como una deleción del cromosoma Y ya que los pacientes que habían analizado eran masculinos; sin embargo, más tarde observaron este mismo cromosoma, hoy llamado Filadelfia, en mujeres con el mismo tipo de leucemia (20). El incremento de rearreglos y rupturas cromosómicas, fueron observados en 1964, en dos enfermedades autosómicas recesivas asociadas con un riesgo incrementado a cáncer: la anemia de Fanconi, descrita por Tarute Schroeder y el síndrome de Bloom por James German (21, 22). Muchos descubrimientos posteriores de rearreglos relativamente complejos, se vieron limitados por la imposibilidad de la identificación de los cromosomas individuales, por lo que fueron propuestas mejoras en la técnica original permitiendo un gran avance en el desarrollo de la citogenética: la solución hipotónica por Tao-Chiuh Hsu por ejemplo, para obtener una mejor diseminación de los cromosomas y así hacer un mejor análisis, Peter Novell quien descubrió que la fitohemaglutinina estimulaba la división de los glóbulos blancos; el efecto de la colchicina por Levan como un agente capaz de inducir el arresto de las células en división.Sin embargo, lo más importante fue la introducción de las técnicas de bandeamiento por Caspersson y colaboradores, lo cual permitió una adecuada identificación de cromosomas normales y de rearreglos cromosómicos de variada naturaleza. Los descubrimientos originales de Caspersson fueron hechos en plantas y permitían distinguir solamente eucromatina y heterocromatina; sin embargo, la aplicación de una técnica de bandeamiento con mostaza de quinacrina a cromosomas humanos, reveló el gran poder que tenía esta metodología para identificar un nivel de organización del cromosoma hasta ahora desconocido: las bandas cromosómicas. Cada banda contiene de 1 a 50 o más megabases de pares de ADN, y contienen 100 o más genes (23-26). John Evans, Marina Seabright y Jerôme Lejeune descubrieron métodos para producir un patrón de bandeamiento similar (bandas G) o de patrón reverso (bandas R). Fue también muy sorprendente e importante el descubrimiento de Sam Latt y Bernard Dutrilaux de un método no radiactivo para analizar características de replicación; éste producía un patrón de bandeamiento G o R, dependiendo si la bromodeoxiuridina (BrdU) es incorporada temprana o tardíamente en la fase S, lo que permitió demostrar que las bandas G son de zonas de replicación tardía y las R de replicación temprana (19).
De esta manera, la introducción del bandeamiento cromosómico condujo a un rápido crecimiento en el conocimiento, lográndose la identificación de cromosomas involucrados en trisomías, translocaciones, deleciones e inversiones, lo cual constituyó el segundo renacimiento de la citogenética de mamíferos y humanos.
Técnicas de bandeamiento
Las técnicas de bandeamiento permiten hacer un adecuado análisis de cada uno de los cromosomas, individualizándolos y permitiendo su análisis e identificación adecuados. Hasta el momento se han descrito las bandas G, las bandas R, las bandas C, las bandas T y las bandas Nor; dentro de ellas las bandas G y las bandas R son las más utilizadas por sus características. Las bandas pueden dividirse en morfológicas (Figura 2) si corresponden a la heterogeneidad de la cromatina, dentro de éstas tenemos: las bandas G, las bandas R, bandas Q, bandas C y bandas T y bandeamiento dinámico si depende de los patrones de replicación de los cromosomas (27).
Bandas G, denominadas bandas GTG, se producen como consecuencia de someter las láminas a la acción de una enzima proteolítica denominada tripsina. Tiñen oscuro regiones ricas en A-T, zonas que son transcripcionalmente inactivas, pobres en genes y en secuencias Alu, pero ricas en secuencias Line, de replicación tardía (Figura 3).
Bandas R, llamadas así porque con ellas se obtiene un patrón inverso al de las bandas G; son ricas en GC, en genes, en secuencias Alu, pobres en secuencias Line, son zonas de replicación temprana y se producen al someter las preparaciones en solución salina a altas temperaturas y coloreadas con giemsa (28).
Bandas Q fue la primera técnica de bandeamiento descrita en un momento en el cual la individualización de cromosomas era imposible. Caspersson se basó en el conocimiento de Köhler de teñir los componentes nucleares mediante métodos fluorescentes descrito 100 años atrás, uniendo dichos fluorocromos con un agente alquilante, ya que el solo fluorocromo generaba una tinción homogénea sobre los cromosomas (23, 29). Caspersson hipotetizó que el uso de un agente alquilante podría permitir la diferenciación de los segmentos cromosómicos ricos en GC (Guanina-Citocina) de aquellos ricos en AT (Adenina-Timina) (11).
La hipótesis de Caspersson a pesar de algunos errores, permitió la visualización de los cromosomas con bandas brillantes (fluorescentes) correspondientes a los segmentos ricos en AT y opacas correspondientes a los segmentos ricos en GC; las bandas eran constantes y esto permitió el reconocimiento de cada uno de los cromosomas.
Bandas C. Se trata de la detección de regiones heterocromáticas, utilizando hidróxido de sodio e incubando los cromosomas en una solución salina para hacer la tinción posterior con giemsa. Debido a que los centrómeros con ricos en heterocromatina, esta tinción tiñe principalmente las regiones centroméricas, pericentroméricas y gran parte del cromosoma Y. Esta técnica fue introducida por la doctora Arrigi y mejorada por Craig-Holmes y colaboradores (30-32).
Bandas T. Es la tinción diferencial de la porción distal de los cromosomas, es una variante de las bandas R ya que las preparaciones son incubadas en el mismo buffer, pero por periodos de tiempo más largos (27, 11).
El cariotipo
El cariotipo es la organización de los cromosomas de acuerdo con el tamaño y la posición del centrómero. El número asignado a cada cromosoma está basado en el patrón de bandas Q como fue propuesto por Caspersson y col. en 1971 (33). El análisis cromosómico requiere de células en metafase, para una mejor clasificación y evaluación de los cromosomas; la obtención de células en esta fase requiere de un tejido con gran número de células en división: los linfocitos de sangre periférica, los fibroblastos, las células del líquido amniótico y células de algunos tumores, las cuales deben ser cultivadas bajo ciertas condiciones in vitro para obtener un número suficiente de células en división. Las células empleadas para cultivo cromosómico deben ser capaces de crecer y dividirse rápidamente en el cultivo, siendo las más accesibles los leucocitos, los cuales en cultivo requieren de estimulantes mitóticos como la fitohemaglutinina, cuyo efecto transforma los linfocitos periféricos en células parecidas a blastos capaces de reentrar en el ciclo mitótico, ya que ellos normalmente sólo se dividen una vez (27).
Una vez se obtienen células en proliferación activa, es posible detener células en metafase al inhibir la formación del huso acromático mediante el uso de la colchicina (34). Además, esta sustancia ayuda a la contracción de los cromosomas, hecho que permite una mejor delineación, un extendido más eficiente y un mejor análisis. Luego, las células son expuestas a solución salina hipotónica con el fin de asegurar la dispersión adecuada y la observación de los cromosomas dentro de la membrana celular, mediante la extensión en un portaobjetos para posteriormente ser coloreados y analizados al microscopio (Figura 4).
Aplicaciones
Las enfermedades genéticas son de cuatro tipos: enfermedades de herencia mendeliana o monogénica, enfermedades multifactoriales, enfermedades mitocondriales y enfermedades cromosómicas. La citogenética es la rama de la genética que estudia las enfermedades de herencia cromosómica. Se ha determinado que aproximadamente uno de cada 160 nacidos vivos tienen una alteración cromosómica y que al menos 50% de los abortos espontáneos se deben a anomalías cromosómicas (35, 36); dadas estas cifras, la determinación del tipo de alteración cromosómica, es una herramienta diagnóstica que permite la confirmación del diagnóstico de dichas enfermedades y además el correcto asesoramiento genético del paciente y sus familias.
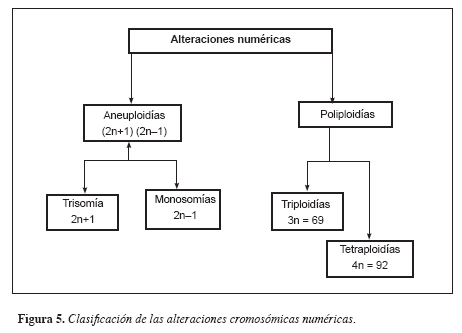
Dentro de las enfermedades cromosómicas numéricas se tienen las aneuploidías y las poliploidías (Figura 5). Dentro de las aneuploidías, tenemos las trisomías y las monosomías, en nacidos vivos, podemos encontrar la trisomía 21 o síndrome de Down, la trisomía 18 o síndrome Edwards, la trisomía 13 o síndrome Patau y alteraciones de cromosomas sexuales como síndrome Klinefelter, entre otros. En cuanto a trisomías en productos de aborto se ha descrito que la trisomía más común es la del cromosoma 16, pero también se han reportado para otros cromosomas. Dentro de las monosomías, la única que llega a la vida son las niñas con síndrome Turner cuyo cariotipo es 45,X. Dentro de las alteraciones estructurales, se tienen las deleciones, inserciones, inversiones, translocaciones, duplicaciones y anillos; hay un gran número de alteraciones descritas, dentro de las más comunes están el síndrome Cri-du-chat (5p-), síndrome Wolf-Hirschorn (4p-), Síndrome Velocardiofacial (Síndrome CATCH22/DiGeorge) (del22q11.2), entre otros. En otras palabras, la citogenética nos permite hacer el diagnóstico de un gran porcentaje de pacientes con síndromes dismórficos, aunque en algunos casos en los cuales la alteración estructural es menor de tres megabases de pares de bases, debemos recurrir a la citogenética molecular.
A continuación las indicaciones para tomar un cariotipo en sangre periférica y en líquido amniótico.
Indicaciones para hacer un cariotipo en sangre periférica
1. Confirmación diagnóstica de enfermedades de herencia cromosómica numéricas o estructurales.
2. Retardo mental de origen desconocido.
3. Talla baja en estudio.
4. Ambigüedad genital.
5. Padres de niños con alteraciones cromosómicas estructurales.
6. Sospecha de síndrome de genes contiguos.
7. Mujeres con enfermedades recesivas ligadas al X, para descartar síndrome Turner o cualquier alteración estructural.
8. Infertilidad y/o aborto recurrente.
9. Diagnóstico preconcepcional.
Indicaciones para hacer un cariotipo en líquido amniótico y/o vellosidades coriales
1. Determinaciones de enfermedades de herencia cromosómica in útero.
2. Hijos previos con una enfermedad de herencia cromosómica.
3. Determinación del sexo en enfermedades genéticas ligadas al sexo.
4. Ansiedad materna.
5. Marcadores séricos sugestivos de aneuploidía (a-feto proteína, b gonadotrofina coriónica y PAPA).
6. Sonoluscencia nucal aumentada.
7. Padres portadores de alguna alteración estructural.
Cuándo no es útil un cariotipo
1. En pacientes con enfermedades genéticas de un único gen (mendelianas), mitocondriales y/o multifactoriales.
2. Padres de niños con enfermedades cromosómicas numéricas.
Hemos pretendido con esta revisión presentar un enfoque actualizado de lo que es la citogenética, sus aplicaciones y su utilidad como herramienta diagnóstica. Ante los avances modernos, la citogenética sigue siendo una herramienta poderosa para los médicos en su ardua tarea de definir el diagnóstico de un paciente ante cromosomopatías, síndromes dismórficos, o entidades donde se sospecha de un componente cromosómico ya sea numérico o estructural. Además, ante la posibilidad del diagnóstico prenatal, mostrar cuáles son las razones para recurrir a este examen.
Referencias
1. Flemming W. Zellsubstanz KZ. Leipzing: Vogel 1882. [ Links ]
2. Waldeyer W. Uber Karyokineze und ihre beziehung zu den befruch-tungsvorgängen. Arch Mikrosk Anat 1888; 32: 1. – 122 [ Links ]
3. Oguma K, Makino S. A revised check-list of the chromosome number in vertebrates. J Genet 1932; 26: 239-54. [ Links ]
4. Painter TS. The Y chromosome of man. Science 1921; 53: 503-4 [ Links ]
5. Tijo JH, Levan A. The chromosome number in man. Heredity 1956; 42: 1-6. [ Links ]
6. Ford CE, Hamerton JL. The chromosome of man. Nature 1956; 168: 1020-3. [ Links ]
7. The London Conference On The Normal Human Karyotype, 28th-30th August, 1963. Cytogenetics 1963; 2: 264-8. [ Links ]
8. Chicago Conference (1966) Standardization in human cytogenetics. Birth Defects Orig Artic Ser 2. [ Links ]
9. Waardenburg PJ, Mongolismus. Das Menschliche Auge und seine erhanlagen. La haya: Nijhoff 1932; 44-8. [ Links ]
10. Lejeune J, Turpin R, Gautier M. Mongolism: a chromosomal disease (trisomy). Bull Acad Natl Med 1959; 143: 256-65. [ Links ]
11. Drets ME. Una saga citogenética: el descubrimiento de los métodos de bandeo cromosómico. Significado y proyección bio-médica. Rev Med Uruguay 2002; 18: 107-21. [ Links ]
12. Ford CE., Miller OJ., Polani PE., de Almeida JC, and Briggs JH: A sex-chromosome anomaly in a case of gonadal dysgenesis (Turner’s Syndrome). Lancet 1959; 1: 711-3. [ Links ]
13. Jacobs PA, Strong JA. A case of human intersexuality having a possible XXY sex-determining mechanism. Nature 1959; 183: 302-3. [ Links ]
14. Hirschhorn K, Decker W, Cooper L. Human intersex with chromosome mosaicism of type XY/XO. N Engl J Med 1960; 263: 1044-8. [ Links ]
15. Gartler SM, Waxman SH and Giblett E. An XX/XY human hermaphrodite resulting from double fertilization. Genetics 1962; 48: 332-5 [ Links ]
16. Smith DW, Patau K, Therman E, Inhorn SL. A new autosomal trisomy syndrome: multiple congenital anomalies caused by an extra chromosome. J Pediatr 1960; 57: 338-45. [ Links ]
17. Patau K, Therman E, Smith DW, Demars RI. Trisomy for chromosome No. 18 in man. Chromosome 1961: 12: 280-5. [ Links ]
18. Carr DH. Chromosome studies in abortuses and stillborn infants. Lancet 1963; 2: 603-6. [ Links ]
19. Miller OJ. The Fifties and the Renaissance in human and mammalian cytogenetics. Genetics 1995; 139: 489-94. [ Links ]
20. Nowel PC, Hungerford DA. Chromosome studies on normal and leukemic leucocytes. J Natl Cancer Inst 1960; 25: 85-109. [ Links ]
21. Schroeder T., Anschutz F and Knopp A. Spontane chromosomal aberration in familiar panmyelopathie 1964; 1: 194-96. [ Links ]
22. German J. Cytological evidence for crossing-over in vitro in human lymphoid cells. Science 1964; 144: 298-301. [ Links ]
23. Casspersson T, Feber S, Foley GE, Kudynowski J, Modest EJ, Simonsson E, et al. Chemical differentiation alogn methaphase choromosomes. Exp Cell Res 1968; 49: 219-22. [ Links ]
24. Caspersson T, Zech L, Johansson C. Dofferential binding of alkylating fluorchoromes in human choromosomes. Exp Cell Res 1970; 60: 315-9. [ Links ]
25. Berger R. Human cytogenetics. From 1956 to 2006. Pathol Biol 2007; 55: 1-12. [ Links ]
26. Gartler SM. The chromosome number in humans: a brief history. Nat Rev Genet 2006; 7: 655-60. [ Links ]
27. Rooney DE, Czepulkowski BH. Human Cytogenetics: a practical approach. 3ra ed. Oxford: IRL PRESS; 1978p18. [ Links ]
28. Dutrillaux B, Lejuane J. A new technic of analysis of the human karyotype. C R Acad Sci Hebd Seances Acad Sci D 1971; 272: 2638-40. [ Links ]
29. Caspersson T. On the development of quantitative cytochemical techniques for studies of cell nuclei. Acta Histochem Suppl 1979; 20: 15-28. [ Links ]
30. Arrigi FE, Hdu TC. Localization of heterochromatin in human chromosomes. Cytogenetics 1971; 10: 81-6. [ Links ]
31. Hsu TC. Heterochromatin pattern in metaphase chromosomes of Drosophila melanogaster. J Hered 1971; 62: 285-7 [ Links ]
32. Craig-Holmes AP, Moore FB, Shaw MW. Polymorphism of human C-band heterochromatin. I. Frequency of variants. Am J Hum Genet 1973; 25: 181-92. [ Links ]
33. An international system for human cytogenetic nomenclature (1978), ISCN (1978). Report of the Standing Committee on Human Cytogenetic Nomenclature. Birth Defects Orig Artic Ser 1978; 14: 313-404 [ Links ]
34. Aronson JF. Demonstration of a colcemid-sensitive attractive force acting between the nucleus and a center. J Cell Biol 1971; 51: 579-83. [ Links ]
35. Buckton KE, Spowart G, Newton MS, Evans HJ. Forty four probands with an additional “marker” Chromosome. Hum Genet 1985; 69: 353-70. [ Links ]
36. Queisser-Luft A, Stolz G, Wiesel A, Schlaefer K, Spranger J. Malformations in newborn: results based on 30,940 infants and fetuses from the Mainz congenital birth defect monitoring system (1990-1998). Arch Gynecol obstet 2002; 266: 163-7. [ Links ]














