Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Medica Colombiana
Print version ISSN 0120-2448
Acta Med Colomb vol.37 no.1 Bogotá Jan./Mar. 2012
Presentación de Casos
Angioedema hereditario
Hereditary angioedema
1Residente de Medicina Interna, Universidad Surcolombiana, Hospital Universitario Hernando Moncaleano Perdomo;
2Ph.D en Inmunología, Especialista en Alergias, Profesor de Inmunología Universidad Surcolombiana, Hospital Universitario Hernando Moncaleano Perdomo. Neiva (Colombia).
Correspondencia. Dr. Hugo Ernesto Osorio Carmona. Neiva, Huila (Colombia).
E-mail: hecosis16@yahoo.es
Recibido: 01/VII/2011 Aceptado 26/I/2012
Resumen
Se presenta el caso de una mujer de 46 años, quien consulta por lesiones dérmicas episódicas de 28 años de evolución, consistentes en edema doloroso ocasionalmente pruriginoso, súbito, recurrente, familiar, que compromete varias regiones corporales incluyendo la laringe. Por la gravedad de los episodios ha requerido repetidas hospitalizaciones en las que se ha recuperado mediante tratamiento sintomático. Se encuentran valores séricos de C3 165.5 mg/dL, C4 1 mg/dL, CH50 < 256 U, e inhibidor de C1 38 mg/dL. Se realiza diagnóstico de angioedema hereditario tipo I y se inicia tratamiento con antifibrinolíticos y andrógeno con mejoría de los síntomas. Se hace énfasis en la necesidad de sospechar la enfermedad clínicamente en pacientes con episodios recurrentes de angioedema sin urticaria con el fin de instaurar el tratamiento adecuado, por falla en dicha sospecha, dos de los familiares de la paciente infortunadamente fallecieron. (Acta Med Colomb 2012; 37: 34-37).
Palabras clave: angioedema hereditario, proteína inhibidora del complemento C1.
Abstract
A 46 year-old woman affected by familiar, recurrent episodes of skin lesions with painful, occasionally pruriginous angioedema who had been hospitalized because of laryngeal compromise is presented. Laboratory results include C3: 165.5 mg/dL, C4: 1 mg/dL, CH50 < 256 Units, and C1 inhibidor 38 mg/dL. Hereditary angioedema Type I is diagnosed, patient is currently on treatment with anti-fibrynolytic and androgen, obtaining clinical improvement. A clinical emphasis in the diagnosis of Hereditary angioedema is performed since misdiagnosis of this disease may lead to death as it happened to two patients's relatives. (Acta Med Colomb 2012; 37: 34-37).
Keywords: hereditary angioedema, complement C1 Inhibitor protein.
Introducción
El angioedema hereditario es una inmunodeficiencia primaria poco frecuente, de carácter autosómico dominante, secundario a deficiencia o disfunción del inhibidor del C1 (1), afectando por igual a hombres y mujeres de todas las edades, iniciando su presentación en la infancia, con mayor afectación durante la pubertad y continuando así por el resto de la vida sin predictores de severidad (2). Su prevalencia es incierta, pero se considera aproximadamente un caso por cada 50000 personas (3), sin diferencias conocidas entre los grupos étnicos.
Se caracteriza por episodios recurrentes de edema subcutáneo o submucoso, no pruriginoso, afectando típicamente brazos, piernas, manos, pies, intestino, genitales, cara, lengua y vía aérea superior, desencadenados por el trauma menor o el estrés, en muchas ocasiones no se logra determinar el factor precipitante (2). Los ataques abdominales causan dolor severo, náusea y vómitos, en muchas ocasiones simulando un abdomen agudo quirúrgico, llevando a cirugía innecesaria. El compromiso de la vía aérea superior con edema laríngeo es una urgencia que pone en riesgo la vida, desencadenando en muchos casos la muerte (2).
La alteración del inhibidor del C1 se debe a mutaciones en su gen, localizado en el cromosoma 11 (4). Según el defecto del inhibidor del C1 se ha agrupado la enfermedad en dos tipos, con similitud en las manifestaciones clínicas y el manejo (5). La tipo I, abarca 80-85% de los casos, y es ocasionada por una secreción reducida del inhibidor del C1 y bajos niveles circulantes. La tipo II se presenta en 15-20% de los casos, el inhibidor del C1 se secreta y sus niveles son normales, pero es disfuncional. Se ha descrito un tercer tipo angioedema de carácter familiar (6, 7) más frecuente en mujeres y se caracteriza por niveles circulantes y funcionales normales del inhibidor del C1, sin tener diferencias clínicas, ocasionado por un defecto funcional del factor XII, debido a mutaciones en su gen, induciendo un incremento en la generación de bradicinina (8). Aunque la mayor proporción de casos de alteraciones del inhibidor del C1 son de carácter hereditario, 25% se debe a mutaciones espontáneas en individuos sin historia familiar (9).
El inhibidor del C1 es una serina proteasa con una amplia variedad de funciones, actúa como inhibidor en la vía clásica del complemento de la proteasa C1r, C1s y la lectina proteasa ligadora de manosa 1 y 2, en el sistema de contacto bloquea la calicreína plasmática, el factor XII y el XIa, además actúa en el sistema fibrinolítico inactivando la plasmina (10, 11). Durante los episodios de angioedema hereditario varias de estas cascadas proteolíticas son activadas, generando sustancias vasoactivas, siendo la bradicinina el mediador predominante del aumento de la fuga vascular.
A continuación presentamos el caso clínico de una paciente que presentaba historia de angioedema recurrente durante largo tiempo, sin haberse realizado un adecuado diagnóstico y manejo, algo que es muy común en este tipo de patología por no tener la sospecha diagnóstica.
Caso clínico
Paciente femenino de 46 años con cuadro clínico que inicia a los 18 años de edad, de episodios de edema a nivel facial, en manos y piernas, sin lesiones urticariformes, y con prurito en algunas ocasiones, con empeoramiento durante el estrés, sin estar asociado a consumo de alimentos ni medicamentos, con periodos de agudización variables.
Antecedentes familiares de dos muertes (padre y hermano) por angioedema laríngeo, personales de hipertensión arterial en manejo con verapamilo 80 mg/12 h y hospitalización en varias oportunidades por angioedema y dolor abdominal, manejado con epinefrina y antihistamínicos con poca respuesta y resolución lenta del edema.
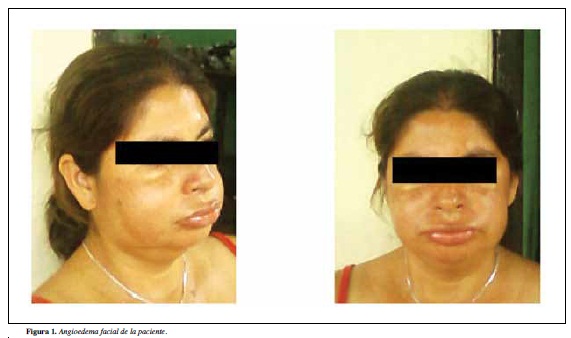
Al momento de la consulta está asintomática y el examen físico es normal, trae reporte de paraclínicos: inmunoglo bulina E total 32,09 (normal) y hemograma normal, se considera por las características del cuadro y los antecedentes familiares descartar angioedema hereditario, se inicia estudio encontrando niveles de complemento C3 165.5 mg/dL (valor de referencia 90 a 180 mg/dL), C4 1 mg/dL (valor de referencia 10 a 40 mg/dL), CH50 < 256 unidades (valor de referencia 392 a 1019 unidades), TSH 2.06 (0.47 a 5.01 uUI/ml), T4 libre 9.56 (9 a 20 pmol/L), por lo que se solicita inhibidor de C1 obteniéndose resultado de 38 mg/dL (valor de referencia 195 a 345 mg/L), se inicia manejo con danazol 400 mg/d, con buena respuesta disminuyendo la frecuencia y severidad de los episodios, considerándose angioedema hereditario tipo I. De manera voluntaria suspendió la medicación, presentando posteriormente un episodio severo de angioedema facial y dolor abdominal con vómito (Figura 1) que requirió manejo en urgencias con epinefrina y plasma fresco congelado con buena respuesta, se reinició manejo con danazol 400 mg/d y ácido tranexámico 500 mg/d continuándose ambulatorio con adecuado control a largo plazo, disminuyéndose la dosis de danazol a 200 mg/d y continuando el ácido tranexámico a igual dosis, valorando la función hepática y el perfil lipídico cada seis meses, sin haber presentado nuevos episodios de ataques severos, con sintomatología leve e infrecuente desencadenada por el estrés.
Discusión
El angioedema hereditario es una entidad poco frecuente y se debe sospechar en todo paciente que se presente con angioedema recurrente sin urticaria, o dolor abdominal que no sea ocasionado por otra patología.
El estudio se inicia con la medición de C4 que se debe tomar idealmente durante los ataques agudos donde todos tienen niveles bajos, debido a que algunos pacientes pueden presentar valores normales durante los periodos asintomáticos, los límites de C3 siempre son normales sin importar la fase clínica, y el diagnóstico se confirma con la medición de los niveles del inhibidor de C1 que estarán bajos, y en caso de ser normales se valorará su funcionalidad (13). Si se sospecha que el angioedema por deficiencia del inhibidor de C1 es adquirido como en pacientes sin historia familiar o edad de presentación tardía (> 40 años), se medirán los niveles de C1q que están bajos en este tipo de patología pero normales en el hereditario (13, 14).
Es importante diferenciar el angioedema hereditario de otras causas de angioedema como el inducido por inhibidores de la enzima convertidora de angiotensina y antiinflamatorios no esteroideos, donde la suspensión del medicamento y evitar su consumo es suficiente para el manejo; del angioedema alérgico donde el pilar del tratamiento se basa en los antihistamínicos y corticoides que son inútiles en el de tipo hereditario (12).
En el manejo del angioedema hereditario se toman en cuenta tres estrategias (13); 1) manejo agudo, 2) manejo a corto plazo o profiláctico, y 3) largo plazo. Los ataques agudos pueden ser severos, constituyendo una urgencia médica que pone en peligro la vida especialmente cuando hay compromiso laríngeo (22), donde los antihistamínicos y glucocorticoides carecen de beneficio y la epinefrina ofrece mejoría en muchas ocasiones transitoria, siendo más útil cuando se inicia temprano (13). Los otros medicamentos eficaces en el manejo a corto y largo plazo como los andrógenos 17 α alquilados y antifibrinolíticos no ofrecen mayor ventaja por su inicio de acción tardío. El plasma fresco congelado ha demostrado utilidad, debido a que contiene niveles del inhibidor de C1, lo que ayuda a la resolución rápida del cuadro, pero su empleo es controversial por la presencia de proteínas del sistema de contacto, lo que provee sustratos para la generación de más bradicinina (2). La terapia de reemplazo con el inhibidor de C1 purificado ha demostrado ser la más eficaz para la rápida resolución de los ataques agudos (13,15-17), sin mayores efectos adversos siendo actualmente el pilar del manejo en Estados Unidos y Europa (18), a la vez el uso de inhibidor del C1 recombinante también ha tenido resultados satisfactorios (19); sin embargo, en muchos países no se disponen de estos medicamentos, lo que ensombrece el panorama para el manejo de los episodios agudos, sin dejar a un lado el manejo sintomático que se debe emprender como la resolución del dolor abdominal con opiáceos, fluidoterapia endovenosa en caso de signos de hipovolemia, y el manejo adecuado de la vía aérea en caso de compromiso laríngeo, donde el monitoreo estrecho es elemental facilitando la realización de intubación orotraqueal o traqueostomía de ser necesario, e ando signos tempranos de edema laríngeo como cambios en la voz, pérdida de la habilidad para deglutir y dificultad respiratoria, optando por la intubación electiva, teniendo en cuenta a la vez que la manipulación de la vía aérea puede agravar el edema (2). El icatiban (20, 22) (antagonista del receptor B2 de bradicinina) y ecallantide (21, 22) (inhibidor de la calicreína plasmática), también se han utilizado y demostrado su eficacia en el manejo agudo, pero aún faltan más estudios que demuestren seguridad y efectividad para ampliar su uso.
El manejo a corto plazo (2, 13, 17, 22) se utiliza cuando se planea la exposición a una situación que puede desencadenar un ataque, como procedimientos médicos invasivos, odontológicos o quirúrgicos que generen estrés o activen vías del sistema de contacto. El inhibidor del C1 purificado ha demostrado utilidad al administrarse una hora antes del procedimiento, en aquellos sitios donde no se dispone de este medicamento, el uso de dos unidades de plasma fresco congelado 1-12 horas antes, es una opción adecuada y eficaz, con la desventaja del riesgo de transmisión de infecciones. También son útiles los derivados de andrógenos 17 α alquilados siendo el danazol el más disponible, y los antifibrinolíticos como el ácido tranexámico y épsilon amino caproico, iniciando la administración 5-10 días antes de la exposición al evento.
La terapia a largo plazo se debe considerar en aquellos paciente con ataques frecuentes o severos (2, 13, 17, 22), donde se ha encontrado que el uso de agentes 17 α alquilados (danazol, estanozolol, oxandrolona y metiltestorterona) y antifibrinolíticos (ácido tranexámico y ácido épsilon amino caproico), disminuye la frecuencia y severidad de los ataques, ajustando la dosis según la respuesta clínica observada. Es importante tener en cuenta los efectos adversos que pueden ocasionar estos medicamentos, especialmente los andrógenos 17 α alquilados por lo que se requiere medición seriada (cada 6-12 meses) de perfil lipídico y niveles de enzimas hepáticas, además de su efecto de masculinización, que puede presentar en niños y mujeres embarazas, donde no está indicado, siendo la mejor opción los agentes antifibrinolíticos. Todos los pacientes con angioedema hereditario deben evitar el uso de inhibidores de la enzima convertidora de angiotensina por disminuir el catabolismo de la bradicinina, y la utilización de estrógenos exógenos (anticonceptivos orales o terapia de reemplazo hormonal), que también se asocia a empeoramiento de la enfermedad.
Conclusión
El angioedema hereditario es una enfermedad poco frecuente, potencialmente fatal, con unas características clínicas bien definidas, por lo que se debe sospechar en aquellos casos de angioedema recurrente de causa no clara, que recibe múltiples manejos sin adecuada respuesta, y presenta el antecedente familiar de episodios similares. La confirmación del diagnóstico es muy importante por el manejo específico que requiere esta patología en el caso de ataques agudos severos que ponen en peligro la vida, en el tratamiento profiláctico y a largo plazo que mejora ostensiblemente los síntomas, y disminuye la frecuencia y severidad de los ataques.
Referencias
1. Donaldson VH, Evans RR. A biochemical abnormality in hereditary angioneurotic edema: absence of serum inhibitor of C' 1-esterase. Am J Med 1963; 35: 37-44. [ Links ]
2. Bruce L. Zuraw. Hereditary Angioedema. N Engl J Med 2008; 359: 1027-36. [ Links ]
3. Nzeako UC, Frigas E, Tremaine WJ. Hereditary angioedema: a broad review for clinicians. Arch Intern Med 2001; 161: 2417-29. [ Links ]
4. Zahedi K, Prada AE, Davis AE III. Structure and regulation of the C1 inhibitor gene. Behring Inst Mitt 1993; 93: 115-9. [ Links ]
5. Lawrence Charles Parish. Hereditary angioedema: Diagnosis and management a perspective for the dermatologist. J Am Acad Dermatol 2010; 9: 715. [ Links ]
6. Bork K, Barnstedt SE, Koch P, Traupe H. Hereditary angioedema with normal C1-inhibitor activity in women. Lancet 2000; 356: 213-7. [ Links ]
7. Konrad Bork. Hereditary Angioedema with Normal C1 Inhibition. Curr Allergy Asthma Rep 2009, 9: 280-285. [ Links ]
8. Dewald G, Bork K. Missense mutations in the coagulation factor XII (Hageman factor) gene in hereditary angioedema with normal C1 inhibitor. Biochem Biophys Res Commun 2006; 343: 1286-9. [ Links ]
9. Pappalardo E, Cicardi M, Duponchel C, Carugati A, Choquet S, Agostoni A, et al. Frequent de novo mutations and exon deletions in the C1 inhibitor gene of patients with angioedema. J Allergy Clin Immunol 2000; 106: 1147-54. [ Links ]
10. Alvin E. Davis III. Mechanism of Angioedema in First Complement Component Inhibitor Defciency. Immunol Allergy Clin N Am 2006; 26: 633-651. [ Links ]
11. Alvin E. Davis. The pathophysiology of hereditary angioedema. Clinical Immunology 2005; 114: 3-9. [ Links ]
12. David Weldon. Differential Diagnosis of Angioedema. Immunol Allergy Clin N Am 2006; 26: 603-613. [ Links ]
13. Bowen et al. International consensus algorithm for the diagnosis, therapy and management of hereditary angioedema 2010. Allergy Asthma Clin Immunol 2010; 6: 24. [ Links ]
14. Marco Cicardi, Andrea Zanichelli. Acquired angioedema. Allergy Asthma Clin Immunol 2010; 6: 14. [ Links ]
15. Waytes AT, Rosen FS, Fran KMM. Treatment of hereditary angioedema with a vapor-heated C1 inhibitor concentrate. N Engl J Med 1996; 334: 1630-4. [ Links ]
16. Kunscha KM, Engl W, Maritsch F, et al. A randomized, controlled trial to study the efficacy and safety of C1 inhibitor concentrate in treating hereditary angioedema. Transfusion 1998; 38: 540-9. [ Links ]
17. Bork K, Barnstedt SE. Treatment of 193 episodes of laryngeal edema with C1 inhibitor concentrate in patients with hereditary angioedema. Arch Intern Med 2001; 161: 714-8. [ Links ]
18. Michael M. Frank. Hereditary Angioedema: The Clinical Syndrome and its Management in the United States. Immunol Allergy Clin N Am 2006; 26: 653–668. [ Links ]
19. Bruce Zuraw, Marco Cicardi, et al. Recombinant human C1-inhibitor for the treatment of acute angioedema attacks in patients with hereditary angioedema. J Allergy Clin Immunol 2010; 126: 821-7. [ Links ]
20. Konrad Bork, et al. Treatment of acute edema attacks in hereditary angioedema with a bradykinin receptor-2 antagonist (Icatibant). J Alergy Clin Immunol 2007; 119: 6. [ Links ]
21. Albert L. Sheffer, et al. Ecallantide (DX-88) for acute hereditary angioedema attacks: Integrated analysis of 2 double-blind, phase 3 studies. J Allergy Clin Immunol 2011; 128: 153-159. [ Links ]
22. Sabina Antonela Antoniu. Therapeutic Approaches in Hereditary Angioedema. Clinic Rev Allerg Immunol 2011; 29: 8254-2. [ Links ]