Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Medica Colombiana
Print version ISSN 0120-2448
Acta Med Colomb vol.37 no.4 Bogotá Oct./Dec. 2012
Trabajos Originales
Seguimiento del periodo inmediato post-autotrasplante de células progenitoras hematopoyéticas
Follow-up of immediate period of post-autologous hematopoietic progenitor cells transplant
Benjamín Ospino1, Luz Mábel Ávila2, Natalia Sánchez3, Bogotá, D.C. (Colombia)
1Dr. Benjamín Ospino Cáliz: Hematólogo. Coordinador Programa de Especialización en Hematología y Oncología Clínica, Servicio de Hemato-Oncología Hospital Militar Central;
2Dra. Luz Mabel Ávila-Portillo: BLC MSc, cPhD. Jefe Unidad de Investigación Científica, Hospital Militar Central. Directora Científica, Stem Medicina Regenerativa, Bogotá;
3Srta. Natalia Sánchez: Estudiante de Bacteriología, Universidad Católica de Manizales. Manizales, Colombia.
Correspondencia. Dr. Benjamín Ospino Cáliz. Bogotá, D.C., (Colombia). E-mail: bospinoc@gmail.com.
Recibido: 28/III/2012 Aceptado: 01/XI/2012
Resumen
Introducción: el objetivo de este estudio fue describir el comportamiento clínico y de laboratorio presentado en autotrasplante de células progenitoras hematopoyéticas en un grupo de pacientes del Hospital Militar Central en el periodo de enero 2007 a octubre de 2010.
Material y métodos: es un estudio descriptivo retrospectivo a través de la revisión de las historias clínicas de estos pacientes obteniendo la información sobre tiempo de alta pos trasplante, requerimiento transfusional, periodo aplásico (neutropenia absoluta, trombocitopenia severa, anemia severa y presentación de neutropenia febril), número de células madre trasplantadas, fuente y criopreservación o no. Los resultados de las diferentes variables por medir fueron tabulados y almacenados en una base para su posterior análisis descriptivo univariado cualitativo y cuantitativo.
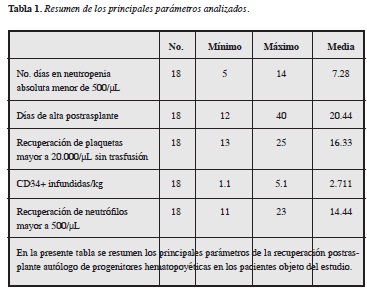
Resultados: todos los pacientes injertaron adecuadamente. El injerto de neutrófilos ocurrió entre 11-23 días, con una media de 14.44; el injerto de plaquetas ocurrió entre 13-25 días, con una media de 16.33, y la duración de la neutropenia absoluta fue de 5-14 días, con una media de 7.28.
Conclusiones: la recuperación de los pacientes fue similar a lo descrito en la literatura internacional. (Acta Med Colomb 2012; 37: 172-176).
Palabras clave: TAMO, CD34+, criopreservación, amifostina.
Abstract
Introduction: the aim of this study was to describe the clinical and laboratory performance in autologous transplants of hematopoietic progenitor cells in a group of patients in the Hospital Militar Central in the period january 2007 to october 2010.
Material and methods: we performed a retrospective descriptive study by reviewing the medical records of these patients in regard to the time of discharge from hospital after transplantation, transfusion requirement, aplastic period (absolute neutropenia, severe thrombocytopenia, severe anemia and febrile neutropenia presentation ), number of transplanted stem cells, source, and whether there was or not cryopreservation. The results of the different variables measured were tabulated and stored in a database for later univariate descriptive qualitative and quantitative analysis.
Results: all patients grafts functioned properly. Neutrophil engraftment occurred between 11-23 days, with a mean of 14.44, platelet engraftment occurred between 13-25 days, with a mean of 16.33, and the absolute duration of neutropenia was 5-14 days, with a median of 7.28.
Conclusions: the recovery of patients was similar to that described in the international literature. (Acta Med Colomb 2012; 37: 172-176).
Keywords: ABMT, CD34 +, cryopreservation, amifostine.
Introducción
El trasplante de células madre hematopoyéticas (TAMO) se refiere al remplazo de las células madre hematopoyéticas (CMH) que han sido dañadas irreversiblemente por las dosis altas de quimioterapia y/o radioterapia. Esto es válido tanto para la médula ósea (MO) obtenida por múltiples aspirados en las crestas iliacas posteriores bajo anestesia, o con las CMH obtenidas de la sangre periférica mediante aféresis. Esta forma de obtención evita la anestesia y la recuperación hematopoyética es más rápida; además es posible la obtención de CMH cuando la pelvis ha sido irradiada o existen metástasis óseas en esa área (1-3).
Cuando la recolección de las CMH se hace durante la recuperación hematopoyética después de la quimioterapia con factores estimulantes de colonias granulocíticas, son necesarias pocas aféresis (ocasionalmente una sola) para obtener el número necesario para garantizar una adecuada recuperación hematopoyética (2 x 106/kg de peso del receptor) (4); esto no siempre es cierto para los pacientes que han recibido un gran número de ciclos de quimioterapia y/o radioterapia. Los desenlaces y complicaciones a largo plazo, no parecen estar relacionados con la fuente de las células, sino con el esquema o régimen de acondicionamiento. Para algunos pacientes el TAMO provee la única opción de curación cuando han fallado a la quimioterapia estándar o han tenido recaída después de lograr una remisión con ella, en especial si ésta es temprana, convirtiéndose en la terapia estándar para estos casos (4-7).
El TAMO es un procedimiento utilizado durante el tratamiento tanto de enfermedades malignas tales como linfoma no Hodgkin, linfoma de Hodgkin, mieloma múltiple, leucemias agudas y crónicas y algunos tumores sólidos, como enfermedades benignas tales como las enfermedades autoinmunes (8-12). El uso de altas dosis de quimioterapia seguido de TAMO, también puede revertir el proceso de autoinmunidad, mejorando en más de un 50% el compromiso cutáneo, con estabilización de los compromisos pulmonar, renal y cardiaco, en los pacientes con esclerosis sistémica difusa que habían fracasado con la terapia inmunosupresora (13, 14).
Las CMH pueden ser a almacenadas a 4°C por un periodo de dos a tres días, cuando el régimen de acondicionamiento pretrasplante es corto como en el caso del mieloma múltiple, o criopreservarlas a -196° C en el caso de regímenes de acondicionamiento más largos como en los linfomas, tumores sólidos y enfermedades autoinmune (14-16). Datos preclínicos procedentes de Alemania sugieren que la activación de las caspasas, en particular durante el proceso de descongelación, puede inducir la apoptosis y por lo tanto, contribuir a la destrucción de los injertos trasplantados. La adición del inhibidor de la caspasa-FMK zVAD como crioconservante presenta una interesante perspectiva de futuro (17).
Las CMH se encuentran en el nicho hematopoyético y la función de este nicho es regular la proliferación, autorrenovación y movilización de las células madre hematopoyéticas (CMH), lo cual se realiza a través de mecanismos complementarios tales como producción de moléculas de señalización, modulación de la rigidez de la matriz, creación de gradientes de citocinas, y regulación del medio fisico-químico, incluyendo el pH y la tensión de oxígeno (18-22).
El fosfoaminotiol o amifostina es un citoprotector de amplio espectro, con el potencial de proteger a muchos órganos y tejidos contra la toxicidad de la radioterapia y/o quimioterapia (23). El principio de acción de este fármaco se basa en las diferencias fisiológicas entre las células normales y tumorales, al interferir con el transporte selectivo a través de la membrana celular. Promueve la acción protectora a través de dos mecanismos principales: "barredores" de radicales libres de oxígeno y reparación citoplásmica de ADN nuclear. La amifostina es un profármaco desarrollado por el ejército americano en la época de la guerra fría, para protegerse de un eventual ataque nuclear y se ha sido utilizado en varios estudios clínicos en los cuales ha demostrado disminución de los efectos adversos de las altas dosis de quimioterapia, además de permitir escalar dosis que permitan disminuir el riesgo de recaídas postrasplante (23-26).
Este trabajo pretende determinar el comportamiento clínico y de laboratorio presentado en un grupo de pacientes del Hospital Militar Central que fueron autotrasplantados con células progenitoras hematopoyéticas, en el periodo comprendido entre 2007 y 2010 mediante el análisis de los requerimientos inmediatos del paciente trasplantado en soporte transfusional, complicaciones infecciosas más comunes, tiempo de recuperación de la aplasia postquimioterapia mieloablativa y hospitalización.
Material y métodos
Es un estudio descriptivo en el cual se revisaron 18 historias clínicas de todos los pacientes trasplantados por la unidad de trasplante del servicio de hemato-oncología del Hospital Militar Central del periodo comprendido entre enero de 2007 y octubre de 2010, cuyos esquemas de acondicionamiento fueron citoprotegidos con amifostina. De acuerdo con la patología se utilizaron los siguientes esquemas de movilización: A) Se inició la movilización después del último ciclo de quimioterapia seguido de G-CSF 5 μg/kg/d subcutáneo cada 12 horas desde las 24 horas de finalizado el ciclo hasta la documentación por citometrìa de flujo de CD34+> 30 cel/uL; B) Ciclofosfamida: 3g/m2/d IV, seguido de G-CSF 5 μg/kg/d subcutáneo cada 12 horas desde las 24 horas de finalizado el ciclo hasta la documentación por citometría de flujo de CD34+> 30 cel/uL; C) A los pacientes libres de quimioterapia durante seis semanas o más. G-CSF: 5-10 μg/kg/d SC cada 12 horas durante 4-7 días, seguido por aféresis. A cada historia clínica se le revisó número, fuente (médula ósea o sangre periférica) y manejo (criopreservación la cual fue realizada en el laboratorio de Stem Medicina Regenerativa o refrigeradas a 4°C hasta su reinfusión) de las células progenitoras hematopoyéticas, comportamiento clínico posterior al trasplante (recuperación hematopoyética, neutropenia febril, etiología de la fiebre y requerimiento transfusional), y tiempo en días de alta posttrasplante. Para efectos del análisis estadístico se elaboró una base de datos la cual fue procesada con el paquete estadístico S.P.S.S. versión 11.05 para Windows. Se realizó un análisis descriptivo univariado. En el desarrollo de esta investigación se respetaron las normas éticas y legales de la investigación clínica aplicada en salud según la legislación nacional e internacional.
Resultados
Se analizaron 10 hombres y ocho mujeres, con edad media de 47 años (23 a 72 años), quienes padecían de las siguientes enfermedades: ocho con mieloma múltiple, cinco con linfoma no Hodgkin, tres con linfoma de Hodgkin, uno con esclerosis sistémica difusa y uno con neuroblastoma estado IV.
El injerto de neutrófilos definido como recuento total de neutrófilos >500/uL durante 72 horas, ocurrió entre 11 y 23 días con una media de 14.44 días, y el injerto de plaquetas, definido como un recuento >20.000/uL sin requerimiento transfusional durante siete días fue de 13 a 25 días, con una media de 16.33 días y posterior de alta de 12 a 40 días, con una media de 20.44 días. El tiempo de neutropenia absoluta estuvo entre 5 y 14 días, con una media de 7.28 días.
Los resultados evidencian que todos los pacientes injertaron neutrófilos y plaquetas adecuadamente (Tabla 1).
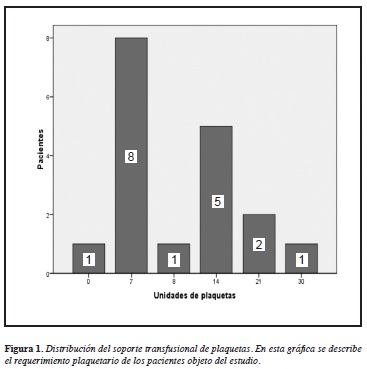
Distribución del soporte transfusional
El requerimiento transfusional de glóbulos rojos estuvo entre 0 y 6 unidades, con una media de 1.27 unidades, con 10 pacientes que no necesitaron transfusión y uno que requirió de seis unidades. El requerimiento transfusional de plaquetas estuvo entre 0 y 30 unidades, con una media de 11.44 unidades, un paciente que no requirió y otro con 30 unidades (Figura 1).
Distribución de la neutropenia febril en los pacientes trasplantados
Durante el periodo neutropénico, la mayoría de los paciente (77.77%) presentaron fiebre, documentándose germen en sólo tres de ellos (21.42%). Todos estos pacientes se tornaron afebriles dentro de las primeras 84 horas de iniciada la terapia empírica de amplio espectro y los gérmenes aislados resultaron sensibles a ella; por lo tanto ningún paciente requirió escalamiento de antibióticos, así como tampoco adición de terapia antimicótica.
La mayor fuente de CMH fue la sangre periférica (66.67%) obtenida mediante el proceso de movilización con factores de crecimiento celular, o estos combinados con quimioterápicos. Sin embargo, hubo un importante número (33.33%) que no lograron un adecuado nivel de células en la sangre periférica, por lo cual fue necesario obtenerlas directamente de la médula ósea. La causa más probable de esto pudo haber sido la gran cantidad de ciclos de quimioterapia recibida por estos pacientes en el curso de su enfermedad.
Fuente y manejo de las células madre hematopoyéticas extraídas previas al trasplante
De los 18 pacientes autotrasplantados, a 11 (61.11%) se les criopreservaron sus células progenitoras hematopoyéticas de los cuales nueve pacientes las tuvieron criopreservadas menos de tres meses y dos durante nueve meses. Aunque la muestra no fue representativa no se observó tendencias de diferencia en cuanto a la fuente y al proceso de criopreservación.
El número de células infundidas estuvo en el promedio internacionalmente recomendado (CD34 + 1-4 x 106/kg) y con respecto al tiempo de criopreservación de las células el 81.81% fueron trasplantados dentro de los tres meses posterior a este proceso. Ninguna de las situaciones afectó negativamente el tiempo de recuperación de los pacientes.
Discusión
La indicación más frecuente de autotrasplante en la muestra analizada en este periodo fue mieloma múltiple, lo cual corresponde con la actual tendencia mundial de TAMO. La media de tiempo de recuperación hematológica fue similar a lo reportado a nivel mundial, pero puede ser afectada por factores como la edad, y patología tratada, que debe ser obtenida al incrementar el tamaño de la muestra. Todos los pacientes injertaron y no hubo ningún reporte de deceso.
Durante el periodo neutropénico, la mayoría de los paciente (77.77%) presentaron fiebre, documentándose germen en sólo tres de ellos (21.42%). Todos estos pacientes se tornaron afebriles dentro de las primeras 84 horas de iniciada la terapia empírica de amplio espectro y los gérmenes aislados resultaron sensibles a ella; por lo tanto ningún paciente requirió escalamiento de antibióticos, así como tampoco adición de terapia antimicótica.
La mayor fuente de células madre hematopoyéticas fue la sangre periférica (66.67%). Sin embargo, hubo un importante número (33.33%), que no lograron un adecuado nivel de células en la sangre periférica, por lo cual fue necesario obtenerlas directamente de la médula ósea. La causa más probable de esto pudo haber sido la gran cantidad de ciclos de quimioterapia recibida por estos pacientes en el curso de su enfermedad. El inóculo de células madre administrado estuvo entre 1.1 y 5.1 millones /kg con media de 2.77, muy similar a lo recomendado en los diferentes estudios (27, 28).
Durante la recuperación postrasplante de los pacientes no se observaron diferencias importantes en los distintos parámetros en relación con el número, la fuente de las células y su proceso de criopreservación.
La recuperación del periodo aplásico postrasplante fue de 20.44 días ubicándose esta cifra dentro del límite inferior normal del promedio de la mayoría de los estudios lo cual podría estar en relación con la sistemática aplicación de la citoprotección con amifostina (29-33).
Habiendo tenido un periodo de recuperación corto, los requerimientos transfusionales de plaquetas y/o glóbulos rojos fue bajo con una media de 11.44 unidades de plaquetas y 1.27 unidades de glóbulos rojos.
La mayor fuente de células progenitoras hematopoyéticas fue la sangre periférica (66.67%), siendo esta cifra inferior a lo publicado en otros estudios (entre 80-95%).
Conclusiones
La recuperación de los pacientes analizados para este estudio fue similar a lo descrito en la literatura internacional en cuanto a injerto de neutrófilos, plaquetas, requerimientos transfusionales, tiempo de hospitalización; no hubo evidencias de diferencias en el injerto entre las células criopreservadas y las células refrigeradas.
Referencias
1. Philip T, Guglielmi C, Hagenbeek A, et al. Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive non-Hodgkin's lymphoma. N Engl J Med 1995; 333: 1540-1545. [ Links ]
2. Linch DC, Winfeld D, Goldstone H, et al. Dose intensification with autologous bone marrow transplantation in relapse and resistant Hodgkin's disease: results of a BNLI randomized trial. Lancet 1993; 341: 1051-1054. [ Links ]
3. Hahn T, Wolff SN, Czuczman M, et al. The role of cytotoxic therapy with hematopoietic stem cell transplantation in the therapy of diffuse large B cell non-Hodgkin's lymphoma: an evidence-based review. Biol Blood Marrow Transplant 2001; 7: 308-331. [ Links ]
4. Petengel R, Morgenstern GR, Woll PJ, et al. Peripheral blood progenitor cell transplantation in lymphoma and leukemia using a single apheresis. Blood 1993; 82: 3770-3777. [ Links ]
5. Ager S, Scott MA, Mahendra P, et al. Peripheral blood stem cell transplantation after high-dose therapy in patients with malignant lymphoma: a retrospective comparison with autologous bone marrow transplantation. Bone Marrow Transplant 1995; 16: 79-83. [ Links ]
6. Lazarus HM, Perez WS, Klein JP, et al. Autologous versus HLA matched un-related donor transplantation for acute myeloid leukemia: a retrospective analysis from the Center for International Blood and Marrow Transplantation Research. Br J Haematol 2006; 132: 755-769. [ Links ]
7. Akpek G, Ambinder RF, Piantadosi S, et al. Long-term results of blood and marrow transplantation for Hodgkin's lymphoma. J Clin Oncol 2001; 19: 4314-4321. [ Links ]
8. Lavoie JC, Connors JM, Phillips GL, et al. High dose chemotherapy and autologous bone-marrow transplantation for primary resistant or relapsed Hodgkin's lymphoma: long term outcome in the first 100 patients treated in Vancouver. Blood 2005; 106: 1473-1478. [ Links ]
9. Majolino I, Pearce R, TaghipourG, et al. Peripheral blood stem cell transplantation versus autologous bone marrow transplantation in Hodgkin's and non-Hodgkin's lymphomas: a new matched-pair analysis of the European Group for Blood and Marrow Transplantation Registry Data. Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 1997; 15: 509-517. [ Links ]
10. Sureda A, Arranz R, Iriondo A, et al. Autologous Stem cell transplantation for Hodgkin's desease: results and prognostic factors in 494 patients from the Grupo Español de Linfomas/Trasplante Autólogo de Médula Ósea Spanish Cooperative Group. J Clin Oncol 2001; 19: 1395-1404. [ Links ]
11. Palumbo A, Bringhen S, Petrucci MT, et al. Intermediate-dose melphalan improves survival of myeloma patients aged 50 to 70: results of a randomized controlled trial. Blood 2004; 104: 3052-7. [ Links ]
12. Facon T, Mary JY, Hulin C, et al. Melphalan and prednisone plus thalidomide versus melphalan and prednisone alone or reduced-intensity autologous stem cell transplantation in elderly patients with multiple myeloma (IFM 99-06): a randomized trial. Lancet 2007; 370: 1209-18. [ Links ]
13. Reyes E, Arbeláez A.M, Ávila-Portillo L.M., Ospino B., y cols. Autotrasplante exitoso de células madre hematopoyéticas en una mujer con esclerosis sistémica severa refractaria al manejo inmunosupresor. Rev Colomb Reumatol 2009; 16: 4. [ Links ]
14. Farge D, Passweg J, van Laar JM, Marjanovic Z, Besenthal C, Finke J, et al. Autologous stem cell transplantation in the treatment of systemic sclerosis: report from the EBMT/EULAR Registry. Ann Rheum Dis 2004; 63: 974-981. [ Links ]
15. Cruz G, Cruz J. Criopreservación de células progenitoras Hematopoyéticas. Gac Méd Méx 2000; 136(Supl. 2): 13-15. [ Links ]
16. Rowley SD. Hematopoietic stem cell cryopreservation: a review of current techniques. J Hematother 1992; 1(3): 233-250. [ Links ]
17. David Berz, Elise M. McCormack, Eric S. Winer, Gerald A. Colvin, and Peter J. Quesenberry. Cryopreservation of Hematopoietic Stem Cells. Am J Hematol 2007; 82(6): 463-472. [ Links ]
18. Kiel MJ, Yilmaz OH, Iwashita T, Yilmaz OH, Terhorst C, Morrison SJ. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell 2005; (121): 1109-1121. [ Links ]
19. Kiel MJ, Morrison SJ. Uncertainty in the niches that maintain haematopoietic stem cells. Nat Rev Immunol 2008; (8): 290-301. [ Links ]
20. Cashen AF, Lazarus HM, Devine SM. Mobilizing stem cells from normal donors: is it possible to improve upon G-CSF?. Bone Marrow Transplantation 2007; (39): 577-588. [ Links ]
21. Dellatore S, Garcia A, Miller W. Mimicking stem cell niches to increase stem cell expansion. Current Opinion in Biotechnology 2008; (19): 534-540. [ Links ]
22. Kondo M, Wagers AJ, Manz MG, Prohaska SS, Scherer DC, Beilhack GF, Shizuru JA, Weissman IL. Biology of hematopoietic stem cells and progenitors: implications for clinical application. Annu Rev Immunol 2003; (21): 759-806. [ Links ]
23. Schuchter LM. Guidelines for administration of amifostine. Semin Onco 1996; 23(suppl. 8): 40-44. [ Links ]
24. Schuchter LM, DiPaola R, Greenberg R, Bird S, Mollman J, Recio A. A phase I study of amifostine (AMI) and escalating doses of taxol in patients (PTS) with advanced cancer. Eur J Cancer 1995; 31(suppl 5): 958. [ Links ]
25. Yuhas JM. Active versus passive absorption kinetics as the basis for selective protection of normal tissues by S-2-(3-Aminopropylomino)-ethylphosphorothioic acid. Cancer Res 1980; 40: 1519-15. [ Links ]
26. Gabriel DA, Shea TC, and Serody JS, et al. Cytoprotection by amifostine during autologous stem cell transplantation for advanced refractory hematologic malignancies. Biol Blood Marrow Transplant 2005; 11 : 1022-1030. [ Links ]
27. Davidson DE, Grenana MM, Sweeney TR. Biological characteristics of some improved radioprotectors. In: Radiation Sensitizers: Their use in the Clinical Management of cancer, 1980; Vol. 5, Chap. 45. LW Brady. Masson Publishing USA Inc. [ Links ]
28. Calabro-Jones PM, Fahey RC, Smoluk GD, Ward JF. Alkaline phosphatase promotes radioprotection and cumulation of WR-1065 in V79-171 cells incubated in medium containing WR-2721. Int J Radiat Oncol Biol Phys 1985; 47: 23-7. [ Links ]
29. Capizzi RL, Scheffer BJ, Schein PS. Amiphostine-mediate protection of normal bone marrow from cytotoxic chemotherapy. Cancer 1993; 72: 3495-501. [ Links ]
30. Yang JL, Fernandes DJ, Capizzi RL. Amiphostine (WR2721) selectively protects human lung fibroblasts versus non-small cell lung carcinoma cells from radiation damage. Proc Annu meet Am Assoc Cancer Res 1994; 35: 324. [ Links ]
31. Yang JL, Fernandes DJ, Speicher L, Capizzi RL. Biochemical determinants of the cytoprotective effect of amiphostine. Proc Annu meet Am Assoc Cancer Res 1995; 36: 290. [ Links ]
32. Yuhas JM. Active versus passive absorption kinetics as the basis for selective normal tissue protection by S-2-(3-aminopropylamino) ethylphosphorothioic acid. Cancer Res 1980; 40: 1519-24. [ Links ]
33. Yuhas JM, Storer JB. Differential chemoprotection of normal and malignant tissue. J Natl Cancer Inst 1969; 42: 331-5. [ Links ]