Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Medica Colombiana
Print version ISSN 0120-2448
Acta Med Colomb vol.38 no.3 Bogotá July/Sept. 2013
Presentación de casos
Cáncer de tiroides y síndromes polipósicos intestinales Síndrome de Gardner
Thyroid cancer and intestinal polyposis syndromes Gardner syndrome
Leonardo Javier Rojas, Ana María Grizales, María Inés Toro, Ana MAría Gómez, Richard Giovanni Buendía • Bogotá, D.C. (Colombia)
Dr. Leonardo Javier Rojas: Internista Endocrinólogo, Hospital Universitario de San Ignacio, Instituto Nacional de Cancerología;
Dra. Ana María Grizales Rodríguez: Internista Universidad de Caldas. Endocrinóloga Pontificia Universidad Javeriana, Hospital Universitario de San Ignacio;
Dra. María Inés Toro Grajales: Internista Fundación Santa Fe de Bogotá. Endocrinóloga Hospital Universitario de San Ignacio, Pontificia Universidad Javeriana;
Dra. Ana María Gómez Medina: Internista Endocrinóloga, Jefe Unidad de Endocrinología Hospital Universitario de San Ignacio, Asociación Colombiana de Diabetes;
Dr. Richard Giovanni Buendía Godoy: Internista Endocrinólogo Pontificia Universidad Javeriana, Hospital Universitario de San Ignacio. Bogotá, D.C. (Colombia).
Correspondencia: Dr. Leonardo Javier Rojas. Bogotá, D.C. (Colombia). E-mail: leonardorojasmd@yahoo.com
Recibido: 18/IX/2012 Aceptado: 27/VI/2013
Resumen
Presentamos el caso de una mujer de 22 años de edad, evaluada debido a que en su historia familiar a su madre se le encontró carcinoma de colon sigmoide. A la paciente se le diagnosticó poliposis colónica, que resolvió tras remoción endoscópica de las lesiones. Se realizó estudio de nódulo tiroideo y se realizó tiroidectomía total encontrándose un carcinoma papilar de tiroides como diagnóstico definitivo. Hicimos una revisión de la literatura. (Acta Med Colomb 2013; 38: 182-185).
Palabras clave: poliposis intestinal familiar, carcinoma de tiroides, síndrome de Gardner, gen RET PTC, gen APC.
Abstract
We report the case of a 22-year-old woman evaluated because in her family history his mother had a sigmoid colon carcinoma. The patient was diagnosed with colonic polyposis, which resolved after endoscopic removal of the lesions. We made the study of a thyroid nodule and performed total finding a papillary thyroid carcinoma as definitive diagnosis. (Acta Med Colomb 2013; 38: 182-185).
Keywords: familial intestinal polyposis, thyroid carcinoma, Gardner's syndrome. PTC RET gene. APC gene.
Caso clínico
Paciente mujer de 22 años de edad, asintomática, a quien se le realizó colonoscopia como tamización por antecedente materno de poliposis intestinal, carcinoma en sigmoides con metástasis pulmonares y hepáticas, tratada con colectomía y quimioterapia.
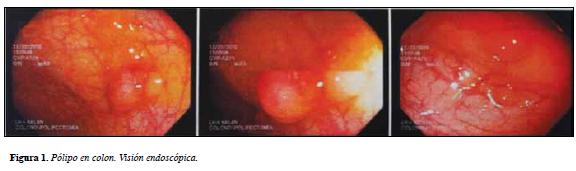
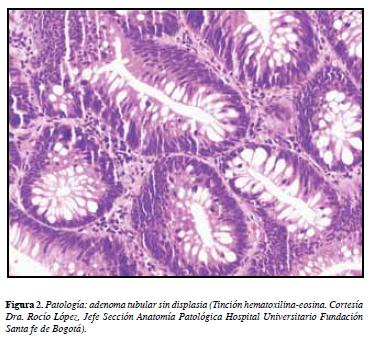
Desde diciembre de 2010 se evidenciaron micropólipos en colon ascendente, resecados en varias oportunidades (Figura 1) con patología que reportó adenoma tubular sin displasia de alto grado (Figura 2).
Se le realizó endoscopia digestiva alta que mostró una lesión umbilicada de 4 mm. En la región prepilórica de la curvatura gástrica mayor que fue resecada y micro lesiones elevadas en la pared anterior del antro y en la segunda porción del duodeno que pudieran corresponder a pólipos incipientes con reporte de patología duodenal sin alteraciones, estómago con microadenoma tubular sin displasia.
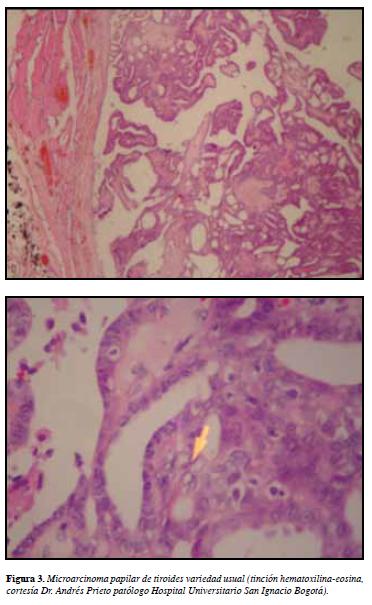
Por la posible asociación se realizó ecografía de tiroides que mostró un nódulo de 8x3.6x6 mm en el lóbulo izquierdo, sin aparentes hallazgos de riesgo. Por el antecedente se realizó ACAF, la cual fue reportada como Ca papilar de tiroides, grado VI de la clasificación de BETHESDA, razón por la cual fue llevada a tiroidectomía total con vaciamiento del compartimiento central, mostrando un carcinoma papilar de variedad usual, de 0.8 cm de diámetro mayor localizado en polo inferior de lóbulo tiroideo izquierdo, sin compromiso capsular, vascular o de tejido peritiroideo, sin compromiso ganglionar (Figura 3).
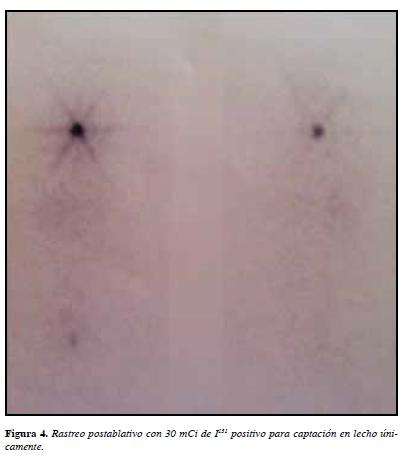
Debido a la alteración genética probable que le implicaría mayor riesgo de recaída a pesar de ser considerado microcarcinoma, se consensuó el beneficio de ablación 30 mCi de I131 bajo estímulo con TSH recombinante para evitar los síntomas del hipotiroidismo, con rastreo postablativo positivo en lecho (Figura 4), con TSH 216 mU/L, tiroglobulina 0.13 ng/mL y anticuerpos antitiroglobulina <10 UI/mL clasificándolo como T1N0M0 estadio I de bajo riesgo.
Sin lesiones óseas aparentes. Actualmente en seguimiento endoscópico de lesiones intestinales con propuesta de colectomía profiláctica.
Está pendiente el trámite para la evaluación molecular genética de la proteína APC.
Poliposis adenomatosa familiar
La poliposis adenomatosa familiar (PAF), el síndrome de Cowden y el síndrome de Peutz-Jeghers, conocidos como síndromes polipósicos intestinales, son desórdenes con herencia autosómica dominante que se caracterizan por el desarrollo de pólipos gastrointestinales y riesgo de cáncer colorrectal en edades tempranas. Se ha recomendado realización de colectomía preventiva para aquellos individuos afectados por la enfermedad, ya que la tasa de desarrollo de cáncer colorrectal es cercana a 100% (2).
Dentro de las manifestaciones extraintestinales, la presencia de patologías malignas en diferentes sitios incluyen el cáncer diferenciado de tiroides (carcinomas papilares y foliculares de tiroides) (1).
La PAF, inicialmente descrita por Cripps en 1882, comprende las formas clásica, la atenuada, el síndrome de Gardner, el síndrome de Turcot tipo 2 y la asociada a MUTYH. Tiene una incidencia de 1/10,000 – 1/30,000 nacimientos, afecta ambos sexos y tiene distribución mundial (3). Es causada por mutaciones germinales del gen de APC: Adenomatous Polyposis Coli, que es un gen supresor de tumores, localizado en el cromosoma 5q21-q22, y activador de RET/PTC, gen quimérico con clara participación en la génesis del carcinoma diferenciado papilar de tiroides (4, 5).
La mayoría de las mutaciones del gen APC que se asocian con el carcinoma papilar de tiroides aparecen en los codones 1286-1513 con sobreposición en los codones 463-1387 (1).
La proteína normal APC tiene como función la inhibición de la división celular en forma indirecta; la proliferación, diferenciación, apoptosis celular, la adhesión, migración y segregación cromosómicas (13).
Ella forma un complejo con la β Catenina y el factor de transcripción tcf 4 que termina en la degradación de la β Catenina. Con la mutación y disminución de la proteína APC,el exceso deβ Catenina activará la transcripción de genes como el oncogen C-myc y Ciclina D1, que controlan el crecimiento y la división celular.
Además de la β Catenina, la proteína APC interacciona con la glucógeno sintetasa quinasa-3b (GSK-3b), ambas partes importantes en la vía Wnt y la ubiquitinación de la Catenina. La activación de Wnt o la ausencia de APC conllevarán a la acción (por no degradación) de la β Catenina (14).
Por otro lado el gen APC en su extremo C-terminal tiene un sitio de unión para la proteína EB1, que está asociada con el centrómero, el huso mitótico y las puntas distales de los microtúbulos, relacionadas con la polaridad celular y la estabilidad cromosómicas (15).
Dado que los pólipos colónicos son en su mayoría asintomáticos, las primeras manifestaciones clínicas de la enfermedad pueden ser el cáncer colorrectal o la aparición de manifestaciones extracolónicas como el cáncer de tiroides. Los pólipos se desarrollan a edades tempranas, con un rango de edades que oscila entre los 5-38 años de edad, con un promedio de diagnóstico a los 38 años de edad, y con una expectativa de vida promedio de 42 años (1).
Según diferentes series, el cáncer diferenciado de tiroides ocurre en 1-2% de los pacientes con PAF (1). Se ha planteado que el tamizaje para PAF debería considerarse en pacientes con carcinoma papilar de tiroides diagnosticado en personas jóvenes, pero dada la poca incidencia de cáncer de tiroides en pacientes con PAF, se ha planteado que quizás el tamizaje debería realizarse en aquellos pacientes jóvenes con diagnóstico temprano de cáncer de tiroides e historia familiar de cáncer de colon (1).
Pacientes con variantes de la PAF, como lo síndromes de Gardner y Turcot, tienen pólipos intestinales y una gran cantidad de manifestaciones extraintestinales, como tumores cerebrales, anormalidades dentales, hepatoblastomas, pólipos gástricos, adenomas y carcinomas duodenales, tumores desmoides, osteomas, hipertrofia del epitelio pigmentado de la retina y carcinoma papilar de tiroides.
Síndrome de Gardner
El síndrome de Gardner siendo un desorden autosómico dominante raro, se caracteriza por la tríada de poliposis colónica, múltiples osteomas y tumores mesenquimatosos de la piel y tejidos blandos. Es una variante de la PAF y se han reportado más de 1400 diferentes mutaciones en el locus del gen APC (6).
Las manifestaciones clínicas se hacen usualmente evidentes hacia los 20 años de edad, pero puede presentarse entre los 2-70 años de vida. Las manifestaciones gastrointestinales incluyen los pólipos adenomatosos colónicos (tubulares, vellosos, túbulo-vellosos), pólipos gástricos y de intestino delgado y carcinomas periampulares. La formación de los pólipos inicia en la pubertad, el diagnóstico se hace en la tercera década de la vida y la transformación maligna de los mismos ocurre hacia la cuarta década de la vida. Los osteomas aparecen en la mitad de los pacientes con síndrome de Gardner y se manifiestan mucho antes que la poliposis. Los huesos más comúnmente afectados son los maxilares y mandibulares y es por ello que los pacientes inicialmente acuden a cirujanos dentales. Por lo anterior, se ha propuesto realización de pesquisa para esta enfermedad en pacientes con osteomas. Dentro de las manifestaciones en piel son comunes los quistes epidermoides y sebáceos, generalmente asintomáticos. Otras manifestaciones frecuentes son el carcinoma papilar de tiroides, neoplasias intracraneanas como meningiomas y quistes dermoides, hepatomas, hepatoblastomas, fibromas, lipomas, neoplasias de la vía biliar y glándulas suprarrenales, osteosarcomas, condrosarcomas y desórdenes dentales en 70% de los pacientes (ausencia congénita de dientes, hipercementosis, odontomas, dientes impactados, dientes supernumerarios, entre otros). El diagnóstico de la PAF y síndrome de Gardner se hace por evaluación genética o por la demostración de múltiples pólipos colónicos en colonoscopia. Dado el riesgo incrementado de neoplasias en otros órganos, se recomienda tamizaje a familiares para lesiones intestinales, hepáticas y tiroideas (6).
Síndrome de Cowden
El síndrome de Cowden es un desorden autosómico dominante raro, que se caracteriza por múltiples hamartomas en la piel, mucosa oral, tracto gastrointestinal, huesos, sistema nervioso central, ojos y tracto genitourinario, y se asocia con mutaciones germinales en el gen homólogo de la fosfatasa y la tensina (PTEN), el cual es un gen supresor de tumor localizado en el cromosoma 10q23.3. No supone un riesgo mayor para enfermedad maligna del tracto gastrointestinal, pero sí tiene riesgo alto para cáncer de mama, tiroides y endometrio (7).
Inicialmente descrito por Lloyd y Dennis en 1963, es más común en mujeres (60% de los casos) y tiene una edad promedio de diagnóstico a los 39 años (7). Los pólipos de esta entidad no son considerados premalignos, y el carcinoma diferenciado de tiroides, predominantemente el folicular, es la segunda neoplasia maligna más frecuente después del cáncer de mama, en pacientes con síndrome de Cowden (1,9).
No existen guías para el tamizaje de carcinoma folicular de tiroides en pacientes con síndrome de Cowden, y se ha propuesto realización de examen físico tiroideo y seguimiento ecográfico cada 1-2 años para pacientes con alto riesgo de presentar este tipo de neoplasias (1). Y aunque la incidencia de carcinoma folicular de tiroides es 5-10 veces mayor en pacientes con síndrome de Cowden que aquella del carcinoma papilar de tiroides en pacientes con PAF, no se ha justificado tiroidectomía profiláctica, dadas la facilidad de diagnóstico (por su manifestación como nódulo tiroideo), el excelente pronóstico del carcinoma folicular de tiroides; y dado que la asociación es más frecuente con el cáncer de mama, y que éste tiene gran potencial de metástasis, se recomienda tamizaje para éste en todos los pacientes con síndrome de Cowden (1).
Síndrome de Peutz-Jeghers
El síndrome Peutz-Jeghers es un desorden raro de poliposis colónica autosómico dominante (10), con una incidencia de 1/25000 a 1/300000 personas, se caracteriza por la presencia de pólipos hamartomatosos en todo el tracto gastrointestinal e hiperpigmentación mucocutánea (1). Se debe a una mutación germinal del gen 11 de la kinasa de serina-treonina (STK11) localizado en el cromosoma 19 (19p13.3) (11).
Esta enfermedad supone alto riesgo para neoplasias malignas intestinales y extraintestinales, entre ellas, el cáncer de mama, cáncer de colon, cáncer de páncreas, cáncer gástrico y ovárico (12).
Conclusión
La poliposis colónica se presenta en forma aislada o puede hacer parte de síndromes con enfermedades heredables, los cuales tienen manifestaciones tumorales extraintestinales. Las vías moleculares que ayudan a entender los mecanismos de génesis de los tumores en la APC han sido elucidadas y son diferentes en cada uno de los síndromes polipósicos.
Le imprimen características en cuanto a agresividad tumoral, inmortalidad celular y capacidad metastásica que los hacen diferentes unos de los otros.
En conclusión, aquí presentamos un caso de poliposis familiar de colon con síndrome de Gardner, asociada a cáncer papilar de tiroides, con antecedente materno de carcinoma de sigmoides y poliposis intestinal. Como se apoya en la literatura, nuestra paciente tuvo anormalidades dentales en la infancia y microcarcinoma papilar de tiroides que requirieron intervenciones quirúrgicas y el manejo apropiado. Según lo planteado en esta revisión de la literatura, y dada la herencia autosómica dominante y alta penetrancia de esta enfermedad, es preciso tener en cuenta que ante la confirmación clínica de la misma, debe hacerse seguimiento a pacientes y evaluación a los familiares para prevenir la aparición de complicaciones que amenacen su vida.
Referencias
1. Harb WJ, Sturgis EM. Differentiated thyroid cancer associated with intestinal polyposis syndromes: a review. Head Neck 2009; 31: 1511-1519. [ Links ]
2. Steinhagen E, Guillem JG, Chang G et al. The Prevalence of Thyroid Cancer and Benign Thyroid Disease in Patients With Familial Adenomatous Polyposis May Be Higher Than Previously Recognized. Clin Colorectal Cancer 2012; 11(4): 304-8. [ Links ]
3. Wennstrom J, Pierce ER, McKusick VA. Hereditary benign and malignant lesions of the large bowel. Cancer 1974; 34 suppl: 850-7. [ Links ]
4. Kinzler KW, Vogelstein B. Lessons from hereditary colorectal cancer. Cell 1996; 87: 159-170. [ Links ]
5. Cetta F, Pelizzo MR, Curia MC, Barbarisi A. Genetics and clinicopathological findings in thyroid carcinomas associated with familial adenomatous polyposis. Am J Pathol 1999; 155: 7-9. [ Links ]
6. Fotiadis C, Tsekouras DK, Antonakis P, Sfiniadakis J, Genetzakis M, Zografos GC. Gardner's syndrome: a case report and review of the literature. World J Gastroenterol 2005; 11: 5408-5411. [ Links ]
7. Ha M, Chung JW, Hahm KB et al. A case of Cowden syndrome diagnosed from multiple gastric polyposis. World J Gastroenterol 2012; 18: 861-864. [ Links ]
8. Williard W, Borgen P, Bol R, Tiwari R, Osborne M. Cowden's disease. A case report with analyses at the molecular level. Cancer 1992; 69: 2969-2974. [ Links ]
9. Zbuk KM, Eng C. Hamartomatous polyposis syndromes. Nat Clin Pract Gastroenterol Hepatol 2007; 4: 492-502. [ Links ]
10. Whittle DO, Lee MG, Hanchard B. Peutz-Jeghers syndrome. West Indian Med J 2011; 60: 340-343. [ Links ]
11. Attard TM, Young RJ. Diagnosis and management of gastrointestinal polyps: pediatric considerations. Gastroenterol Nurs 2006; 29: 16-22. [ Links ]
12. Giardiello FM, Brensinger JD, Tersmette AC et al. Very high risk of cancer in familial Peutz-Jeghers syndrome. Gastroenterology 2000; 119: 1447-1453. [ Links ]
13. Van Es JH, Giles RH, Clevers HC. The many faces of the tumor suppressor gene APC. Exp Cell Res 2001; 264: 126-34. [ Links ]
14. Chung DC. The genetic basis of colorectal cancer: insights into critical pathways of tumorigenesis. Gastroenterology 2000; 119: 854-65. [ Links ]
15. Rehberg M, Graf R. Dictyostelium EB1 is a genuine centrosomal component required for proper spindle formation. Mol Biol Cell 2002; 13: 2301-2310. [ Links ]