Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Medica Colombiana
Print version ISSN 0120-2448
Acta Med Colomb vol.38 no.4 Bogotá Oct./Dec. 2013
Presentación de casos
Mieloma de células plasmáticas secretor de IgD, un reto diagnóstico
IgD secretory plasma cell myeloma, a diagnostic challenge
Lina María Gaviria1, Beatriz Cárdenas2, María Cecilia Mondragón3, Natalia María Guevara4
1 Médica Internista Hematóloga, Hospital Universitario de San Vicente Fundación. Medellín (Colombia). Correspondencia. E-mail: lina.gaviria.jllo@hotmail.com.
2 Médica Internista, Hospital Universitario de San Vicente Fundación. Medellín (Colombia).
3 Bacterióloga Especialista en Hematología, Universidad de Antioquia. Medellín (Colombia).
4 Microbióloga y bioanalista, Magister en Microbiología y Bioanálisis, énfasis Hematología. Hospital Universitario de San Vicente Fundación. Medellín (Colombia).
Recibido: 20/III/2013 Aceptado: 25/VII/2013
Resumen
El mieloma de células plasmáticas secretor de IgD es una neoplasia de células plasmáticas poco frecuente, generalmente afecta individuos más jóvenes que los demás mielomas. Es de difícil diagnóstico, ya que no se observa el pico de proteína monoclonal característico de los mielomas; no obstante, la inmunofijación, la cuantificación de IgD y el estudio de orina son pruebas de gran utilidad para su diagnóstico. Con respecto a las manifestaciones clínicas, es frecuente anemia, falla renal y múltiples lesiones óseas; además, la enfermedad tiene un curso agresivo, con poca respuesta a la quimioterapia convencional. A continuación, se describe un caso de una mujer de 57 años con antecedentes de dolor óseo y múltiples lesiones líticas óseas, quien fue diagnosticada con mieloma secretor de IgD a partir de la electroforesis de proteínas en suero, la inmunofijación en suero y orina, la cuantificación de IgD y el estudio medular. (Acta Med Colomb 2013; 38: 268-272).
Palabras clave: mieloma múltiple, inmunoglobulina D, insuficiencia renal.
Abstract
IgD secretory plasma cell myeloma is a rare and aggressive plasma cell neoplasm which usually affects younger individuals than other myelomas. Diagnosis is difficult since there is no monoclonal protein spike, characteristic of myelomas; however, immunofixation, IgD quantification and urine tests are useful for its diagnosis. With regard to clinical manifestations, anemia, renal failure and multiple bone lesions are frequent. In addition, the disease has an aggressive course with poor response to conventional chemotherapy. Here is reported a case of a 57 year old woman with a history of bone pain and multiple lytic bone lesions who was diagnosed with IgD secretory myeloma through serum protein electrophoresis, immunofixation in serum and urine, IgD quantification and medullary study. (Acta Med Colomb 2013; 38: 268-272).
Key words: multiple myeloma, immunoglobulin D, renal failure.
Introducción
El mieloma de células plasmáticas secretor de inmunoglobulina D (IgD) es uno de los mielomas menos frecuente, ya que representa entre el 1% y el 2% del total de casos de mieloma (1-3). Es más común en hombres, con tendencia a presentarse en edades más tempranas (promedio de edad entre 53 y 57 años) (2-4) y el rango de edad de los individuos afectados oscila entre los 34 y 80 años (2-6).
Tradicionalmente, se ha descrito como de mal pronóstico cuando se compara con los tipos más comunes (secretor de IgG, IgA o de cadenas ligeras), con una media de sobrevida global entre 12 y 17 meses. Se postula que su pronóstico adverso se debe en gran parte a que es un reto diagnóstico y en la mayoría de los casos se diagnostica en etapas avanzadas de la enfermedad (7, 8).
El mieloma secretor de IgD tiene características de laboratorio y en las manifestaciones clínicas que lo hacen único (4). El diagnóstico es particularmente difícil porque aproximadamente en 40% de los casos no se observa pico monoclonal en la electroforesis de proteínas en suero (7, 8) y en los pacientes restantes el pico monoclonal es discreto; además a causa de la proteinuria monoclonal se puede confundir con un mieloma secretor de cadenas ligeras.
Con respecto a las manifestaciones clínicas, lo más común es el dolor óseo (entre 70 y 80% de los pacientes), seguido por anemia (72-75%), fatiga (36-77%) y en menor proporción pérdida de peso (32%), plasmocitomas extramedulares (19%) y amiloidosis (19%). La proteinuria en rango masivo y la afección renal son muy comunes, y entre 16% y el 53% de los pacientes tienen algún grado de daño renal (3, 4). La presencia de adenopatías, hepatomegalia y esplenomegalia ha sido reportada igualmente con frecuencias tan altas como 55% en algunas series (2).
En Colombia, los estudios realizados en dos de las principales instituciones que diagnostican y tratan estos pacientes, no reportan casos de mieloma de células plasmáticas secretor de IgD (9, 10). Debido a que este mieloma es raro y se requiere de una alta sospecha clínica para estar alerta tanto a los hallazgos clínicos como de laboratorio que lo sugieran, se presenta el caso de una paciente diagnosticada en nuestra institución.
Presentación del caso
Mujer de 57 años, con antecedente personal de anemia ferropénica por pérdidas ginecológicas y osteoporosis severa con múltiples fracturas vertebrales en tratamiento con alendronato.
La paciente consultó a nuestra institución por un mes de evolución de dolor dorsal que se irradiaba y se acentuaba en la columna lumbar; además, refería limitación para la marcha, pérdida de la fuerza muscular en extremidades superiores e inferiores acompañada de parestesias en ambos, y pérdida de aproximadamente 11 Kg. Al examen físico, la paciente se encontró alerta, orientada, con signos vitales normales, hidratada, sin adenopatías palpables, sin organomegalias y sin estigmas de sangrado; sin embargo, en el examen neurológico se evidenció disminución de la fuerza muscular en miembros inferiores (3/5), sin alteraciones sensitivas.
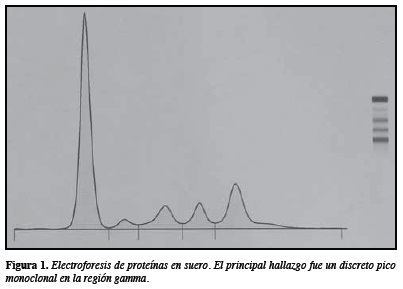
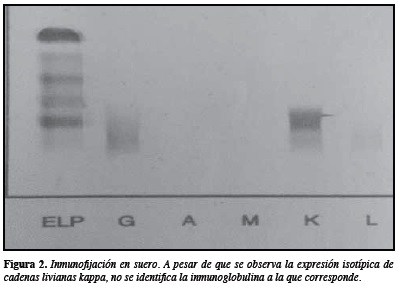
Durante los estudios iniciales se encontró osteoporosis severa con múltiples fracturas vertebrales patológicas de etiología por esclarecer, como también hiperparatiroidismo secundario. Debido a la sospecha de mieloma, se analizó la concentración sérica de las inmunoglobulinas más comúnmente asociadas a mieloma, sin encontrarse incremento de éstas, pero en la electroforesis en agarosa (Hydragel Protein K 20 Sebia) se encontró una concentración de proteínas totales de 7 g/dL, y el hallazgo más llamativo fue la presencia de un discreto pico monoclonal en la región gamma (Figura 1). La viscosidad sérica estaba dentro de los valores normales, mientras que en la inmunofijación en suero realizada en agarosa (Hydragel IF K 20 Sebia) se observó una banda monoclonal con el antisuero kappa (Figura 2). En la Tabla 1 se presentan los principales hallazgos de laboratorio y de otras pruebas diagnósticas.
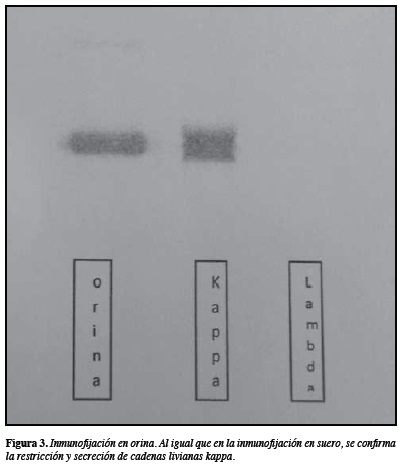
En el estudio de orina se encontró una proteinuria de 7.491 mg/24 horas, con una banda monoclonal de cadenas livianas de 94,2% en la electroforesis de proteínas y en la inmunofijación se confirmó la presencia de cadenas livianas Kappa (Figura 3); adicionalmente, la proteína de Bence Jones fue positiva.
Teniendo en cuenta los hallazgos descritos, en especial la presencia en suero de una banda monoclonal que no se identificó con los antisueros contra IgG, IgA e IgM, y que las concentraciones séricas de estas inmunoglobulinas eran normales, se decidió cuantificar la concentración sérica de IgE e IgD, y se obtuvo un aumento de IgD (25.700 mg/L). De igual forma, se realizó biopsia y aspirado de médula ósea, y en ambas se confirmó la extensa infiltración por células plasmáticas, con desplazamiento de hematopoyesis normal, lo cual permitió, sumado a los demás criterios, la confirmación del diagnóstico de mieloma de células plasmáticas. Finalmente, en el estudio de la biopsia renal se observó tubulopatía aguda por cadenas ligeras kappa.
Con diagnóstico confirmado de mieloma de células plasmáticas secretor de IgD con restricción de cadenas Kappa, la paciente se estadificó en etapa IIIA según el sistema de Durie Salmon y en estado III según el sistema de estadificación internacional (ISS, por su significado en inglés International StagingSystem), e inició su primer ciclo de quimioterapia con bortezomib-dexametasona y ácido zoledrónico. La paciente se dio de alta y siguió con tratamiento ambulatorio.
Discusión
Aunque no se conoce la frecuencia del mieloma de células plasmáticas secretor de IgD en nuestro medio, las series de caso publicadas en el contexto internacional evidencian que es uno de los mielomas menos frecuente (2, 3) y su diagnóstico sólo se logra a partir de una correcta integración de los signos, los síntomas y los hallazgos de laboratorio.
Característicamente, el mieloma secretor de IgD no posee pico monoclonal en la electroforesis de proteínas en suero o si la hay, corresponde a un pico monoclonal muy pequeño con respecto a los demás tipos de mieloma (7, 11), tal y como se observó en esta paciente, quien tenía un pico discreto en la región gamma (1,65 g/dL) de la electroforesis de proteínas, hallazgo que no es típico en los pacientes con mieloma de células plasmáticas secretores de cadenas pesadas. La baja concentración de la proteína monoclonal dificulta el diagnóstico de mieloma y se requiere de una alta sospecha clínica para orientar el estudio por laboratorio. Todo lo anterior se explica a raíz de la vida media corta que tiene la IgD en sangre periférica, debido a una alta tasa de catabolismo, de 26% por día, comparada con una tasa entre 3 y 6% para IgG y entre 10 y 15% para IgA, lo que disminuye notablemente sus concentraciones séricas y constituye un problema para su diagnóstico (11).
En este caso, el discreto aumento que se observó en la región gamma en la electroforesis de proteínas en suero (1,65 g/dL, correspondiente a 20,9%), no se pudo identificar con el uso de antisueros contra IgA, IgG o IgM, pero en la inmunofijación tanto de suero como de orina se observó un componente isotípico de cadenas livianas kappa. Con la persistente sospecha de mieloma de células plasmáticas secretor de cadenas pesadas, a pesar de la importante excreción de cadenas livianas en orina, el estudio medular en conjunto con la cuantificación de IgD sérica permitió identificar que la paciente tenía un mieloma secretor de IgD.
La cadena ligera que predomina en el mieloma secretor de IgD es la lambda, contrario a lo que sucede en los demás mielomas de cadenas pesadas (3, 11); de hecho, se ha observado que esta diferencia es estadísticamente significativa (4). Pisani y colaboradores, en una serie de casos de 17 pacientes con mieloma secretor de IgD observaron que en 64% la cadena liviana identificada era lambda, mientras que en los restantes era kappa (6), lo que coincide con la paciente descrita.
Por otra parte, los pacientes cursan con proteinuria masiva de cadenas livianas en orina, similar al mieloma Bence Jones positivo o mieloma de cadenas ligeras (12), en tanto que entre 70 y 96% tienen proteinuria Bence Jones positiva (6, 12). Ello implica un riesgo de progresión de la afección renal, aun cuando al diagnóstico los pacientes se presenten con valores normales de creatinina, pues durante el curso de la enfermedad se puede acentuar el daño renal (3).
En relación con las anormalidades citogenéticas, éstas son variables (3, 11, 13) y algunos de los pacientes pueden tener un cariotipo normal (8, 13), aunque no se ha descrito el efecto que tienen en el pronóstico de los pacientes con mieloma secretor de IgD.
Con respecto a las manifestaciones clínicas, se sabe que el mieloma secretor de IgD difiere de los demás subtipos de mieloma, aunque se desconocen las razones biológicas y fisiopatológicas que dan origen a dicha diferencia (4). Wechalekar y colaboradores realizaron seguimiento a 25 pacientes con mieloma secretor de IgD y observaron que solo el 20% tenían hipercalcemia y tan sólo 16% tenían falla renal al inicio, pero el 16% la desarrollaron durante la evolución de la enfermedad; por su parte, el dolor óseo y la anemia fueron los hallazgos más frecuentes (80% y 72%) al diagnóstico (3). Lo anterior se correlaciona con la paciente descrita en este caso, quien tenía un mieloma sintomático, con la presencia característica de dolor óseo, anemia, proteinuria por cadenas livianas y múltiples lesiones óseas líticas. A pesar del hallazgo de lesiones líticas en antebrazo, múltiples aplastamientos vertebrales, osteopenia marcada en columna y fracturas vertebrales desde T6 hasta L5, la paciente tenía una concentración de calcio normal, hallazgo frecuente en los pacientes con mieloma secretor de IgD (3, 4, 6).
En cuanto a la β2 microglobulina, clásicamente se ha considerado un factor pronóstico de los pacientes con mieloma de células plasmáticas, por lo que hace parte del ISS para estadificar a los pacientes. Debido a que la paciente presentó una β2 microglobulina de 7.65 mg/dL, se clasificó en estado III según el ISS. Kim y colaboradores, en un seguimiento de 75 pacientes con mieloma secretor de IgD, observaron que 65.3% de los pacientes tenían β2 microglobulina mayor que 5.5 mg/dL, comparado con un 39.3% de los pacientes con otro tipo de mieloma de células plasmáticas; dicha diferencia fue estadísticamente significativa (p= 0,0001) (4). De igual forma, cuando se compara con los demás pacientes con mieloma, en aquellos con mieloma secretor de IgD es más frecuente un estado III de Durie y Salmón y un estado III de ISS (4).
Se ha descrito que el pronóstico de los pacientes es peor que el de los otros tipos de mieloma (4, 5), en especial cuando se tratan con quimioterapia (3). No obstante, es importante reevaluar el pronóstico de los pacientes con mieloma secretor de IgD, ya que la introducción de nuevos agentes terapéuticos, como los inmunomoduladores y los inhibidores de proteosomas, pudo modificar la respuesta a la terapia y la sobrevida de los pacientes (6). En relación con lo anterior, se ha observado que el tratamiento con bortezomib, un inhibidor de proteosomas, en conjunto con dexametasona resulta útil para el tratamiento de pacientes con mieloma secretor de IgD y permite alcanzar remisiones completas en los casos descritos hasta el momento (8).
Hay poca información respecto al trasplante autólogo de médula ósea en estos pacientes y los hallazgos son contradictorios, ya que en las series de casos publicadas la supervivencia global oscila entre menos de doce meses hasta más de sesenta meses (3, 4, 14) o es incluso similar a la reportada para los demás subtipos de mieloma (15, 16). Lo anterior se puede deber no sólo a aspectos relacionados con la terapia sino con la heterogeneidad de los pacientes, que en la mayoría de los casos se diagnostican en etapas avanzadas de la enfermedad.
Para finalizar, el presente caso demuestra que a pesar de la ausencia de estadísticas nacionales sobre la frecuencia del mieloma secretor de IgD, es una neoplasia que afecta a la población colombiana y que se debe sospechar cuando los pacientes se presentan con falla renal de causa desconocida, dolor óseo, bandas pequeñas de proteína monoclonal en suero con isotipo desconocido por inmunofijación y proteinuria en rango nefrótico. Además, es de importancia que en el medio se desarrollen estudios de caracterización de pacientes con mieloma de células plasmáticas, de forma que se establezca su epidemiología local, la frecuencia de cada subtipo, como también sus características al diagnóstico, la evolución clínica y la respuesta al tratamiento.
Fuentes de financiación
Para la realización de este manuscrito no se requirió de fuente de financiación alguna.
Conflicto de intereses
Los autores declaramos que no tenemos conflicto de intereses.
Referencias
1. Ameis A, Ko HS, Pruzanski W. M components-a review of 1242 cases. Can Med Assoc J 1976; 114(10): 889-92, 95. [ Links ]
2. Jancelewicz Z, Takatsuki K, Sugai S, Pruzanski W. IgD multiple myeloma. Review of 133 cases. Arch Intern Med 1975; 135(1): 87-93. [ Links ]
3. Wechalekar A, Amato D, Chen C, Keith Stewart A, Reece D. IgD multiple myeloma--a clinical profile and outcome with chemotherapy and autologous stem cell transplantation. Ann Hematol 2005; 84(2): 115-7. [ Links ]
4. Kim MK, Suh C, Lee DH, Min CK, Kim SJ, Kim K, et al. Immunoglobulin D multiple myeloma: response to therapy, survival, and prognostic factors in 75 patients. Ann Oncol 2011; 22(2): 411-6. [ Links ]
5. Blade J, Kyle RA. Nonsecretory myeloma, immunoglobulin D myeloma, and plasma cell leukemia. Hematol Oncol Clin North Am 1999; 13(6): 1259-72. [ Links ]
6. Pisani F, Petrucci MT, Giannarelli D, Bongarzoni V, Montanaro M, De Stefano V, et al. IgD multiple myeloma a descriptive report of 17 cases: survival and response to therapy. J Exp Clin Cancer Res 2012; 31: 17. [ Links ]
7. Kuliszkiewicz-Janus M, Zimny A, Sokolska V, Sasiadek M, Kuliczkowski K. Immunoglobulin D myeloma--problems with diagnosing and staging (own experience and literature review). Leuk Lymphoma 2005; 46(7): 1029-37. [ Links ]
8. Sekiguchi N, Takezako N, Nagata A, Wagatsuma M, Noto S, Yamada K, et al. Successful treatment of immunoglobulin D myeloma by bortezomib and dexamethasone therapy. Intern Med 2011; 50(21): 2653-7. [ Links ]
9. Abello V, Figueroa J, Villamizar L. Mieloma Múltiple: Clínica, Paraclínica y Principales esquemas de tratamiento. Hospital San José de Bogotá 2003-2010. Repertorio de Medicina y Cirugía 2012; 21(2):108-14. [ Links ]
10. Segovia J, Duarte M, Restrepo JG, Saavedra CE, Andrade RE. Mieloma Múltiple en el Hospital Universitario Fundación Santa Fé de Bogotá (1983-2006). Acta Med Colomb 2008; 33(4): 276-81. [ Links ]
11. Natori K, Izumi H, Nagase D, Fujimoto Y, Ishihara S, Kato M, et al. IgD myeloma indicated by plasma cells in the peripheral blood and massive pleural effusion. Ann Hematol 2008; 87(7): 587-9. [ Links ]
12. Blade J, Lust JA, Kyle RA. Immunoglobulin D multiple myeloma: presenting features, response to therapy, and survival in a series of 53 cases. J Clin Oncol 1994; 12(11): 2398-404. [ Links ]
13. Machida H, Shinohara T, Hino H, Yoshida M, Hatakeyama N, Okano Y, et al. Immunoglobulin D-lambda type multiple myeloma presenting with FDG-PET/ CT negative bone marrow involvement. Intern Med 2011; 50(14): 1483-7. [ Links ]
14. Chong YP, Kim S, Ko OB, Koo JE, Lee D, Park SH, et al. Poor outcomes for IgD multiple myeloma patients following high-dose melphalan and autologous stem cell transplantation: a single center experience. J Korean Med Sci 2008; 23(5): 819-24. [ Links ]
15. Maisnar V, Hajek R, Scudla V, Gregora E, Buchler T, Tichy M, et al. High-dose chemotherapy followed by autologous stem cell transplantation changes prognosis of IgD multiple myeloma. Bone Marrow Transplant 2008; 41(1): 51-4. [ Links ]
16. Reece DE, Vesole DH, Shrestha S, Zhang MJ, Perez WS, Dispenzieri A, et al. Outcome of patients with IgD and IgM multiple myeloma undergoing autologous hematopoietic stem cell transplantation: a retrospective CIBMTR study. Clin Lymphoma Myeloma Leuk 2010; 10(6): 458-63. [ Links ]