Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Medica Colombiana
versão impressa ISSN 0120-2448
Acta Med Colomb vol.39 no.2 Bogotá abr./jun. 2014
Comentarios editoriales
Factores pronósticos en el linfoma B difuso de célula grande
Prognostic factors in diffuse large B-cell lymphoma
M. Duarte1
1 Especialista en Medicina Interna y Hematología. Profesor Titular Clínico, Facultad de Medicina, Universidad de los Andes. Docente Facultad de Medicina, Universidad El Bosque. Hematóloga Institucional Fundación Santa Fe de Bogotá. Bogotá, D.C. (Colombia).
E-mail: monicadarte2008@gmail.com
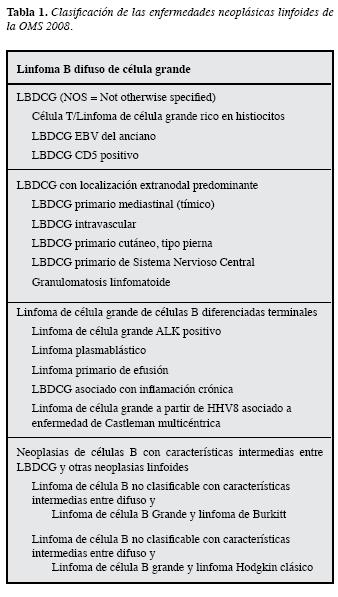
Dentro del grupo de linfomas no Hodgkinde tipo agresivo encontramos los linfomas B difusos de célula grande (LBDCG) bien reconocidos por sus características histopatológicas dentro de la clasificación de neoplasias linfoides de la Organización Mundial de la Salud (WHO 2008) (1-3) (Tabla 1). Los LBDCG corresponden del 30-40% de loslinfomas en adultos en la población occidental. Este grupo de linfomas comprende unavariedad heterogénea de linfomas tanto por sus características clínicas como biológicas con un comportamiento clínico variable, que puede presentar respuesta y remisión a lostratamientos asociando rituximab en la mayoría de los casos y, sin embargo, por lo menos una tercera parte de los pacientes van a morir por esta enfermedad (4). En un gran esfuerzopor comprender mejor la fisiopatología y así mismo lograr una terapia más dirigida y con mejores resultados, se han desarrollado diferentes clasificaciones que permitan conocer, agrupar y predecir el comportamiento en la forma más homogénea posible de las diversas presentaciones de LBDCG.
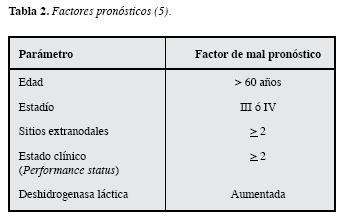
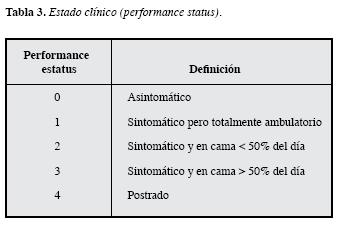
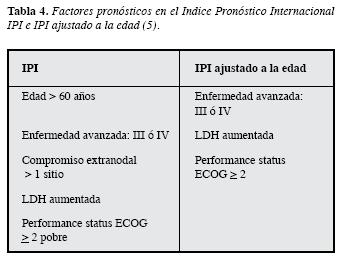
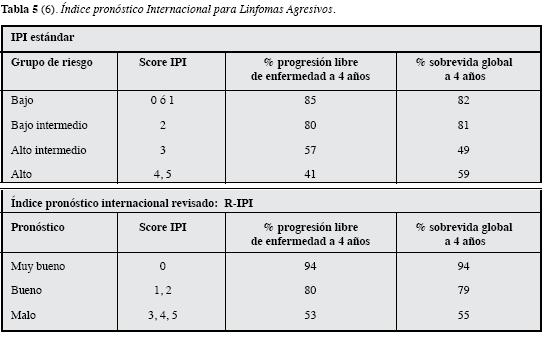
La clasificación más reconocida a nivel mundial y validada en grandes series de pacientes con LBDCG, es la estratificación pronóstica basada en parámetros clínicos y bioquímicos que se encuentran fácilmenteal alcance de toda evaluación clínica inicial, conocida como el Índice PronósticoInternacional desarrollada por: "El proyecto internacional de factores pronósticos paralinfoma no Hodgkin" publicado en 1993 que aún permanece vigente (5). Inicialmente se tuvieron en cuenta cinco factores pronósticos (Tabla 2): edad, estadío según la clasificación de Ann Arbor, nivel de deshidrogenasa lácticasérica, estado clínico general determinado porel "performance status" (Tabla 3) y el compromiso de sitios extranodales como parámetros para clasificar los pacientes en riesgo bajo, bajo intermedio, alto intermedio y alto. Posteriormente se propuso esta misma clasificación revisada conocida como revised IPI (6) en la que se evalúa la clasificación IPI en pacientes tratados con Rituximab Tabla 4. Teniendo en cuenta el comportamiento de las curvas de sobrevida, se reducen los grupos de riesgo a tres grupos pronósticos: muy buen pronóstico,bueno y mal pronóstico (6) Tabla 5. Mediante estas clasificaciones se han logrado determinar pronósticos de sobrevida en grupos grandes depacientes con LBDCG.
Métodos moleculares
Teniendo en cuenta los pacientes de mal pronóstico de la clasificación pronóstica IPI y ante la gran variabilidad del comportamiento clínico de los LBDCG con evolución rápidamente progresiva y en algunos casos desenlaces impredecibles, se requieren nuevos métodos diagnósticos que permitan abordar los diferentes mecanismos fisiopatológicos desde otras perspectivas biológicas para plantear alternativas terapéuticas apropiadas y dirigidas.Con el advenimiento de nuevas tecnologías, surgen otros caminos como la propuesta del proyecto de perfil molecular de leucemias y linfomas a comienzos de la década del 2000 en el que se caracterizan subtipos fenotípicos de LBDCG según el origen celular manifestado en el perfil de expresión génica (7). Se identifican los linfomas de tipo centrogerminal B (GCB) que expresan genes "normales" de las células B centrogerminales que corresponden a 50% de los LBDCG, los linfomas B de fenotipo activado (ABC) que expresan genes que se observan en la activación de células en sangre periférica, corresponden a 30% de los LBDCG y un tercer grupo aproximadamente 20% de los LBDCG denominado no clasificable conocido como "no GCB". Se reconoce al grupo ABC como el grupo de peor pronóstico.El pronóstico favorable de los linfomas GCB está asociado con la actividad disminuída de la vía de señal del factor nuclear kB que protegecontra el efecto apoptótico de la quimioterapia; mientras que en el fenotipo ABC en el quese observa una activación constitutiva de esta vía que puede bloquear la apoptosis inducida por la quimioterapia, contribuyendo con el pobre pronóstico de este tipo de LBDCG (7, 8).
El fenotipo ABC se asocia con la activación de la vía de señal NF-kB, que se lleva a cabo mediante la dimerización de los factores de transcripción NF-kB en el citoplasma que migran a activar la transcripción de los genes blanco en el núcleo. Mediante métodos que reprimen la vía de señal NF-kB, se ha demostrado que los LBDCG dependen de esta vía de señal para sobrevivir, a diferencia de los LBDCG GCB. En los LBDCG ABC se encuentran alteraciones en los genes que codifican para el complejo de señal CBM, que incluyen CARD11, BCL10, MALT1 y que también hacen parte de la vía de señal delreceptor de la célula B: BCR; favoreciendo estimulación de la vía de señal NF-kB y alteraciones de la señal para el BCR. Por otra parte, se han detectado con mayor frecuencia mutaciones específicas de la subunidad CD79B que promueven activación crónica deseñal para el BCR. Así mismo se han descrito otras alteraciones como amplificación 19q, deleción del locus tumor supresor INKa/ARF,trisomía 3, inactivación del tumor supresor BLIMP1 y la sobreexpresión de la familia de kinasas serina/treonina PIM, en relación con los LBDCG fenotipo ABC (9).
Para el fenotipo GCB se reconocen dosalteraciones genéticas: la translocación enBCL-2 t(14;18) y la amplificación C-REL quese presentan con una frecuencia de 25% y 15%respectivamente. La translocación t(14;18) genera la expresión de la proteína antiapoptóticaBCL2 que se encuentra en el centrogerminaly en pacientes tratados con rituximab se asocia con mal pronóstico en el fenotipo GCB adiferencia del ABC (9).
Métodos inmunohistoquímicos
Los LBDCG expresan marcadores pan Bcomo CD19, CD20, CD22, CD79a y PAX5. Lainmunoglobulina de superficie /citoplasmática(IgM > IgG> IgA) se encuentra presente de50-75% de los casos. Otros marcadores incluyen: CD10 (endopeptidasa neutral asociadaa la membrana que se expresa en las célulascentrogerminales y en tejido linfoide reactivo)en 40% de los casos, BCL-6 (proteína dedo dezinc que actúa como represora transcripcionaly se expresa en células centrogerminales B yalgunas células T CD4+) en 60%, BCL2 en50%, CD43 en 20%, IRF4/MUM1 (factorespecífico linfoide de la familia de los factoresreguladores de interferón de los factores detranscripción, que se expresa en células plasmáticas y algunas células centrogerminales)hasta en 77% y p53 (el gen supresor tumoralp53 actúa como factor multifuncional detranscripción involucrado en la detención delciclo celular, apoptosis, diferenciación celular,reparación del DNA y mantenimiento de laestabilidad genómica) en 30% de los casos.La identificación de la proteína MYC nuclear se puede realizar mediante anticuerpo monoclonal, que se correlaciona positivamente conlas translocaciones MYC. Tanto la expresión de MYC como de BCL2 son predictores independientes de menor sobrevida global y sobrevidalibre de progresión (10).
Teniendo en cuenta las grandes exigencias en equipos, tecnología y costos de lasdiferentes pruebas moleculares, se desarrollóuna forma más simplificada de identificarlos factores pronósticos mediante métodosinmunohistoquímicos, utilizando algoritmoscomo el propuesto por Hans, que estratificalos linfomas en GCB o "no GC" según laexpresión de los marcadores CD10, BCL6y IRF4/MUM-1 (7, 8, 11). Los LBDCG queson CD10+ en más de 30% de las células,corresponden al grupo GCB; los casos queson CD10- y BCL6+, IRF4/MUM1-, también corresponden al grupo GCB. Los casos queson BCL6- CD10- ó BCL6+ y IRF4/MUM1+son "no GCB". Este algoritmo pronóstico secorrelaciona con el subtipo de perfil de expresión génica en algunos estudios hasta en un86% de los casos (10).
Posteriormente se desarrollaron algoritmos con algunas modificaciones como el algoritmo de CHOI, en el que se incluye laexpresión de FOXP1 [Forkhead boxprotein 1: es un factor de transcripción alas hélice queactúa como un represor transcripcional que seexpresa tanto en tejido normal como tejidoneoplásico y se expresa en células linfoidesB pero no en células plasmáticas (10, 12)] yGCET1 [Germinal center B-cell expressed transcript-1 gene codifica para una proteína expresada en las células B centrogerminales (12)], que se correlacionado con el perfil de expresión génica en algunos estudios hastaen un 87% de los casos. También se describe el método de Tally que sustituye BCL-6 porLMO2 [LIM domain only 2: es un marcadorde linfocitos centrogerminal, cuya función sedesconoce (12)]; sin embargo, este método fueel menos sensible de todos (9, 10). El grupo deestudio internacional de LBDCG tratados con Rituximab-CHOP reportó un algoritmo basadoen la expresión de CD10, FOXP1 y BCL6 quese correlacionó hasta en un 92,6% de los casos con el perfil de expresión génica (13).
Las moléculas de reconocimiento inmunológico como la beta2microglobulina(componente de las moléculas de histocompatibilidad clase I presentes en las célulasnucleadas) y CD58 (molécula de adhesiónexpresada en las células presentadoras deantígeno especialmente en los macrófagos) sehan identificado tanto en LBDCG de fenotipoGCB como de fenotipo ABC, lo que involucrael control inmunológico como otro mecanismolinfomagénico (9).
El microambiente tumoral
El microambiente tumoral se ha reconocido recientemente como uno de los factores pronósticos en el LBDCG más importantes.Se describen cuatro grupos pronósticos queinvolucran parámetros de expresión génicacomo el origen celular GCB, nódulo linfoide, elcomplejo mayor de histocompatibilidad claseII y la proliferación celular (8, 14). Como semenciona previamente el origen celular GCBse correlaciona con mejor pronóstico.
Las características del nódulo linfoide reflejan el microamiente tumoral que se ha divididoen dos grupos: estroma-1 y estroma-2. Los genes que definen la firma estromal-1 codifican para componentes de la matriz extracelular como la fibronectina, osteonectina, isoformas de colágeno y laminina y factor antiangiogénico tromboespondina. También modificadores de la síntesis de colágeno como LOXL1 ySERPINH1, proteínas que remodelan la matrizextracelular como MMP2, MMP9, MMP14,PLAU y TIMP2 y factor de crecimiento de tejido conectivo (CTGF). Además incluye genesque se expresan en células de linaje monocítico como CEBPA y CSF2RA (15).
Los genes que definen la firma estromal-2 codifican para marcadores de células endoteliales como el factor de von Willebrand y CD31 (molécula de adhesión plaquetaria o PECAM1); genes que se expresan en elendotelio como EGFL7, MMRN2, GPR116, SPARCL1; genes reguladores de la angiogénesis como el receptor 2 del factor de crecimiento vascular endotelial (VEGF), GRB10 o factor receptor de crecimiento que se une a la proteína 10 y media la vía de señal KDR; integrina alfa 9 que desencadena la señal para VEGF; la tirosina kinasa endotelial (TEK), el receptor de la tirosina kinasa para la citoquina angiopoyetina; ROBO4 molécula endotelial específica que regula angiogénesis y el oncogen homólogo del virus de la eritroblastosis E26 (ERG) factor de transcripción necesario en la formación túbulo endotelial. Otros genes como CAV1, CAV2 y EHD2 codifican componentes de caveolae que se especializan en las estructuras de membrana plasmática abundantes en las células endoteliales necesarias para la angiogénesis (15).
En caso de alta representación de componente estromal tipo 1, se correlaciona con grandepósito de matriz extracelular e infiltraciónpor monocitos y macrófagos que predicebuen pronóstico; mientras que el componenteestromal tipo 2 refleja angiogénesis y grandensidad vascular en el estroma tumoral quese relaciona con mal pronóstico (14, 15). Conel fin de evaluar el tipo estromal 1 se utilizaun anticuerpo dirigido contra la proteína secretada, ácida y rica en histidina SPARC: sise encuentra una tinción SPARC muy positivaen el estroma tumoral, se correlaciona con unmejor pronóstico comparado con los linfomasSPARC cuya tinción es escasa o ausente (16).Otro método reportado consiste en medir ladensidad de los microvasos, lo que se relaciona con mal pronóstico aún en pacientes tratadoscon esquemas de quimioterapia asociandorituximab (17).
La pérdida del complejo mayor de histocompatibilidad clase II (HLA-DRA) fueidentificada como un factor pronóstico independiente que se correlaciona con la pérdidade la respuesta celular inmunológica dadapor los linfocitos CD8+ y por ende con malpronóstico. En la respuesta inmunológicalos linfocitos citotóxicos CD8+ reaccionan frente a antígenos presentados por moléculasdel complejo mayor de histocompatibilidadclase I que se encuentran en casi todas lascélulas nucleadas. Los antígenos del complejomayor de histocompatibilidad clase II sólo sepresentan por algunas células presentadorasde antígenos como células B, macrófagos ycélulas dendríticas generando una respuestacelular T ayudadora CD4+. La respuesta celular T ayudadora contribuye con la respuestacelular T citotóxica que es la respuesta celularinmunológica asociada con la vía final encargada de la muerte celular tumoral (18).
La proliferación celular se manifiestaclínicamente por el estado avanzado delcompromiso clínico y biológicamente pormarcadores como el porcentaje del Ki67. ElKi67 es un antígeno nuclear que se expresa enlas células en ciclo celular y el porcentaje delas células que expresan Ki 67 se correlacionacon el volumen de células tumorales. No se considera marcador pronóstico independienteen pacientes tratados con rituximab (14, 15).
MicroRNAs
Los MicroRNAs además de tener un rol en el diagnóstico de los LBDCG también se consideran con potencial pronóstico. Aún no sonmuchos los microRNA identificados con los fenotipos de LBDCG; sin embargo, miR-21 seha establecido como un diferenciador entre el fenotipo GCB y ABC. Niveles aumentados demiR-21 se asocian con mayor sobrevida librede enfermedad. En pacientes con LBDCG defenotipo ABC y alta expresión de MiR-155 seencontró una mayor sobrevida (19).
Otros microRNA identificados como factores pronósticos independientes en elseguimiento de pacientes con LBDCG tantopara la sobrevida global a cinco años comola sobrevida libre de enfermedad fueron: miR-18a, miR-181a y miR- 222 (19). En laactualidad los microRNA clasificados porgrupos se encuentran en evaluación tanto en la patogénesis de los linfomas como en suvalor predictivo.
Doble hit y triple hit
La proliferación celular asociada a MYC se correlaciona con mal pronóstico (14, 20, 21).Las translocaciones que comprometen MYC se observan hasta en 10% de los casos (20). MYC se localiza en el cromosoma 8q24 y codificapara un factor de transcripción involucrado enla regulación de la procesos celulares comoel control del ciclo celular, la proliferación,metabolismo, apoptosis y migración celular.Se define como un factor pronóstico adversoindependiente en los pacientes con LBDCGtratados con rituximab (14). La presencia deMYC no pudo ser correlacionada con los factores pronósticos clínicos ni con la proliferacióncelular medida por Ki67 (20).
Los linfomas B que presentan simultáneamente rearreglos en MYC y en IGH-BCL2 se conocen como linfomas doble hit y secaracterizan por su comportamiento clínicoagresivo asociado a alteraciones cromosómicascomplejas, alta proliferación celular con Ki67superior a 80% y muy pobre pronóstico conuna sobrevida media inferior a 1 año (3, 14,21, 22). El inmunofenotipo de los LBDCGdoble hit se presenta usualmente como fenotipo GCB con expresión de CD10+, BCL6+ yIRF4/MUM1-. La proteína BCL2 se detectó en95% de los casos (22). Los linfomas triple hitse presentan asociando compromiso de MYC,BCL2 y BCL6 (21, 22).
CD5
CD5 es una glicoproteína transmembranaque se expresa en células T normales y enun grupo de células B neoplásicas (12). LosLBDCG CD5+ tienen un comportamientoclínico más agresivo, generalmente se trata depacientes mujeres mayores con enfermedadretroperitoneal de tipo bulky. Se presentande novo y no se relacionan con proliferaciónlinfocitaria crónica CD5+ como leucemia linfoide crónica o con linfoma del manto. La agresividad del linfoma parece dependientede la activación del CD5 (3). Sin embargo lamayoría de los LBDCG CD5+ pertenecen alfenotipo ABC, generalmente CD10-, Bcl2+y MUM1+. Se asocian con factores de malpronóstico como LDH elevada, síntomas B,compromiso extranodal frecuente y en particular del SNC, estado clínico avanzado y pobreperformance status. El tratamiento con rituximab parece haber disminuído el compromiso del SNC. También se identifican alteraciones cromosómicas complejas (23).
Conclusiones
La aplicación del indice pronóstico internacional sigue siendo aún una clasificación muy valiosa a pesar de que fue desarrollada antesdel tratamiento de rutina con rituximab paratodos los pacientes con LBDCG. En la nuevaera de tratamiento aún no se han validado las diferentes tentativas de estratificación pronóstica, aunque el aporte al conocimiento sobreel comportamiento biológico de los diferentesLBDCG ha sido considerable con estas nuevas tecnologías. Aún en la actualidad no se puedenaplicar estos métodos moleculares de rutina enla práctica clínica debido no solamente a que estos parámetros carecen de estandarización quepermita su validez a gran escala, sino tambiénpor tratarse de recursos de alto costo que requieren laboratorios de alta tecnología. Teniendo encuenta que los métodos inmunohistoquímicosconstituyen una herramienta de menor costo,se vienen aplicando más ampliamente en lapráctica clínica.
Todas estas posibilidades de identificaciónde factores pronósticos, permiten desarrollar estrategias terapéuticas dirigidas como tratamientos antiangiogénicos en el caso de linfomascon densidad vascular aumentada como porejemplo lenalidomida o como bevacizumab quees un anticuerpo monoclonal dirigido contra elfactor de crecimiento endotelial (VEGF) actualmente en investigación (9, 24); de estimulacióninmunológica celular T en el caso de linfomascon disminución de la capacidad de respuestainmunológica mediante activación de célulasT in vitro; entre otras.
Según la biología tumoral se vienen investigando anticuerpos monoclonales dirigidoscontra otras molélulas de los LBDCG como el epratuzumab anticuerpo monoclonal humanizado dirigido contra el marcador célula BCD22; dacetuzumab anticuerpo monoclonalanti – CD40 siendo CD40 una proteína transmembrana de la superfamilia del receptor delfactor de necrosis tumoral expresada en célulasB; blinatumomab un bi-anticuerpo dirigido contra el marcador B CD19 y el marcador T CD3;inotuzumab ozogamicin dirigido contra CD22conjugado con calicheamicina (24). También seutilizan moléculas inhibidoras de marcadores específicos como BCL6 (25). En el caso del LBDCG de fenotipoABC se viene investigando la asociación de esquemas de quimioterapia conbortezomib inhibidor del proteasoma Barton ymás recientemente el inhibidor de la tirosina kinasa de la agamaglobulinemia de Bruton(BTK) conocido como ibrutinib asociado alenalidomida (26).
Los marcadores de mal pronóstico detectados en el estudio de Guevara y cols (27), estáncorrelacionados con pacientes con enfermedad avanzada y con el fin de considerarloscomo factores pronósticos aislados, debenser corroborados con el desenlace clínico ylos marcadores biológicos que actualmentese encuentran en investigación; teniendo encuenta que en estudios clínicos previos, elki67 y la beta2microglobulina no han sidovalidados como factores pronósticos aisladosen pacientes tratados con rituximab y puedenexplicarse únicamente por el diagnóstico tardíode la enfermedad (12, 14, 15).
Estos esfuerzos permitirán mejores resultados con tratamientos más dirigidos y ajustados apacientes con LBDCG según sus característicasclínicas, biológicas y moleculares; teniendoen cuenta que todo tratamiento incluyendo laadición de rituximab puede mejorar la respuestatumoral pero además de aumentar costos también comporta toxicidad adicional asociada adesenlaces fatales que debe ser evaluada conmodelos de seguimiento estricto (28).
Referencias
1. Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA,Stein H, et al. Who classification of tumors of haematopoietic and lymphoid tissues. 4th ed. Lyon: IARC Press; 2008. [ Links ]
2. Campo E, Swerdlow SH, Harris NL, Pileri S, Stein H, Jaffe ES. The 2008 WHO classification of lymphoid neoplasms and beyond: evolving concepts and practical applications. Blood 2011; 117. [ Links ]
3. Jaffe ES, Pittaluga S. Aggressive B-cell lymphomas: a review of new and old entities in the WHO classification. Hematology Am Soc Hematol Educ Program 2011; 2011: 506-14. [ Links ]
4. Sehn LH. Paramount prognostic factors that guide therapeutic strategies in diffuse large B-cell lymphoma. Hematology AmSoc Hematol Educ Program 2012;2012:402-9. [ Links ]
5. A predictive model for agressive non-Hodgkin´s lymphoma: The international non-Hodgkin´s lymphoma prognostic factors project. N Engl J Med 1993; 329 (14). 987-94. [ Links ]
6. Sehn LH, Berry B, Chhanabhai M, Fitzgerald C, Gill K,Hoskins P, et al. The revised International Prognostic Index(R-IPI) is a better predictor outcome than the standard IPI forpatients with diffuse large B cell-lymphoma treated wiht RCHOP. Blood 2007;109 (5):1857 - 61. [ Links ]
7. Alizadeh AA, Eisen MB, Davis RE, Ma C, Lossos IS, Rosenwald A, et al. Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling. Nature 2000; 403: 503-11. [ Links ]
8. Rosenwald A, Wright G, Chan WC, Connors JM, Campo E, Fisher RI, et al. Lymphoma/Leukemia Molecular Profiling Project. The use of molecular profiling to predict survival after chemotherapy for diffuse large B-cell lymphoma. N Engl J Med 2002 Jun 20; 346 (25): 1937 -47. [ Links ]
9. Barton S, Hawkes EA, Wotherspoon A, Cunningham D. Are we ready to stratify treatment for diffuse large B-cell lymphomausing molecular hallmarks? Oncologist 2012;17(12):1562-73. [ Links ]
10. Said JW. Aggressive B-cell lymphomas: how many categoriesdo we need? Mod Pathol 2013 Jan;26 Suppl 1:S42-56. [ Links ]
11. Hans CP, Weisenberger DD, Greiner TC, Gascoyne RD,Delabie J, Ott G, Müller-Hermelink HK, Campo E, BrazielRM, Jaffe ES, Pan Z, Farinha P, Smith LM, Falini B, Banham AH, Rosenwald A, Staudt LM, Connors JM, Armitage JO, Chan WC. Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray. Blood 2004; 103: 275 -282. [ Links ]
12. Ninan MJ, Wadhwa PD, Gupta P. Prognostication of diffuse large B-cell lymphoma in the rituximab era. Leuk Lymphoma 2011 Mar; 52(3): 360-73. [ Links ]
13. Visco C, Li Y, Xu-Monette ZY RN, Green TM, Li Y,Tzankov A, et al. Comprehensive gene expression profilingand immunohistochemical studies support application of immunophenotypic algorithm for molecular subtypeclassification in diffuse large B-cell lymphoma: a report form the International DLBCL Rituximab-CHOP Consortium ProgramStudy. Leukemia 2012; 2103-2113. [ Links ]
14. Perry AM, Mitrovic Z, Chan WC. Biological prognostic markers in diffuse large B-cell lymphoma. Cancer Control 2012 Jul;19(3):214-26. [ Links ]
15. Lenz G, Wright G, Dave SS, Xiao W, Powell J, Zhao H, et al. Lymphoma/Leukemia Molecular Profiling Project. Stromalgene signatures in large B-cell lymphomas. N Engl J Med 2008;359 (22): 2313 -2323. [ Links ]
16. Meyer PN, Fu K, Greiner T, Smith L, Delabie J, Gascoyne R, et al. The stromal cell marker SPARC predicts for survivalin patients with diffuse large B-cell lymphoma treated with Rituximab. Am J Clin Pathol 2011; 135 (1):54-61. [ Links ]
17. Cardessa-Zalzmann TM, Colomo L, Gutiérrez G, ChanWC, Weisenberger D, Climent F, et al. High microvessel density determines a poor outcome in patients with diffuse large B-cell lymphoma treated with Rituximab plus chemotherapy. Haematologica 2011; 96(7): 996-1001. [ Links ]
18. Rimsza LM, Roberts RA, Miller TP, Unger JM, LeBlanc M, Braziel RM, et al. Loss of MHC class II gene and proteinexpression in diffuse large B-cell lympho- ma is related to decreased tumor immu- nosurveillance and poor patient survival regardless of other prognostic factors: a follow-up study fromthe Leukemia and Lymphoma Molecular Profiling Project. Blood 2004;103:4251-8. [ Links ]
19. Troppan K, Wenzl K, Deutsch A, Ling H, Neumeister P, Pichler M. MicroRNAs in diffuse large B-cell lymphoma: implications for pathogenesis, diagnosis, prognosis and therapy. Anticancer Res 2014 Feb; 34(2): 557-64. [ Links ]
20. Savage KJ, Johnson NA, Ben-Neriah S, Connors JM, Sehn LH, Farinha P, et al. MYC gene rearrangements are associated with a poor prognosis in diffuse large B-cell lymphoma patients treated with R-CHOP chemotherapy. Blood 2009 Oct 22; 114(17): 3533-7. [ Links ]
21. Lin P, Medeiros LJ. The impact of MYC rearrangements and"double hit" abnormalities in diffuse large B-cell lymphoma.Curr Hematol Malig Rep 2013 Sep; 8(3): 243-52. [ Links ]
22. Aukema SM, Siebert R, Schuuring E, van Imhoff GW, Kluin-Nelemans HC, Boerma EJ, et al. Double-hit B-cell lymphomas. Blood 2011 Feb 24; 117(8):2319-31. [ Links ]
23. Jain P, Fayad LE, Rosenwald A, Young KH, O›Brien S. Recent advances in de novo CD5+ diffuse large B cell lymphoma. Am J Hematol 2013 Sep;88(9):798-802. [ Links ]
24. Cultrera JL, Dalia SM. Diffuse large B-cell lymphoma: current strategies and future directions. Cancer Control 2012 Jul; 19(3): 204-13. [ Links ]
25. Pasqualucci L. The genetic basis of diffuse large B-cell lymphoma. Curr Opin Hematol 2013 Jul; 20(4): 336-44. [ Links ]
26. Staudt LM. II. Therapy of DLBCL based on genomics. Hematol Oncol 2013 Jun; 31 (Suppl 1):26-8. [ Links ]
27. Guevara NM, Jaramillo PE, Rendón J, Gaviria LM. Caracterización de factores pronósticos al diagnóstico depacientes con Linfoma B difuso de células grandes en unHospital Universitario, 2009-2012. Acta Med Colomb 2014; 39: 137-147. [ Links ]
28. Lindenmeyer LP, Hegele V, Caregnato JP, Wüst D, Grazziotin L, Stoll P. Follow-up of patients receiving rituximab for diffuse large B cell lymphoma: an overview of systematic reviews. Ann Hematol 2013 Nov; 92(11): 1451-9. [ Links ]