Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Medica Colombiana
Print version ISSN 0120-2448
Acta Med Colomb vol.39 no.2 Bogotá Apr./June 2014
Trabajos originales
Caracterización de factores pronósticos en pacientes con linfoma B difuso de células grandes
Characterization of prognostic factors to diagnosis of patients with diffuse large B cell lymphoma
Natalia María Guevara1, Patricia Elena Jaramillo2, Javier Rendón3, Lina María Gaviria4 • Medellín (Colombia)
1 Microbióloga y Bioanalista, Magíster en Microbiología y Bioanálisis, énfasis Hematología, Hospital Universitario de San Vicente Fundación; Medellín (Colombia).
2 Bacterióloga Especialista en Hematología, Magíster en Microbiología y Bioanálisis, énfasis Hematología, Docente Universidad de Antioquia; Medellín (Colombia).
3 Patólogo, Docente Universidad de Antioquia, Patólogo Dinámica IPS y Hospital Pablo Tobón Uribe; Medellín (Colombia).
4 Hematóloga Hospital Universitario de San Vicente Fundación. Medellín (Colombia). Correspondencia. Dra. Natalia María Guevara. Medellín (Colombia).
E-mail: natalia4612@gmail.com
Recibido: 19/VII/2013 Aceptado: 3/III/2014
Resumen
Objetivo: describir los factores pronósticos demográficos, clínicos, hematológicos, inmunohistoquímicos y bioquímicos al diagnóstico de pacientes con linfoma B difuso de células grandes y su asociacióncon la severidad según el Índice Pronóstico Internacional en un Hospital Universitario, 2009-2012.
Métodos: se realizó un estudio descriptivo en 40 pacientes con dicho linfoma. Se comparó laconcentración de β2 microglobulina con los factores pronósticos que componen el IPI y otros que nohacen parte; se determinó la asociación entre el IPI e IPI revisado y la concentración de β2 microglobulina,infiltración medular, masa voluminosa y expresión de BCL-2 y Ki-67. La información se analizó en SPSS.
Resultados: 40% de los pacientes pertenecían al grupo de riesgo alto según el IPI y 55% al grupocon pronóstico pobre según el IPI revisado; 82.5% expresaron BCL-2 y 61.5% tenían un Ki-67>70%.Se observó asociación entre la β2 microglobulina y el Ann Arbor (p=0.036), la β2 microglobulina y lainfiltración medular (p=0.003), y la β2 microglobulina y el IPI revisado (p=0.037).
Conclusiones: es probable que el tiempo transcurrido entre la aparición de los síntomas y eldiagnóstico haya favorecido que los pacientes se presentaran en estados avanzados de la enfermedady como consecuencia, con un pronóstico pobre. Así mismo, el estudio de la infiltración medular, elporcentaje de expresión de Ki-67 y la concentración de β2 microglobulina favorece a la identificaciónde pacientes con un pronóstico adverso. (Acta Med Colomb 2014: 39: 137-147).
Palabras clave: Linfoma B difuso de células grandes, rituximab, pronóstico, médula ósea, antígeno Ki-67, beta 2-microglobulina.
Abstract
Objective: to describe demographic, clinical, hematological, and immunohistochemical and biochemical prognostic factors to the diagnosis of patients with diffuse large B cell lymphoma and itsassociation with the severity according to the International Prognostic Index in a University Hospital,2009-2012.
Methods: a descriptive study was conducted in 40 patients with this lymphoma. β2 microglobulinconcentration was compared with prognostic factors that compose the IPI and others which are not part of it; the association between IPI and revised IPI and β2 microglobulin concentration, bone marrow infiltration, bulky mass and expression of BCL -2 and Ki p-67 was determined. Data was analyzed in SPSS.
Results: 40% of the patients were in the high risk group according to IPI and 55% to the group with poor prognosis according to the revised IPI; 82.5% expressed BCL-2 and 61.5% had a Ki-67 > 70%. Association between β2 microglobulin and Ann Arbor (p = 0.036), the β2 microglobulin and bone marrow infiltration (p = 0.003), and β2 microglobulin and revised IPI (p = 0.037) was observed.
Conclusions: it is likely that the time between onset of symptoms and diagnosis has favored tha patients presented in advanced stages of the disease and as a result, with a poor prognosis. Likewise, the study of bone marrow infiltration, the percentage of Ki-67 expression and the concentration of β2 microglobulin favors the identification of patients with an adverse prognosis. (Acta Med Colomb 2014: 39: 137-147).
Keywords: diffuse large B cell lymphoma, rituximab, prognosis, bone marrow, Ki-67 antigen, beta 2-microglobulin.
Introducción
El linfoma B difuso de células grandes (LBDCG) esuna neoplasia linfoide B agresiva, alrededor de 50% delos pacientes se diagnostican en estados avanzados de laenfermedad y presentan diseminación tumoral a variosórganos (1). Éste es el linfoma no Hodgkin más frecuenteen la población adulta y representa más de 30% de lospacientes con linfoma no Hodgkin (2). De acuerdo conGLOBOCAN en el contexto internacional, el número decasos nuevos de los linfomas no Hodgkin en 2008 fue de356431 casos y la mortalidad de 191599 (3); en Colombiase estiman 2802 casos nuevos al año (4), pero no se conocecuántos corresponden a LBDCG.
Los pacientes con LBDCG presentan heterogeneidad en la evolución clínica y en la respuesta al tratamiento, lo cual se relaciona con ciertas características demográficas, clínicas, inmunohistoquímicas, bioquímicas y genéticas, y algunas de ellas se comportan como factores determinantes para el pronóstico, por lo cual su evaluación al diagnóstico es de vital importancia (5). Por ello desde finales del siglo XX se instauró la determinación de algunos factores que permitieran predecir el desenlace clínico a largo plazo y algunos se unificaron en un sistema estándar denominado Índice Pronóstico Internacional (IPI), que permitió clasificara los pacientes en cuatro grupos de riesgo según la edad, el estado general ECOG definido por el Eastern Cooperative Oncology Group (6), los niveles de lactato deshidrogenasa (LDH), el compromiso extranodal y la diseminación tumoral(estado Ann Arbor) (7). Con base en la cantidad de factores adversos, el paciente se clasifica en uno de cuatro grupos de riesgo y se determina la probabilidad de supervivencia total y supervivencia libre de enfermedad (8).
El IPI se determinó en un estudio multicéntrico de pacientes con linfomas agresivos tratados con quimioterapia basada en antraciclinas (8); no obstante, en la última década el tratamiento de elección incluye el rituximab, un anticuerpo monoclonal que en combinación con regímenes de quimioterapia como el CHOP (ciclofosfamida, doxorrubicina, vincistrina y prednisona) mejora la supervivencia y la remisión completa de los pacientes (9, 10).
Cuando se aplica el IPI en pacientes tratados con rituximab más CHOP (R-CHOP) hay limitaciones paraidentificar los pacientes con menos de 50% de posibilidad de supervivencia y para discriminar los grupos de riesgo (11-13), por lo que Sehn y colaboradores han propuesto la redistribución del IPI en tres grupos de riesgo a través del IPI revisado, el cual logra una mejor discriminación de los pacientes según la posibilidad de supervivencia (12). Así es como la introducción de un nuevo fármaco puede alterar el significado de los factores pronósticos preestablecidos, por lo que se requiere la identificación de nuevos marcadores con potencial pronóstico en los pacientes con LBDCG que son tratados con rituximab (12, 14).
Tal es el caso de la β2 microglobulina (β2M) una molécula con rol pronóstico en varias neoplasias (15). En el LBDCG las concentraciones superiores a 3 mg/L confieren un pronóstico adverso en pacientes tratados con R-CHOP (9); la β2M se puede cuantificar en suero a través de inmunoensayos estandarizados y está incluida en el Plan Obligatorio de Salud, por lo cual su implementación al momento del diagnóstico podría presentar grandes ventajas en cuanto a su uso potencial como factor pronóstico sin un incremento significativo de los costos.
Adicionalmente, se han identificado otros factores quetienen un efecto pronóstico en pacientes con LBDCG tratados con rituximab, como la infiltración de médula ósea(16), la presencia de masa voluminosa (17), la expresiónelevada de Ki-67 (18, 19), la expresión de BCL-2 (20),BCL-6 (13) y CD5 (21), y el perfil de expresión inmunohistoquímica (22), entre otros factores pronósticos. El perfil inmunohistoquímico, propuesto inicialmente por Hans ycolaboradores, se basa en la diferenciación de estos linfomas en dos grupos, origen en centro germinal y diferente alcentro germinal, teniendo en cuenta la expresión de CD10,BCL-6 y MUM1 (22).
En el caso de Colombia, hay poca información disponiblesobre cuáles factores adversos se presentan al momento del diagnóstico, como también sobre el pronóstico que presentanlos pacientes colombianos con linfoma B difuso de células grandes. Dada la importancia clínica de la determinación de los factores pronósticos en los pacientes con LBDCG y la poca información sobre el pronóstico que presentan los pacientes colombianos, es importante, como primer paso, identificar cuáles factores pronósticos que confieren un efecto adverso, están presentes en los pacientes colombianosal momento del diagnóstico, tales como el grupo de riesgo IPI, el riesgo según el IPI revisado, la infiltración medular, la presencia de masa voluminosa, la concentración de β2M sérica, la expresión de BCL-2 y el porcentaje de expresión de Ki-67; los cuales son factores pronósticos que se evalúanrutinariamente en estos pacientes.
Por lo anterior, el presente estudio tuvo como objetivocaracterizar los factores pronósticos demográficos, clínicos, bioquímicos e inmunohistoquímicos al momento deldiagnóstico de los pacientes con LBDCG diagnosticadosentre enero de 2009 y junio de 2012 en el Hospital Universitario de San Vicente Fundación, Medellín. Así mismo, se compararon los niveles de β2M con otros factorespronósticos como los componentes del IPI, la presenciade masa voluminosa, la infiltración de médula ósea, laexpresión de BCL-2 y el porcentaje de expresión de Ki67; igualmente, se determinó la asociación entre la β2My el grupo de riesgo según el IPI y el IPI revisado, comotambién se exploró la asociación de los demás factorespronósticos con el grupo de riesgo IPI.
Materiales y métodos
Se realizó un estudio descriptivo transversal. La población estuvo conformada por todos los pacientes mayores de 18 años que se diagnosticaron con LBDCG entre enero de 2009 y junio de 2012. Se incluyeron los pacientes con diagnóstico confirmado mediante estudio histopatológico en el Departamento de Patología de la Universidad de Antioquia. Se excluyeron aquellos con datos incongruentes, ausencia de información para definir el grupo de riesgo del IPI o análisis inmunohistoquímico insuficiente.
En el sistema de información del hospital se encontraron 52 pacientes con LBDCG diagnosticados entre el periodo detiempo establecido. Debido a que a 11 de los 52 pacientes nose les realizó biopsia de médula ósea y seis de ellos tenían una estadificación inicial de Ann Arbor menor que IV, no se pudo definir con exactitud el estado de Ann Arbor ni el IPI y por lo tanto se excluyeron del estudio; aunque otros cinco pacientes no tenían estudio de médula ósea, ya presentaban un Ann Arbor de IV y se incluyeron en el análisis. Adicionalmente, otros cinco pacientes tenían estudio de inmunohistoquímica insuficiente con respecto al BCL-2, Ki-67 o ambos, o el estudio fue externo y no se pudo confirmar el diagnóstico, por lo que también se excluyeron del estudio. A su vez, se excluyó otro paciente por presentar simultáneamente LBDCG y linfoma de Hodgkin. Finalmente, se incluyeron y describieron 40 pacientes.
La información se obtuvo de fuente secundaria a partir de la búsqueda en los sistemas informáticos del hospital, la historia clínica, el sistema informático de laboratorio y de pruebas de imagenología, así como los registros del Departamento de Patología de la Universidad de Antioquia. Para cada paciente se consignó sexo, edad, resultados de TAC, áreas extranodales infiltradas, síntomas B, infiltración de médula ósea, masa voluminosa, infección por VIH, estado ECOG, concentración de LDH y de β2M, subtipo de LBDCG, resultado de BCL-2, BCL-6, Ki-67 y demás marcadores estudiados.
Acada paciente se le calculó el estado ECOG (6) con baseen la evolución médica y la evaluación de enfermería, el estado Ann Arbor (7) según los resultados deTAC y la biopsiade médula ósea, y finalmente, se calculó el IPI; se empleó el IPI ajustado a la edad en los menores de 60 años (8). El grupo de estudio se clasificó como riesgo bajo, intermedio bajo, intermedio alto o alto. Para el análisis exploratorio, el IPI se redefinió en dos grupos (bajo o intermedio bajo versusintermedio alto o alto), debido a la ausencia de diferencias en la supervivencia de estos grupos cuando los pacientes se tratan con R-CHOP (12). Adicionalmente, se determinó el IPI revisado (12) y el grupo se clasificó con pronóstico muy bueno, bueno y pobre. La β2M se categorizó como <3.0mg/L o >3.0mg/L (9).
Con respecto al estudio histopatológico del ganglio u órgano primario infiltrado, los pacientes fueron diagnosticados en el Departamento de Patología de la Universidad deAntioquia y en caso que el diagnóstico hubiese sido externo,se revisaron nuevamente. El porcentaje de expresión de Ki-67 se definió según los puntos de corte 70% (18) y 85% (19); su cuantificación fue manual (operador dependiente) y no se realizó coeficiente de correlación kappa.
Análisis estadístico
En el análisis univariado se emplearon medidas de frecuencia y de resumen. Para evaluar la asociación entre la β2M y los demás factores pronósticos, se empleó correlaciónde Pearson con la edad y correlación de Spearman con el número de áreas extranodales infiltradas, la concentración de LDH y el porcentaje de expresión de Ki-67; para la asociación entre la β2M y el estado Ann Arbor, el estado ECOGy el grupo de riesgo IPI se empleóANOVA y comparacionesmúltiples de Tukey; en el caso del Ann Arbor, se excluyó el estado II, ya que sólo había un paciente en esta categoría.
En la evaluación de la asociación entre la β2M con las variables bicategóricas se empleó T de Student. Se excluyeron dos valores aberrantes en el grupo de pacientes sin infiltración al evaluar la asociación entre la concentración de β2 microglobulina y la infiltración de médula ósea.
La asociación de los factores pronósticos con el grupo deriesgo del IPI o el IPI revisado se evaluó mediante tablas de contingencia y prueba de chi cuadrado Pearson en las variables cualitativas y H de Kruskall-Wallis para el porcentaje deKi-67 y la concentración de β2M, en esta última también se aplicó T3 de Dunnet cuando se comparó con el IPI revisado.
La aplicación de pruebas paramétricas o no paramétricasse basó en el cumplimiento o no del supuesto de normalidadbivariada según la prueba Shapiro-Wilk. Para ANOVA, también se evaluó el cumplimiento del supuesto de homocedasticidad con el estadístico de Levene.
La información se almacenó y analizó en el Statistical Package for Social Sciences for Windows, SPSS, versión 18.0, y para el chi cuadrado de Pearson se empleó Epidat. En todos los casos se tomó un nivel de significación estadística de 0,05.
Aspectos éticos
El Comité de Investigaciones y el Comité de Ética de la Investigación del Hospital Universitario de San Vicente Fundación aprobaron la ejecución del estudio. Según la resolución N° 008430 de 1993, fue una investigación sin riesgo. Teniendo en cuenta la declaración de Helsinki, durante todas las etapas del proyecto se garantizó la protecciónde la identidad y la confidencialidad de la información.
Resultados
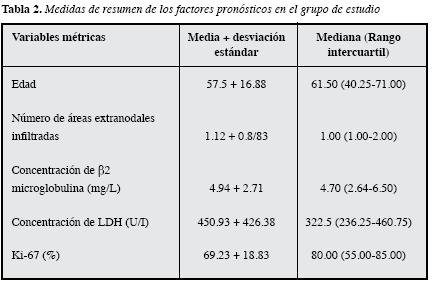
De los 40 pacientes incluidos, 60% fueron hombres, la mediana para la edad fue de 61.5 años (rango 28-85 años). Con respecto a las características clínicas, 82.5% de los pacientes presentaron uno o más síntomas B y la pérdida de peso fue el más frecuente (67.6%), seguida por fiebre (45.9%) y sudoración nocturna (32.5%). El 77.5% presentaron infiltración extranodal y los órganos infiltrados con mayor frecuencia fueron médula ósea (22.9%) y el componente óseo (15.0%).
En cuanto al estudio histopatológico, el LBDCG NOS (not otherwise specified) fue el subtipo más frecuente(79.48%), seguido por el primario de sistema nervioso central (10.26%), rico en histiocitos/linfocitos T (5.13%)y cutáneo primario tipo pierna (5.13%). No se encontraronpacientes con LBDCG virus Epstein-Barr positivo de lavejez.
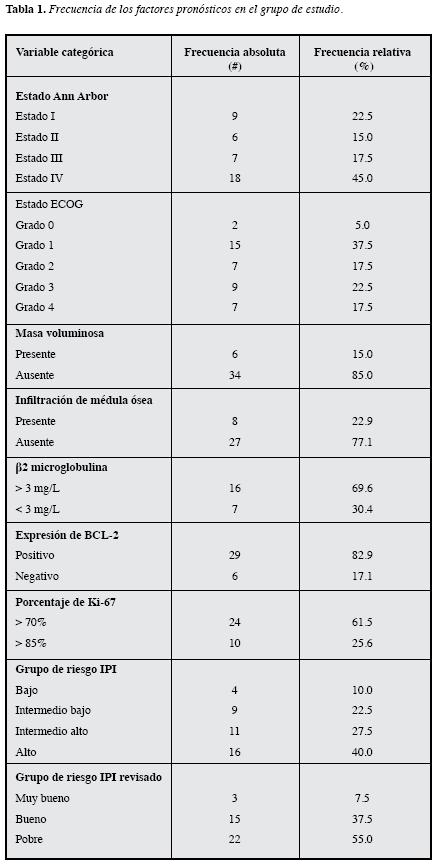
En relación con los factores pronósticos que hacenparte del IPI, 52.5% de los pacientes eran mayores de 60 años, 57.5% tuvieron un ECOG grado 2 o superior, 62.5% presentaron un estado Ann Arbor III o IV (Tabla 1); 22.5% no presentaron afección de órganos diferentes a ganglios linfáticos, mientras que 50% sólo tenían infiltración de un sitio extranodal (no se muestran datos). La concentración promedio de LDH fue 450 U/I (Tabla 2) y 67.5% tenían una concentración de LDH por encima del intervalo biológico de referencia. Al calcular tanto el IPI como el IPI ajustado a la edad, según el caso, el grupo de riesgo más frecuente fue el alto (40.0%); cuando se calculó el IPI revisado 55% de los pacientes se clasificaron en el grupo de pronóstico pobre (Tabla 1).
Respecto a los demás factores pronósticos, 22.9% presentaron infiltración de médula ósea y 15% tenían masa voluminosa (mayor que 10 cm). A 23 pacientes se les determinó concentración sérica de β2M, 82.5% presentaron concentraciones superiores al valor de referencia y 69.6% tenían una concentración >3.0 mg/L. El 82.5% de los pacientes fueron positivos para BCL-2; 61.5% de los pacientestenían una expresión de Ki-67 >70% y 25.6% >85% (Tabla 1). La expresión de BCL-6 sólo se estudió en 18 pacientes y fue positivo en 55.6%; además, ocho pacientes tenían resultado de CD5 y en todos fue negativo. Debido al bajo número de pacientes con resultado de BCL-6 y CD5, éstos no se incluyeron en los análisis estadísticos posteriores.
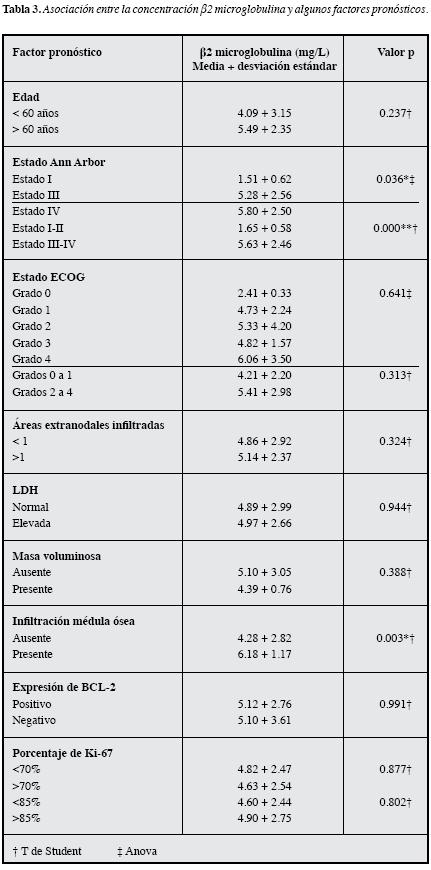
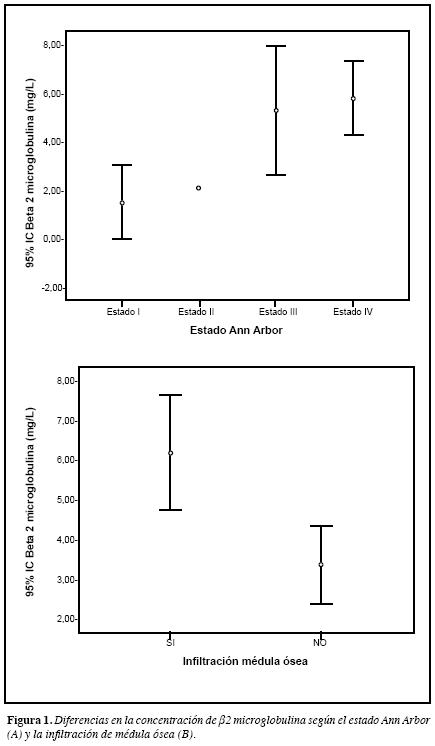
Cuando se analizó la asociación entre la concentración de β2M con los factores pronósticos que componen el IPI y los que no (Tabla 3 y 4), sólo se hallaron diferencias significativas para la infiltración de médula ósea (p=0.003), siendomenores las concentraciones en los pacientes sin infiltración (Figura 1B); así mismo, se halló diferencia estadística segúnel Ann Arbor (p=0.036), ya que la concentración fue menor en los pacientes con estado I con respecto a aquellos con estado IV (p=0.029).
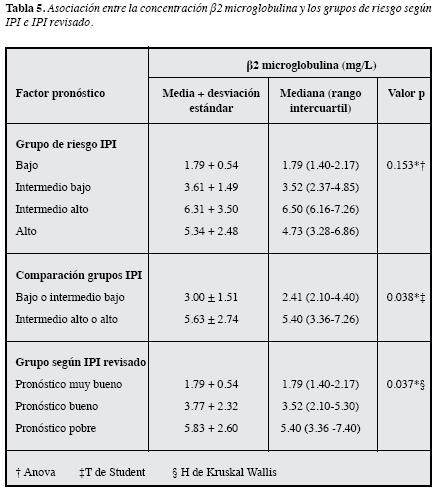
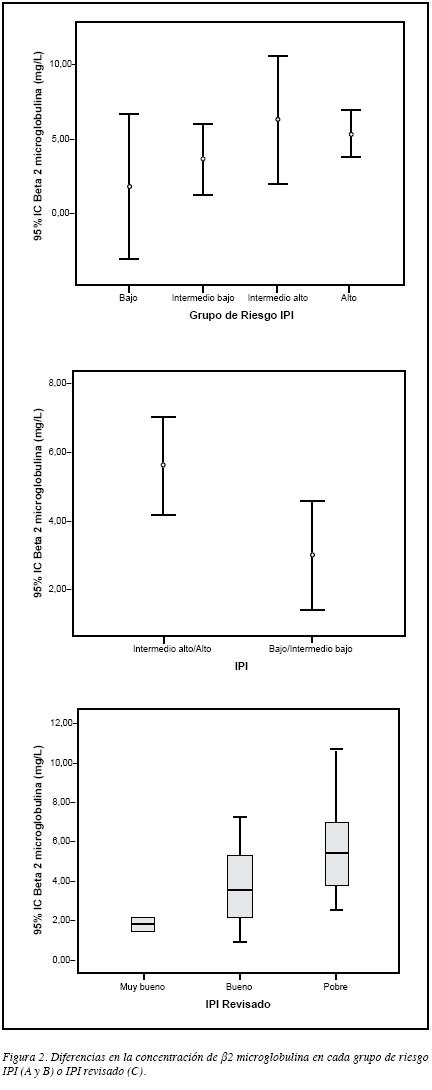
Cuando se analizó la asociación entre la concentración de β2M según el grupo de riesgo definido por el IPI no se halló diferencia significativa (Tabla 5), aunque las concentracionesfueron superiores en aquellos con un riesgo intermedio alto o alto (Figura 2A), y al comparar la concentración entre los pacientes con un riesgo bajo o intermedio bajo y aquellos con un riesgo intermedio alto o alto, se observó diferencia significativa (p=0.038) (Figura 2B). Por su parte, se observódiferencia estadísticamente significativa según el grupo de riesgo del IPI revisado (p=0.037) (Tabla 5); ésta se debió a que la concentración de esta molécula es diferente en los pacientes del grupo de pobre pronóstico con respecto a aquellos con pronóstico muy bueno (p=0.001, T3 de Dunnett), siendo más altas las concentraciones en aquellos del grupo de pobre pronóstico (Figura 2C).
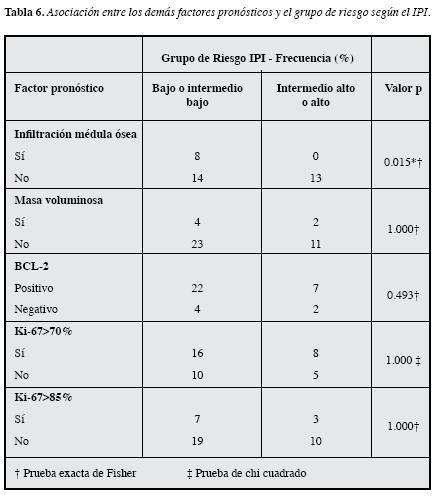
En cuanto a la comparación de los demás factores pronósticos con los grupos de riesgo según el IPI revisado y el IPI convencional, no se observó diferencia estadística alguna (no se muestran datos), pero al comparar según el IPI (bajo o intermedio bajo versus intermedio alto o alto), se observó significación estadística para la infiltración de médula ósea (p=0.015) (Tabla 6).
Discusión
Durante enero de 2009 a junio de 2012, en el Hospital Universitario de San Vicente Fundación, Medellín, se diagnosticaron 52 pacientes con LBDCG. Aunque este linfoma corresponde a aproximadamente 30% de los linfomas no Hodgkin de acuerdo con estudios internacionales (2), no hayinformación sobre la incidencia del LBDCG en el departamento de Antioquia. García y colaboradores encontraron queen el área metropolitana de Bucaramanga, entre 2000 y 2006,se diagnosticaron 320 pacientes con linfoma no Hodgkin y de estos 95 correspondían a LBDCG (23).
En relación con los pacientes incluidos en el presente estudio, la mediana de la edad del grupo de estudio es similar a la identificada en estudios internacionales (54 a 66 años) (12, 13, 18, 19, 24, 25) en los que se incluyen pacientes mayores de 16 años; además, 52.5% de los pacientes eran mayores de 60 años, lo que se correlaciona con otras investigaciones en las que la incidencia del tumor fue superior a 50% a partir de la séptima década de la vida (2, 11, 12, 26).
La alta frecuencia de infiltración extranodal es menor con la de los pacientes asiáticos con LBDCG, en quienes hasta 86.5% presentan afección de uno o más órganos extranodales (25, 27), pero es superior que la encontrada por otros investigadores (24, 28-30), como López y colaboradores, quienes describieron las características clinicopatológicas de 382 pacientes diagnosticados con LBDCG durante un período de 13 años y encontraron que 71% de los pacientes tenían infiltración extranodal y los sitios infiltrados con mayor frecuencia fueron la médula ósea (19%) y el tracto gastrointestinal (12%) (29), lo cual concuerda con lo encontrado en el estudio (22.9 y 10%, respectivamente).
Dada la marcada heterogeneidad clínica, histopatológica,genética, molecular y de respuesta al tratamiento que presentan los pacientes con LBDCG (1), la predicción acertadade la supervivencia facilita que se defina el esquema de tratamiento inicial con base en expectativas de supervivenciareales y a su vez, favorece una estadificación adecuada de los pacientes que vayan a participar en ensayos clínicos (12).Es por ello, que la identificación de los factores pronósticos al diagnóstico de pacientes con LBDCG de la ciudad de Medellín es un acercamiento inicial al estudio de esta neoplasia que afectan a la población de la región, pues a partir de una correcta caracterización del riesgo de acuerdo con losfactores pronósticos que se determinan al diagnóstico y que son de fácil aplicación, se podrá establecer el tratamiento más adecuado para cada paciente.
En relación con los demás factores pronósticos que componen el IPI, la baja proporción de pacientes con estado AnnArbor I o II difiere de estudios grandes, como el realizado porGrupo de Estudio Internacional en Linfomas (ILSG), en el cual 51% de los pacientes acudían en estado I o II (2). Por suparte, Sehn y colaboradores, en el estudio para la definición del IPI revisado, incluyeron 365 pacientes mayores de 16 años con LBDCG y observaron que 59% tenían un estado Ann Arbor III o IV (12), proporción similar al de los pacientes del presente estudio (62.5%) y al encontrado en series de pacientes asiáticos con LBDCG (62%) (27). Ello indica que en la población de estudio se presentó una evolución rápida del linfoma, o bien, hubo un periodo prolongado de tiempo entre el inicio de los síntomas, el diagnóstico y la instauración del tratamiento.
El predominio de pacientes con riesgo alto según el IPI (40%) difiere de lo encontrado en estudios internacionales (2, 11, 30); por ejemplo, según el ILSG sólo 16% de los pacientes con LBDCG presentan un grupo de riesgo IPI altoy 31% tienen un riesgo bajo (2), proporciones similares a las de pacientes asiáticos (27), mientras que otros grupos han encontrado proporciones similares de los cuatro grupos de riesgo (12, 24). Cuando los pacientes se clasificaron con el IPI revisado, el grupo menos frecuente fue el de muy buen pronóstico (7.5%), lo cual coincide con el estudio de Sehn y colaboradores para la instauración de este modelo pronóstico, en el que 10% de los pacientes se clasificaron en dicho grupo de riesgo y 45% tenían un pronóstico pobre (12); por su parte, en el presente estudio 55% se clasificaronen el grupo de pronóstico pobre. Lo anterior, es una evidencia adicional de que los pacientes descritos tienen mayor cantidad de factores adversos al diagnóstico con respecto a los pacientes de series internacionales, probablemente por el tiempo que transcurre entre el inicio de los síntomas, el diagnóstico y la instauración del tratamiento; por lo tanto, es posible que estos pacientes requirieran regímenes de quimioterapia más agresivos.
Si bien en el grupo de estudio hubo mayor frecuencia de pacientes con un IPI alto o intermedio alto, en la literatura se describe que el IPI no permite una correcta diferenciaciónde los cuatro grupos de riesgo cuando se adiciona rituximab al tratamiento (11, 12), ya que los pacientes con riesgo alto e intermedio alto tienen igual supervivencia total y libre de progresión, similar a lo que sucede entre los pacientes de riesgo bajo e intermedio bajo (12); por su parte, la reorganización de los grupos de riesgo según el IPI revisado ha permitido la diferenciación de los pacientes en tres grupos de riesgo con diferente pronóstico (12, 13). Sin embargo, tanto el IPI como el IPI revisado impiden reconocer a los pacientes con una posibilidad de supervivencia total o libre de progresión inferior a 50% (12). Es por esto, que se ha hecho un gran esfuerzo en la búsqueda de nuevos marcadorespara la definición del riesgo antes de iniciar el tratamiento, para lo cual se debe tener en cuenta que la introducción de un medicamento más efectivo, como el rituximab, puede afectar la significancia de factores pronósticos identificadospreviamente, e incluso, factores que carecían de significanciapronóstica pudieron ganarla (14).
En este sentido, la β2M cobra un interés especial para la definición del riesgo de los pacientes con LBDCG que se tratan con rituximab, ya que se determina en suero, existen metodologías estandarizadas para su cuantificación y el Grupo de Estudio de Linfomas del Adulto (GELA), en uno de las investigaciones iniciales en las que se confirmó el beneficio de la adición de rituximab a esquemas de quimioterapia basados en CHOP, encontraron que los pacientes con β2M sérica superior a 3 mg/L tenían un riesgo de 1.58 (intervalo de confianza 1.14-2.21) de muerte, progresión de la enfermedad u otro evento adverso (9).
En el presente estudio, aunque a sólo 23 pacientes se les evaluó la concentración sérica de β2M, 69.6% tenían concentraciones superiores a 3 mg/L, lo cual podría indicar una menor posibilidad de supervivencia total en dichos pacientes, incluso si se tratan con quimioterapia combinada con rituximab, y por esto la cuantificación de β2M sérica al diagnóstico en los pacientes con LBDCG podría favorecer una mejor definición del riesgo y la identificación de aquellosque requieren esquemas de quimioterapia más agresivos.
Lin y colaboradores, en 2012, publicaron un estudio acerca de las características de 332 pacientes mayores de 60 años con LBDCG y encontraron que 74.1% tenían una concentración de β2M por encima del intervalo biológico de referencia (31), lo cual es similar a lo observado en el presente estudio, en el que 82.5% presentaron concentraciones por encima del valor de referencia y difiere de lo observado por Colomo y colaboradores, quienes encontraron aumento de β2M en 42% de 72 pacientes con diagnóstico de LBDCG (24).
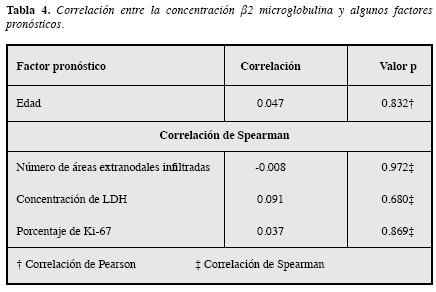
Por otra parte, se observó asociación entre la β2M y la infiltración de médula ósea, siendo los valores más altos en aquellos pacientes con infiltración; también se obtuvo asociación con el estado Ann Arbor y ésta se debió a que la concentración de β2M es mayor en aquellos pacientes con estado IV con respecto a los que tenían estado I. Ke y colaboradores (27), en un estudio que incluyó 83 pacientes con LBDCG, observaron correlación entre la concentraciónde β2M y de LDH, como también con la edad, pero éstas no se observaron en el presente estudio (Correlación de Spearman para LDH 0,091, p=0.680, Correlación de Pearsonpara la edad 0.047, p=0.832). Con respecto a la asociación observada entre la concentración de β2M y el estado Ann Arbor, Ke y colaboradores no observaron correlación entre estos dos factores pronósticos (27), lo cual se puede deber a que hubo diferencias en el análisis estadístico entre los dos estudios.
Adicionalmente, en la revisión de la literatura realizada no se encontró otro artículo que se refiriera a la asociación entre los factores pronósticos mencionados en pacientes con LBDCG; sin embargo, esta asociación se ha observado en linfomas agresivos. Johnson y colaboradores, en su publicación de 1993, hacen referencia a la asociación entre la concentración de β2M y el estado Ann Arbor, siendo las concentraciones más altas en los pacientes con estados III o IV, mientras que no se obtuvo asociación con la presencia de masa voluminosa o la infiltración de médula ósea; no obstante, el grupo de estudio estuvo conformado por pacientes con linfoma de alto grado, independiente del tipo histológico (32).
La β2M corresponde a la cadena liviana del antígeno leucocitario humano clase I, HLA-I, se expresa en todas las células nucleadas y participa en la presentación antigénica a los linfocitos T CD8 (33). Se postula que su aumento en las neoplasias puede reflejar la masa tumoral y el recambio celular, o bien se puede deber a la respuesta frente al tumor; sin embargo, no se conoce la razón por la cual aumenta en lospacientes con LBDCG (34). En caso que su concentración se relacione con el recambio celular y el estado tumoral, ello podría explicar por qué los pacientes con estado Ann Arbor más avanzado tenían concentraciones más altas con respecto a los pacientes con una masa tumoral localizada y por qué los pacientes con infiltración de médula ósea tenían concentraciones más altas que aquellos sin infiltración; sin embargo, bajo dicho supuesto, se esperaría que se relacionaracon otros factores que indican crecimiento tumoral, como el número de áreas extranodales infiltradas, la presencia de masa voluminosa, el porcentaje de expresión de Ki-67 comomarcador de proliferación celular, y específicamente, la concentración sérica de LDH, la cual indica el recambio celulary el crecimiento de la masa tumoral (14, 35). Es importante que en futuros estudios, idealmente multicéntricos para incluir mayor cantidad de pacientes, se evalúe nuevamente la asociación estadística de la β2M con todas las variables relacionadas con el crecimiento y la diseminación tumoral.
En cuanto a la asociación entre la β2M y el grupo de riesgo IPI, no se observaron diferencias estadísticamente significativas, lo cual se puede deber al poco número de pacientes con resultado de β2M en cada categoría del IPI o a que el cambio de la concentración sea muy sutil entre los grupos de riesgo. Esto se relaciona con la diferencia significativa que se observó cuando los pacientes con IPI bajo se agruparon con los de intermedio bajo y se compararon con los de IPI alto o intermedio alto (Figura 2B), de forma que aumentó el número de pacientes entre los grupos comparados y se evidenció la diferencia estadísticamente significativa en la concentración de β2M entre los dos grupos. Estos hallazgos concuerdan con los de Duletic y cols., quienes en un estudio realizado en 46 pacientes con LBDCG observaron que 45.7% tenían concentraciones>3.4 mg/L y cuando comparaban los niveles séricos de β2M entre los pacientes con riesgo bajo o intermedio bajo y los de riesgo intermedio alto o alto, hallaron diferencias estadísticamente significativas (34). Es probable que si se evalúa esta asociación en un estudio multicéntrico para garantizar mayor cantidad de pacientes en cada categoría del IPI, se puedan identificar diferencias estadísticamente significativas al comparar los cuatro grupos de riesgo y se pueda establecer cuál es el grupo con las concentraciones más altas, si el intermedio alto o el alto.
En cuanto a los factores pronósticos que no hacen partedel IPI, la infiltración de médula ósea se presenta al diagnóstico aproximadamente en 10-25% de pacientes con LBDCG(16, 24, 28, 29), cifra que coincide con la observada en el presente estudio. En relación con la significancia estadísticaobtenida con el grupo de riesgo IPI (bajo o intermedio bajo versus alto o intermedio alto), ésta concuerda con lo halladopor Sehn y colaboradores, quienes en una cohorte de 795 pacientes, de los cuales 15.7% tenían infiltración de médula ósea, observaron que ésta era más frecuente en los pacientescon una puntuación más alta de IPI, ya fuese intermedio alto o alto (16); de igual forma, Chung y colaboradores han observado que la infiltración de médula ósea es más frecuente en los pacientes con una puntuación alta de IPI (36) y en ambos estudios se observó significancia estadística (16, 36). Aunque Chung y colaboradores sugieren que las asociaciones observadas se pueden deber a que en los pacientes que se clasifican en un grupo con mayor riesgo tienen más posibilidad de tener más de un área extranodal infiltrada (36), se ha evidenciado que aun con el tratamientocon R-CHOP la infiltración de médula ósea continúa como un factor adverso para los pacientes LBDCG (16, 37), comotambién se ha confirmado que su rol pronóstico es independiente del IPI y de las variables que lo componen (16). Adicionalmente, hasta 3.6% de pacientes que inicialmente se clasifican como Ann Arbor I o II según los resultados de imagenología, tienen infiltración de médula ósea identificadapor biopsia (38). Por lo anterior, es imprescindible determinar si hay infiltración medular para predecir la supervivenciatotal y libre de enfermedad, y poder identificar los pacientescon mayor riesgo de recaída y que se puedan beneficiar de terapias más agresivas.
En el grupo descrito se observó una frecuencia baja de masa voluminosa (15%), la cual difiere de la observada en otros estudios (17, 24), como el de Pfreundschuh y colaboradores, quienes encontraron que 32% de 802 pacientes entre 18 y 60 años con LBDCG tenían masa voluminosa; en contraste, la frecuencia hallada es similar a la de otros estudios (9.6-11%) (39, 40). La presencia de masas voluminosas se relaciona con menor supervivencia total y libre de enfermedad en pacientes tratados con R-CHOP; además,es independiente del IPI y de otros factores para predecir la respuesta al tratamiento (17, 40, 41); no obstante, en estos estudios no se aclara si la presencia de masa voluminosa es más frecuente en alguno de los grupos de riesgo.
Aunque se han propuesto varios perfiles inmunohistoquímicos basados en estudios de expresión génica, como el propuesto por Hans y colaboradores (22), éstos tienen una asociación pronóstica debatida cuando se incluye rituximabdentro del esquema de tratamiento (13, 42-44). Adicional-mente, aún no se cuenta con un esquema por inmunohistoquímica que pueda diferenciar claramente a estos linfomas como de centro germinal o activado. En el presente estudio, no se pudo definir el perfil inmunohistoquímico, debido a que a muy pocos pacientes se les evaluó la expresión de BCL-6 y, en especial, de MUM-1. No obstante, se evaluó la expresión de BCL-2, la cual también hace parte del perfil inmunohistoquímico.
La significancia pronóstica de la expresión de BCL-2 en pacientes tratados con R-CHOP resulta controversial (13, 20, 39). La frecuencia de expresión de BCL-2 (82.9%) es superior a la encontrada en otros estudios (37-60.5%) (13, 19, 28, 45); sin embargo, la ausencia de significancia con el IPI coincide con lo hallado por otros investigadores (39), aunque difiere de lo observado por Nyman y colaboradores, quienes encontraron que el BCL-2 negativo era más frecuente en los pacientes con IPI bajo (puntuación de 0 a 2) (20) y esta diferencia era estadísticamente significativa. Dichas contradicciones se pueden deber a los puntos de corte que seutilicen para definir una muestra como positiva; sin embargo,se debe tener presente que la frecuencia observada de BCL-2positiva fue homogénea entre los grupos de riesgo del IPI.
Con respecto a CD5, si bien sólo se incluyó en el análisis inmunohistoquímico de ocho pacientes, en todos los casos fue negativo. Se ha observado que alrededor de 10% de los pacientes con LBDCG de novo presentan expresión de CD5(46, 47) y cuando se tratan con esquemas de quimioterapia que contienen rituximab, no mejora su pronóstico con respecto a aquellos que se tratan con esquemas que no contienenrituximab (48), por lo que la expresión de CD5 continúa como un factor pronóstico adverso. Por su parte, Ennishi y colaboradores (47) y Niitsu y colaboradores (21), describen que los pacientes con LBDCG de novo CD5 positivo tratados con quimioterapia más rituximab tienen una posibilidad de supervivencia libre menor que los demás pacientes con LBDCG tratados con el mismo esquema, aunque su efecto en la supervivencia total resulta controversial (21, 47).
Adicionalmente, diversos estudios confirman el efecto pronóstico de la expresión de Ki-67 en pacientes con LBDCG tratados con R-CHOP, aunque no hay consenso sobre el punto de corte y algunos estudios lo han definido en 70% (18), 80% (37) u 85% (19). Es de interés que 61.5% tuvieranuna expresión de Ki-67 mayor o igual que 70%, ya que esta frecuencia es superior a la hallada por Li y colaboradores (47%) (18); en contraste, 25.6% tenían una expresión mayor o igual que 85%, la cual difiere de la observada por Yoon y colaboradores (31.9%). Con respecto a la ausencia de asociación entre un porcentaje de expresión Ki-67 alto y el grupo de riesgo según el IPI, este hallazgo concuerda con lo descrito por Yoon y colaboradores, quienes no observaron asociación entre la expresión (mayor o menor que 85%) y el grupo de riesgo IPI, o con los factores pronósticos que hacen parte del IPI u otros externos al IPI; por otra parte, los pacientes con un IPI bajo o intermedio bajo y un Ki-67 inferior a 85% tienen una posibilidad de supervivencia librede enfermedad superior a aquellos en el mismo grupo IPI y con una expresión igual o mayor que 85% (19). Es por ello, que el nivel de expresión de Ki-67, independiente del IPI, contribuirá a predecir la posibilidad de respuesta y de supervivencia al tratamiento con R-CHOP.
Por otra parte, aunque no se incluyeron en esta investigación, existen marcadores genéticos que a su vez tienen unefecto pronóstico, entre ellos las mutaciones doble hit, las cuales corresponden a rearreglos entre el gen MYC/8q24 y uno de los genes BCL2, BCL3 o BCL6; estos rearreglos soncomunes en las neoplasias con características intermedias entre LBDCG y linfoma de Burkitt (49, 50). En el caso del LBDCG, aproximadamente 6% de los pacientes tienen mutación doble hit de MYC y BCL2, los cuales presentan mayor diseminación tumoral e IPI mayor que los pacientes con LBDCG sin dicha alteración genética; adicionalmente, cuando se tratan con R-CHOP, aquellos con mutación doblehit tienen menor supervivencia total y libre de enfermedad que los demás pacientes con LBDCG (51). Por lo anterior, es importante que se impulse la realización de estudios citogenéticos y moleculares en el medio, entre los cuales se incluya la búsqueda de mutaciones doble hit, y que los resultados se incluyan en futuros estudios relacionados con el pronóstico de pacientes con este linfoma.
Entre las limitantes del estudio se encuentran los inherentes a un estudio descriptivo, ya que no se hizo seguimiento y para las asociaciones estadísticas encontradas no se puededefinir causalidad; además, la cantidad de pacientes por categoría de cada variable puede favorecer a imprecisión estadística y por ello existe el riesgo de que no se hayan identificado todas las asociaciones estadísticas posibles; sin embargo, la caracterización de los factores pronósticos en estos pacientes es de vital importancia debido a la heterogeneidad del linfoma y si se conocen los factores pronósticos al diagnóstico, se podrá predecir el comportamiento del tumor y definir el esquema de tratamiento más adecuado. Así mismo, las limitantes anteriores reflejan las deficienciasque existen acerca del conocimiento de la frecuencia de los tipos de linfoma no Hodgkin en la población adulta de la región y evidencia la importancia de desarrollar estudios epidemiológicos al respecto, idealmente multicéntricos.
En conclusión, la determinación de factores pronósticos que no hacen parte del IPI, tales como el porcentaje de expresión de Ki-67, la infiltración de médula ósea, la presencia de masa voluminosa y la concentración sérica de β2M contribuirán a definir la posibilidad de respuesta y supervivencia en pacientes con LBDCG, así como permitirán identificar a quienes se puedan beneficiar de esquemas de tratamiento más agresivos.
Adicionalmente, en el grupo de estudio se observó una frecuencia mayor de factores pronósticos con efecto adverso,como estado Ann Arbor avanzado, IPI alto, expresión de Ki67 superior a 70%, expresión de BCL-2 y β2M > 3mg/L, porlo que estos pacientes podrían requerir quimioterapias más agresivas, y por lo tanto, tendrían mayor riesgo de toxicidad. Si bien no se estableció el tiempo transcurrido entre el inicio de los síntomas, el establecimiento del diagnóstico y el inicio del tratamiento, es probable que una prolongación del tiempo a causa de inconvenientes relacionados con factores culturales que impiden consultar el lugar de residencia(urbana o rural), el acceso a los servicios de salud, los trámites administrativos para la aprobación de citas médicas, exámenes y medicamentos, y los factores biológicos innatosa nuestros pacientes y a sus linfomas, haya favorecido que los pacientes se presentaran en estados avanzados de la enfermedad, y como consecuencia, con un pronóstico pobre.
Fuentes de financiación
Este proyecto no requirió fuentes de financiación. Apoyo de la Universidad de Antioquia y Hospital Universitario de San Vicente Fundación.
Agradecimientos
Al personal de registros médicos, del Laboratorio Clínico y de Hematooncología del Hospital Universitario de San Vicente Fundación, al personal del Departamento de Patología de la Universidad de Antioquia, y a Jaiberth Cardona Arias, MSc, por sus aportes para el análisis estadístico de la información.
Referencias
1. Stein H, Warnke RA, Chan WC, Jaffe ES, Chan JKC, Gatter KC, et al. Diffuse large B-cell lymohoma, not otherwise specified. En: In: Swerdlow SH, Campo E, Lee Harris N, Jaffe ES, Pileri SA, Stein H, et al., editors. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues 4ed. Lyon: IARC 2008. [ Links ]
2. Aclinical evaluation of the International Lymphoma Study Group classification ofnon-Hodgkin's lymphoma. The Non-Hodgkin's Lymphoma Classification Project.Blood 1997; 89 (11): 3909-18. [ Links ]
3. IARC, WHO. GLOBOCAN 2008. Cancer Incidence and Mortality Worldwide in 2008. International Agency for Research on Cancer; 2010. [ Links ]
4. República de Colombia, Ministerio de la Protección Social, Instituto Nacional de Cancerología. Pardo C, Cendales R. Incidencia estimada y mortalidad por cáncer en Colombia, 2002-2006. Bogotá: Legis S.A; 2010. [ Links ]
5. Hunt KE, Reichard KK. Diffuse large B-cell lymphoma. Arch Pathol Lab Med 2008; 132 (1): 118-24. [ Links ]
6. Armitage JO. Staging non-Hodgkin lymphoma. CA Cancer J Clin 2005; 55 (6):368-76. [ Links ]
7. Lister TA, Crowther D, Sutcliffe SB, Glatstein E, Canellos GP, Young RC, et al. Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin's disease: Cotswolds meeting. J Clin Oncol 1989; 7 (11): 1630-6. [ Links ]
8. A predictive model for aggressive non-Hodgkin's lymphoma. The International Non-Hodgkin's Lymphoma Prognostic Factors Project. N Engl J Med 1993; 329 (14): 987-94. [ Links ]
9. Coiffier B, Lepage E, Briere J, Herbrecht R, Tilly H, Bouabdallah R, et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma. N Engl J Med 2002; 346 (4): 235-42. [ Links ]
10. Mounier N, Briere J, Gisselbrecht C, Emile JF, Lederlin P, Sebban C, et al. Rituximab plus CHOP (R-CHOP) overcomes bcl-2--associated resistance to chemotherapy in elderly patients with diffuse large B-cell lymphoma (DLBCL). Blood 2003; 101 (11): 4279-84. [ Links ]
11. Li X, Liu Z, Cao J, Hong X, Wang J, Chen F, et al. Rituximab in combination with CHOP chemotherapy for the treatment of diffuse large B cell lymphoma in China: a 10-year retrospective follow-up analysis of 437 cases from Shanghai Lymphoma Research Group. Ann Hematol 2012; 91 (6): 837-45. [ Links ]
12. Sehn LH, Berry B, Chhanabhai M, Fitzgerald C, Gill K, Hoskins P, et al. The revised International Prognostic Index (R-IPI) is a better predictor of outcome than the standard IPI for patients with diffuse large B-cell lymphoma treated with R-CHOP. Blood 2007; 109 (5): 1857-61. [ Links ]
13. Seki R, Ohshima K, Fujisaki T, Uike N, Kawano F, Gondo H, et al. Prognostic impact of immunohistochemical biomarkers in diffuse large B-cell lymphoma in the rituximab era. Cancer Sci 2009; 100 (10): 1842-7. [ Links ]
14. Sehn LH. Optimal use of prognostic factors in non-Hodgkin lymphoma. Hematology Am Soc Hematol Educ Program 2006; 295-302. [ Links ]
15. Federico M, Guglielmi C, Luminari S, Mammi C, Marcheselli L, Gianelli U, et al. Prognostic relevance of serum beta2 microglobulin in patients with follicular lymphoma treated with anthracycline-containing regimens. A GISL study. Haematologica 2007; 92 (11): 1482-8. [ Links ]
16. Sehn LH, Scott DW, Chhanabhai M, Berry B, Ruskova A, Berkahn L, et al.Impact of concordant and discordant bone marrow involvement on outcome in diffuse large B-cell lymphoma treated with R-CHOP. J Clin Oncol 2011; 29 (11): 1452-7. [ Links ]
17. Pfreundschuh M, Ho AD, Cavallin-Stahl E, Wolf M, Pettengell R, Vasova I, et al. Prognostic significance of maximum tumour (bulk) diameter in young patientswith good-prognosis diffuse large-B-cell lymphoma treated with CHOP-like chemotherapy with or without rituximab: an exploratory analysis of the MabThera International Trial Group (MInT) study. Lancet Oncol 2008; 9 (5): 435-44. [ Links ]
18. Li ZM, Huang JJ, Xia Y, Zhu YJ, Zhao W, Wei WX, et al. High Ki-67 expression in diffuse large B-cell lymphoma patients with non-germinal center subtype indicates limited survival benefit from R-CHOP therapy. Eur J Haematol 2012;88 (6): 510-7. [ Links ]
19. Yoon DH, Choi DR, Ahn HJ, Kim S, Lee DH, Kim SW, et al. Ki-67 expression as a prognostic factor in diffuse large B-cell lymphoma patients treated with rituximab plus CHOP. Eur J Haematol 2010; 85 (2): 149-57. [ Links ]
20. Nyman H, Jerkeman M, Karjalainen-Lindsberg ML, Banham AH, Enblad G,Leppa S. Bcl-2 but not FOXP1, is an adverse risk factor in immunochemotherapytreated non-germinal center diffuse large B-cell lymphomas. Eur J Haematol 2009;82 (5): 364-72. [ Links ]
21. Niitsu N, Okamoto M, Tamaru JI, Yoshino T, Nakamura N, Nakamura S, et al. Clinicopathologic characteristics and treatment outcome of the addition of rituximab to chemotherapy for CD5-positive in comparison with CD5-negative diffuse large B-cell lymphoma. Ann Oncol 2010; 21 (10): 2069-74. [ Links ]
22. Hans CP, Weisenburger DD, Greiner TC, Gascoyne RD, Delabie J, Ott G, et al. Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray. Blood 2004; 103 (1): 275-82. [ Links ]
23. García CA, Uribe CJ, Niño PM, Salazar DS, Vásquez LE. Linfomas no Hodgkin: Área metropolitana de Bucaramanga. Rev Univ Ind Santander Salud 2011; 43: 39-47. [ Links ]
24. Colomo L, Lopez-Guillermo A, Perales M, Rives S, Martinez A, Bosch F, et al. Clinical impact of the differentiation profile assessed by immunophenotyping in patients with diffuse large B-cell lymphoma. Blood 2003; 101 (1): 78-84. [ Links ]
25. Yoo C, Kim S, Sohn BS, Kim JE, Yoon DH, Huh J, et al. Modified number of extranodal involved sites as a prognosticator in R-CHOP-treated patients with disseminated diffuse large B-cell lymphoma. Korean J Intern Med 2010; 25 (3):301-8. [ Links ]
26. Martín L, Quijano S, Bravo MM. Proteínas pro-apoptóticas y anti-apoptóticas como factores de pronóstico en Linfoma B difuso de célula grande en adultos. Univ Sci 2010; 15: 240-50. [ Links ]
27. Ke X, Wang J, Gao Z, Zhao L, Li M, Jing H, et al. Clinical characteristics and prognostic analysis of Chinese patients with diffuse large B-cell lymphoma. Blood Cells Mols Dis 2010; 44 (1): 55-61. [ Links ]
28. Hallack Neto AE, Siqueira SA, Dulley FL, Chauobah A, Belesso M, Saboia R, et al. Bcl-2 protein frequency in patients with high-risk diffuse large B-cell lymphoma. Sao Paulo Med J 2010; 128 (1): 14-7. [ Links ]
29. Lopez-Guillermo A, Colomo L, Jimenez M, Bosch F, Villamor N, Arenillas L, et al. Diffuse large B-cell lymphoma: clinical and biological characterization and outcome according to the nodal or extranodal primary origin. J Clin Oncol 2005; 23 (12): 2797-804. [ Links ]
30. Sohn SK, Jung JT, Kim DH, Kim JG, Kwak EK, Park T, et al. Prognostic significance of bcl-2, bax, and p53 expression in diffuse large B-cell lymphoma. Am J Hematol 2003; 73 (2): 101-7. [ Links ]
31. Lin TL, Kuo MC, Shih LY, Dunn P, Wang PN, Wu JH, et al. The impact of age, Charlson comorbidity index, and performance status on treatment of elderly patients with diffuse large B cell lymphoma. Ann Hematol 2012; 91 (9): 1383-91. [ Links ]
32. Johnson PW, Whelan J, Longhurst S, Stepniewska K, Matthews J, Amess J, et al. Beta-2 microglobulin: a prognostic factor in diffuse aggressive non-Hodgkin'slymphomas. Br J Cancer 1993; 67 (4): 792-7. [ Links ]
33. Cresswell P, Springer T, Strominger JL, Turner MJ, Grey HM, Kubo RT. Immunological identity of the small subunit of HL-A antigens and beta2microglobulin and its turnover on the cell membrane. Proc Natl Acad Sci 1974; 71: 2123-7. [ Links ]
34. Duletic-Nacinovic A, Stifter S, Marijic B, Lucin K, Valkovic T, Petranovic D, et al. Serum IL-6, IL-8, IL-10 and beta2-microglobulin in association with International Prognostic Index in diffuse large B cell lymphoma. Tumori 2008;94 (4): 511-7. [ Links ]
35. Nicolaides C, Dimou S, Pavlidisa N. Prognostic Factors in Aggressive NonHodgkin's Lymphomas. The oncologist 1998; 3 (3): 189-97. [ Links ]
36. Chung R, Lai R, Wei P, Lee J, Hanson J, Belch AR, et al. Concordant but not discordant bone marrow involvement in diffuse large B-cell lymphoma predicts a poor clinical outcome independent of the International Prognostic Index. Blood 2007; 110 (4): 1278-82. [ Links ]
37. Gaudio F, Giordano A, Perrone T, Pastore D, Curci P, Delia M, et al. HighKi67 index and bulky disease remain significant adverse prognostic factors in patients with diffuse large B cell lymphoma before and after the introduction of rituximab. Acta Haematol 2011; 126 (1): 44-51. [ Links ]
38. Lim ST, Tao M, Cheung YB, Rajan S, Mann B. Can patients with early-stage diffuse large B-cell lymphoma be treated without bone marrow biopsy? Ann Oncol 2005; 16 (2): 215-8. [ Links ]
39. Song MK, Chung JS, Shin DH, Seol YM, Shin HJ, Choi YJ, et al. Prognostic significance of the Bcl-2 negative germinal centre in patients with diffuse large B cell lymphoma treated with R-CHOP. Leuk Lymphoma 2009; 50 (1): 54-61. [ Links ]
40. Yang S, Yu Y, Jun-Min L, Jian-Qing M, Qiu-Sheng C, Yu C, et al. Reassessment of the prognostic factors of international prognostic index (IPI) in the patients with diffuse large B-cell lymphoma in an era of R-CHOP in Chinese population. Ann Hematol 2009; 88 (9): 863-9. [ Links ]
41. Pfreundschuh M, Trumper L, Osterborg A, Pettengell R, Trneny M, Imrie K,et al. CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group. Lancet Oncol 2006; 7 (5): 379-91. [ Links ]
42. Hong J, Park S, Park J, Kim HS, Kim KH, Ahn JY, et al. Evaluation of prognostic values of clinical and histopathologic characteristics in diffuse large B-cell lymphoma treated with rituximab, cyclophosphamide, doxorubicin, vincristine, and prednisolone therapy. Leuk Lymphoma 2011; 52 (10): 1904-12. [ Links ]
43. Ilic I, Mitrovic Z, Aurer I, Basic-Kinda S, Radman I, Ajdukovic R, et al. Lack of prognostic significance of the germinal-center phenotype in diffuse large Bcell lymphoma patients treated with CHOP-like chemotherapy with and without rituximab. Int J Hematol 2009; 90 (1): 74-80. [ Links ]
44. Xia ZG, Xu ZZ, Zhao WL, Zhao SQ, Ding F, Chen Y, et al. The prognostic value of immunohistochemical subtyping in Chinese patients with de novo diffuselarge B-cell lymphoma undergoing CHOP or R-CHOP treatment. Ann Hematol 2010; 89 (2): 171-7. [ Links ]
45. Visco C, Tzankov A, Xu-Monette ZY, Miranda RN, Tai YC, Li Y, et al. Patients with diffuse large B cell lymphoma of germinal center origin with BCL2 translocations have poor outcome, irrespective of MYC status: a report from an International DLBCL rituximab-CHOP Consortium Program Study. Haematologica 2012; 98 (2): 255-263. [ Links ]
46. Chan A, Chan J. Diffuse Large B-Cell Lymphoma. In: Jaffe ES, Harris NL, Vardiman JW, Campo E, Arber DA, editors. Hematopathology. Philadelphia: Elsevier Saunders; 2011. [ Links ]
47. Ennishi D, Takeuchi K, Yokoyama M, Asai H, Mishima Y, Terui Y, et al. CD5 expression is potentially predictive of poor outcome among biomarkers in patients with diffuse large B-cell lymphoma receiving rituximab plus CHOP therapy. Ann Oncol 2008; 19 (11): 1921-6. [ Links ]
48. Hyo R, Tomita N, Takeuchi K, Aoshima T, Fujita A, Kuwabara H, et al. The therapeutic effect of rituximab on CD5-positive and CD5-negative diffuse large B-cell lymphoma. Hematol Oncol 2010; 28 (1):27-32. [ Links ]
49. Lin P, Medeiros LJ.The Impact of MYC Rearrangements and "DoubleHit" Abnormalities in Diffuse Large B-Cell Lymphoma. Curr Hematol Malig Rep 2013; 8 (3): 243-52. [ Links ]
50. Pillai RK, Sathanoori M, Van Oss SB, Swerdlow SH. Double-hitB-cell lymphomas with BCL6 and MYC translocations are aggressive, frequently extranodal lymphomas distinct from BCL2 double-hitB-cell lymphomas.Am J Surg Pathol 2013; 37 (3): 323-32. [ Links ]
51. Green TM, Young KH, Visco C, Xu-Monette ZY, Orazi A, Go RS, Nielsen O, Gadeberg OV, Mourits-Andersen T, Frederiksen M, Pedersen LM, MøllerMB. Immunohistochemical double-hit score is a strong predictor of outcome in patients with diffuse large B-cell lymphoma treated with rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisone. J Clin Oncol 2012; 30 (28): 3460-7. [ Links ]