Introducción
Las enfermedades cardiovasculares generan 17 millones de muertes al año, y se espera que aumente a 25 millones al año en 2030. La falla cardiaca se presenta en 1-2% de la población mundial y aumenta a 10% en pacientes mayores de 70 años. En Estados Unidos constituye la primera causa de hospitalización con más de un millón de admisiones al año. Los pacientes con falla cardiaca tienen supervivencia a cinco años de 25%, disminución promedio de nueve años en la expectativa de vida y mortalidad intrahospitalaria de 6.7% 1.
La falla cardiaca es un síndrome clínico que resulta de cualquier alteración cardiaca estructural o funcional que limita la capacidad del ventrículo para llenarse o expulsar la sangre 2 y cursa con activación del sistema neurohumoral reflejado principalmente en la estimulación del sistema nervioso simpático y del eje renina-angiotensina 3; también hay aumento de la producción de varias citoquinas proinflamatorias tales como el factor de necrosis tumoral alfa, la interleuquina 1-beta, la interleuquina 6, la óxido nítrico sintetasa inducible y el péptido natriurético cerebral, los cuales han sido identificados como marcadores séricos de severidad en diversos estadios de la enfermedad y son predictores independientes de los resultados en los pacientes 4. En pacientes con falla cardiaca se produce aumento de los niveles de la familia de péptidos natriuréticos, especialmente el atrial y el cerebral (BNP), en respuesta al aumento de la tensión sobre la pared miocárdica, como mecanismo compensatorio 5, los cuales se han convertido en una valiosa herramienta diagnóstica y pronóstica, tanto en la presencia de fracción de eyección reducida como en la preservada 6.
Durante las últimas décadas el ejercicio ha mostrado beneficios en los pacientes con diagnóstico de falla cardiaca y se ha propuesto como un complemento de la terapia farmacológica para revertir parcialmente las alteraciones neurohormonales y músculo-esqueléticas 7, que acompañan la enfermedad sin inducir un mayor estrés cardiovascular al mismo tiempo que reduce la mortalidad de los pacientes 1-10. Se ha descrito disminución de niveles de BNP luego de entrenamiento aeróbico prolongado 11, pero con resultados diferentes cuando se evalúan en programas de ejercicio, que incluyen diferentes estrategias, en cuanto a escenario, intensidad, duración y tipo de entrenamiento 12.
El presente estudio busca establecer si un programa de ejercicio supervisado durante ocho semanas realizado en una población de pacientes con falla cardiaca disminuye significativamente los niveles de pro-péptido natriurético cerebral (Pro-PNC1- 76) en comparación a un programa de ejercicio basado en la comunidad; los objetivos secundarios son determinar los cambios en el consumo de O2, la clase funcional y la calidad de vida relacionada con la salud. El estudio se diseñó como ensayo clínico con asignación aleatoria, de superioridad, con grupos paralelos, enmascarado para el evaluador de los desenlaces y evaluación del desenlace primario a las ocho semanas.
Métodos
Diseño del estudio
Ensayo clínico, con asignación al azar, enmascarado para los profesionales que evaluaron los desenlaces y realizaron el análisis estadístico. El diseño del estudio fue paralelo y el propósito superioridad. La asignación de los participantes a los grupos se realizó a razón de 1:1 por medio de una secuencia de números aleatorios generados por un computador y el ocultamiento por un sistema de sobres cerrados y opacos.
Participantes
Se incluyeron pacientes mayores de 18 años con diagnóstico de falla cardiaca de más de seis meses de evolución con terapia médica óptima y sin alteraciones ventriculares del ritmo cardiaco adecuadamente controladas. Se excluyeron pacientes con clase funcional NYHA I, que hubiesen asistido a un programa de rehabilitación cardiaca previamente, pacientes con diabetes mellitus descompensada, hipertensión arterial de difícil control, enfermedad cardiaca isquémica en el último mes, embolismo pulmonar previo, enfermedad pulmonar obstructiva crónica, enfermedad restrictiva pulmonar, estenosis valvular aórtica, episodio nuevo de fibrilación auricular y enfermedades osteomusculares que limitaran la realización de actividad física.
El estudio se realizó en la clínica de falla cardiaca del Hospital Universitario de San Vicente Fundación (HUSVF) y en el servicio de rehabilitación cardiaca de la Clínica Las Américas en Medellín, Colombia. Fue aprobado por el comité de ética de cada una de las instituciones, teniendo en cuenta la Declaración de Helsinki. Los participantes recibieron por parte de los investigadores un consentimiento informado escrito luego de evaluar el cumplimiento de los criterios de inclusión y exclusión.
Intervenciones
Los participantes fueron asignados a dos grupos, programa de ejercicio supervisado (grupo de intervención) y programa de ejercicio basado en la comunidad (grupo de control). En el primer grupo recibieron actividades educativas y el programa de ejercicio supervisado por ocho semanas, en una unidad de rehabilitación cardiaca. El programa consistió en sesiones de ejercicio aeróbico cardiovascular dos veces por semana, con una mediana de asistencia a 14 sesiones durante las ocho semanas, supervisadas por un médico especialista en medicina física y rehabilitación y una terapista física. Cada sesión tuvo una duración aproximada de una hora y consistía en periodo de calentamiento, entrenamiento en una banda sin fin, a una intensidad de ejercicio que oscilaba entre 60 y 80% de la capacidad de ejercicio aeróbico del paciente, determinada durante la primera sesión del programa, con la aplicación de un protocolo de Bruce modificado 10; o a una intensidad de ejercicio entre 12 y 16 en la escala de percepción del ejercicio de Borg 13; y por último un periodo de enfriamiento. La intensidad del ejercicio fue ajustada posteriormente de acuerdo con la adaptación del paciente al programa. Los pacientes recibieron además, una sesión de terapia física por semana en la cual se realizó entrenamiento segmentario de la fuerza muscular y un promedio de dos sesiones de terapia ocupacional, en las cuales se brindó educación sobre técnicas de ahorro energético y recomendaciones ergonómicas.
A los participantes asignados al grupo control se les educó en la disminución de los factores de riesgo cardiovascular como malos hábitos alimentarios, tratamiento de las comorbilidades, consumo del cigarrillo, control del peso y control psicológico; adicionalmente se les brindó una orientación y un apoyo ocupacional. Con respecto al ejercicio se les sugirió continuar la actividad física que realizaban normalmente, con indicaciones básicas para ejecutarla en forma segura, sin ningún tipo de seguimiento o instrucciones específicas. Todos los pacientes continuaron la medicación y los cuidados de la dieta recomendada.
Desenlaces
A todos los pacientes se les realizó evaluación inicial y a las ocho semanas que incluía historia clínica completa y clasificación funcional de acuerdo con la NYHA (New York Heart Association). El desenlace primario fueron los niveles de pro-péptido natriurético cerebral (Pro-PNC1-76) a las ocho semanas. Los desenlaces secundarios fueron el consumo de oxígeno, cambios en la prueba de esfuerzo, capacidad funcional y en la calidad de vida relacionada con la salud a los dos meses.
Pro-péptido natriurético cerebral (Pro-PNC 1-76 ): en forma cuantitativa se determinaron los niveles plasmáticos del Pro-PNC 1-76 con el test ELECSYS Pro- BNP, técnica de inmunoensayo de electroquimioluminiscencia (ECLIA), que requiere dos tubos de muestra con EDTA como anticoagulante. La recolección de la muestra fue llevada a cabo por la enfermera de la clínica de falla cardiaca; posteriormente se realizó centrifugación de la muestra en la primera hora, la cual puede almacenarse por tres días a 2-8°C o por 12 meses a -20°C. La toma de muestra se hizo previa firma de consentimiento informado, al inicio y a los dos meses de comenzado el estudio. Todo lo anterior se realizó en el laboratorio clínico del Hospital Universitario San Vicente Fundación (HUSVF) que cuenta con el equipo analizador Elecsys Modular Analytics E 170.
Consumo de oxígeno (VO 2 ): se determinó con una prueba de esfuerzo cardiopulmonar, la cual fue llevada a cabo, por un médico fisiólogo, en un ergoespirómetro (Quinton Metabolic Cart Q710), utilizando un protocolo de aumento de la resistencia de 17 vatios cada tres minutos. La prueba se suspendió en caso de presentación de síntomas, tales como cansancio físico, fatiga, disnea, o cuando se presentaban cualquier criterio adicional de terminación de la prueba de esfuerzo 14,15. Durante el ejercicio se hizo monitoreo con electrocardiograma de 12 derivaciones, registrando la frecuencia cardiaca máxima, presión arterial, tiempo total de ejercicio y los equivalentes metabólicos (Mets); 1 Met es equivalente a la tasa metabólica en reposo, es decir, 3.5 ml/kg/min. El pico del consumo de oxígeno (VO2 pico) fue determinado con el promedio de las mediciones de los últimos 30 segundos del ejercicio y el umbral anaeróbico (UA) fue determinado de forma no invasiva por el método V-Slope 16,17. Las medidas determinadas en el pico del ejercicio y el umbral anaeróbico fueron la ventilación pulmonar (VE), el consumo de oxígeno (VO2) y la producción de dióxido de carbono (VCO2).
Test de seis minutos: es una medida de la capacidad funcional y fue llevada a cabo por un médico entrenado en su aplicación, quien determinó la distancia recorrida. Al inició y al final de la prueba se evaluó la frecuencia cardiaca, la presión arterial y la intensidad del ejercicio con la escala de percepción del ejercicio de Borg.
Calidad de vida: se utilizó la escala Medical Outcome Study (MOS) SF36, la cual tiene validación para Colombia 18. Esta escala mide nueve dimensiones: función física (FF), desempeño físico (DF), dolor corporal (DC), salud general (SG), vitalidad (VT), función social (FS), desempeño emocional (DE), salud mental (SM), y un ítem adicional de cambio en la percepción del estado de salud actual; se evalúa de 0-100 (el máximo valor indica estar mejor). En forma simultánea con el MOS SF36 se aplicó la escala de Zung 19, que es una escala formada por 20 frases relacionadas con la depresión, formuladas la mitad en términos positivos y la otra mitad en términos negativos. El paciente cuantifica la frecuencia de los síntomas, utilizando una escala de Likert de cuatro puntos, desde uno (raramente o nunca) hasta cuatro (casi todo el tiempo o siempre). La escala de Likert de cada ítem puntúa de 1 a 4 para los de sentido negativo, o de 4 a 1 para los de sentido positivo; el rango de puntuación es de 20-80 puntos. El resultado puede presentarse como la sumatoria de estas puntuaciones, o como puntuación normalizada (suma de las puntuaciones de cada ítem expresada como porcentaje de la máxima puntuación posible), oscilando en este caso el rango de valores entre 20 y 100. Esta escala puede categorizar la depresión en leve, moderada y grave o ausencia de síntomas.
Ecocardiografía: se realizó con un equipo Hewlett-Packard Sonos 5500 con características Modo M, Bidimensional y Doppler color, evaluó los parámetros con un valor de referencia para el HUSVF: diámetro sistólico del ventrículo izquierdo de 2.5-3.5 cm, diámetro diastólico del ventrículo izquierdo de 3.5-5.5 cm, fracción de eyección mayor del 60%, fracción de acortamiento 28-45%, onda E 70-120 cm/seg., onda A 47-70 cm/seg., relación Onda E / Onda A 1-2.2, disfunción diastólica si/ no, patrón restrictivo si / no.
Tamaño de muestra
El tamaño de muestra 20 se calculó con el software EPIDAT versión 3.1 teniendo en cuenta un error alfa de 0.05, error beta 0.2 , una diferencia clínica estandarizada de medias por el estadístico de Cohen de 0.92 con una razón entre muestras de 1 y un índice de correlación entre las mediciones de 0.6 21. Con estos parámetros se tuvo un tamaño de muestra de 38 pacientes más un 10% de pérdidas por posible falta de adherencia al protocolo, por las comorbilidades asociadas, complicaciones propias de la enfermedad y por hospitalizaciones, lo que dio un total de 42 pacientes.
Análisis estadístico
Las variables cualitativas se describieron por medio de frecuencias y las variables cuantitativas por medio de medias y desviaciones estándar o medianas y los valores máximos y mínimos dependiendo de la distribución de la variable. Se realizó un análisis entre los grupos y dentro de ellos a los dos meses de seguimiento por medio de una diferencia de medias o comparación de medianas con la prueba U de Mann Whitney y de Wilcoxon de acuerdo con la distribución de cada una de las variables; para el análisis de las variables categóricas se utilizó una comparación de frecuencias por medio de una prueba de chi2. Se realizó un análisis por intención a tratar y por protocolo.
Resultados
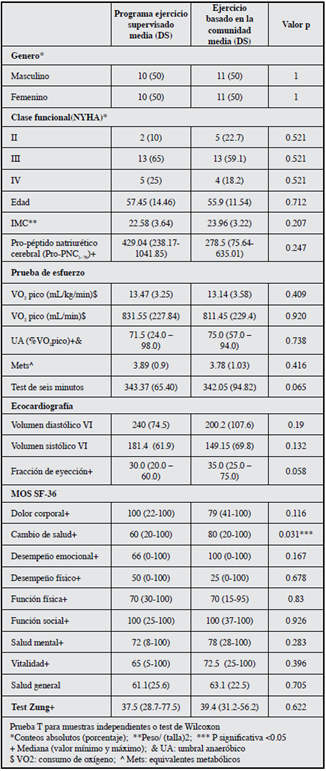
Luego de la asignación aleatoria 23 pacientes ingresaron al grupo de intervención y 26 al grupo control. Durante el seguimiento cinco pacientes fallecieron (tres en el grupo de intervención y dos en el grupo control); seis rehusaron completar todas las evaluaciones (tres participantes para cada grupo) y un paciente no logró realizar las pruebas de esfuerzo cardiopulmonar (grupo control). En total 17 participantes en el grupo de intervención y 20 en el grupo control recibieron el tratamiento y fueron analizados en cada grupo (Figura 1). No hubo diferencias significativas en las características demográficas o clínicas entre los dos grupos al inicio del estudio excepto por la dimensión de cambio de salud del MOS-SF36 (P 0.031) (Tabla 1).
Aproximadamente la mitad de los pacientes del grupo de intervención asistieron a 14 o más sesiones de ejercicio. No se presentaron complicaciones durante los programas de entrenamiento, ni se presentaron efectos adversos durante el seguimiento. La mayoría de los pacientes se encontraban en una clase funcional NYHA III (68% grupo de intervención y 58% en el grupo de ejercicio basado en la comunidad). La fracción de eyección en promedio fue 34.9%, para la clase funcional NYHA III de 33.1% y para la NYHA IV de 29.6%.
Desenlace primario
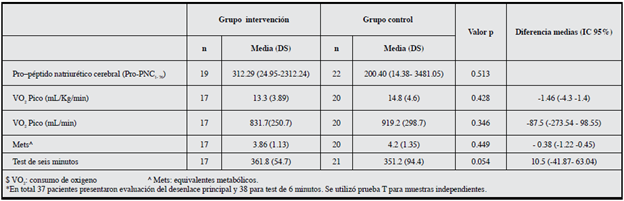
La mediana de los niveles basales de pro-péptido natriurético cerebral (Pro-PNC1-76) fue de 429.04 pg/mL para el grupo de intervención y de 278.5 pg/mL para el grupo control; luego de la realización del programa de ejercicio supervisado no se encontró una disminución estadísticamente significativa (p=0.513) en los niveles de esta pro-hormona para ninguno de los grupos. El análisis de las muestras fue realizado en 19 pacientes del grupo de intervención y en 22 pacientes del grupo control (Tabla 2).
Desenlaces secundarios
El consumo de oxígeno (VO2) y los Mets fueron evaluados como parámetros de ejercicio a las ocho semanas (Tabla 2) y no se encontraron cambios estadísticamente significativos al terminar el programa de ejercicio supervisado. Un total de 37 participantes fueron evaluados a los dos meses. La media de VO2 Pico fue de 13.47 mL/Kg/min y 831.55 ml/min en el grupo de intervención. La evaluación de estos parámetros dos meses después de terminar el programa de ejercicio supervisado tampoco mostró diferencias entre los grupos (p=0.428); sin embargo el consumo de oxígeno (mL/ min) mejoró en ambos grupos, pero este hallazgo no fue estadísticamente significativo.
La distancia recorrida durante el test de seis minutos fue cercana a los 300 metros para los dos grupos, con una diferencia absoluta entre los grupos de 10 metros a las ocho semanas. Esta prueba no presentó diferencias estadísticamente significativas entre los grupos en la evaluación a los dos meses.
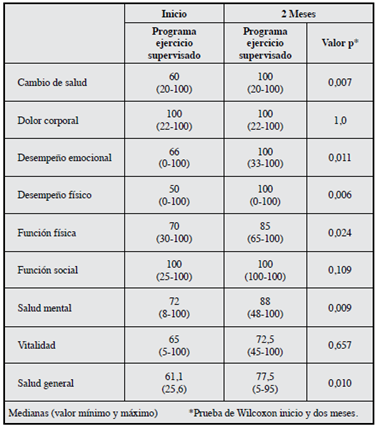
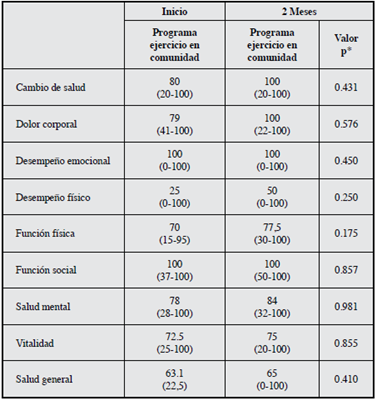
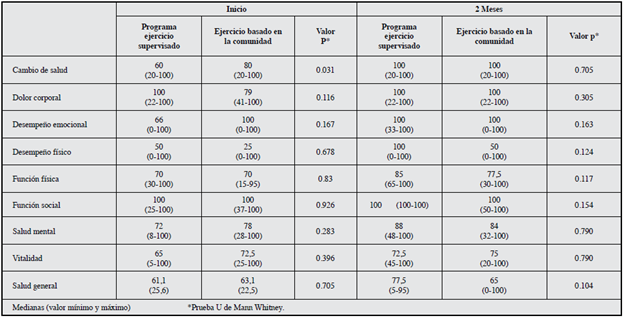
La calidad de vida evaluada por el MOS SF 36 en los dos grupos al inicio presentó valores superiores a 50 (Tabla 1), en el dominio función social en los dos grupos durante todo el seguimiento presentó valores de 100. Los cambios más importantes al evaluar la magnitud de la intervención fueron cambio de salud (60 vs 100), DE (66 vs 100) y DF (50 vs 100) (Tabla 3). En el grupo control no hubo modificaciones en ninguna de las dimensiones del MOS SF 36 a las ocho semanas de seguimiento (Tabla 4). No se presentaron diferencias estadísticamente significativas entre los grupos a las ocho semanas (Tabla 5). El puntaje total de la escala de Zung no presentó ningún cambio en los grupos de intervención o de control.
Discusión
Los cardiomiocitos producen y secretan una familia de hormonas peptídicas, denominadas hormonas natriuréticas cardiacas las cuales tienen efecto diurético, natriurético y actúan en el músculo liso vascular e interactúan con el sistema neurohormonal; dicha familia está compuesta por el péptido natriurético auricular (PNA), el péptido natriurético cerebral (PNC) y el péptido natriurético tipo C (que no se encuentra en el tejido miocárdico y actúa como neurotransmisor); los dos primeros son secretados por el corazón y actúan a través de receptores acoplados a guanidilciclasa, aumentando la síntesis y acumulación intracelular de 3'5' GMP cíclico 5.
El precursor del péptido natriurético cerebral (pro PNC) con 108 aminoácidos se divide en dos fragmentos durante su secreción extracelular: el NT-pro PNC (aminoácidos 1-76 y corresponde al extremo N terminal de la prohormona) y PNC (aminoácidos 77-108); esta molécula es una neurohormona cardiaca secretada desde los ventrículos como respuesta a la expansión por volumen y sobrecarga de presión en los miocitos de las paredes y de igual forma se libera en las aurículas; lo anterior ha llevado a plantear que la expresión de los genes del péptido natriurético cerebral aumenta rápidamente como respuesta a los estímulos asociados a la falla cardiaca 22.
Los estudios iniciales demostraron correlación entre los niveles de péptidos natriuréticos y el deterioro de la función ventricular 23-25, por lo que se constituyeron en herramienta diagnóstica 26 y posteriormente pronóstica 27-29; además, fueron probados como alternativa terapéutica por su efecto diurético y vasodilatador con resultados iniciales alentadores, pero posteriormente se comprobó un efecto benéfico marginal, por lo que su uso ha disminuido en la actualidad 30,31.
Esta claro que la alteración de la capacidad funcional de los pacientes con falla cardiaca no se correlaciona con la función cardiaca, puesto que tanto factores hemodinámicos periféricos como la disfunción del músculo esquelético y alteraciones ventilatorias explican en mayor parte el deterioro 32. En la literatura existen numerosos estudios 33-38, incluidos ensayos clínicos controlados y guías donde se demuestra la seguridad, eficacia y mejoría de resultados cardiovasculares (mortalidad y hospitalizaciones de origen cardiovascular HR 0.89 IC 95% 0.81-0.99; p=0.03), así como de la capacidad funcional y calidad de vida relacionada con la salud mediante la realización de ejercicio aeróbico y de resistencia, al igual que con el ejercicio continuo y en intervalos en pacientes estables con insuficiencia cardiaca clase funcional II, III y IV según la NYHA con disfunción tanto sistólica como diastólica en varios grupos etarios con nivel de evidencia B. Adicionalmente, el ejercicio regular puede proteger la función endotelial 39, evidenciado por disminución de las moléculas de adhesión vascular, el fibrinógeno y otros marcadores 12, e incluso la actividad inflamatoria en cardiomiopatía dilatada idiopática 40.
Nuestro estudio evaluó los efectos de un programa de ejercicio supervisado en comparación con un programa basado en la comunidad durante ocho semanas en una población de pacientes con falla cardiaca no sólo desde el punto de vista hemodinámico sino también funcional, encontrando que la realización de dicho protocolo no modificó significativamente los niveles de Pro-Péptido Natriurético Cerebral (Pro-PNC1-76), así como tampoco el consumo de oxígeno, ni el desempeño en la prueba de esfuerzo o en la caminata de seis minutos; sin embargo, mostró una tendencia a la mejoría de dichos parámetros en ambos grupos sin presentar eventos adversos relacionados con el ejercicio.
Estos resultados están en contra de la evidencia previa que aduce disminución de la actividad neurohormonal relacionado con el ejercicio físico (renina plasmática, angiotensina II, aldosterona, vasopresina y endotelina) 9; los niveles de péptido natriurético disminuyen entre 20 y 49% con una reducción de la resistencia vascular periférica hasta de 75% que se reflejó en un aumento del gasto cardiaco de 25% y en el consumo de oxígeno entre 12 y 31% según la modalidad de intervención aplicada (17% en pacientes que realizan ejercicio aeróbico y 15% combinado con ejercicios de estiramiento) 8,11,41-43 y todos estos efectos se acompañan de la disminución de los síntomas en reposo y el aumento de la capacidad de realizar actividades de la vida diaria y de la calidad de vida; además de tener impacto en la morbimortalidad y las hospitalizaciones de los pacientes sin reportes de muertes directamente relacionadas con la realización del ejercicio 44,45.
Algunos estudios acerca del impacto del ejercicio en la disminución de los niveles del péptido natriurético cerebral 11,46-48 demuestran que la magnitud del efecto se modifica según la modalidad del ejercicio y el gasto energético semanal alcanzado y definen un consumo mínimo de 400450 Kcal por semana para poder obtener los resultados esperados. En el presente estudió el entrenamiento se realizó básicamente mediante ejercicio aeróbico cardiovascular dos veces por semana con algunas sesiones de ejercicio de resistencia, sin ejercer un control estricto del gasto calórico por sesión lo que pudo afectar la disminución de los niveles de Pro-PNC1-76 y la poca mejoría de la capacidad funcional de los pacientes medidas con el VO2 y los METS.
Hay reportes en la literatura 49-52 en los cuales no se demostró disminución significativa de los niveles del PNC y del NT pro-PNC a pesar de lograr un impacto significativo en la capacidad funcional y los parámetros hemodinámicos de los pacientes, con diversas modalidades de ejercicio. Proponen como explicación teórica el hecho de que la práctica de ejercicio en pacientes con falla cardiaca modifica principalmente el funcionamiento del músculo esquelético periférico, lo que conduce a una mejoría en la capacidad funcional, pero no tiene un efecto directo en los cardiomiocitos y por consiguiente sobre los niveles de pro-PNC y PNC; todo lo anterior se suma al periodo de intervención llevado a cabo por los pacientes en este estudio de tan sólo ocho semanas durante las cuales se alcanza un acondicionamiento cardiovascular mínimo, pero no modifica los parámetros neurohormonales que se alteran en la disfunción ventricular y que es corto cuando se compara con otras estrategias publicadas hasta ahora 11,33,46,47. Una revisión sistemática demuestra que los niveles de NT-proPNC pueden modificarse con el ejercicio aeróbico; sin embargo, hay gran heterogeneidad entre los estudios y los resultados son limitados a pacientes con falla cardiaca con fracción de eyección reducida 53.
Consideramos que otras variables involucradas impidieron alcanzar el cambio en los niveles de PNC esperado con el plan de ejercicio supervisado; el efecto sumatorio de otros factores descritos en la literatura como la edad, el sexo y las comorbilidades asociadas (hipertensión arterial, enfermedad coronaria y diabetes mellitus) que de manera intrínseca pueden aumentar los niveles del PNC y el Pro-PNC1-76; de igual forma plantean que las mujeres tienen mayores concentraciones basales de ambas hormonas por el influjo hormonal durante el periodo fértil combinado con un aumento en el grosor de las paredes del septum ventricular en la posmenopausia; también se ha reportado un aumento gradual de los valores de estas hormonas asociado al envejecimiento por un incremento en la fibrosis cardiaca como resultado de la tensión en las paredes ventriculares 54,55. De la misma forma otras enfermedades cardiovasculares y no cardiacas se han asociado a un aumento en los niveles de éstas hormonas; entre las últimas están la nefropatía diabética, el accidente cerebrovascular agudo, la hipertensión arterial y la disnea de origen no cardiaco 56, algunos de ellos se consideraron como criterio de exclusión pero otros no, lo que pudo haber influido en los resultados, de igual forma no se realizó un análisis por subgrupos según el género o las patologías de base relacionadas que permitiera individualizar los desenlaces.
Los pacientes sometidos a intervención tuvieron niveles de Pro-PNC1-76 menores de 500 pg/mL a pesar de que la mayoría tenían una clasificación funcional III de la NYHA; sin embargo, presentaron disminución de los niveles hormonales con la realización de ambos programas de entrenamiento sin sufrir efectos adversos relacionados con el ejercicio además de presentar mejoría estadísticamente significativa en la mayoría de las dimensiones del MOS SF-36 en el grupo de ejercicio supervisado, éstos hacen parte del análisis de resultados centrados en el paciente que constituyen el principal objetivo al momento de analizar el impacto de una intervención y se asocian a una mejor calidad de vida 2.
Conclusiones
La realización de programas de rehabilitación que incluyen protocolo de ejercicio supervisado en pacientes con falla cardiaca crónica mejora la calidad de vida relacionada con la salud, sin cambiar significativamente la activación neurohormonal asociada a la disfunción cardiovascular, en forma segura, en cuanto a eventos adversos relacionados con la actividad física.