Introducción
Staphylococcus aureus es el patógeno bacteriano más comúnmente aislado en humanos 1, con un espectro infeccioso bastante amplio desde infecciones cutáneas superficiales hasta condiciones amenazantes como bacteriemia, endocarditis, neumonía, síndrome de choque tóxico y sepsis 2. Está asociado con mayor mortalidad que cualquier otro microorganismo 3 y es la principal causa de bacteriemias en numerosas áreas geográficas 3. S. aureus infecta frecuentemente en el ámbito hospitalario y en la comunidad y es un problema creciente que genera aumento tanto en los costos del sistema de salud, como en morbilidad y mortalidad. El incremento en las tasas de resistencia dificulta el enfoque inicial de la bacteriemia por S. aureus4. Desde los últimos años la incidencia de bacteriemias por S. aureus resistente a meticilina (SAMR) ha aumentado, principalmente en las infecciones adquiridas en el medio hospitalario 5. No obstante, la bacteriemia por S. aureus sensible a meticilina (SAMS) continúa siendo un problema importante 4.
La epidemiología de las cepas de S. aureus y su resistencia es muy cambiante según el área geográfica e incluso entre diferentes hospitales 6. El curso de la infección es diferente dependiendo de la resistencia y el lugar de adquisición del microorganismo y se ha sugerido que la infección por SAMR tiene una mayor mortalidad asociada que la infección debida a SAMS 7. La instauración de una terapia empírica inapropiada o retardada se encuentra relacionada con el aumento de la mortalidad a corto plazo y con los días de estancia hospitalaria 8. Sin embargo, el tratamiento de la bacteriemia debe ser encaminado idealmente según el patrón de resistencia del germen, ya que la evidencia actual demuestra que la vancomicina, que ha sido usada durante muchos años como terapia empírica, tiene resultados subóptimos en el tratamiento de infecciones por SAMS 4.
En Latinoamérica y específicamente en Colombia el estudio de S. aureus ha estado más enfocado en la descripción del SAMR 2. Con respecto a la bacteriemia por S. aureus en Colombia existen estudios publicados sobre factores de mortalidad en pacientes con cáncer y sobre mortalidad asociada específicamente a la bacteriemia por SAMR 9,10. El propósito de este estudio fue caracterizar clínicamente a los pacientes con bacteriemia por S. aureus detectados en un hospital de tercer nivel de atención de la ciudad de Medellín y definir su perfil de resistencia microbiana.
Material y Métodos
Diseño, lugar y participantes
Se realizó un estudio de cohorte retrospectivo en el Hospital Universitario San Vicente de Paúl, Medellín, Colombia. El hospital es un centro de tercer nivel de atención, de carácter universitario, con 672 camas de las cuales 470 son de hospitalización de adultos distribuidas de la siguiente manera: 45 camas de cuidados intensivos, 30 de cuidados intermedios y 395 en salas generales.
Se incluyeron pacientes mayores de 16 años con aislamiento microbiológico en muestras de sangre periférica para Staphylococcus aureus entre enero de 2012 y agosto de 2016. Se excluyeron segundos episodios de un mismo paciente, muestras de catéteres vasculares o de otros tipo pero sin aislamiento en sangre periférica, aquellos sin información disponible en la historia clínica y las bacteriemias polimicrobianas (dos o más gérmenes).
Definición de variables
Comorbilidades: se evaluó el número y la gravedad de las condiciones asociadas de acuerdo con la clasificación de comorbilidades del índice de Charlson 11, el cual estima la supervivencia a 10 años a partir de la presencia de insuficiencia cardiaca congestiva, enfermedad hepática leve, demencia, hemiplejía o paraplejia, enfermedad renal, tumor primario incluyendo leucemia y linfoma, enfermedad pulmonar crónica, diabetes con complicaciones crónicas, sida/VIH, enfermedad reumatológica, tumor sólido metastásico o enfermedad hepática moderada-grave. Además de las anteriores, se registraron los antecedentes de drogadicción y alcoholismo, uso de esteroides, trasplante de órgano, embarazo, orden de no reanimación y antecedente de endocarditis.
Origen de la bacteriemia: se catalogó según la clasificación de Friedman et al 12 como nosocomial en aquellos pacientes hospitalizados por 48 o más horas; asociada al cuidado de la salud definida como hemocultivo positivo dentro de las primeras 48 horas del ingreso con alguno de los siguientes criterios: terapia intravenosa domiciliaria en los últimos 30 días, cuidado de heridas, hemodiálisis, quimioterapia intravenosa, hospitalización igual o mayor a dos días en los últimos 90 días o residencia en un lugar con asistencia médica; y la bacteriemia adquirida en la comunidad como hemocultivo positivo dentro las primeras 48 horas de hospitalización en pacientes quienes no cumplían criterios para bacteriemia asociada al cuidado de la salud.
Clasificación microbiológica: la muestra de los hemocultivos se procesó en el equipo Bact-alert (bioMérieux®), una vez marcó un cultivo como positivo, se realizó coloración de Gram y posteriormente se sembró en el medio de cultivo sólido correspondiente (Agar MacConkey). Una vez se obtuvo crecimiento de colonias bacterianas, éstas fueron llevadas al equipo VITEKTWO (bioMérieux®) para hacer la identificación del género y especie del microorganismo, además de la realización del antibiograma que permitió conocer la presencia o no de resistencia a antibióticos, teniendo en cuenta las concentraciones inhibitorias mínimas (MIC, por sus siglas en inglés) determinadas por el Instituto de Estándares Clínicos y de Laboratorio de Estados Unidos del 2012 (CLSI, por sus siglas en inglés).
Resistencia a la meticilina: según CLSI, los criterios de interpretación para oxacilina en Staphylococcus aureus son, si MIC < 2 se considera sensible, si MIC > 4 se considera resistente.
Otras variables relacionadas
Se documentó la presencia en los pacientes de prótesis valvulares, prótesis ortopédicas, ventilación mecánica previa al cultivo; catéteres intravasculares centrales, procedimientos quirúrgicos, trauma o quemaduras en los últimos tres meses. Prescripción de antibióticos (nombre, dosificación, duración); gravedad de la enfermedad valorada usando la puntuación APACHE II (Acute Physiologic and Chronic Health Evaluation II)13 y la frecuencia y magnitud de la disfunción de órganos se midió con la puntuación SOFA 14, estas puntuaciones se determinaron con la información obtenida del registro.
Se clasificó la gravedad de la enfermedad como sepsis grave como aquella disfunción orgánica aguda secundaria a infección y choque séptico como la sepsis grave sumada a hipotensión no revertida con reanimación mediante fluidos; de acuerdo con la guía de supervivencia en sepsis 15.
Se reportó el número de horas en que el Bact-alert se demoró en reportar microorganismos en el hemocultivo inicial; de la misma forma se hizo con el hemocultivo de control.
Variables de desenlace
Muerte en la misma hospitalización del ingreso al estudio, tiempo de estancia hospitalaria, necesidad de ingreso a unidad de cuidados intensivos posterior al cultivo.
Fuente de la información
La información clínica fue recolectada de forma retrospectiva únicamente a partir de la historia clínica y de las notas de enfermería. Se recolectó la información relacionada con la toma de la muestra del hemocultivo, los signos vitales y los exámenes de laboratorios más próximos a la toma de la muestra. Todo el seguimiento y registro de información se realizó por parte del personal capacitado para la recolección de los datos.
Resultados
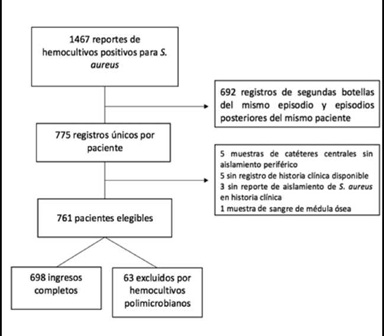
De 1467 reportes de hemocultivos positivos para S. aureus, luego de exclusiones, se tuvieron como elegibles a 761 pacientes (Figura 1).
Las características clínicas y demográficas de la población del estudio se presentan en la Tabla 1. En 354 pacientes (50.7%) la bacteriemia era de origen nosocomial y 26.2% del total (n= 183) eran SAMR. El factor asociado con la bacteriemia con mayor frecuencia fue tener al menos un catéter venoso central o ambulatorio en 321 pacientes (46%). La mortalidad total fue del 24.9% (174/698).
Tabla 1 Características generales y evolución de los participantes del estudio .
| Características de la población | (n=698) | |
|---|---|---|
| Edad (RIQ) | 58 (42-69) | |
| Género masculino | 383 (54.9 %) | |
| Factores relacionados al momento del hemocultivo | ||
| Prótesis valvulares | 14 (2.0%) | |
| Prótesis ortopédica | 10 (1.4%) | |
| Ventilación Mecánica | 69 (9.9%) | |
| Catéter IV centrales y/o ambulatorios | 321 (46%) | |
| Terapia de remplazo renal | 300 (43%) | |
| En los tres meses previos | ||
| Uso de terapia antibiótica | 143 (20.5%) | |
| Uso terapia inmunosupresora | 130 (18.6%) | |
| Cirugía | 94 (13.5%) | |
| Procedimiento invasivo ambulatorio | 105 (15.0%) | |
| Trauma | 157 (22.5 %) | |
| Quemaduras | 18 (2.6 %) | |
| Causa de ingreso | ||
| Infección/ sospecha de infección | 341 (48.9%) | |
| Enfermedad general/intoxicación | 314 (45%) | |
| Trauma/ quemadura/ Cirugía | 43 (6.2%) | |
| Presunto origen de la bacteriemia | ||
| Bacteriemia nosocomial | 354 (50.8%) | |
| Bacteriemia asociada al cuidado de la salud | 221 (31.6%) | |
| Bacteriemia adquirida en la comunidad | 123 (17.6%) | |
| Sospecha foco primario | ||
| Desconocido | 105 (15.0%) | |
| Piel y tejidos blandos/ISO sup-prof | 189 ( 27.1%) | |
| Línea venosa periférica CVP/FAV | 82 (11.8%) | |
| Línea central CVC/CAC/PICC | 273 (39.1%) | |
| Pulmonar/ foco respiratorio | 34 (4.9%) | |
| Otro | 15 (2.2%) | |
| Puntaje Charlson (RIQ) | 2 (1-3) | |
| Horas positivo inicial (RIQ) | 12.6 (10.7-15.5) (n=650) | |
| Horas positivo control (RIQ) | 16.9 (13.7-23.4) (n= 107) | |
| SAMR | 183 26.2% | |
| MIC vancomicina | ||
| MIC <=0.5 | 247 35.4% | |
| MIC 1 | 442 63.3% | |
| MIC 2 | 4 0.6% | |
| Sin dato | 5 0.7% | |
| Gravedad del cuadro | ||
| SOFA (RIQ) | 4 (1-6) | |
| APACHE II (RIQ) | 15 (10-19) | |
| Abreviaciones: ISO, infección sitio operatorio; CVP, catéter venoso periférico; FAV, fistula arterio venosa; CVC, catéter venoso central; CAC, catéter arterial central; PICC, catéter central de inserción periférica; MIC, concentración mínima inhibitoria; SOFA, Sepsis-related Organ Failure Assessment; APACHE II, Acute Physiology And Chronic Health Evaluation; SAMR, Staphylococcus aureus metelicino-resistente. | ||
Se inició terapia empírica en el 67.2% de los casos (n=469), en la Tabla 2 se muestra en detalle la terapia empírica administrada, dividida en seis grupos según el origen de la bacteriemia (nosocomial, intermedia, de la comunidad) y su resistencia (SAMR y SAMS).
Tabla 2 Terapia antibiótica empírica según fuente de la infección y tipo de resistencia .
| Nosocomial (n= 354) | Asociada al cuidado de la salud (n=221) | Comunidad (n=123) | Todos (n=698) (%) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| SAMS (n=259) (73.2%) | SAMR (n=95) (26.8%) | SAMS (n=174) (78.7%) | SAMR (n=47) (21.3%) | SAMS (n=82) (66.7%) | SAMR (n=41) (33.3%) | ||||
| Oxacilina | 1 (0.4) | 0 | 0 | 0 | 0 | 0 | 1 (0.1) | ||
| Betalactamicos | 50 (19.3) | 19 (20.0) | 24 (13.8 ) | 9 (19.2) | 18 (21.9) | 8 (19.5) | 129 (18.5) | ||
| Glicopeptidos | 30 (11.6) | 10 (10.5) | 19 (10.9) | 5 (10.6) | 6 (7.3) | 4 (9.8) | 74 (10.6) | ||
| Otros | 8 (3.1) | 2(2.1) | 3 (1.7) | 0 | 1 (1.2) | 1 (2.4) | 15 (2.2) | ||
| Betalactamicos+ glicopeptidos | 73 (28.2) | 23 (24.2) | 79 (45.4) | 19 (40.4) | 20 (24.4) | 11 (26.8) | 225 (32.2) | ||
| Betalactamicos+ glicopeptidos+ otros | 3 (1.2) | 0 | 2 (1.2) | 0 | 3 (3.7) | 2 (4.9) | 10 (1.4) | ||
| Betalactamicos+ otros | 2 (0.8) | 2 (2.1) | 1 (0.6) | 0 | 4 (4.9) | 2 (4.9) | 11(1.6) | ||
| Glicopeptidos + otros | 1 (0.4) | 2 (2.1) | 2 (1.2) | 0 | 0 | 0 | 5 (0.7) | ||
| Sin terapia empírica | 91 (35.1) | 37 (38.9) | 44 (25.3) | 14 (29.8) | 30 (36.6) | 13 (31.7) | 229 (32.8) | ||
| Abreviaciones: SAMS, Staphylococcus aureus metelicino-sensible; SAMR, Staphylococcus aureus metelicino-resistente | |||||||||
La mortalidad más alta se encontró en el grupo de SAMS adquirido en la comunidad en 40.2% (33/82) y en este mismo grupo se encontró la necesidad de UCI posterior al hemocultivo más alto: 36.6% (30/82) (Tabla 3).
Tabla 3 Descenlaces de acuerdo con la fuente de infección y el tipo de resistencia
| Nosocomial (n= 354) | Asociada al cuidado de la salud | Comunidad (n=123) | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|
| (n=221) | (n=698) | ||||||||
| SAMS | SAMR | SAMS | SAMR | SAMS | SAMR | (%) | |||
| (n=259) | (n=95) | (n=174) | (n=47) | (n=82) | (n=41) | ||||
| (73.2%) | (26.8%) | (78.7%) | (21.3%) | (66.7%) | (33.3%) | ||||
| Vegetación ecocardio | 14 (10.8) | 2 (4.4) | 14 (12.7) | 1 (3.2) | 3 (7.9) | 1 (4) | 36 (9.5) | ||
| (n=130) | (n=45) | (n=110) | (n= 31) | (n=38) | (n=25) | (n= 380) | |||
| Siembras | 57 (22.1) | 20 (21.1) | 25 (14.4) | 9 (19.2) | 24 (29.6) | 13 (31.7) | 149 (21.4) | ||
| (n=258) | (n=95) | (n=174) | (n=47) | (n=81) | (n=41) | (n= 697) | |||
| Sepsis grave | 147 (57.7) | 54 (56.8) | 85 (49.4) | 22 (47.8) | 53 (65.4) | 26 (63.4) | 388 (56.2) | ||
| (n=255) | (n=95) | (n=172) | (n=46) | (n=81) | (n=41) | (n=691) | |||
| Choque séptico | 51 (20) | 17 (17.9) | 22 (12.79) | 6 (13.0) | 22 (27.2) | 9 (21.9) | 127 (18.4) | ||
| (n=255) | (n=95) | (n=172) | (n=46) | (n=81) | (n=41) | (n= 691) | |||
| UCI posterior hemocultivo | 63 (24.3) | 21 (21.1) | 34 (19.5) | 8 (17.0) | 30 (36.6) | 11 (26.8) | 167 (23.9) | ||
| Muerte al alta | 66 (25.5) | 25 (26.3) | 27 (15.5) | 11 (23.4) | 33 (40.2) | 12 (29.3) | 174 (24.9) | ||
| Abreviaciones: SAMS, Staphylococcus aureus metelicino-sensible; SAMR, Staphylococcus aureus metelicino-resistente. | |||||||||
Discusión
En esta cohorte restrospectiva de pacientes con bacteriemia por S. aureus en un hospital universitario, se encontró que más de 50% de las mismas eran de origen nosocomial y el SAMS fue el patógeno más prevalente, aislado en 73.8% del total de las muestras. Lo anterior difiere de lo reportado actualmente en países desarrollados, donde el SAMR supera el 50% 16,17. En Estados Unidos, Wisplinghoff y colaboradores mostraron que la proporción de SAMR se incrementó de 22% en 1995 a 57% en 2001 18. Todo esto sugiere que el comportamiento del SAMR en nuestro medio se asemeja al reportado en décadas pasadas en países industrializados y, como hemos encontrado en otras investigaciones 19, nuestra ecología bacteriana parece seguir con aproximadamente 20 años de retraso, lo que ocurre en las naciones más industrializadas.
Con respecto a la proporción de bateriemias por S. aureus adquiridas en la comunidad, Mylotte y colaboradores reportaron en 1987 que la estafilococcemia proveniente de la comunidad era 14% contra 86% proveniente del hospital 20, aclarando que para este entonces no se diferenciaban estas infecciones realmente nosocomiales con respecto a las simplemente asociadas al cuidado de la salud. Friedman y colaboradores en el año 2002 reportaron para las estafilo-coccemias un porcentaje de 14.5% para las adquiridas en la comunidad, 46% asociadas al cuidado de la salud y 39% a las nosocomiales 12. En nuestro estudio encontramos una distribución similar para la comunidad (17.6%), pero diferente para las asociadas al cuidado de la salud y las nosocomiales, con 31.6% y 50.8%, respectivamente. A pesar de lo anterior, la prevalencia de SAMR en cada uno de los subgrupos difiere significativamente entre nuestros resultados y los del estudio de Friedman: mientras nosotros hallamos SAMR en 26.8% de los aislamientos nosocomiales, 21.3% de los asociados al cuidado de la salud y 33.3% en la comunidad, ellos describieron la proporción de SAMR de 61, 52 y 14%, respectivamente 12. Un estudio realizado en Argentina entre el 2002 y 2013 por Togneri y colaboradores, reportó una prevalencia del SAMR de 37% del total de aislamientos de la comunidad, similar al reportado en nuestro estudio. Sin embargo, el SAMR del total asociado a la asistencia sanitaria se encontró en 63% 21, lo cual es superior a nuestros hallazgos pero se asemeja más a resultados de otros estudios como el de Friedman y Mylote 12,20.
Kaasch y colaboradores realizaron un análisis de 3395 pacientes con bacteriemia por S. aureus, incluidos en cinco estudios prospectivos realizados entre 2006 y 2011 en 20 centros médicos de tercer nivel en Alemania, España, Reino Unido y Estados Unidos 22. La mortalidad general fue de 40.7%, superior a 24.9% que reportamos en esta cohorte, aunque la frecuencia de infección por MRSA (20.6%) y la fuente en catéter venoso periférico o central (27.7%), fueron similares a las encontradas en nuestro estudio. Es de resaltar que la mortalidad en nuestra cohorte fue mayor en el grupo con infección por SAMS proveniente de la comunidad. Con respecto a la mortalidad por patrones de resistencia exclusivamente, se describen diferencias tan amplias como en el estudio de Chang y colaboradores, donde los pacientes con bacteriemia por SAMR exhibieron una mortalidad de 50%, comparada con 23% en los pacientes con SAMS 23. De igual manera, en un estudio retrospectivo realizado por Kobayashi y colaboradores en Japón con 340 pacientes con bacteriemia por S. aureus24, la mortalidad global fue de 34.7%, la frecuencia de infección por MRSA de 44.4% y la mortalidad asociada a este grupo fue de 39.7%, comparada con 30.7% en el grupo infectado por SAMS. Este mismo estudio reportó un origen de la bacteriemia en la comunidad en 27% de los casos, valor cercano al porcentaje encontrado en nuestro estudio. Respecto a la mortalidad según el sitio de infección; autores como Kaech y colaboradores en un estudio retrospectivo en un hospital suizo, describen que de 308 episodios de bacteriemia por S. aureus, 26% de los provenientes de la comunidad fallecieron, a diferencia de los de origen nosocomial en que dicho desenlace se presentó en 13% 25. Nuestro estudio también mostró mayor mortalidad en los pacientes con infecciones de la comunidad, pero con proporciones mayores a las encontradas en el estudio suizo.
Varios estudios de cohorte han reportado menores efectos en desenlaces clínicos, o eficacia disminuida, en bacteriemias por SAMS tratadas con vancomicina 26,27, por lo que la bacteremia por SAMS debería ser siempre tratada de primera elección con penicilinas antiestafilocócicas o cefalosporinas de primera generación. A pesar de esta recomendación, en nuestra cohorte se empleó en la terapia empírica oxacilina solamente en un paciente y apenas en 20% se inició un betalactámico. Casi la mitad de los pacientes recibieron empíricamente glicopéptidos solos o en combinación, y en una tercera parte no se consideró la necesidad de un tratamiento empírico. Aunque no es posible establecer y valorar los criterios clínicos con base en los cuales los médicos decidieron iniciar terapia empíríca y escogieron el antibiótico de elección, la relativamente baja prevalencia de SAMR de nuestra cohorte (26.2%) refuerza la necesidad de la educación continua en la prescripción adecuada de antibióticos.
En nuestro medio encontramos sólo un estudio con características similares al que realizamos 2, específicamente con respecto a la mortalidad en bacteriemia por S aureus discriminada tanto por el patrón de resistencia (SAMR vs SAMS) como por el lugar de adquisición (comunidad vs institución). A pesar de incluir un número similar de pacientes (n=810), los años de reclutamiento fueron diferentes (2008-2010) y las distribuciones por grupo difieren con las nuestras: bacteriemia nosocomial 40.9% (n=331), bacteriemia asociada al cuidado de la salud 46.8% (n=379) y bacteriemia adquirida en la comunidad 12.3% (n=100). La mortalidad fue más frecuente entre las infecciones nosocomiales MRSA (12.8%) y las asociadas al cuidado de la salud MSSA (8.8%).
Nuestro trabajo tiene la ventaja de un número de pacientes significativamente mayor, comparado con otros estudios de este tipo realizados en nuestro medio. Como limitaciones, por tratarse de un estudio retrospectivo tiene mayor riesgo de obtener información inexacta o incompleta para algunos episodios de bacteriemia. Así mismo, por ser realizado en un solo centro de alta complejidad y de referencia para la región, tiene limitaciones en la posibilidad de generalizar sus resultados. A pesar de que en Colombia la prevalencia de cepas resistentes es baja comparada con otros países, el manejo de la bacteriemia por Staphylococcus aureus es un problema mundial cuyo tratamiento es motivo de amplio debate. Por esta razón, consideramos que estudios posteriores con mayor tamaño de muestra deben evaluar la magnitud de los desenlaces clínicos discriminados de acuerdo con el patrón de resistencia y el lugar de adquisición, además de considerar la pertinencia y eficacia de las medidas usadas en su tratamiento. Adicionalmente, se deben realizar estudios que busquen determinar con mayor exactitud el riesgo y la presentación clínica de la bacteriemia por S. aureus de origen de la comunidad, ya que su sospecha temprana y manejo oportuno podrían disminuir sus complicaciones y mortalidad.
Conclusiones
En una cohorte de pacientes con bacteriemia por S. aureus en un hospital universitario de referencia en una ciudad capital, más del 80% de las mismas fueron de origen nosocomial o asociadas al cuidado de la salud; sin embargo, el aislamiento más frecuente fue el SAMS en todos los subgrupos. La mayor mortalidad se observó en los pacientes con bacteriemia adquirida en la comunidad y particularmente en aquellos infectados con SAMS.