Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Medica Colombiana
versão impressa ISSN 0120-2448
Acta Med Colomb vol.46 no.3 Bogotá jul./set. 2021 Epub 30-Mar-2022
https://doi.org/10.36104/amc.2021.2025
Presentación de Casos
Loxoscelismo en un paciente VIH. La complejidad detrás de la mordedura de una araña
b Especialista en Medicina Interna
c Especialista en Medicina Interna y Docencia Universitaria. Profesor Adjunto Departamento de Medicina interna. Universidad Industrial de Santander. Bucaramanga (Colombia)
El loxoscelismo es un evento toxinológico relativamente frecuente en los países tropicales. A pesar de que la mayoría son autolimitados, hay casos que pueden tener consecuencias locales o sistémicas graves. Lamentablemente el desconocimiento y la limitación en estrategias diagnósticas y terapéuticas aún representan desenlaces adversos en pacientes susceptibles. El objetivo de este trabajo es presentar un caso clínico de loxoscelismo grave en un paciente VIH, destacando la correlación entre la presentación clínica con las características toxinológicas del veneno.
Se trató de un paciente masculino de 48 años previamente sano y con hábitos sexuales de riesgo, quien presentó accidente arácnido grave, posterior a mordedura por araña de género Loxosceles; con posterior evolución tórpida, desarrollo de trombosis venosa profunda, aumento progresivo de las transaminasas hasta el rango de hepatitis y diagnóstico de novo de VIH confirmado con Elisa de cuarta generación. Es el primer reporte de caso de aracnidismo en contexto de infección por VIH que lleva a discutir sobre una posible respuesta diferencial de esta población al efecto del veneno de araña. (Acta Med Colomb 2021; 46. DOI:https://doi.org/10.36104/amc.2021.2025).
Palabras clave: aracnidismo; loxoscelismo; araña; biotoxina; dermatonecrosis; VIH
Loxoscelism is a relatively common toxinological event in tropical countries. Although most are self-limiting, some cases may have serious local or systemic consequences. Unfortunately, lack of knowledge and limited diagnostic and treatment strategies still result in adverse outcomes in susceptible patients. The aim of this paper is to present a clinical case of serious loxoscelism in an HIV patient, highlighting the correlation between the clinical presentation and the toxinological characteristics of the poison.
This was a previously healthy 48-year-old male patient with risky sexual habits, who experienced a serious arachnid accident after being bitten by a spider of the Loxosceles genus. He subsequently experienced a difficult clinical course, with deep vein thrombosis, progressively increasing transaminases to the range of hepatitis, and a de novo diagnosis of HIV, confirmed by fourth generation ELISA. This is the first case report of arachnidism in the context of HIV infection, which opens a discussion on the possible differential response of this population to the effects of spider poison. (Acta Med Colomb 2021; 46. DOI:https://doi.org/10.36104/amc.2021.2025).
Key words: arachnidism; loxoscelism; spider; biotoxin; dermatonecrosis; HIV
Introducción
Las arañas son artrópodos ampliamente distribuidos en el mundo. Más de 35 000 especies han sido descritas, no obstante, menos del 1% tienen interés clínico dada la letalidad de su veneno 1,2. En Colombia el aracnidismo se ubica en tercer lugar (11%), después del ofidismo (47.5%) y escorpionismo (25%), con reportes en la mayoría del territorio nacional, principalmente en los departamentos de Antioquia, Valle del Cauca, Cundinamarca y Santander 3,4. Los casos involucran cuatro géneros principales:
Theraphosa (tarántulas), Latrodectus (Viuda negra), Phoneutria (arañas bananeras) y Loxosceles (araña reclusa, violinista o parda) 5, siendo el loxoscelismo el accidente arácnido de mayor importancia epidemiológica dada su amplia distribución geográfica y potente veneno, capaz de generar necrosis cutánea intensa y en algunos casos compromiso orgánico severo.
El objetivo de este trabajo es destacar la correlación entre la clínica y las características toxinológicas del veneno arácnido, presentando el primer reporte de caso de aracnidismo en contexto de infección por VIH y una revisión actualizada de la literatura, con el fin de motivar al lector sobre esta enfermedad tropical olvidada que puede presentarse como un verdadero reto en la práctica clínica. Fue diligenciado consentimiento informado por el paciente la información descrita a continuación.
Reporte de caso
Un hombre de 48 años previamente sano, con hábitos sexuales de riesgo, ingresó al servicio de urgencias refiriendo que un animal recorrió su pierna derecha mientras dormía, con posterior dolor y prurito intenso en el dorso del pie ipsilateral, con posterior aparición de una mácula eritematosa. Describe que encontró en su cama una araña de patas delgadas, de aproximadamente 3.0 cm de diámetro de color pardo, sin otras especificaciones. En las siguientes horas presenta astenia, adinamia, cefalea y dolor osteomioarticular difuso, por lo cual consultó a puesto de salud siendo remitido 12 horas después del incidente a centro de referencia por sospecha de aracnidismo grave.
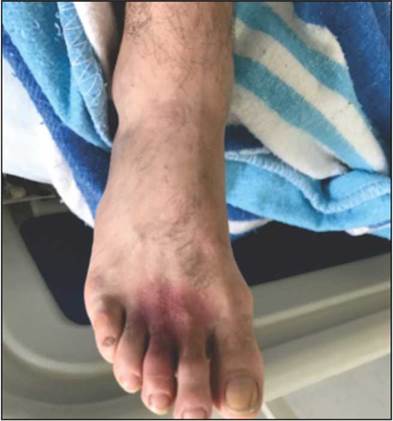
Al ingreso hemodinámicamente estable, con lesión macular eritematosa de aproximadamente 5 cm en dorso de la base del segundo y tercer dedo (Figura 1), con bordes pálidos y centro violáceo, escasas flictenas, descamación y signos de isquemia local (llenado capilar lento). El manejo inicial incluyó líquidos endovenosos, analgesia, antihistamínico y esteroide; no se administró suero antiarácnido debido al tiempo transcurrido desde el inóculo y que los paraclínicos de ingreso fueron normales (Tabla 1).
Tabla 1 Paraclínicos al ingreso (+12 horas), 48 horas y al quinto día de hospitalización.
| Examen | Ingreso | Día 2 | Día 5 |
|---|---|---|---|
| Hb Hto WBC Neutrófilos Plaquetas |
14.2 g/dL 42.6% 7200/µL 88.5% 178 000/ µL |
12.5 g/dL 37.1% 6600/ µL 62.1% 199 000/ µL |
3.4 g/dL 38.8% 6800/ µL 57.2% 206 000/ µL |
| BUN Creatinina |
12.5 mg/dL 0.75 mg/dL |
11.6 mg/dL 0.65 mg/dL |
12.1 mg/dL 0.81 mg/dL |
| Sodio Potasio |
138 mEq/L 4.52 mEq/L |
142 mEq/L 3.65 mEq/L |
- |
| PTT PT INR |
23.8 seg 10.7 seg 1.03 |
24.9 seg 10.8 seg 1.04 |
29.2 seg 12.1 seg 1.16 |
| Bilirrubina total Bilirrubina directa |
0.36 mg/dL 0.18 mg/dL |
0.24 mg/dL 0.14 mg/dL |
- |
| AST ALT |
22.9 U/L 25.3 U/L |
17.4 U/L 30.6 U/L |
221.6 U/L 410.0 U/L |
| Hb: hemoglobina; Hto: hematocrito; WBC: recuento de glóbulos blancos; BUN: nitrógeno ureico en sangre; PTT: tiempo parcial de tromboplastina; PT: tiempo de protrombina; INR: razón normalizada internacional; AST: aspartato aminotransferasa; ALT: alanin aminotransferasa. | |||
En las siguientes 48 horas se evidenció aumento del dolor local y progresión del edema hacia proximal. Se realizó ecografía doppler con hallazgo de trombosis venosa profunda del tercio proximal de la vena tibial posterior y tercio distal del tronco tibioperoneo. Setenta y dos horas después, presentó disfunción hepática con aumento de transaminasas hasta rango de hepatitis, sin alteraciones en ecografía abdominal o doppler hepatoportoespénico, virus hepatótropos negativos; sin embargo, se realizó diagnóstico de novo de VIH confirmado por Elisa de cuarta generación, con carga viral de 25 477 copias/ml y recuento de CD4 de 517 células, catalogándose como infección de VIH estadio A1.
En las siguientes semanas se inició terapia antirretroviral y anticoagulante con (rivaroxaban) dado el riesgo trombótico en pacientes VIH. También se evidenció resolución de la lesión cutánea y normalización de las enzimas hepáticas sin intervenciones adicionales a las descritas.
Discusión
Las arañas son animales cosmopolitas ampliamente distribuidas en Latinoamérica, siendo el loxoscelismo relativamente común en nuestro medio 6. La mayoría (excepto Atrax robustus) evitan el contacto con el hombre y poseen un aparato inoculador poco desarrollado para atacar a mamíferos de mayor tamaño. No obstante, sólo 30 microgramos de proteína contenidos en el veneno pueden producir desde síntomas locales leves, hasta la muerte en pacientes susceptibles (extremos de la vida o comórbidos) 7,8. A pesar de su importancia clínica y relativa frecuencia en la región, existe un subregistro importante debido a que no es objeto de vigilancia obligatoria, lo que dificulta la obtención de datos epidemiológicos confiables 9.
Se han descrito más de 100 especies del género loxosceles, las cuales tienen la capacidad de producir dermatonecrosis mediante la acción de la esfingomielinasa D (SMaseD), enzima inductora de metaloproteinasas endógenas 10, cuyo efecto citotóxico es capaz de producir hemólisis, lesión renal, alteración de coagulación y compromiso hepático. Si bien SMaseD, es el principal componente del veneno, otros elementos como histamina, hialuronidasa, fosfatasa alcalina y metaloproteasas, también tienen importante actividad biológica 11, lo cual ha impulsado un enfoque "venómico" en la búsqueda de terapias específicas 12,13.
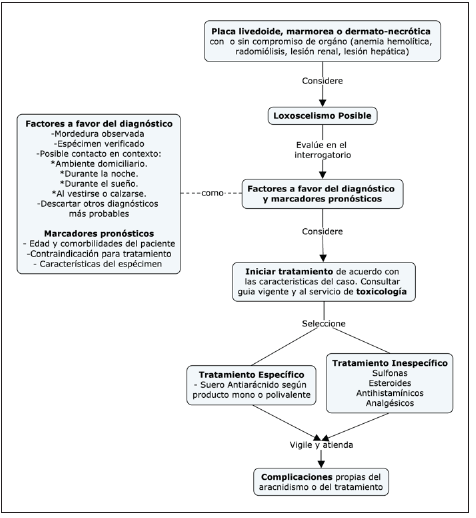
El diagnóstico de esta entidad es clínico y se basa en la historia relatada por el paciente. En la literatura anglosajona se recomienda capturar al arácnido para realizar tipificación morfológica, teniendo en cuenta su pequeño tamaño (14.5 cm de longitud), color café en forma de violín y sus 3 pares de ojos dispuestos en tres diadas (14). Sin embargo, se recomienda evitar la reexposición a animales ponzoñosos con el fin de prevenir nuevos eventos de inoculación, de tal forma que una historia clínica cuidadosa es la base para identificar casos presuntivos y realizar un diagnóstico adecuado (Figura 2). En el caso de loxoscelismo, la mordedura suele ocurrir dentro del domicilio, durante la noche, al vestirse o mientras duerme, seguido por dolor lancinante de incremento progresivo 8,15,16. Hay que advertir que algunos casos no presentan síntomas locales inmediatos, por lo que la mordedura puede pasar desapercibida y el diagnóstico se limita a la identificación de lesiones cutáneas y una evolución clínica compatible 17.
El loxoscelismo se clasifica de acuerdo a sus manifestaciones como dermatonecrótico (90%) cuando se limitan a la piel, presentando prurito, dolor, eritema local, flictenas y aparición de una "placa livedoide" caracterizada por su centro violáceo isquémico rodeado por un halo pálido de vasoconstricción (15). Por otra parte, la manifestación cutáneo-visceral, incluye compromiso orgánico de instauración rápida (menor a 24 h); advirtiendo que 50% de las manifestaciones dermatonecróticas se asocian a fiebre, cefalea, vómitos, artralgias y mialgias sin que esto implique compromiso cutáneo-visceral (20). El último requiere evidencia paraclínica con la alteración en los niveles de hemoglobina, lactato deshidrogenasa y bilirrubinas secundario a hemólisis intravascular, alteraciones en la coagulación por disfunción de la proteína C, o alteración en creatincinasa, azoados y transaminasas por rabdomiólisis, lesión renal y hepática respectivamente 18,19.
En este caso particular se evidenció una presentación clínica atípica, dado la instauración de manifestación cutáneo-visceral tardía, probablemente relacionado a la coexistencia de infección por VIH como factor proinflamatorio y procoagulante por excesiva producción de citoquinas como TNF-a, IL-1 e IL-6, que activan el sistema de coagulación y disminuyen síntesis de proteínas del sistema fibrinolítico 25,26, lo cual favorecería (sinergia) las alteraciones en la hemostasia atribuibles al loxoscelismo 27,28. Esto pone en manifiesto una posible respuesta diferencial al veneno arácnido en esta población particular, hecho que se sustenta en estudios previos sobre el contacto de artrópodos con pacientes infectados por retrovirus 29.
Con respecto al tratamiento del aracnidismo existe controversia actual, debido a la carencia de ensayos clínicos que evalúen las intervenciones propuestas en la literatura Tabla 2). De momento, prevalece la recomendación de expertos y las intervenciones basadas en estudios observacionales retrospectivos. Como medida general se recomienda observación mínima de 24 horas para realizar lavado con solución estéril, inmovilización en posición funcional y profilaxis antitetánica, además considerar analgesia y antihistamínicos según necesidad 7, prednisona (40-60 mg/día), dapsona (100 mg/día con fines antiinflamatorios) y suero antiarácnido 21. Llama la atención que la guía nacional para el manejo de urgencias toxicológicas (2017) no existe un periodo ventana para el uso del suero antiarácnido; al respecto, en la literatura no se ha evidenciado beneficio al administrarlo tras 12 horas del inóculo, además señala que puede provocar reacciones inmunes inmediatas y/o tardías importantes, lo que limita su uso 22-24. En nuestro caso no se administró suero antiarácnido debido a que no estaba disponible y la consulta fue fuera de ventana.
Tabla 2 Opciones terapéuticas reportadas en la literatura.
El aracnidismo en Latinoamérica continúa siendo un evento subestimado actualmente, aun cuando se ha descrito su importancia clínica y relativa frecuencia. Los campos de investigación a futuro deben incluir pruebas diagnósticas específicas que permitan detección del veneno para confirmar casos presuntivos, además de intervenciones terapéuticas alternativas al suero antiarácnido actual, en busca de disminuir respuestas adversas y desarrollar terapias dirigidas. Se propone la producción de anticuerpos monoclonales o síntesis de inhibidores de moléculas diana tales como el complemento y adamalisina (metaloproteinasa activada por SMaseD). Además, es necesario el desarrollo de ensayos clínicos que evalúen la seguridad y efectividad de las opciones terapéuticas disponibles; incluso se plantea el uso de quelantes como las tetraciclinas, heparina y ácido etilendiaminotetraacético (EDTA), que podrían ser útiles para evitar la extensión de la dermatonecrosis al actuar contra las metaloproteinasas inoculadas. Hasta entonces, las medidas preventivas para evitar el contacto y la adherencia a las recomendaciones de expertos en las guías disponibles, parece lo más prudente.
Referencias
1. Hauke TJ, Herzig V. Dangerous arachnids-Fake news or reality? Toxicon [Internet]. 2017;138:173-83. Available from: http://dx.doi.org/10.1016/j.toxicon.2017.08.024 [ Links ]
2. Gómez C JP. Accidente por animales ponzoñosos y venenosos. Su impacto en la salud ocupacional en Colombia. Fac Nac Salud Pública [Internet]. 2012 [cited 2019 Nov 13];29(4). Available from: Available from: https://www.redalyc.org/pdf/120/12021522008.pdf [ Links ]
3. García J. AF, Bedoya H. RG, Montoya G. MA, Rodríguez CA, Zuluaga AF. Caracterización de los casos de accidente ofídico atendidos por el Centro de Información y Estudio de Medicamentos y Tóxicos (CIEMTO) de Medellín, Colombia durante 2016. Rev la Univ Ind Santander Salud [Internet]. 2017 [cited 2019 Nov 11];49(3):450-7. Available from: Available from: http://dx.doi.org/10.18273/revsal.v49n3-2017003 [ Links ]
4. Ariadna Lorena Rodríguez Vargas. Comportamiento general de los accidentes provocados por animales venenosos en Colombia entre 2006 y 2010, atendidos en el Centro de Investigación, Gestión e Información Toxicológica de la Universidad Nacional de Colombia [Internet]. Bogotá; 2012 [cited 2019 Nov 13]. Available from: Available from: http://www.bdigital.unal.edu.co/8874/1/598907.2012.pdf [ Links ]
5. Violet L L, Montes V D, Cardona A J. Accidente ponzoñoso por arañas del género loxosceles spp en bovinos del departamento de Córdoba. Rev Colomb Cienc Anim - RECIA [Internet]. 2017 [cited 2019 Nov 13];9(S):55. Available from: Available from: https://revistas.unisucre.edu.co/index.php/recia/article/view/521/pdf [ Links ]
6. Castillo D, Dueñas F, Santafé C. Catálogo de artrópodos ponzoñosos para instituciones hospitalarias (cuenca del río Bahamón, Cundinamarca, Colombia) [Internet]. 1st ed. Bogotá: Universidad del Bosque; 2014 [cited 2019 Nov 13]. 26 p. Available from: Available from: https://www.unbosque.edu.co/nuestro-bosque/catalogocatalogo-de-artropodos-ponzonosos-para-instituciones-hospitalarias-cuenca/ [ Links ]
7. Swanson DL, Vetter RS. Medical progress: Bites of brown recluse spiders and suspected necrotic arachnidism [Internet]. Vol. 352, New England Journal of Medicine. 2005. p. 700-7. Available from: www.nejm.org [ Links ]
8. Tambourgi D V., Gonçalves-de-Andrade RM, van den Berg CW. Loxoscelism: From basic research to the proposal of new therapies. Toxicon [Internet]. 2010;56(7):1113-9. Available from: http://dx.doi.org/10.1016/j.toxicon.2010.01.021 [ Links ]
9. Correa L, Berdejo JP. Guías para el manejo de urgencias toxicológicas ministerio de la protección social [internet]. 1st ed. Luis fernando correa, m.d. juan pablo berdejo, m.d. víctor hugo mora, c.s. diana marcela sánchez alarcón, p.s. myriam gutiérrez de salazar m., editor. Bogotá, D. C., Colombia: Imprenta Nacional de Colombia; 2008. Available from: https://www.minsalud.gov.co/documentos y publicaciones/guía de manejo de urgencias toxicológicaas.pdf [ Links ]
10. Gremski LH, Trevisan-Silva D, Ferrer VP, Matsubara FH, Meissner GO, Wille ACM, et al. Recent advances in the understanding of brown spider venoms: From the biology of spiders to the molecular mechanisms of toxins. Toxicon [Internet]. 2014;83:91-120. Available from: http://dx.doi.org/10.1016/j.toxicon.2014.02.023 [ Links ]
11. Manríquez M JJ, Silva V S. Loxoscelismo cutáneo y cutáneo-visceral: Revisión sistemática. Rev Chil infectología [Internet]. 2009;26(5):420-32. Available from: http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0716-10182009000600004&lng=en&nrm=iso&tlng=en [ Links ]
12. Laustsen AH, Solà M, Jappe EC, Oscoz S, Lauridsen LP, Engmark M. Biotechnological trends in spider and scorpion antivenom development. Toxins (Basel). 2016;8(8). [ Links ]
13. Fernandes-Pedrosa M de F, Junqueira-de-Azevedo I de LM, Gonçalves-de-Andrade RM, Kobashi LS, Almeida DD, Ho PL, et al. Transcriptome analysis of Loxosceles laeta (Araneae, Sicariidae) spider venomous gland using expressed sequence tags. BMC Genomics [Internet]. 2008 [cited 2019 Nov 9];9. Available from: Available from: http://www.biomedcentral.com/1471-2164/9/279 [ Links ]
14. Mauricio Canals Lambarri. Aproximación al nicho e interacciones de la araña del rincón Loxosceles laeta (Nicolet, 1849) y de la araña de patas atigradas Scytodes globula (Nicolet, 1849) [Internet]. Concepción, Chile; 2015 [cited 2019 Nov 13]. Available from: Available from: http://repositorio.udec.cl/bitstream/handle/11594/1903/TESIS_Aproximacion_al_nicho_e_interacciones_de_la_araña_del_rincon.pdf?sequence=1&isAllowed=y [ Links ]
15. Mendoza A, Cabezas C. Loxoscelismo: Evaluación clínica, tratamiento y prevención. Rev Peru Enfermedades Infecc y Trop. 2006 Jan 1;5:2-8. [ Links ]
16. Paula de la Barra, Verónica Vial, Yenis Labraña AMÁ y HS. Loxoscelismo cutáneo predominantemente edematoso, a propósito de un caso. Rev Chil Infectol [Internet]. 2015 [cited 2019 Nov 13];32(4):467-71. Available from: Available from: www.sochinf.cl [ Links ]
17. Moranchel-García L, Pineda-Galindo LF, Casarrubias-Ramírez M, Mendoza-Álvarez SA, Olvera-Acevedo A, Alfaro-Mejía JA, et al. Evolución clínica de pacientes con loxoscelismo sistémico y dermonecrótico en un hospital de tercer nivel. Med Interna Mex [Internet]. 2017 [cited 2019 Nov 13];33(1):18-27. Available from: Available from: http://www.scielo.org.mx/pdf/mim/v33n1/0186-4866-mim-33-01-00018.pdf [ Links ]
18. Martin MM, Luis J, Poveda Á, Eunice M, Martínez N, Moreno Martínez Y. Picadura de araña marrón (Loxosceles laeta). 2018 [cited 2019 Nov 13]; Available from: Available from: http://scielo.sld.cu/pdf/rric/v97n2/1028-9933-ric-97-02-369.pdf [ Links ]
19. Pichardo-Rodriguez R, Saavedra-Velasco M, Grandez-Urbina JA. Una aproximación fisiopatológica del loxoscelismo hepático [Internet]. Vol. 37, Revista de gastroenterologia del Peru: organo oficial de la Sociedad de Gastroenterologia del Peru. 2017 [cited 2019 Nov 9]. p. 287-8. Available from: Available from: http://www.scielo.org.pe/pdf/rgp/v37n3/a16v37n3.pdf [ Links ]
20. Isbister GK, Fan HW. Spider bite. Lancet. 2011;378(9808):2039-47. [ Links ]
21. Martinez A, Cruz A, Agudelo A, Restrepo A, Estrada A, Ramirez A, et al. Guía para el Manejo de Emergencias Toxicológicas. Guía para el Manejo de Emergencias Toxicológicas. 2017. 465-496 p. [ Links ]
22. Maguiña Vargas C, Figueroa Vásquez V, Pulcha Ugarte R. Actualización sobre manejo de araneismo en Perú. Rev Medica Hered [Internet]. 2017 [cited 2019 Nov 13];28(3):200. Available from: Available from: http://www.scielo.org.pe/pdf/rmh/v28n3/a11v28n3.pdf [ Links ]
23. Rahmani F, Mahdi S, Khojasteh B, Bakhtavar HE, Rahmani F, Nia KS, et al. Poisonous Spiders: Bites, Symptoms, and Treatment; an Educational Review. Emergency [Internet]. 2014;2(2):54-8. Available from: www.jemerg.com [ Links ]
24. Haddad V, Cardoso JLC, Lupi O, Tyring SK. Tropical dermatology: Venomous arthropods and human skin: Part II. Diplopoda, Chilopoda, and Arachnida. J Am Acad Dermatol. 2012;67(3):1-9. [ Links ]
25. Franco Moreno AI, De Ancos Aracil CL, Cabello Clotet N, San Martín López JV. Infección por el virus de la inmunodeficiencia humana y enfermedad tromboembólica venosa: descripción de una serie de casos. Vol. 30, Enfermedades Infecciosas y Microbiologia Clinica. 2012. p. 216-7. [ Links ]
26. S PW, Oliva S, Chamorro J, Aranda F, Santoro J, Corti M, et al. Trombosis Venosa Profunda en pacientes infectados por el Virus de la Inmunodeficiencia Humana. Rol de la Trombofilia hereditaria y adquirida y de los factores de riesgo tradicionales. HEMATOLOGÍA [Internet]. 2014 [cited 2019 Nov 13];18(2):11-9. Available from: Available from: http://www.sah.org.ar/revista/numeros/02 - Tro Venosa Profunda pacientes inf.pdf [ Links ]
27. Van den berg CW, Gonçalves-de-andrade RM, Magnoli FC. Loxosceles spider venom induces the release of thrombomodulin and endothelial protein c receptor: implications for the pathogenesis of intravascular coagulation as observed in loxoscelism. J thromb haemost [internet]. 2007 may 1 [cited 2019 nov 9];5(5):989-95. Available from: Available from: http://doi.wiley.com/10.1111/j.1538-7836.2007.02382.x [ Links ]
28. Bascur L, Ismael Y, Pilar B. Short communications effects of loxosceles laeta spider venom on hemorrhage and inflammation may help in choosing more effective treatment. In the / seta venom in rabbits. Toxico. 1982;20:795-6. [ Links ]
29. Ajithkumar K, George S, Babu PG. Abnormal insect bite reactions: a manifestation of immunosuppression of HIV infection? Indian J Dermatol Venereol Leprol [Internet]. 2001 [cited 2019 Nov 13];67(2):72-4. Available from: Available from: http://www.ncbi.nlm.nih.gov/pubmed/17664712 . [ Links ]
Recibido: 24 de Septiembre de 2020; Aprobado: 09 de Febrero de 2021











 texto em
texto em