Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Medica Colombiana
Print version ISSN 0120-2448
Acta Med Colomb vol.46 no.4 Bogotá Oct./Dec. 2021 Epub Apr 24, 2022
https://doi.org/10.36104/amc.2021.2091
Trabajos originales
Eficacia de la terapia dual para la erradicación de H. pylori en una población colombiana
a Internista, Fellow de Gastroenterología; Universidad Nacional de Colombia, Hospital Universitario Nacional de Colombia. Bogotá, D.C. (Colombia).
b Residente de Medicina Interna; Universidad Nacional de Colombia, Hospital Universitario Nacional de Colombia. Bogotá, D.C. (Colombia).
c Profesor Titular de Medicina, Unidad de Gastroenterología. Universidad Nacional de Colombia, Hospital Universitario Nacional de Colombia. Bogotá, D.C. (Colombia).
Antecedentes:
Helicobacter pylori (H. pylori) afecta a 50% de la humanidad. Los tratamientos usuales han disminuido su eficacia por aumento de la resistencia a los antibióticos, excepto: amoxicilina, tetraciclina, furazolidona y bismuto. Recientemente hay un nuevo interés en la terapia dual con altas dosis de inhibidores de bomba de protones (IBP) y amoxicilina como terapia inicial y como rescate. En nuestro medio no hay estudios al respecto.
Objetivo:
determinar la eficacia de la terapia dual con altas dosis de IBP y amoxicilina para erradicar H. pylori.
Material y métodos:
estudio cuasiexperimental realizado entre diciembre de 2019 y julio de 2020 en mayores de 18 años, con H.pylori identificado histológicamente. Todos recibieron esomeprazol 40 mg media hora antes de desayuno, almuerzo y cena mas amoxicilina 1 gramo oral cada 8 horas por 14 días. La erradicación se determinó con antígenos fecales (OnSiteTM H. pylori Biotech Inc) después de cuatro semanas del tratamiento.
Resultados:
se incluyeron 108 pacientes, con edad promedio de 67 años, 70% mujeres. La erradicación por protocolo (PP) e intención de tratar (ITT) fue de 86% (IC95% 79.4-92.5%) para ambos. En los pacientes con tratamiento previo (26%) la eficacia fue de 85.7% (IC95% 71.8-99.5%). Los eventos adversos fueron leves en 31%, especialmente náuseas (16%) y distensión abdominal (14%). En ninguno se suspendió el tratamiento.
Conclusión:
la terapia dual es eficaz, fácil de administrar y con pocos efectos adversos. Sería una buena opción en nuestro medio como terapia inicial y como rescate. Se requieren estudios más grandes para verificar nuestros resultados. (Acta Med Colomb 2021; 46. DOI:https://doi.org/10.36104/amc.2021.2091).
Palabras clave: Helicobacter pylori; terapia dual; inhibidor de bomba de protones; amoxicilina
Background:
Helicobacter pylori (H. pylori) affects 50% of the human population. The efficacy of the usual treatments has decreased due to increased antibiotic resistance, except for that of amoxicillin, tetracycline, furazolidone and bismuth. Recently, there has been a new interest in dual therapy with high-dose proton pump inhibitors (PPI) and amoxicillin as initial and rescue treatment. There are no studies on this topic in our setting.
Objective:
to determine the efficacy of dual therapy with high-dose IPP and amoxicillin for eradicating H. pylori.
Materials and methods:
this was a quasi-experimental study carried out from December 2019 to July 2020 in people over the age of 18 with histologically confirmed H. pylori. All received 40 mg of esomeprazole half an hour before breakfast, lunch and dinner, plus 1 gram of oral amoxicillin every eight hours for 14 days. Eradication was determined by fecal antigens (OnSiteTM H. pylori Biotech Inc.) after four weeks of treatment.
Results:
108 patients with an average age of 67 years were included, 70% of whom were women. Eradication per protocol (PP) and intention to treat (ITT) was 86% (95%CI 79.4-92.5%) for both. In previously treated patients (26%) the efficacy was 85.7% (95%CI 71.8-99.5%). Adverse events were mild in 31%, especially nausea (16%) and abdominal distension (14%). Treatment was not suspended in any patient.
Conclusion:
Dual therapy is effective, easy to administer, and has few adverse effects. It would be a good option in our setting as initial or rescue therapy. Larger studies are needed to confirm our results. (Acta Med Colomb 2021; 46. DOI:https://doi.org/10.36104/amc.2021.2091).
Keywords: Helicobacter pylori; dual therapy; proton pump inhibitor; amoxicillin
Introducción
En el mundo más de 50% de la población está infectada por Helicobacter pylori (H. pylori), siendo Latinoamérica la segunda región con mayor prevalencia después de África 1,2.
En todos los infectados se produce gastritis crónica, la cual puede llevar al desarrollo de úlceras pépticas, gastritis atrófica, adenocarcinoma gástrico y linfoma gástrico tipo MALT. La infección por H. pylori también puede producir con menor frecuencia anemia por déficit de vitamina B12 y trombocitopenia inmune 3-4. La erradicación de H. pylori cura la gastritis y puede alterar la progresión a largo plazo de estas complicaciones, por lo cual todos los infectados deben ser tratados 5.
Se considera que un tratamiento anti H. pylori es recomendable cuando tiene eficacia de 90% por intención de tratar (ITT) y 95% por protocolo (PP) 6. El fracaso terapéutico se debe principalmente a la alta tasa de resistencia a los antibióticos más frecuentemente utilizados 3. Otros factores que repercuten en el fracaso terapéutico son el incumplimiento del tratamiento, la insuficiente inhibición de la secreción de ácido y que H. pylori tiene varios nichos de crecimiento, lo cual exige una terapia prolongada y con antibióticos que puedan llegar a tales lugares 7,8. En América Latina, se han documentado altas tasas de resistencia a claritromicina, metronidazol y levofloxacina, por lo cual la recomendación actual es el uso de terapias cuádruples (inhibidor de bomba de protones más tres antibióticos) que incluya o no bismuto, durante 14 días 7,9-11. En Colombia estudios han determinado que la tasa de resistencia a claritromicina es mayor a 20%, a levofloxacina 27.3% y a metronidazol mayor a 80%, razón por la cual en nuestro país se recomienda adicionar subsalicilato de bismuto dos a tres veces al día, a las terapias triples de 14 días que incluyan esos antibióticos 7,12-14.
La profunda inhibición de ácido favorece una mejor actividad de los antibióticos sensibles al ácido como amoxicilina y una mayor replicación de H. pylori, haciéndolo más vulnerable a los antibióticos 15-17.
H.pylori rara vez hace resistencia a la amoxicilina (menos de 5%); sin embargo, es un antibiótico muy inestable al pH ácido y por lo tanto, su eficacia se puede mantener siempre y cuando se logre una profunda inhibición de ácido logrando un pH gástrico mayor o igual a seis y que sus niveles terapéuticos se mantengan en sangre durante 24 horas, lo cual exige administrarlo tres o cuatro veces al día 18,19. En 1995, Bayerdörfer y col., demostraron que el tratamiento con altas dosis de amoxicilina (750 mg tres veces al día) y omeprazol (40 mg tres veces al día) tenía una eficacia superior a 90%, en pacientes con ulcera péptica o linfoma MALT gástrico 20,21. Sin embargo, este esquema perdió importancia con el advenimiento de terapias triples con amoxicilina (dos veces al día) y claritromicina (dos veces al día) o metronidazol, pero con la aparición de altas tasas de resistencia a los antimicrobianos, ha resurgido el interés en la terapia dual con amoxicilina e IBP 22.
Recientemente, se ha encontrado que esta terapia tiene eficacia de al menos 90%, independientemente de que se le adicione o no sales de bismuto 18,23-25. Lou Yu, et al. comparó la tasa de erradicación de terapia dual (esomeprazol 40 mg dos veces al día más amoxicilina un gramo tres veces al día) con o sin bismuto, con tasas de erradicación por intención de tratar de 88.8 - 92.5% en un centro médico de China. De forma similar, Yang J et al. encontró tasas de erradicación similar entre terapia dual (esomeprazol 20 mg cuatro veces al día más amoxicilina 750 mg cuatro veces al día) y terapia cuádruple con bismuto, siendo de 91.1- 91.2% respectivamente en el análisis por intención a tratar (ITT) 15,24,26.
La capacidad de los IBPs para bloquear la producción de ácido depende de su metabolismo por la enzima CYP2C19 a nivel hepático 27-29. De acuerdo con la velocidad de inactivación o metabolismo de los IBPs existen cuatro diferentes fenotipos: metabolizadores ultrarrápidos, rápidos o extensos, intermedios y lentos 27,30. En un reciente ensayo clínico desarrollado en Colombia, se estableció que 62.4% de los sujetos son metabolizadores rápidos y 21.1% ultrarrápidos 30. Este hallazgo implica que para erradicar H. pylori en nuestro medio, se necesitarían dosis más altas de los IBPs dependientes de CYP (lansoprazol, omeprazol y pantoprazol) o utilizar IBPs no dependientes de CYP (Esomeprazol o rabeprazol) 27-29 o IBPs de tercera generación bloqueadores de potasio en la ATP asa gástrica, como el vonoprazan, disponible sólo en Japón 16,31.
En 2015, un estudio desarrollado en Taiwán, evaluó la combinación de rabeprazol (20 mg dos veces al día) más amoxicilina (750 mg cuatro veces al día), encontrando tasas de curación en pacientes sin tratamiento previo del 95.3% y 89.3% en pacientes con tratamiento previo 25. Por el contrario, en China otro estudio utilizando este último régimen con rabeprazol no logró la tasa mínima de eficacia requerida 19.
Mucho más reciente, se realizó el primer ensayo clínico aleatorizado comparando terapia dual con vonoprazan 20 mg dos veces al día y amoxicilina 750 mg dos veces al día por siete días con y sin claritromicina, encontrando tasas de erradicación en análisis por intención de tratar 87.1 y 90.2%, diferencia que no fue estadísticamente significativa 31.
Este estudio busca evaluar la eficacia de la terapia dual con dosis altas de esomeprazol y amoxicilina como tratamiento de primera línea o de rescate para erradicar H. pylori en la población colombiana así como describir los efectos adversos de este esquema terapéutico.
Material y métodos
Diseño y población a estudio
Estudio prospectivo cuasiexperimental, se realizó en el Centro de Gastroenterología y Endoscopia Digestiva en Bogotá Colombia, adscrito al posgrado de gastroenterología de la Universidad Nacional de Colombia entre diciembre de 2019 y julio de 2020.
Criterios de inclusión
Se incluyeron pacientes mayores de 18 años, remitidos a endoscopia digestiva alta (EDA) con diagnóstico dispepsia, enfermedad por reflujo gastroesofágico o anemia y que tuvieran H. pylori, identificado por histología, independientemente de que hubieran recibido tratamientos previos de erradicación. Todos los pacientes firmaron el consentimiento informado
Criterios de exclusión
Pacientes con antecedente de Linfoma gástrico tipo MALT o cáncer gástrico, alergia a la penicilina o a los inhibidores de bomba de protones, cirugías resectivas gastrointestinales superiores.
Intervención
A todos los pacientes se les hizo EDA realizada en la forma usual, con ayuno mínimo de ocho horas. A todos se les hizo el procedimiento con sedación (propofol y remifentanil), administrada por un anestesiólogo. Durante el procedimiento se tomaron biopsias del cuerpo y del antro de acuerdo con el protocolo de Sídney 32. Brevemente, se tomaron dos biopsias del cuerpo, dos biopsias del antro y una biopsia de la incisura, las cuales se enviaron en frascos separados adecuadamente marcados y además de la determinación de la presencia de H. pylori, también se estratificó la severidad de la gastritis crónica mediante el sistema OLGA (Operative Link on Gastritis Assessment) 33. Después de tomadas las biopsias se fijaron en formol a 10% y fueron enviadas a patología. En esa patología se siguió el proceso estándar de embeberlas en parafina y de cada muestra se obtuvieron múltiples secciones histológicas de cinco micras, que fueron coloreadas con hematoxilina y eosina (HE). Si H. pylori no era identificado, se investigó adicionalmente con coloración de Giemsa 34. Las variables demográficas, comorbilidades, hallazgos endoscópicos y la eficacia del tratamiento, se consignaron en un instrumento de recolección de datos, diseñado para la presente investigación.
Tratamiento
Todos los pacientes recibieron esomeprazol 40 mg media hora antes de cada comida y amoxicilina 1 gramo cada ocho horas (7 a.m., 3 p.m. y 11 p.m.) durante 14 días. Los pacientes fueron evaluados en cuatro ocasiones durante la investigación. Al inicio del tratamiento en una consulta presencial. En la primera valoración se registraron los datos generales, indicación de endoscopia, antecedentes médicos y se prescribió la terapia dual, explicando de manera clara y comprensible, la importancia del tratamiento y la forma correcta de seguir la posología. La segunda valoración, fue una consulta presencial a los 15 días de finalizar el tratamiento. En esta consulta se determinó la aparición de efectos adversos y si hubo o no suspensión del tratamiento, como también si se omitieron o no dosis de este. En esta consulta, se les dio la orden de solicitud para que se realizaran los antígenos fecales a las cuatro semanas o más de terminar el tratamiento, para determinar la eficacia de este. Durante la investigación, los pacientes estaban instruidos para que llamaran de manera inmediata a dos de los investigadores (EJB y CR) si aparecía cualquier efecto adverso e igualmente si decidieran suspender el tratamiento. Los efectos adversos se evaluaron con un cuestionario aplicado al final de la terapia y se clasificaron en leves (transitorios y bien tolerados), moderados (malestar que interfiere parcialmente con las actividades diarias) y severos (causan interferencia significativa con las actividades diarias).
La última valoración a las seis semanas después del tratamiento se revisaron los resultados de los antígenos fecales para determinar curación o falla terapéutica.
Verificación de la erradicación
La erradicación de H. pylori, se determinó con antígenos fecales después de cuatro semanas de terminar el tratamiento. La medición de antígenos fecales se hizo con la prueba rápida OnSiteTM H. pylori de Biotech Inc, que es un inmunoensayo cromatográfico de flujo lateral que permite la detección cualitativa del antígeno H. pylori mediante el uso de anticuerpos específicos. Las muestras aprobadas como matrices para uso de la prueba con heces sólidas, semisólidas y líquidas, que serán transportadas en envases herméticos y almacenadas a una temperatura de 2-8°C hasta el momento de realizar la prueba. La muestra debe analizarse lo más pronto posible, pero puede haber un periodo de espera de hasta 72 horas. La prueba se procesó en un laboratorio de bacteriología donde se encuentra estandarizado el procedimiento. Los resultados se interpretarán como negativos si solo aparece la línea C, positivo si además aparece también la línea T, y como inválidos si no aparece la línea azul, en cuyo caso se debe repetir la prueba con la misma muestra para eliminar el potencial error 35. Para la realización de los antígenos fecales, los pacientes debían suspender los IBPs por lo menos 15 días antes de realizar la prueba y los antibióticos por lo menos un mes antes, para evitar falsos negativos 7.
Cálculo del tamaño de la muestra
El tamaño de la muestra se calculó utilizando el programa Epidat versión 4.1, con la ruta módulos/muestreo/cálculo del tamaño de la muestra/contraste de hipótesis/comparación de proporciones, grupos emparejados; los parámetros incluidos fueron proporción esperada en la población 1 (erradicación de infección por H. pylori en la terapia estándar del 73%) 15,16, proporción esperada en la población 2, eficacia del 90% (eficacia de la terapia dual) 12, nivel de confianza 95% y potencia del 80%, para lo cual se requiere un mínimo de 84 pares. Las diferentes variables del estudio se muestran en la Tabla 1.
Tabla 1 Variables del estudio y definición de variables.
| Variable | Naturaleza | Escala | Categoría |
|---|---|---|---|
| Edad | Cuantitativa | Razón Discreta | Años cumplidos |
| Sexo | Cualitativa | Nominal Dicotómica | Masculino Femenino |
| Procedencia | Cualitativa | Nominal Dicotómica | Rural Urbana |
| Antecedentes | Cualitativa | Nominal Policotómica | Antecedentes médicos |
| Indicación de la toma de endoscopia | Cualitativa | Nominal Policotómica | Indicación especifica (Ej; dispepsia) |
| Infección por H. pylori | Cualitativa | Nominal Dicotómica | Presente Ausente |
| Clasificación histológica OLGA | Cualitativa | Nominal Policotómica | I II III IV |
| Tratamiento previo para H. pylori | Cualitativa | Nominal Dicotómica | Si No |
| Completó tratamiento con terapia dual | Cualitativa | Nominal Dicotómica | Completó No completó |
| Razón por la cual suspende el tratamiento | Cualitativa | Nominal Policotómica | Razón específica de la suspensión |
| Efectos secundarios | Cualitativa | Nominal Policotómica | Efecto secundario especifico (dolor abdominal, vómito, rash) |
| Antígenos fecales cuatro semanas posterior al tratamiento dual | Cualitativa | Nominal Dicotómica | Positivos Negativos |
| Curación | Cualitativa | Nominal Dicotómica | Si No |
| Falla terapéutica | Cualitativa | Nominal Dicotómica | Si No |
Análisis estadístico
La base de datos se registró en Excel versión 2013. El análisis univariado se realizó por medio de un estadístico descriptivo determinando frecuencias absolutas y frecuencias relativas en las variables cualitativas y en el caso de las variables cuantitativas se realizan medidas de tendencia central, medidas de dispersión o medidas de posición (utilizando media y desviación estándar cuando la variable numérica sigue la distribución normal o mediana, rango intercuartil y percentiles en el caso contrario). Las tasas de curación son expresadas como una proporción (porcentaje) con sus intervalos de confianza. Se realizaron análisis descriptivos de la frecuencia de antígenos fecales positivos y negativos según efectos adversos, consumo de tabaco y alcohol. Además, se realizó un análisis de diferencia de proporciones para evaluar las diferencias en el éxito de la terapia dual en el grupo de pacientes que consumen tabaco, alcohol y aquellos que presentaron efectos adversos. Para evaluar dicha diferencia de proporciones se llevó a cabo en sçStata 14 la prueba Chi2. Se definió la significancia menor o igual a 0.05.
Objetivos
El objetivo del presente estudio fue determinar la tasa de erradicación de H. pylori con la terapia dual (altas dosis de IBP y amoxicilina) y valorar los efectos adversos de la misma.
Consideraciones éticas
El protocolo de investigación y el consentimiento informado fueron aprobados por el Comité de Ética e investigación de la Facultad de Medicina de la Universidad Nacional de Colombia.
Resultados
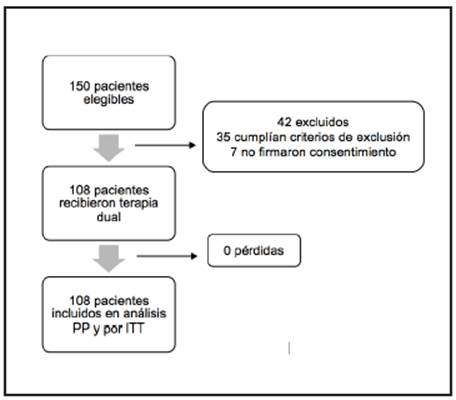
En total 108 pacientes cumplieron los criterios de inclusión, con edad de 67 años, 70% eran mujeres. No hubo pérdidas durante el seguimiento (Figura 1). El 49% presentaba sobrepeso (definición por índice de masa corporal) y 16% obesidad grado I. Los hallazgos endoscópicos fueron los siguientes: gastritis crónica 100% esofagitis erosiva 33%, duodenitis erosiva 14%, úlcera gástrica 4%. Los resultados de OLGA fueron los siguientes: OLGA 0/IV 88%, OLGA I/IV 10% y OLGA II/IV 2%. Ningún paciente tuvo OLGA IV (Tabla 2).
Tabla 2. Características demográficas y clínicas de la población.
| Variable | Población (n=108) |
|---|---|
| Edad n (Intervalo) | 67 (30-85) |
| Género | |
| Mujeres n (%) | 76 (70) |
| Hombres n (%) | 32 (30) |
| IMC n(%) | |
| Normal | 38 (35.2) |
| Sobrepeso | 53 (49.1) |
| Obesidad grado 1 | 17 (15.7) |
| Alcohol n (%) | 3 (2.78) |
| Tabaquismo n (%) | 4 (3.7) |
| Antígenos fecales | |
| Negativo n (%) | 93 (86) |
| Positivo n (%) | 15 (14) |
| Tratamiento previo n(%) | |
| Si | 28 (26) |
| No | 61 (56) |
| No recuerda | 19 (18) |
| Clasificación OLGA n(%) | |
| OLGA 0 | 95 (87.9) |
| OLGA 1 | 10 (10.8) |
| OLGA >1 | 3 (2.8) |
La tasa de erradicación de H. pylori fue 86% (93/108; IC95% 79.4-92.5%) tanto por ITT como PP (Tabla 2). El 14% de los pacientes tuvo fracaso terapéutico, de los cuales 60% tenía sobrepeso y 14% obesidad. El 56% de los pacientes no había recibido tratamiento(s) previo(s) y 26% (28/108) había recibido algún esquema de tratamiento. En los pacientes con tratamiento previo H. pylori se erradicó en 85.7% (24/28; IC95% 71.8 - 99.5%) (Tabla 3). Los eventos adversos se presentaron en 31% de los pacientes, siendo las más frecuentes náuseas (16%) y distensión abdominal (14%). No hubo eventos adversos graves o que obligaran a suspender el tratamiento (Tablas 2 y 4).
Tabla 3 Tasa de erradicación.
| Total (n=108) | Tratamiento previo | |
|---|---|---|
| ITT y PP | 86% (93/108) | 85.7% (24/28) |
| IC 95% | 79.4% - 92.5% | 71.8% - 99.5% |
| ITT, intención de tratar; PP, por protocolo. |
Tabla 4 Eventos adversos.
| Eventos adversos n(%) | 34 (31.5) |
|---|---|
| Náuseas | 17 (15.7) |
| Bloating | 15 (13.4) |
| Dolor abdominal | 9 (8.3) |
| Cefalea | 9 (8.3) |
| Diarrea | 8 (7.4) |
| Vómito | 4 (3.7) |
| Exantema | 3 (2.8) |
Al comparar la tasa de erradicación entre el grupo que presentó eventos adversos y los que no, se encontró una diferencia estadísticamente significativa (p= 0.05), encontrando mayor tasa de erradicación en quienes no tuvieron eventos adversos, también se encontró diferencias entre el grupo que consumía alcohol y tabaco (p<0.05) con menor tasa de erradicación en quienes estaban expuestos.
Discusión
En el presente estudio, que hasta donde investigamos, es el primero en describir la terapia dual para la erradicación de H. pylori en Latinoamérica, encontramos que la tasa de erradicación global fue 86% (IC95% 79.4-92.5%), tanto por ITT como PP sin diferencias con los pacientes que habían tenido tratamientos previos fallidos (85.7% IC95% 71.8-99.5%). Los resultados globales son similares a los encontrados por Hu 19.
En este estudio se decidió utilizar esomeprazol teniendo en cuenta la alta prevalencia en nuestro medio de metabolizadores rápidos y ultrarrápidos de IBP de primera generación (omeprazol, pantoprazol, lansoprazol), que juntos superan 80% y son una causa reconocida de fracaso terapéutico 30,36. Con este medicamento teóricamente obviaríamos una causa de fracaso terapéutico. La amoxicilina se administró tres veces al día y al igual que otros investigadores, desconocemos si administrándola cuatro veces al día (1 gr o 750 mg), se podría aumentar la eficacia 37. No obstante lo anterior, no se confirmaron ni el pH gástrico ni los niveles de amoxicilina en plasma, por lo cual existe la posibilidad que aumentando la frecuencia de la amoxicilina y/o del IBP (hasta cuatro veces al día), se alcance mayor tasa de éxito como se reporta en los estudios de Yang y Tai 25,38. Se ha demostrado que la optimización de las terapias de erradicación elevando el pH gástrico por encima de seis y aumentando la frecuencia de la amoxicilina se puede mejorar el éxito considerando que su efecto bactericida es dosis dependiente 15-17.
Un metaanálisis reciente 37, publicado durante el desarrollo de este estudio, encontró que el éxito de esta terapia dual, tiene eficacia similar a las terapias cuádruples, recomendadas por las principales guías sobre el manejo de H. pylori3,6. En ese importante metaanálisis 33, la mayoría de los estudios incluidos son asiáticos, haciendo difícil la extrapolación a la población occidental incluyendo latinoamericana. El presente trabajo, contribuye a subsanar la poca información sobre el uso de esta terapia en nuestro medio y sus resultados, apoyan la recomendación actual de utilizarla no solo como tratamiento de primera línea, sino también como tratamiento de rescate, ya que en ambos la erradicación fue similar 37,39.
Otros factores que se han asociado con menor respuesta a las terapias avaladas para la erradicación de H. pylori son el tabaquismo y el alcohol 40. El tabaquismo se asocia a menor tasa de erradicación al disminuir el flujo arterial gástrico y aumentar la secreción del ácido clorhídrico impidiendo una adecuada acción de la amoxicilina 41,42. En nuestra población la tasa de tabaquismo y alcoholismo activo fue baja, aunque puede estar subestimada por el sesgo de memoria, a pesar que el estudio no fue diseñado para encontrar asociaciones, se encontraron diferencias entre el grupo que consumía alcohol y tabaco (p<0.05) con menor tasa de erradicación en quienes estaban expuestos. Yan 18 demostró que adicionar bismuto a la terapia dual solo tuvo impacto en mejorar la tasa de respuesta de pacientes fumadores. Los eventos adversos de los medicamentos utilizados en las terapias para la erradicación de H. pylori aumentan la tasa de abandono, y concomitantemente afectan la tasa de éxito 6,7. Los diferentes estudios realizados para evaluar la efectividad la terapia dual han demostrado de forma consistente que es la terapia con menos efectos adversos 37,39, lo cual también se refleja en nuestro estudio donde 31% de los pacientes presentaron eventos adversos, pero ninguno de ellos grave o que llevara a la suspensión del tratamiento. La severidad de la gastritis crónica encontrada en este estudio, de acuerdo al puntaje OLGA es similar a lo encontrado en un estudio colombiano con más de 1500 pacientes, en el cual la mayoría de los pacientes (88%) tenían severidad de 0-II, que significa poco riesgo de cáncer gástrico en el futuro y por lo tanto después de erradicar H. pylori, no habría necesidad de vigilancia endoscópica en contraste con los grados III y IV 42. Por lo tanto consideramos muy importante que en todas las endoscopias, además de investigar la presencia de H. pylori, siempre se determine la severidad de la atrofia o de la metaplasia intestinal ya que esto permite identificar los pacientes que necesitan endoscopias de control por el riesgo de cáncer gástrico 3,5.
Teniendo en cuenta que a nivel mundial y en Colombia también, es muy rara la resistencia de H. pylori a amoxicilina, sería una excelente opción por su fácil administración y más aún porque en nuestro medio al igual que en Latinoamérica y otras partes del mundo, no se dispone de cultivos para elegir la terapia de primera línea para erradicar H. pylori, como ha sido recomendado por expertos 3,6,7. Adicionalmente, la fácil administración permitiría un mayor cumplimento del tratamiento y de igual forma no se aumentaría resistencia del microorganismo a los antibióticos. Consideramos que serían necesarios futuros estudios con mayor número de pacientes para verificar esta eficacia y probablemente establecer la frecuencia de administración y dosis de amoxicilina y/o de IBP que permita alcanzar mayores tasas de éxito.
En conclusión, nuestros hallazgos demuestran que la terapia dual con altas dosis de amoxicilina e IBP es una terapia eficaz y segura tanto como terapia de primera vez (pacientes "naives") como en pacientes con uno o dos tratamientos previos fallidos
Agradecimientos
A la ingeniera Liliana Oino, coordinadora del Centro de Gastroenterología y Endoscopia y de los convenios docencia-asistencia por todo su apoyo en el reclutamiento y seguimiento de los pacientes, a la doctora Azucena Arévalo PhD en ciencias, por su asesoría, revisión y recomendaciones metodológicas sobre el manuscrito. A los doctores Elder Otero, Hernán Ballén y Hernando Marulanda por su entusiasmo y apoyo a esta investigación. A todas las enfermeras y secretarias de la institución. Al doctor Luis Peña y laboratorio Serpat por el interés y dedicación en la evaluación histológica de las biopsias gástricas.
REFERENCIAS
1. Hooi JKY, Lai WY, Ng WK, et al. Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis. Gastroenterology. 2017;153(2):420-429. doi: 1010.1053/j.gastro.2017.04.022 [ Links ]
2. Kalali B, Formichella L, Gerhard M. Diagnosis of Helicobacter pylori: Changes towards the Future. Diseases. 2015;3(3):122-135. doi:10.3390/diseases3030122 [ Links ]
3. Malfertheiner P, Megraud F, O'Morain C, et al. Management of helicobacter pylori infection-the Maastricht V/Florence consensus report. Gut. 2017;66(1):6-30. doi:10.1136/gutjnl-2016-312288 [ Links ]
4. Hu Q, Zhang Y, Zhang X, Fu K. Gastric mucosa-associated lymphoid tissue lymphoma and Helicobacter pylori infection: A review of current diagnosis and management. Biomark Res. 2016;4(1):1-9. doi:10.1186/s40364-016-0068-1 [ Links ]
5. Sugano K, Tack J, Kuipers EJ, et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut. 2015;64(9):1353-1367. doi:10.1136/gutjnl-2015-309252 [ Links ]
6. Gisbert JP, Molina-Infante J, Amador J, et al. IV Conferencia Española de Consenso sobre el tratamiento de la infección por Helicobacter pylori. Gastroenterol Hepatol. 2016;39(10):697-721. doi:10.1016/j.gastrohep.2016.05.003 [ Links ]
7. Otero RW, Gómez ZM, Otero PL, Trespalacios RA. Helicobacter pylori: ¿cómo se trata en el 2018? Rev Gastroenterol Peru. 2018;38(1):54-63. [ Links ]
8. Molina-Infante J, Shiotani A. Practical Aspects in Choosing a Helicobacter pylori Therapy. Gastroenterol Clin North Am. 2015;44(3):519-535. doi:10.1016/j.gtc.2015.05.004 [ Links ]
9. Camargo MC, García A, Riquelme A, et al. Systematic Review in Latin America. Am J Gastroenterol. 2014;109(4):485-495. doi:10.1038/ajg.2014.24.The [ Links ]
10. Liao J, Zheng Q, Liang X, et al. Effect of fluoroquinolone resistance on 14-day levofloxacin triple and triple plus bismuth quadruple therapy. Helicobacter. 2013;18(5):373-377. doi:10.1111/hel.12052 [ Links ]
11. Liang X, Xu X, Zheng Q, et al. Efficacy of bismuth-containing quadruple therapies for clarithromycin-, metronidazole-, and fluoroquinolone-resistant helicobacter pylori infections in a prospective study. Clin Gastroenterol Hepatol. 2013;11(7):802-807.e1. doi:10.1016/j.cgh.2013.01.008 [ Links ]
12. Henao Riveros SC, Quiroga A, Martínez Marín JD, Otero Regino W. Resistencia primaria a la claritromicina en aislamientos de Helicobacter pylori. Rev colomb gastroenterol. 2009;24(2):110-114. doi: ISSN: 0120-9957 [ Links ]
13. Arévalo A, Otero W, Trespalacios AA. Helicobacter pylori: resistencia múltiple en pacientes de Bogotá, Colombia. Biomédica. 2019;39:125-134. https://www.revistabiomedica.org/index.php/biomedica/article/view/4437/4121. [ Links ]
14. Trespalacios-Rangél AA, Otero W, Arévalo-Galvis A, Poutou-Piñales RA, Rimbara E, Graham DY. Surveillance of levofloxacin resistance in helicobacter pylori isolates in Bogotá-Colombia (2009-2014). PLoS One. 2016;11(7):1-10. doi:10.1371/journal.pone.0160007 [ Links ]
15. Graham DY, Shiotani A. Newer concepts regarding resistance in the treatment Helicobacter pylori infections. Nat Clin Pr Gastroenterol Hepatol. 2008;5(6):321-331. doi:10.1038/ncpgasthep1138.Newer [ Links ]
16. Gisbert JP, McNicholl AG. Optimization strategies aimed to increase the efficacy of H. pylori eradication therapies. Helicobacter. 2017;22(4):1-13. doi:10.1111/hel.12392 [ Links ]
17. Villoria A, Garcia P, Calvet X, Gisbert JP, Vergara M. Meta-analysis: High-dose proton pump inhibitors vs. standard dose in triple therapy for Helicobacter pylori eradication. Aliment Pharmacol Ther. 2008;28(7):868-877. doi:10.1111/j.1365-2036.2008.03807.x [ Links ]
18. Yu L, Luo L, Long X, et al. High-dose PPI-amoxicillin dual therapy with or without bismuth for first-line Helicobacter pylori therapy: A randomized trial. Helicobacter. 2019;24(4):1-7. doi:10.1111/hel.12596 [ Links ]
19. Hu J. Optimized high-dose amoxicillin dual therapies fail to achieve high cure rates in China. Saudi J Gastroenterol. 2017;23(5):275-280. [ Links ]
20. Bayerdorffer E, Miehlke S, Mannes GA, et al. Double-blind trial of omeprazole and amoxicillin to cure Helicobacter pylori infection in patients with duodenal ulcers. Gastroenterology. 1995;108(5):1412-1417. doi:10.1016/0016-5085(95)90689-4 [ Links ]
21. Bayerdorffer E, Rudolph B, Neubauer A, et al. Regression of primary gastric lymphoma of mucosa-associated lymphoid tissue type after cure of Helicobacter pylori infection. Lancet. 1995;345(8965):1591-1594. doi:10.1016/S0140-6736(95)90113-2 [ Links ]
22. Malfertheiner P. Current European concepts in the management of Helicobacter pylori infection. The Maastricht consensus report. Gut. 1997;41(1):8-13. doi:10.1136/gut.41.1.8 [ Links ]
23. Graham D, Lu H, Shiotani A. Failure of optimized dual proton pump inhibitor amoxicillin therapy: What now? Saudi J Gastroenterol. 2017;23(5):265-267. doi:10.4103/sjg.SJG_292_17 [ Links ]
24. Yang J, Zhang Y, Fan L, et al. Eradication Efficacy of Modified Dual Therapy Compared with Bismuth-Containing Quadruple Therapy as a First-Line Treatment of Helicobacter pylori. Am J Gastroenterol. 2019;114(3):437-445. doi:10.14309/ajg.0000000000000132 [ Links ]
25. Yang JC, Lin CJ, Wang HL, et al. High-dose dual therapy is superior to standard first-line or rescue therapy for helicobacter pylori infection. Clin Gastroenterol Hepatol. 2015;13(5):895-905.e5. doi:10.1016/j.cgh.2014.10.036 [ Links ]
26. Scott D, Weeks D, Melchers K, Sachs G. The life and death of Helicobacter pylori. Gut. 1998;43(SUPPL. 1):56-60. doi:10.1136/gut.43.2008.s56 [ Links ]
27. El Rouby N, Lima JJ, Johnson JA. Proton pump inhibitors: from CYP2C19 pharmacogenetics to precision medicine. Expert Opin Drug Metab Toxicol. 2018;14(4):447-460. doi:10.1080/17425255.2018.1461835 [ Links ]
28. Sim SC, Risinger C, Dahl ML, et al. A common novel CYP2C19 gene variant causes ultrarapid drug metabolism relevant for the drug response to proton pump inhibitors and antidepressants. Clin Pharmacol Ther. 2006;79(1):103-113. doi:10.1016/j.clpt.2005.10.002 [ Links ]
29. Deshpande N, V. S, Ravi RK, et al. Rapid and ultra-rapid metabolizers with CYP2C19*17 polymorphism do not respond to standard therapy with proton pump inhibitors. Meta Gene. 2016;9:159-164. doi:10.1016/j.mgene.2016.06.004 [ Links ]
30. Arévalo Galvis A, Trespalacios Rangel AA, Otero Regino W. Personalized therapy for Helicobacter pylori: CYP2C19 genotype effect on first-line triple therapy. Helicobacter. 2019;24(3):1-11. doi:10.1111/hel.12574 [ Links ]
31. Suzuki S, Gotoda T, Kusano C, et al. day vonoprazan and low- dose amoxicillin dual therapy as first- line Helicobacter pylori treatment: a multicentre randomised trial in Japan. 2020:1-8. doi:10.1136/gutjnl-2019-319954 [ Links ]
32. Dixon MF, Genta RM, Yardley HJ et al. Classification and grading of gastritis. The updated Sydney System. Am J Surg Pathol. 1996;20(10):1161-1181. [ Links ]
33. Rugge M, Correa P, Di Mario F, et al. OLGA staging for gastritis: A tutorial. Dig Liver Dis. 2008;40(8):650-658. doi:10.1016/j.dld.2008.02.030 [ Links ]
34. Otero R. W, Trespalacios R. AA, Otero P. L, et al. Guía de práctica clínica para el diagnóstico y tratamiento de la infección por Helicobacter pylori en adultos. Rev Colomb Gastroenterol. 2015;30:17-33. [ Links ]
35. Farmalatina. Prueba Rápida OnSite H. pylori Ag -Casete (Muestra Fecal). En: https://www.farmalatina.cl/wp-content/uploads/2020/04/PI-R0192C-Spanish-Rev-H.pylori.pdf [ Links ]
36. Tang HL, Li Y, Hu YF, Xie HG, Zhai S Di. Effects of CYP2C19 Loss-of-Function Variants on the Eradication of H. pylori Infection in Patients Treated with Proton Pump Inhibitor-Based Triple Therapy Regimens: A Meta-Analysis of Randomized Clinical Trials. PLoS One. 2013;8(4). doi:10.1371/journal.pone.0062162 [ Links ]
37. Gao CP, Zhang D, Zhang T, et al. PPI-amoxicillin dual therapy for Helicobacter pylori infection: An update based on a systematic review and meta-analysis. Helicobacter. 2020;25(4):1-8. doi:10.1111/hel.12692 [ Links ]
38. Tai WC, Liang CM, Kuo CM, et al. A 14 day esomeprazole- And amoxicillin-containing high-dose dual therapy regimen achieves a high eradication rate as first-line anti-Helicobacter pylori treatment in Taiwan: a prospective randomized trial. J Antimicrob Chemother. 2019;74(6):1718-1724. doi:10.1093/jac/dkz046 [ Links ]
39. Zhu YJ, Zhang Y, Wang TY, et al. High dose PPI-amoxicillin dual therapy for the treatment of Helicobacter pylori infection: a systematic review with meta-analysis. Therap Adv Gastroenterol. 2020;13:1-12. doi:10.1177/1756284820937115 [ Links ]
40. Pan KF, Zhang L, Gerhard M, et al. A large randomised controlled intervention trial to prevent gastric cancer by eradication of Helicobacter pylori in Linqu County, China: Baseline results and factors affecting the eradication. Gut. 2016;65(1):9-18. doi:10.1136/gutjnl-2015-309197 [ Links ]
41. Itskoviz D, Boltin D, Leibovitzh H, et al. Smoking increases the likelihood of Helicobacter pylori treatment failure. Dig Liver Dis. 2017;49(7):764-768. doi:10.1016/j.dld.2017.03.010 [ Links ]
42. Suzuki T, Matsuo K, Ito H, et al. Smoking increases the treatment failure for Helicobacter pylori eradication. Am J Med. 2006;119(3):217-224. doi:10.1016/j.amjmed.2005.10.003 [ Links ]
Recibido: 13 de Enero de 2021; Aprobado: 25 de Mayo de 2021











 text in
text in