Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Medica Colombiana
Print version ISSN 0120-2448
Acta Med Colomb vol.46 no.4 Bogotá Oct./Dec. 2021 Epub Apr 28, 2022
https://doi.org/10.36104/amc.2021.2108
Revisión
Tratamiento actual de la falla cardiaca con fracción de expulsión reducida. Revisión sistemática de las nuevas terapias
a Cardiólogo. Sección de Cardiología, Departamento de Medicina Interna Universidad de Antioquia. Clínica de Falla Cardiaca Hospital Universitario San Vicente Fundación. Grupo para el Estudio de las Enfermedades Cardiovasculares Universidad de Antioquia. Medellín (Colombia).
b Cardiólogo. Sección de Cardiología, Departamento de Medicina Interna Universidad de Antioquia. Clínica de Falla Cardiaca Hospital Universitario San Vicente Fundación. Grupo para el Estudio de las Enfermedades Cardiovasculares Universidad de Antioquia. Medellín (Colombia).
c Residentes de Cardiología Clínica, Sección de Cardiología, Departamento de Medicina Interna, Universidad de Antioquia y Pertenecientes al Grupo para el Estudio de las Enfermedades Cardiovasculares Universidad de Antioquia. Medellín (Colombia).
d MSc en Epidemiología Clínica. Coordinador de Posgrado de Cardiología Clínica y Cardiología Intervencionista, Sección de Cardiología, Departamento de Medicina Interna Universidad de Antioquia. Clínica de Falla Cardiaca Hospital Universitario San Vicente Fundación. Grupo para el Estudio de las Enfermedades Cardiovasculares Universidad de Antioquia. Medellín (Colombia).
Introducción:
la falla cardiaca con fracción de eyección reducida dispone de un arsenal terapéutico cada vez más amplio por lo que se requiere refinar las indicaciones de cada una de ellas.
Métodos:
se realizó una revisión sistemática siguiendo las directrices de Preferred Reporting Items for Systematic Reviews and Meta-Analysis (PRISMA), para actualizar la búsqueda sistemática realizada para el desarrollo de la "Guía de Practica Clínica para la prevención, diagnóstico, tratamiento y rehabilitación" (GPC) del Ministerio de Salud de Colombia.
Resultados:
se detectaron seis ensayos clínicos nuevos que modifican sustancialmente las recomendaciones principales de la GPC. Los antagonistas del receptor de angiotensina combinado con inhibidor de neprilisina (ARNI), los inhibidores del cotransportador sodio glucosa-2 (ISGLT-2), los betabloqueadores y los antagonistas mineralocorticoides (ARM) se convierten en el núcleo principal del tratamiento de los pacientes con falla cardiaca con fracción de eyección reducida. Otras opciones terapéuticas deben ser consideradas después de iniciar y titular las dosis de estos cuatro medicamentos.
Discusión:
el esquema práctico propuesto, como núcleo central con cuatro estrategias terapéuticas fundamentales, dada la robustez de los resultados de los ensayos en que fueron evaluados, permitirá mejorar el tratamiento de los pacientes con falla cardiaca e incluir en forma escalonada con el uso de otras alternativas, graficado como órbitas, para impactar otros desenlaces individuales. (Acta Med Colomb 2021; 46. DOI:https://doi.org/10.36104/amc.2021.2108).
Palabras clave: falla cardiaca; epidemiología; tratamiento; mortalidad
Introduction:
heart failure with reduced ejection fraction has a growing therapeutic arsenal. Thus, the indications for each therapy must be refined.
Methods:
a systematic review was performed following the Preferred Reporting Items for Systematic Reviews and Meta-Analysis (PRISMA) guidelines, to update the systematic search performed in the development of the "Clinical Practice Guidelines for Prevention, Diagnosis, Treatment and Rehabilitation" (CPG) of the Colombian Ministry of Health.
Results:
six new clinical trials were found which substantially modify the main recommendations of the CPG. Angiotensin receptor antagonists combined with neprilysin inhibitors (ARNI), sodium-glucose cotransporter 2 (SGLT2) inhibitors, betablockers and mineralocorticoid receptor antagonists (MRA) are now the main core of treatment for patients with heart failure with reduced ejection fraction. Other therapeutic options should be considered after beginning and titrating the doses of these four medications.
Discussion:
given the robustness of the evaluating studies, the proposed practical scheme, as the central core with four fundamental therapeutic strategies, will improve the treatment of patients with heart failure and allow the stepwise inclusion of other alternatives, plotted as orbits, to impact on other individual outcomes. (Acta Med Colomb 2021; 46. DOI:https://doi.org/10.36104/amc.2021.2108).
Keywords: heart failure; epidemiology; mortality
Introducción
La falla cardiaca (FC) es un síndrome clínico caracterizado por signos y síntomas típicos, adicional a la evidencia objetiva de una anomalía estructural o funcional del corazón 1. Se asocia a morbimortalidad significativa, con tasas de mortalidad de 7.2% y hospitalización de 31.9% a un año en pacientes con FC crónica, con incremento de estos desenlaces a 17.4% de mortalidad y 43.9% de hospitalización en pacientes con FC aguda 2; y tasas de supervivencia a cinco años de 56.7% (IC 95% 54-59.4%) y a los 10 años de 34.9% (IC 95% 24-46.8%) 3.
Tradicionalmente la fracción de expulsión del ventrículo izquierdo (FEVI) ha sido la forma de clasificación más utilizada, dadas sus implicaciones prácticas para definir la estrategia terapéutica adecuada, aunque en los últimos años ha ganado terreno la medición del strain longitudinal global y la fracción de contracción miocárdica 4. La Sociedad Europea de Cardiología la clasifica en tres categorías de acuerdo con la FEVI: FC con FEVI preservada cuando es mayor o igual a 50%, FC con FEVI levemente reducida si se encuentra entre 40-49% y FC con FEVI reducida (FC-FEVIr) cuando es menor a 40% 5.
La FC con FEVI preservada y en rango medio, a la fecha no tienen terapias específicas basadas en la evidencia, y su tratamiento se enfoca en el manejo de los factores de riesgo y control de comorbilidades 1,2,5; mientras que la FC-FEVIr tiene terapias claramente basadas en la evidencia, con un arsenal terapéutico cada vez más amplio y en la actualidad incluso ofrece nuevos paradigmas de tratamiento 6. Es por ello por lo que, en esta revisión sistemática de la literatura, abordamos el tratamiento actual de la FC-FEVIr.
Obtención de los datos
El diseño del estudio es de revisión sistemática siguiendo las directrices de Preferred Reporting Items for Systematic Reviews and Meta-Analysis (PRISMA) 7. Se realizó actualización de la búsqueda sistemática realizada para el desarrollo de la "Guía de Practica Clínica para la prevención, diagnóstico, tratamiento y rehabilitación de la falla cardiaca en población mayor de 18 años, clasificación B, C y D" 1.
Objetivo
Las preguntas con la estrategia PICO (población, intervención, comparador, desenlace) fueron:
¿En pacientes mayores de 18 años con FC-FEVIr el manejo farmacológico, intervencionista o con dispositivos comparado con placebo o tratamiento activo o con no utilizarlos disminuye desenlace primario combinado, mortalidad y hospitalizaciones por cualquier causa o por causa cardiovascular?
Criterios de elegibilidad
La selección de los estudios fue realizada por dos de los investigadores y las diferencias se resolvieron por consenso: se incluyeron ensayos clínicos con asignación aleatoria que compararan el uso de terapia farmacológica, intervencionista o dispositivos en FC-FEVIr, definida por FEVI menor de 40%, contra placebo, tratamiento activo o en el caso de los dispositivos, sin el uso de estos, y que reportaran desenlaces combinados relevantes, mortalidad de cualquier causa o de origen cardiovascular, hospitalización por cualquier causa o por FC. Se extrajo de cada estudio las características basales y los desenlaces evaluados en cada uno de ellos.
Estrategia de búsqueda
Se realizó una búsqueda sistemática en las bases de datos bibliográficas PUBMED, EMBASE, CENTRAL, DARE, Epistemonikos, SciELO, LILACS y OpenGray; además, se consultaron páginas web de registros de ensayos clínicos como Clinical-Trials; la búsqueda manual incluyó páginas de congresos internacionales, sitios WEB y medios electrónicos, como Twitter, de Cardiología como el de la European Society of Cardiology, American Heart Association, Canadian Cardiovascular Society y American College of Cardiology, así como los estudios primarios incluidos en las guías de práctica clínica de esas sociedades y de la National Institute for Health and Care Excellence (NICE) y metaanálisis. Se incluyeron estudios para la actualización desde enero de 2014 a diciembre de 2020 en idioma inglés.
Se realizó una búsqueda general y manual que incluyó los siguientes términos: "heart failure" or "congestive heart failure" or "left ventricular dysfunction" or "reduced ejection fraction" or "systolic heart failure" and "treatment" "management" or "drug therapy" and randomized controlled trial or controlled clinical trial or randomized or randomly or trial".
Análisis estadístico
De acuerdo con las características individuales de los ensayos incluidos, la heterogeneidad entre ellos y que se comportan como terapias complementarias se decidió en consenso del grupo desarrollador, no realizar metaanálisis sino revisión sistemática. Se analizaron los ensayos individuales en sus características basales y desenlaces definidos que se presentan en tablas para comparación, se evaluó el riesgo de sesgos con la estrategia sugerida por Cochrane y se calculó el índice de fragilidad para los estudios nuevos y un comparativo con los clásicos con el desenlace de mortalidad de cualquier causa. Se define el índice de fragilidad como el número mínimo de eventos que se requiere cambiar al estado sin eventos para convertir un resultado significativo a no significativo, como evidencia de la robustez del ensayo, puesto que muchos de ellos dependen de tres o menos eventos de diferencia; su interpretación evidencia que entre más pequeño el índice, más frágil el resultado 8.
Resultados
La búsqueda sistemática y manual recuperó 1424 resultados, de los cuales solo se analizaron los ensayos clínicos originales, excluyendo publicaciones con análisis de subgrupos individuales o desenlaces secundarios o subrogados. No se recuperaron estudios nuevos de inhibidores de la enzima convertidora de angiotensina (IECA), ni de los antagonistas del receptor de angiotensina II (ARAII), ni de los beta-bloqueadores, y tampoco de los antagonistas del receptor mineralocorticoide (ARM) ni de ivabradina.
El riesgo de sesgos para los seis estudios nuevos analizados se consideró bajo en todos los aspectos evaluados: generación de la secuencia de asignación, ocultamiento de la asignación, enmascaramiento de participantes y personal, enmascaramiento de desenlaces, desenlaces incompletos y reporte selectivo (Tabla 1).
Tabla 1 Riesgo de sesgos de los ensayos clínicos.
| Estudio | Generación secuencia de asignación | Ocultamiento de la asignación | Enmascaramiento participantes y personal | Enmascaramiento Desenlaces | Desenlaces incompletos | Reporte selectivo |
|---|---|---|---|---|---|---|
| PARADIGM HF | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo |
| DAPA HF | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo |
| VICTORIA | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo |
| EMPEROR REDUCED | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo |
| GALACTIC HF | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo |
| SOLOIST WHF | Bajo | Bajo | Bajo | Bajo | Bajo | Bajo |
El índice de fragilidad demuestra resultados robustos para el sacubitril/valsartán tanto para el desenlace primario combinado como para el de muerte cardiovascular, muerte de origen cardiovascular y hospitalización por FC; para la dapaglifozina los resultados son robustos en el desenlace combinado primario y en hospitalización por FC; el estudio con empaglifozina muestra resultados robustos para el desenlace combinado primario y para hospitalización por FC; para la sotaglifozina es robusto para el desenlace primario; el vericiguat y el omecamtiv mecarbil tienen índices de fragilidad muy bajos, especialmente este último (Tabla 2).
Tabla 2 Índice de fragilidad para todos los desenlaces en los ensayos nuevos incluidos.
| Índice de fragilidad | PARADIGM HF Activo/superioridad LCZ696/enalapril |
DAPA HF Placebo/superioridad Dapaglifozina/placebo |
VICTORIA Placebo/superioridad Vericiguat/placebo |
EMPEROR R Placebo/superioridad Empaglifozina/placebo |
GALACTIC HF Placebo/superioridad Omecamtiv/placebo |
SOLOIST WHF Placebo/superioridad Sotaglifozina/placebo |
|---|---|---|---|---|---|---|
| Desenlace primario | 118 | 62 | 8 | 50 | 1 | 72 |
| Muerte cardiovascular | 66 | 5 | 0 | 0 | 0 | 0 |
| Muerte total | 49 | 8 | 0 | 0 | 0 | 0 |
| Hospitalización por falla | 54 | 43 | 0 | 50 | 0 | NA |
Se realizó un análisis comparativo de los estudios clásicos con los nuevos analizados en el desenlace de mortalidad (Tabla 3). Los resultados demuestran estimativos menores de 1 en casi todos, con excepción del valsartán, losartán y omecamtiv mecarbil; con IC 95% que superan el 1: valsartán, candesartan en el CHARM Added, losartán en el ELITE II y en el HEAAL, carvedilol en el ANZ, nebivolol, digoxina, ivabradina, vericiguat, empaglifozina, omecamtiv mecarbil y sotaglifozina. Los índices de fragilidad son robustos para los betabloqueadores, espironolactona y sacubitril/valsartán.
Tabla 3 Comparación de índice de fragilidad de los ensayos clásicos en FC.
| Estudio | Mortalidad total | Estimativo IC 95% | Índice de fragilidad |
|---|---|---|---|
| CONSENSUS | 1 año • 36 vs 52% | RR 0.69 (0.52-0.91) | 7 |
| SOLVD T | 2 años • 35.1 vs 39.7% | RR 0.84 (0.74-0.95) | 10 |
| Val-HeFT | 2 años • 19.7 vs 19.4% | RR 1.02 (0.88-1.18) | 0 |
| CHARM Alternative | 3 años • 26.1 vs 29.1% | HRa 0.83 (0.7-0.99) | 0 |
| CHARM Added | 3.5 años • 29.5 vs 32.4% | HR 0.89 (0.77-1.02) | 0 |
| ELITE II | 1.5 años • 17.7 vs 15.9 % | HR 1.13 (0.95-1.35) | 0 |
| HEAAL | 4.7 años • 33 vs 34.8 % | HR 0.94 (0.84-1.04) | 0 |
| CIBIS II | 1.3 años • 12 vs 17% | HR 0.66 (0.54-0.81) | 37 |
| MERIT HF | 1 año • 7.2 vs 11% | RR 0.66 (0.53-0.81) | 34 |
| COPERNICUS | 10.4 m • 11.4 vs 18.5% | RR 0.66 (0.53-0.81) | 30 |
| ANZ CARVEDILOL | 1.6 años • 9.7 vs 12.5% | RR 0.76 (0.44-1.32) | 0 |
| COMET | 5 años • 34 vs 40% | HR 0.83 (0.74-0.93) | 33 |
| SENIORS | 1.75 años • 15.8 vs 18.1% | HR 0.88 (0.71-1.08) | 0 |
| RALES | 2 años • 35 vs 46% | RR 0.70 (0.6-0.82) | 54 |
| EMPHASIS HF | 1.75 años • 12.5 vs 15.5% | HR 0.76 (0.62-0.93) | 5 |
| DIG | 3 años • 34.8 vs 35.1% | RR 0.99 (0.91-1.07) | 0 |
| A-HeFT | 10 m • 6.2 vs 10.2% | HR 0.57 (sin IC) RR 0.63 (0.41-0.96) | 3 |
| SHIFT | 2 años • 16 vs 17% | HR 0.9 (0.8-1.02) | 0 |
| PARADIGM | 2.25 años • 17 vs 19.8% | HR 0.84 (0.76-0.93) | 49 |
| DAPA HF | 18.2 m • 11.6 vs 13.9% | HR 0.83 (0.71 to 0.97) | 8 |
| VICTORIA | 10.8 m • 20.3 vs 21.2% | HR 0.95 (0.84-1.07) | 0 |
| EMPEROR R | 16 m • 13.4 vs 14.2% | HR 0.92 (0.77 to 1.10) | 0 |
| GALACTIC HF | 21.8 m • 25.9 vs 25.9% | HR 1.00 (0.92 to 1.09) | 0 |
| SOLOIST WHF | 9 m • 13.5 vs 16.3% | HR 0.82 (0.59-1.14) | 0 |
Tratamiento farmacológico
Inhibidores de la enzima convertidora de angiotensina (IECA)
Los IECA producen disminución de la concentración de angiotensina II y aldosterona, aumento de la liberación de renina y de la concentración de angiotensina 9-12, reducen la concentración plasmática de epinefrina, norepinefrina y vasopresina; e incremento de la producción de bradicinina 10,13,14.
El CONSENSUS 15 con enalapril, fue el primer fármaco (1986) en lograr demostrar reducción de la mortalidad en FC, en pacientes en clase IV de la New York Heart Association (NYHA). La mortalidad a los seis meses se redujo significativamente en el grupo que recibió enalapril (44% frente a 26%). Desde entonces, numerosos estudios han demostrado que el antagonismo del SRAA para la reducción de la morbilidad y la mortalidad en FC-FEVIr, con reducciones en la mortalidad por todas las causas en el rango del 20-30% 16-20.
Antagonistas del receptor de angiotensina II (ARA-II)
Los resultados de los ensayos clínicos indican que los ARA-II no son superiores a los IECA, pero son una alternativa para los pacientes con intolerancia. En ensayos clínicos se ha evaluado la eficacia no solo de losartán (OPTIME-ELITE II), sino también de valsartán (Val-HeFT) y candesartán (CHARM) en pacientes con FC, en términos de mobimortalidad cardiovascular 21-24; sin embargo, estos no han sido capaces de superar a los IECA en la consistencia de la reducción en la morbilidad y mortalidad; su principal ventaja radica en la mejor tolerancia. El uso como terapia alternativa está basada en los resultados del estudio CHARM-Alternative, en pacientes con FC sintomática y FEVI <40% que no estaban tomando IECA por intolerancia, la introducción de candesartán logró una reducción significativa tanto de la mortalidad como del número de hospitalizaciones por FC 25.
Betabloqueadores
Los betabloqueadores deben hacer parte del tratamiento de todos los pacientes crónicos estables y su inicio debe ser temprano luego de la compensación en los pacientes con FC aguda de nuevo diagnóstico 1,5. Sus beneficios están demostrados, independientemente de la etiología de la FC; estos incluyen el alivio de los síntomas y mejoría en la calidad de vida, reducción del riesgo de hospitalización e incidencia de muerte súbita, así como mejoría en la supervivencia. Adicionalmente tienen efectos significativos en el remodelado inverso ventricular, con recuperación de la FEVI 26-30. La terapia con betabloqueadores debe usarse con precaución en los pacientes con PA limítrofe, uso reciente de terapia inotrópica o clase funcional NYHA IV.
Un metaanálisis reciente genera duda sobre el efecto de los betabloqueadores en pacientes con FC con fibrilación auricular (FA) por demostrar impacto diferente al de los pacientes en ritmo sinusal 31. El reciente ensayo clínico RATE AF demuestra que la digoxina comparada con el bisoprolol tiene una efectividad similar, pero con menores eventos adversos 32.
Antagonistas del receptor mineralocorticoide (ARM)
Los ARM (espironolactona y eplerenona) reducen el fenómeno de escape de aldosterona, contribuyen al bloqueo del SRAA 33-35 y reducen la mortalidad entre 15 y 30%; además, disminuyen las hospitalizaciones por FC entre 15 y 40% en tres ensayos clínicos aleatorizados (RALES, EMPHASIS, EPHESUS) 36-38, en pacientes con FC-FEVIr crónica, incluidos pacientes que habían tenido un infarto de miocardio, con la exclusión de pacientes con un nivel de creatinina sérica basal superior a 2.5 mg/dL (o tasa de filtración glomerular [TFG] estimada <30 mL/min/1.73 m2) o nivel de potasio sérico >5.0 mEq/L.
Evidencia reciente, que utiliza métodos de comparación indirecta, sugiere mayores beneficios en la sobrevida de una estrategia de inicio de los tres agentes en comparación con la terapia convencional 39. Moléculas nuevas como la finerenona ha demostrado beneficios en un estudio fase 2 (ARTS-HF) y en pacientes diabéticos tipo 2 con enfermedad renal crónica 40-41.
Antagonistas del receptor de angiotensina e inhibidor de neprilisina (ARNI)
Para complementar el bloqueo neurohormonal se intentó inicialmente aumentar los niveles de péptidos natriuréticos con la administración de nesiritide y carperitide, con resultados desalentadores 42-45; luego, la inhibición aislada de la neprilisina con las moléculas: racecodotril, candoxatrilat y ecadotril, sin éxito puesto que su efecto rápidamente se perdía 46; el paso siguiente fue utilizar un nuevo grupo conocido como inhibidor de vasopeptidasa que posee un mecanismo dual, inhibe las endopeptidasas neutrales (como la neprilisina) y la ECA (omapatrilat). El estudio OVERTURE demostró no inferioridad comparado con enalapril, pero mayor número de pacientes con angioedema [24 (0.8%) vs 14 (0.5%)] 47; esto se debe a que la neprilisina degrada la aminopeptidasa P la cual, igual que la ECA, degrada las bradiquininas.
Finalmente, se combinó la molécula sacubitril (inhibidor de neprelisina) a un ARA-II (valsartán), el cual se probó en el estudio PARADIGM HF (48), en pacientes con FEVI <35%, con probada tolerancia a IECA o ARA-II, NYHA ≥II, elevación en los péptidos natriuréticos, presión arterial sistólica (PAS) > 100 mmHg, TFG > 30mL/min/1.73m2 y potasio ≤5.2 mEq/L; se demostró superioridad de sacubitril/ valsartan en dosis de 200 mg cada 12 horas, comparado con enalapril en dosis de 10 mg cada 12 horas, en mortalidad cardiovascular, incluido muerte súbita y empeoramiento de FC (HR 0.8, IC 0.73-0.87) y hospitalización por FC (HR 0.79, IC 0.71-0.89).
En el estudio PIONEER HF (49) se comprobó la seguridad del inicio en FC descompensada, en éste los pacientes con FEVI <40%, BNP ≥400 ng/L o NT-proBNP ≥1600 ng/L, sin requerimiento de inotrópicos en las últimas 24 horas, ni uso de vasodilatadores, PAS <100 mmHg o aumento en diuréticos en las últimas seis horas; se demostró superioridad de sacubitril/valsartan en dosis 200 mg cada 12 horas comparado con enalapril en dosis de 10 mg cada 12 horas, respecto a disminución del valor de NT-ProBNP y reducción de rehospitalizaciones a 30 días como desenlace secundario.
De forma subsecuente se realizó el estudio TITRATION para establecer la seguridad de la titulación de la dosis en forma conservadora (estándar) o condensada (agresiva) con buenos resultados en ambas ramas 50; de forma similar el ensayo TRANSITION 51 demostró que el inicio antes o después del alta de sacubitril/valsartan no implicaba cambios en la consecución de la dosis objetivo y finalmente el estudio PROVE HF 52 en el cual se encontró una asociación débil pero estadísticamente significativa entre los valores de NT-ProBNP y el cambio en la FEVI; dado que la biodisponibilidad del valsartán del ARNI es 50% mayor que la del valsartán solo, lo que significa que 400 mg de la combinación contiene ~203 mg de valsartán, equivalente a 320 mg del valsartan comercializado solo; además, tiene demostrada costo-efectividad (Tablas 4-6) 19.
Tabla 4 Comparación de las nuevas terapias en FC. Características basales.
| Variable | PARADIGM HF Activo/superioridad LCZ696/enalapril | DAPA HF Placebo/superioridad DAPA/placebo | VICTORIA Placebo/superioridad Vericiguat/placebo | EMPEROR R Placebo/superioridad Empaglifozina/placebo | GALACTIC HF Placebo/superioridad Omecamtiv/placebo | SOLOIST WHF Placebo/superioridad Sotaglifozina/placebo |
|---|---|---|---|---|---|---|
| Grupo | ARNI | ISGLT2 | SGCE | ISGLT2 | CMA | ISGLT2 |
| Año | 2014 | 2019 | 2020 | 2020 | 2020 | 2020 |
| Seguimiento mediana | 27 meses | 18 meses | 11 meses | 16 meses | 21.8 meses | 9 meses |
| Tamaño de muestra | 4187/4212 | 2373/2371 | 2526/2524 | 1863/1867 | 4120/4112 | 608/614 |
| Diseño | RCT | RCT | RCT | RCT | RCT | RCT |
| Edad (años) | 63.8 ± 11.5/63.8±11.3 | 66.2±11/66.5±10.8 | 67.5±12.2/67.2±12.2 | 67.2±10.8/66.5±11.2 | 64.5±11.3/64.5±11.4 | 69 (63-76)/70 (64-76) |
| TFG promedio | 68±20/68±20 | 66±19.6/65.5±19.3 | 61.3±27/61.7±27.3 | 61.8±21.7/62.2±21.5 | 58.7 (43.8-73.7)/58.8 (44.3-74.3) | 49.2 (39.5-61.2)/50.5 (40.5-64.6) |
| Fracción de eyección (%) | 29.6±6.1/29.4±6.3 | 31.2±6.7/30.9±6.9 | 29±8.3/28.8±8.3 | 27.7±6.0/27.2±6.1 | 26.6±6.3/26.5±6.3 | 35 (28-47)/35 (28-45) |
| Isquémica (%) | 59.9/60.1 | 55.5/57.3 | 59.8/56.8 | 52.8/50.7 | 53.2/54 | |
| NYHA I/II/III/IV (%) | 4.3/71.6/23.1/0.8; 5/69.3/24.9/0.6 | 0/67.7/31.5/0.8; 0/67.4/31.7/1.0 | 0/58.6/40/1.4; 0.1/59.3/39.4/1.2 | 0/75.1/24.4/0.5; 0/75/24.4/0.6 | 0/53.3/43.7/3; 0/52.8/44.1/3 | Hospitalizado + diurético IV |
| Hipertensión (%) | 70.9/70.5 | 79.3/79 | 72.4/72.3 | |||
| Diabetes (%) | 34.7/34.6 | 41.8/41.8 | 48.6/45.3 | 49.8/49.8 | 40.1/40.3 | Tipo 2 100% |
| Fibrilación auricular (%) | 36.2/37.4 | 38.6/38 | 43.5/46.4 | 35.6/37.8 | 27.8/26.7 | |
| Betabloqueador (%) | 93.1/92.9 | 96/96.2 | 93.2/93 | 94.7/94.7 | 94.2/94.4 | 92.8/91.4 |
| Antialdosterónico (%) | 54.2/57 | 71.5/70.6 | 69.3/71.4 | 70.1/72.6 | 77.6/77.8 | 66.3/62.7 |
| IECA/ARAII (%) | 84.5/82.8 | 73.3/73.6 | 70.5/68.9 | 87/87 | 82/83 | |
| Sacubitril/valsartán (%) | 10.5/10.9 | 14.3/14.7 | 18.3/20.7 | 19.9/19 | 15.3/18.2 | |
| CDI | 14.9/14.7 | 26.2/26.1 | 27.6/27.9 | 31.0/31.8 | 32.2/31.3 | |
| TRC | 7/6.7 | 8/6.9 | 14.7/14.6 | 11.8/11.9 | 14.4/13.8 | |
| NTproBNP pg/mL | 1631/1594 | 1428/1446 | 2803.5/2821 | 1887/1926 | 1977/2025 | 1816/1741 |
Tabla 5 Comparación de las nuevas terapias en FC. Desenlaces.
| Desenlace | PARADIGM HF Activo/superioridad LCZ696/enalapril |
DAPA HF Placebo/superioridad DAPA/placebo |
VICTORIA Placebo/superioridad Vericiguat/placebo |
EMPEROR R Placebo/superioridad Empaglifozina/placebo |
GALACTIC HF Placebo/superioridad Omecamtiv/placebo |
SOLOIST WHF Placebo/superioridad Sotaglifozina/placebo |
|---|---|---|---|---|---|---|
| Primario combinado (%,HR, eventos 100 pac/año) | 21.8/26.5 HR 0.80 (0.73-0.87) | 16.3/21.2 HR 0.74 (0.65-0.85) 11.6/15.6 | 35.5/38.5 HR 0.90 (0.82-0.98) 33.6/37.8 | 19.4/24.7 HR 0.75 ( 0.65-0.86) 15.8/21.0 | 37/39.1 HR 0.92 (0.86-0.99) 24.2/26.3 | 40.3/ 57.8 HR 0.67 (0.52-0.85) 51/76.3 |
| Muerte CV | 13.3/16.5 HR 0.80 (0.71-0.89) | 9.6/11.5 HR 0.82 (0.69-0.98) 6.5/11.5 | 16.4/17.5 HR 0.93 (0.81-1.06) 12.9/13.9 | 10/10.8 HR 0.92 (0.75-1.12) 7.6/8.1 | 19.1/19.4 HR 1.01 (0.92-1.11) 10.9/10.8 | 8.4/ 9.5 HR 0-84 (0.58-1.22) 10.6/12.5 |
| 1a Hospitalización por falla | 12.8/15.6 HR 0.79 (0.71-0.89) | 9.7/13.4 HR 0.70 (0.59-0.83) 6.9/9.8 | 27.4/29.6 HR 0.90 (0.81-1.0) 25.9/29.1 | 13.2/18.3 HR 0.69 (0.59-0.81) 10.7/15.5 | 27.7/28.7 HR 0.95 (0.87-1.03) 18/19.1 | |
| Hospitalización total | 39.7/43.5 HR 0.88 (0.82-0.94) | HR 0.85 (0.75-0.95) | 28.6/30.1 HR 0.93 (0.86-1) 18.7/20.3 | |||
| Muerte total | 17/19.8 HR 0.84 (0.76-0.93) | 11.6/13.9 HR 0.83 (0.71-0.97) 7.9/9.5 | 20.3/21.2 HR 0.95 (0.84-1.07) 16/16.9 | 13.4/14.2 HR 0.92 (0.77-1.10) 10.1/ 10.7 | 25.9/25.9 HR 1 (0.92-1.09) 14.4/14.4 | 10.7/ 12.4 HR 0.82 (0.59-1.14) 13.5/16.3 |
| Cambio KCCQ | "-2.9±0.36/-4.63±0.36" HR 1.64 (0.63-2.65) | 6.1±18.6/3.3±19.2 HR 1.18 (1.11-1.26) | 5.8±0.4/4.1±0.4 HR 1.7 (0.5-3.0) | 5.8±0.3/6.3±0.3 -0.5 (-1.4 to 0.5) | 17.7/13.6 | |
| Empeoramiento renal | 2.2/2.6 HR 0.86 (0.65-1.13) | 1.2/1.6 HR 0.71 (0.44-1.16) 0.8/1.2 | 1.6/3.1 HR 0.50 (0.32-0.77) |
Tabla 6 Comparación de las nuevas terapias en FC. Eventos adversos.
| Evento adverso | PARADIGM HF Activo/superioridad LCZ696/enalapril |
DAPA HF Placebo/superioridad DAPA/placebo |
VICTORIA Placebo/superioridad Vericiguat/placebo |
EMPEROR R Placebo/superioridad Empaglifozina/placebo |
GALACTIC HF Placebo/superioridad Omecamtiv/placebo |
SOLOIST WHF Placebo/superioridad Sotaglifozina/placebo |
| Hipotensión sintomática (%, p) | 14/9.2 p<0.001 | 0.3/0.5 | 9.1/7.9 p=0.12 | 6/4.9 | ||
| Hipoglicemia | 1.5/0.3 | |||||
| Evento adverso renal | 3.3/4.5 p<0.007 | 6.5/7.2 p=0.36 | 2.1/2.2 | |||
| Hipercalemia | 16.1/17.3 p=0.15 | 0.1/0.2 | 4.4/5.6 | |||
| Tos | 11.3/14.3 p<0.001 | 4.4/4.2 | ||||
| Angioedema | 0.4/0.2 | |||||
| Depleción de volumen | 7.5/6.8 P=0.4 | |||||
| Síncope | 4/3.5 p=0.30 | |||||
| Infección tracto urinario | 4.8/5.1 | |||||
| Diarrea | 6.1/3.4 | |||||
| Anemia | 7.6/5.7 | |||||
| Evento isquémico cardiaco | 4.9/4.6 | |||||
| Arritmia ventricular severa | 2.9/3.1 |
Inhibidores del cotransportador sodio-glucosa 2 (ISGLT-2)
Desde el 2016 con la publicación del estudio EMPAREG-OUTCOME 53, en el cual se encontró disminución de la hospitalización por FC en los pacientes con diabetes mellitus (DM) sometidos a tratamiento con empagliflozina se despertó un creciente interés por el efecto de este grupo de medicamentos en el manejo de la FC. Se propone como mecanismo de acción de los ISGLT-2 en primer lugar la natriuresis y la glucosuria que además de disminuir la pre-carga y la poscarga, disminuye el edema intersticial lo cual está relacionado con la hipertrofia ventricular si bien este efecto se neutraliza hacia la semana 12 de tratamiento 54. El segundo efecto propuesto es la disminución de la PA, secundario a la disminución del tono simpático por inhibición directa de síntesis de noradrenalina por bloqueo de la hidroxilasa de tirosina renal 55; el tercer mecanismo es la disminución del consumo de glucosa por el cardiomiocito a favor del consumo de ácidos grasos y cetonas, los cuales además de ser más eficientes energéticamente tienen la capacidad de disminuir el estrés oxidativo 56; finalmente, aunque existen varios planteamientos que explican la mejoría de la contractilidad a partir del metabolismo del calcio, es el bloqueo del receptor NHE1 de forma directa por el ISGLT2 y la consiguiente disminución del sodio y el calcio intracelular, así como el aumento del calcio mitocondrial el que tiene mayor evidencia 56.
Su efecto clínico ha sido comprobado en años recientes en pacientes sin DM; así en el estudio DEFINE HF 57 se encontró que en pacientes con FEVI <40%, NYHA II-III, péptidos natriuréticos elevados con TFG ≥ 30mL/ min/1.73m2 se demostró superioridad de dapagliflozina en dosis 10 mg/día comparado con placebo en la disminución del desenlace coprimario dual que incluía reducción de al menos 20% de los niveles de NT-proBNP y aumento de > 5 puntos en la escala de Kansas (OR 1.8 IC 1.03-3.06), aunque en el otro desenlace coprimario del promedio de los niveles de NT-proBNP a las 6-12 semanas no hubo diferencias.
Posteriormente en el ensayo DAPA-HF 58 se demostró que en pacientes con FEVI <40% y NYHA >II con elevación de péptidos natriuréticos, a pesar de estar en terapia óptima, con TFG > 30 mL/min/1.73m2, PAS > 95 mmHg, sin DM tipo 1 se demostró superioridad de dapagliflozina en dosis 10 mg/día comparado con placebo en el desenlace combinado de empeoramiento de FC (hospitalización no planeada o visita urgente a urgencias para terapia intravenosa) o muerte cardiovascular (HR 0.74 IC 0.65-0.85).
En el estudio EMPEROR REDUCED 59 se aleatorizaron pacientes con FEVI <30%, NYHA ≥II, elevación de péptidos natriuréticos (en el caso de FEVI entre 30 y 40% se exigía además hospitalización por FC en el año previo o niveles muy altos de péptidos), a pesar de estar en terapia óptima, con TFG ≥20 mL/min/1.73m2, PAS >100 mmHg, se demostró superioridad de empagliflozina en dosis 10 mg/día comparado con placebo en disminución de hospitalización por FC o muerte cardiovascular (HR 0.75 IC 95% 0.65-0.86).
Finalmente, el estudio SOLOIST WHF en pacientes diabéticos tipo 2 con descompensación de FC, asignó en forma aleatoria después de estabilización, antes o dentro de los tres días siguientes al alta, a 200 mg de sotaglifozina (aumentando a 400 mg dependiendo de efectos secundarios) versus placebo; luego de una mediana de seguimiento de nueve meses redujo el desenlace primario combinado en forma significativa (HR 0.67 IC95% 0.52-0.85). Este estudio abre un horizonte interesante al sugerir que el inicio temprano de la terapia tiene efectos importantes, además, el efecto se mantiene en pacientes con FEVI ≥50%, lo que sugiere efecto esperanzador en pacientes con FC con fracción levemente reducida y preservada 60, como lo sugieren los resultados del reciente estudio EMPEROR PRESERVED (N Engl J Med 2021 DOI:10.1056/NEJMoa2107038).
Aunque dada la consistencia en la evidencia descrita se podría concluir que es efecto de grupo, los resultados del ensayo VERTIS CV 61 generan dudas al respecto, puesto que el uso de ertuglifozina en pacientes con diabetes tipo 2 no logró demostrar superioridad frente al placebo, pero si, no inferioridad; aunque la población de pacientes con FC incluida no superó el 25%; un reporte posterior con el análisis preespecificado sobre eventos relacionados con FC sugiere reducción de la hospitalización por FC (RR 0.70 IC 95% 0.56-0.87) y del desenlace combinado de hospitalización por FC/muerte de origen cardiovascular (RR 0.83 IC 95% 0.72-0.96) 62.
Ivabradina
La ivabradina inhibe la actividad de marcapasos del nodo sinusal al bloquear selectivamente los canales de hiperpolarización conocidos como funny (If), lo que produce disminución de la frecuencia cardiaca en pacientes con ritmo sinusal, sin afectar las cifras de presión arterial, la contractilidad cardiaca o la conducción intracardiaca 30. Entre los estudios encontrados sobre esta terapia tenemos el antecedente inicial en el estudio BEAUTIFUL 63, en pacientes con enfermedad coronaria y disfunción ventricular (FEVI <40%), no se encontraron diferencias entre la ivabradina y el placebo en el desenlace primario (HR 1 IC 95% 0.91-1.1), ni en los desenlaces secundarios integrantes del desenlace combinado primario; sin embargo, en el análisis de subgrupos, los pacientes con frecuencia cardiaca basal ≥70 lpm, reducía la incidencia de hospitalización por infarto de miocardio y la revascularización coronaria, aunque sin disminuir el objetivo primario ni la mortalidad total 64.
El estudio SHIFT 65, en pacientes con FC crónica con FEVI ≤35%, ritmo sinusal y frecuencia cardiaca en reposo ≥70 lpm. La ivabradina impactó el desenlace primario de muerte cardiovascular u hospitalización por FC (HR 0.82 IC 95% 0.75-0.90); además, de los desenlaces relacionados con la FC (hospitalización por FC HR 0.74 IC 95% 0.66-0.83; y mortalidad por FC HR 0.74 IC 95% 0.58-0.94).
Los pacientes tratados con ivabradina tienen una reducción promedio de la frecuencia cardiaca de 8 lpm, mientras que un metaanálisis de pacientes con FC-FEVIr con betabloqueadores mostró reducción de 12 lpm 66; Cullington y colaboradores 67 demostraron que la proporción de pacientes en los que estaría indicada la adición de ivabradina según los criterios del estudio SHIFT, cayó de 19.4% del total en la visita inicial a sólo 9% a los 12 meses de seguimiento tras el ajuste adecuado de la dosis de betabloqueadores.
Hidralazina y dinitrato de isosorbide
La evidencia de la utilidad clínica de hidralazina y dinitrato de isosorbide viene inicialmente del ensayo V-HeFT I, que comparó tres tratamientos: placebo, prazosina o dinitrato de isosorbide e hidralazina; a los dos años hubo una reducción en el desenlace primario de mortalidad acumulada de 34% en el grupo de hidralazina y dinitrato de isosorbide comparado con placebo (p=0.028, 95% IC 95% 4-54%) 68; posteriormente, el estudio V-HeFT II comparó hidralazina en combinación con dinitrato de isosorbide frente a enalapril; a los dos años hubo reducción de la mortalidad por todas las causas significativamente más alta en el grupo enalapril (RAR 6%, p= 0.016) y a los 2.5 años las diferencias en mortalidad no se mantuvieron entre los dos grupos (RAR 5.4%, p=0.08), mejoría del consumo pico de oxígeno y de la FEVI en el grupo hidralazina-dinitrato de isosorbide comparado con enalapril de forma temprana como parte de los resultados secundarios 69.
A partir de observaciones que sugerían mayor beneficio en población afroamericana se realizó el estudio A-HeFT, el cual aleatorizó 1050 pacientes de raza negra con FC en clase funcional III/IV y dilatación ventricular a recibir una dosis fija de hidralazina y dinitrato de isosorbide (n=518) comparado con placebo (n=532) además de la terapia médica estándar. El estudio se terminó de forma temprana al demostrar que la hidralazina en combinación con dinitrato de isosorbide resultaba en una mortalidad significativamente menor comparado con placebo (6.2% vs 10.2%, p= 0.02). El resultado compuesto de eventos secundarios fue igualmente mejor en el grupo de intervención con 43% de reducción en la muerte por cualquier causa (HR 0.57; p=0.01), 33% de reducción en la tasa de primera hospitalización por FC (16.4% vs 22.4%, p=0.01) así como mejoría en la calidad de vida 70.
Vericiguat
El vericiguat es un estimulador oral de la guanilato cicla-sa soluble que incrementa la actividad del GMP cíclico, el cual es un segundo mensajero involucrado en la regulación de acciones protectoras a nivel cardiorrenal y metabólico. El estudio SOCRATES-REDUCED aleatorizó 456 pacientes con FC con FEVI <45% y un episodio de descompensación reciente (<4 semanas); en total 377 pacientes completaron el tratamiento y no hubo diferencia entre el nivel basal y el de las 12 semanas de NT-proBNP entre el grupo de tratamiento con vericiguat y el grupo placebo, con adecuada tolerancia sin diferencias en eventos adversos, con relación lineal entre la dosis de vericiguat utilizada y el grado de reducción en los niveles de NT-proBNP 71.
El estudio VICTORIA, involucró 5050 pacientes con FC-FEVIr de alto riesgo (40% en clase funcional III de la NYHA), compromiso sistólico severo de la función ventricular (FEVI media de 29%), con niveles de péptidos natriuréticos elevados y con descompensación reciente (80% en los últimos tres meses) a recibir vericiguat oral, dosis objetivo de 10 mg día comparado con placebo además de la terapia dirigida por guías. El estudio demostró reducción modesta en el desenlace primario de muerte cardiovascular o primera hospitalización por FC (35.5% vs 38.5%, HR 0.9 [95% IC, 0.82-0.98, p=0.02]), derivado principalmente del efecto sobre hospitalizaciones por FC o por cualquier causa, sin impacto en muerte de origen cardiovascular o en las totales. La media de seguimiento de los pacientes fue de 10.8 meses. Dadas sus propiedades vasodilatadoras, hubo hipotensión sintomática en 9.1% de los pacientes comparado con 7.9% en el grupo placebo (p=0.12) y síncope en 4% frente a 3.5% en grupo placebo (p=0.30) 72.
Omecamtiv mecarbil
El omecamtiv mecarbil es un activador de la miosina cardiaca selectivo que aumenta la contractilidad al unirse en un sitio alostérico, lo que acelera la velocidad de transición de una unión débil a una fuerte, logrando el aumento del número de cabezas de miosina que se unen al filamento de actina con la generación de mayor fuerza; además, al estabilizar el estado basal disminuye el recambio de ATP en ausencia de interacción con la actina, lo que mejora la eficiencia energética.
El ensayo de fase 3 GALACTIC HF en 8256 pacientes con FC crónica con FEVI ≤35% comparó omecamtiv mecarbil con placebo, demostró reducción del desenlace primario de evento relacionado a FC o muerte cardiovascular (HR 0.92 IC 95% 0.86-0.99), sin impacto en mortalidad cardiovascular ni en calidad de vida evaluada con el cuestionario de Kansas. A pesar de su modesto efecto en el grupo total, el hallazgo sobre el impacto diferencial de acuerdo con la FEVI, con punto de corte de mediana ≤ 28%, genera una hipótesis interesante que debe comprobarse en un ensayo clínico posterior 73.
Digoxina
La digoxina, un inhibidor de la bomba sodio/potasio ATPasa 74, fue evaluada en el estudio DIG, en 6800 pacientes con FC y FEVI <45%; el estudio no demostró diferencias en mortalidad [34.8% vs 35.1% (RR 0.99 IC 95% 0.91-1.07, p=0.08)], pero sí hubo reducción en las tasas de hospitalización total y por descompensación de FC [26.8% vs 34.7% (RR 0.72 IC 95% 0.66-0.79, p=0.001)]. En un análisis de resultados secundarios se demostró que la digoxina presentó tendencia a disminuir la muerte atribuible al empeoramiento de FC [RR 0.88 (95% IC, 0.77-1.01, p=0.06)] 75. El análisis preespecificado de subgrupos de alto riesgo (NYHA III-IV, FEVI < 25%, índice cardiotorácico > 55%), demostró a los dos años de seguimiento reducción del desenlace de hospitalización y muerte de cualquier causa 76.
Una revisión de Cochrane demostró que la digoxina no reduce la mortalidad por todas las causas ni por FC, pero reduce síntomas y readmisiones por FC en 32% [OR 0.68, 95% (IC 95% 0.61-0.75, p < 0.00001)]. Los beneficios fueron mayores en pacientes con mayor compromiso de la FEVI (< 25%) o clase funcional NYHA III/IV. En un análisis por subgrupos de acuerdo con las concentraciones séricas de digoxina mostró que los pacientes que mantenían niveles entre 0.5 y 0.8 ng/mL tenían reducción de mortalidad por todas las causas en 20% (HR 0.8, [95% IC 0.68-0.94, p= 0.005]). El incremento en las complicaciones arrítmicas se identificó en pacientes con niveles séricos de digoxina >1.2 ng/mL, especialmente en pacientes con enfermedad renal en donde se hace necesario el monitoreo estrecho 77.
Diuréticos
Su uso se fundamenta principalmente en pequeños ensayos clínicos controlados en los que se ha demostrado que son bien tolerados y alivian la congestión mejorando los edemas y reducción de peso corporal 78. Se ha demostrado así mismo la modificación en parámetros neurohormonales asociados a la congestión 63. Los agentes preferidos son los diuréticos de asa (furosemida, bumetanida, torasemida), aunque las tiazidas pueden adicionarse en pacientes con resistencia a los diuréticos, al igual que los ahorradores de potasio 3,25. Los principales eventos adversos relacionados a su uso lo constituyen los trastornos hidroelectrolíticos y alteración en la función renal 79; a largo plazo los efectos sobre desenlaces no son claros 80.
Los estudios con otras alternativas terapéuticas para manejar la congestión, como los antagonistas de la arginina vasopresina, no han demostrado impacto sobre desenlaces clínicos, aunque si aumento de volumen urinario y disminución de peso 81,82.
Tratamiento de las comorbilidades y dispositivos
Existe otro tipo de terapias que incluyen la suplementación de hierro, el manejo de la fibrilación auricular, desfibrilador automático implantable, resincronización cardiaca, modulación de la contractilidad cardiaca, Clip mitral, CardioMEMS y los dispositivos de asistencia ventricular que han demostrado beneficio en grupos específicos de pacientes, luego de optimizar el manejo considerado como estándar 83-129 (Anexo 1).
Discusión
Dada la evidencia actual, los ensayos publicados especialmente durante el último año, el algoritmo sugerido en la GPC de falla cardiaca debe actualizarse con la intención de introducir nuevas terapias; teniendo en cuenta la magnitud del beneficio del tratamiento y que el efecto podría considerarse independiente de cada uno de los grupos de medicamentos, soportado en el análisis de subgrupos de los estudios.
La consistencia de los estudios con ARNI lo ubican como terapia de elección en reemplazo de los IECA/ARA II, reservando estos últimos para algunos casos, específicamente en pacientes que no lo toleren por hipotensión. De igual manera los ISGLT2, en conjunto con los ya posicionados betabloqueadores y ARM complementan esta terapia de primera línea. Los resultados con otras moléculas nuevas como el vericiguat y el omecamtiv mecarbil son modestos y deberían reservarse solo para algunos casos que no logren estabilizarse con el manejo estándar. El riesgo de sesgos se consideró bajo en todos los ítems.
El análisis del índice de fragilidad comparando las estrategias clásicas con las nuevas demuestran resultados robustos para betabloqueadores, espironolactona y sacubitril/valsartan y débiles para los IECAS, ARA II, vericiguat y omecamtiv mecarbil, aunque se debe tener en cuenta que pueden influir algunos factores como el tamaño del efecto esperado, el número de eventos y la potencia del estudio 130.
La propuesta se diseñó como un círculo de decisiones con un núcleo central, que incluye lo que se considera el pilar de manejo de la FC (Figura 1), el cual se amplía de acuerdo a ciertas variables que pueden considerarse o introducirse en el manejo, considerando la evolución del cuadro clínico.
El núcleo central se organiza en forma jerárquica con la intención de resaltar los pilares fundamentales del tratamiento y dar una recomendación general del inicio y la titulación de las dosis de acuerdo con el monitoreo y la evolución clínica del paciente, apoyado en los ensayos mencionados. La siguiente órbita contiene las intervenciones a seguir luego de alcanzar las metas del núcleo fundamental que contiene cuatro estrategias, cuya fortaleza de la evidencia se discrimina con base en el soporte del diseño de ensayos clínicos, el desenlace impactado y las variables a considerar para su utilización.
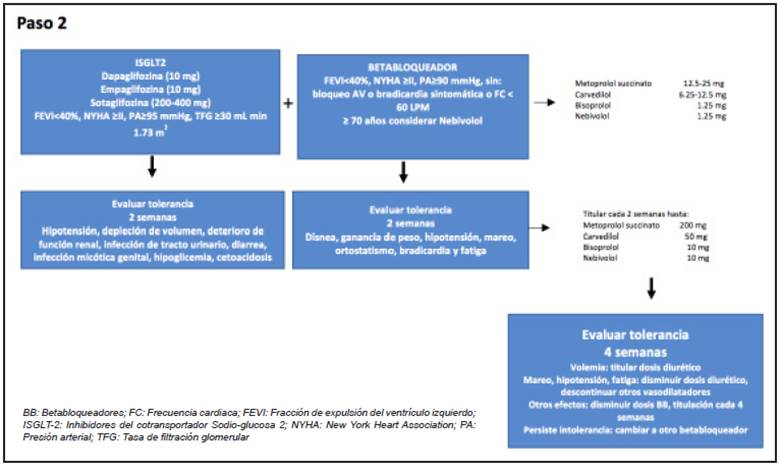
La sugerencia es iniciar en el paso uno con el ARNI (Figura 2), hasta ahora el único disponible es la combinación de sacubitril/valsartán. En el paso 2 el ISGLT-2 más el betabloqueador (Figura 3) y por último el ARM (Figura 4).
Es importante resaltar que el algoritmo está concebido con la intención de dar inicio temprano a estas terapias consideradas como pilares, que la titulación sugerida puede ser modificada de acuerdo con el estado clínico del paciente, aunque se espera que el uso de estas recomendaciones mejore la tolerancia y adherencia como norma general y que pueden dejarse dosis bajas de todos los grupos, para luego aumentar la dosis en la secuencia de pasos definida 131.
Otras terapias como la rehabilitación cardiaca, incluido programa de ejercicio, vacunación y cuidados paliativos deben ser utilizadas en forma concomitante, idealmente en un programa estructurado de Clínica de Falla Cardiaca. Los pacientes que persistan sintomáticos a pesar del uso de esta estrategia deben ser remitidos para valoración por un grupo de trasplante cardiaco, especialmente si tienen entre 18 y 70 años; estado funcional NYHA III o IV; consumo de oxígeno pico (VO2 pico) ≤ 14 mL/Kg/minuto o en presencia de betabloqueador ≤ 12 mL/Kg/minuto, en pacientes < 50 años adicionar VO2 pico ≤ 50% del valor esperado (predicho) y en prueba submáxima (RER <1.05) utilizar la pendiente del equivalente de la ventilación de CO2 > 35 en la prueba de esfuerzo cardiopulmonar; y se clasifiquen como alto riesgo por la escala de Heart Failure Survival Score o tengan expectativa de vida < 80% a un año en la escala de Seattle Heart Failure Model132.
REFERENCIAS
1. Senior JM, Lugo LH, Díaz JS, Muñoz E TN et al. C. Ministerio de Salud y Protección Social. Guía de Práctica Clínica para la prevención, diagnóstico, tratamiento y rehabilitación de la falla cardíaca en población mayor de 18 años clasificación B, C y D. Gpc.minsalud.gov.co, Guía Complet No 53 [GPC en Internet] Edición 1° Bogotá DC El Minist 2016 [consultada 2016]. 2016: Disponible en gpc.minsalud.gov.co. [ Links ]
2. Maggioni AP, Dahlstrom U, Filippatos G, et al. EUR Observational Research Programme: regional differences and 1-year follow-up results of the Heart Failure Pilot Survey (ESC-HF Pilot). Eur J Heart Fail. 2013;15(7):808-817. doi:10.1093/eurjhf/hft050 [ Links ]
3. Jones NR, Roalfe AK, Adoki I, Hobbs FDR, Taylor CJ. Survival of patients with chronic heart failure in the community: a systematic review and meta D analysis. Eur J Heart Fail. 2019;21(11):1306-1325. doi:10.1002/ejhf.1594 [ Links ]
4. Cikes M, Solomon SD. Beyond ejection fraction: an integrative approach for assessment of cardiac structure and function in heart failure. Eur Heart J. 2016;37(21):1642-1650. doi:10.1093/eurheartj/ehv510 [ Links ]
5. McDonagh T, Metra M, Adamo M, Gardner R, Baumbach A et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart Failure. Eur Heart J 2021;42(36):3599-3726. doi: 10.1093/eurheartj/ehab368. [ Links ]
6. Burnett H, Earley A, Voors AA, et al. Thirty Years of Evidence on the Efficacy of Drug Treatments for Chronic Heart Failure With Reduced Ejection Fraction. Circ Hear Fail. 2017;10(1). doi:10.1161/CIRCHEARTFAILURE.116.003529 [ Links ]
7. Liberati A. The PRISMA Statement for Reporting Systematic Reviews and Meta-Analyses of Studies That Evaluate Health Care Interventions: Explanation and Elaboration. Ann Intern Med. 2009;151(4):W. doi:10.7326/0003-4819-151-4-200908180-00136 [ Links ]
8. Walsh M, Srinathan SK, McAuley DF, et al. The statistical significance of randomized controlled trial results is frequently fragile: a case for a Fragility Index. J Clin Epidemiol. 2014;67(6):622-628. doi:10.1016/j.jclinepi.2013.10.019 [ Links ]
9. Ondetti, M. A., Williams, N. J., Sabo, E., Pluscec, J., Weaver, E. R., & Kocy, O. Angiotensin-converting enzyme inhibitors from the venom of Bothrops jararaca. Isolation, elucidation of structure, and synthesis. Biochemistry, 10(22), 4033-4039. [ Links ]
10. Hoyer J, Schulte K-L, Lenz T. Clinical Pharmacokinetics of Angiotensin Converting Enzyme (ACE) Inhibitors in Renal Failure. Clin Pharmacokinet. 1993;24(3):230-254. doi:10.2165/00003088-199324030-00005 [ Links ]
11. Kostis JB. Angiotensin-Converting Enzyme Inhibitors. Am J Hypertens. 1989;2(1):57-64. doi:10.1093/ajh/2.1.57 [ Links ]
12. Francis GS, Benedict C, Johnstone DE, et al. Comparison of neuroendocrine activation in patients with left ventricular dysfunction with and without congestive heart failure. A substudy of the Studies of Left Ventricular Dysfunction (SOLVD). Circulation. 1990;82(5):1724-1729. doi:10.1161/01.CIR.82.5.1724 [ Links ]
13. Swedberg K. Importance of neuroendocrine activation in chronic heart failure. Impact on treatment strategies. Eur J Heart Fail. 2000;2(3):229-233. doi:10.1016/S1388-9842(00)00102-1 [ Links ]
14. Oates JA, Wood AJJ, Williams GH. Converting-Enzyme Inhibitors in the Treatment of Hypertension. N Engl J Med. 1988;319(23):1517-1525. doi:10.1056/NEJM198812083192305 [ Links ]
15. Effects of Enalapril on Mortality in Severe Congestive Heart Failure. N Engl J Med. 1987;316(23):1429-1435. doi:10.1056/NEJM198706043162301 [ Links ]
16. Effect of Enalapril on Survival in Patients with Reduced Left Ventricular Ejection Fractions and Congestive Heart Failure. N Engl J Med. 1991;325(5):293-302. doi:10.1056/NEJM199108013250501 [ Links ]
17. Pfeffer MA, Braunwald E, Moyé LA, et al. Effect of Captopril on Mortality and Morbidity in Patients with Left Ventricular Dysfunction after Myocardial Infarction. N Engl J Med. 1992;327(10):669-677. doi:10.1056/NEJM199209033271001 [ Links ]
18. The Acute Infarction Ramipril Efficacy (AIRE) Study Investigators. Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure. Lancet. 1993;342(8875). doi:10.1016/0140-6736(93)92693-N [ Links ]
19. Gaziano TA, Fonarow GC, Velazquez EJ, Morrow DA, Braunwald E, Solomon SD. Cost-effectiveness of Sacubitril-Valsartan in Hospitalized Patients Who Have Heart Failure With Reduced Ejection Fraction. JAMA Cardiol. August 2020. doi:10.1001/jamacardio.2020.2822 [ Links ]
20. López-Sendón J, Swedberg K, McMurray J, et al. Documento de Consenso de Expertos sobre el uso de inhibidores de la enzima de conversión de la angiotensina en la enfermedad cardiovascular. Rev Española Cardiol. 2004;57(12):1213-1232. doi:10.1157/13069868 [ Links ]
21. McMurray JJ, Ostergren J, Swedberg K, et al. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial. Lancet. 2003;362(9386):767-771. doi:10.1016/S0140-6736(03)14283-3 [ Links ]
22. Cohn JN, Tognoni G. A Randomized Trial of the Angiotensin-Receptor Blocker Valsartan in Chronic Heart Failure. N Engl J Med. 2001;345(23):1667-1675. doi:10.1056/NEJMoa010713 [ Links ]
23. Pitt B, Poole-Wilson PA, Segal R, et al. Effect of losartan compared with captopril on mortality in patients with symptomatic heart failure: randomised trial-the Losartan Heart Failure Survival Study ELITE II. Lancet. 2000;355(9215):1582-1587. doi:10.1016/S0140-6736(00)02213-3 [ Links ]
24. Dickstein K, Kjekshus J. Effects of losartan and captopril on mortality and morbidity in high-risk patients after acute myocardial infarction: the OPTI-MAAL randomised trial. Lancet. 2002;360(9335):752-760. doi:10.1016/S0140-6736(02)09895-1 [ Links ]
25. Granger CB, McMurray JJ, Yusuf S, et al. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial. Lancet. 2003;362(9386):772-776. doi:10.1016/S0140-6736(03)14284-5 [ Links ]
26. Foody JM, Farrell MH, Krumholz HM. p-Blocker Therapy in Heart Failure. JAMA. 2002;287(7):883. doi:10.1001/jama.287.7.883 [ Links ]
27. Shah NB, Der E, Ruggerio C, Heidenreich PA, Massie BM. Prevention of hospitalizations for heart failure with an interactive home monitoring program. Am Heart J. 1998;135(3):373-378. doi:10.1016/S0002-8703(98)70310-2 [ Links ]
28. Khand A, Gemmel I, Clark AL, Cleland JG. Is the prognosis of heart failure improving? J Am Coll Cardiol. 2000;36(7):2284-2286. doi:10.1016/S0735-1097(00)00995-5 [ Links ]
29. Bristow MR, Gilbert EM, Abraham WT, et al. Carvedilol Produces Dose-Related Improvements in Left Ventricular Function and Survival in Subjects With Chronic Heart Failure. Circulation. 1996;94(11):2807-2816. doi:10.1161/01.CIR.94.11.2807 [ Links ]
30. Murphy SP, Ibrahim NE, Januzzi JL. Heart Failure With Reduced Ejection Fraction. JAMA. 2020;324(5):488. doi:10.1001/jama.2020.10262 [ Links ]
31. Kotecha D, Holmes J, Krum H, et al. Efficacy of p blockers in patients with heart failure plus atrial fibrillation: an individual-patient data meta-analysis. Lancet. 2014;384(9961):2235-2243. doi:10.1016/S0140-6736(14)61373-8 [ Links ]
32. Kotecha D, Bunting K V., Gill SK, et al. Effect of Digoxin vs Bisoprolol for Heart Rate Control in Atrial Fibrillation on Patient-Reported Quality of Life. JAMA. 2020;324(24):2497. doi:10.1001/jama.2020.23138 [ Links ]
33. Struthers AD, Unger T. Physiology of aldosterone and pharmacology of aldosterone blockers. Eur Heart J Suppl B 2011; 13: 27B-30B. [ Links ]
34. Struthers AD. The clinical implications of aldosterone escape in congestive heart failure. Eur J Heart Fail. 2004;6(5):539-545. doi:10.1016/j.ejheart.2004.04.013 [ Links ]
35. Turban S, Wang X-Y, Knepper MA. Regulation of NHE3, NKCC2, and NCC abundance in kidney during aldosterone escape phenomenon: role of NO. Am J Physiol Physiol. 2003;285(5):F843-F851. doi:10.1152/ajprenal.00110.2003 [ Links ]
36. Zannad F, McMurray JJV, Krum H, et al. Eplerenone in Patients with Systolic Heart Failure and Mild Symptoms. N Engl J Med. 2011;364(1):11-21. doi:10.1056/NEJMoa1009492 [ Links ]
37. Pitt B, Remme W, Zannad F, et al. Eplerenone, a Selective Aldosterone Blocker, in Patients with Left Ventricular Dysfunction after Myocardial Infarction. N Engl J Med. 2003;348(14):1309-1321. doi:10.1056/NEJMoa030207 [ Links ]
38. Pitt B, Zannad F, Remme WJ, et al. The Effect of Spironolactone on Morbidity and Mortality in Patients with Severe Heart Failure. N Engl J Med. 1999;341(10):709-717. doi:10.1056/NEJM199909023411001 [ Links ]
39. Vaduganathan M, Claggett BL, Jhund PS, et al. Estimating lifetime benefits of comprehensive disease-modifying pharmacological therapies in patients with heart failure with reduced ejection fraction: a comparative analysis of three randomised controlled trials. Lancet. 2020;396(10244):121-128. doi:10.1016/S0140-6736(20)30748-0 [ Links ]
40. Filippatos G, Anker SD, Bohm M, et al. A randomized controlled study of finerenone vs. eplerenone in patients with worsening chronic heart failure and diabetes mellitus and/or chronic kidney disease. Eur Heart J. 2016;37(27):2105-2114. doi:10.1093/eurheartj/ehw132 [ Links ]
41. Bakris GL, Agarwal R, Anker SD, et al. Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes. N Engl J Med. 2020;383(23):2219-2229. doi:10.1056/NEJMoa2025845 [ Links ]
42. Tsao CW, Lyass A, Enserro D, et al. Temporal Trends in the Incidence of and Mortality Associated With Heart Failure With Preserved and Reduced Ejection Fraction. JACC Hear Fail. 2018;6(8):678-685. doi:10.1016/j.jchf.2018.03.006 [ Links ]
43. Daniels LB, Maisel AS. Natriuretic Peptides. J Am Coll Cardiol. 2007;50(25):2357-2368. doi:10.1016/j.jacc.2007.09.021 [ Links ]
44. O'Connor CM, Starling RC, Hernandez AF, et al. Effect of Nesiritide in Patients with Acute Decompensated Heart Failure. N Engl J Med. 2011;365(1):32-43. doi:10.1056/NEJMoa1100171 [ Links ]
45. Hata N, Seino Y, Tsutamoto T, et al. Effects of Carperitide on the Long-Term Prognosis of Patients With Acute Decompensated Chronic Heart Failure. Circ J. 2008;72(11):1787-1793. doi:10.1253/circj.CJ-08-0130 [ Links ]
46. O.Connell JE, Jardine AG, Davidson G, Connell JMC. Candoxatril, an orally active neutral endopeptidase inhibitor, raises plasma atrial natriuretic factor and is natriuretic in essential hypertension. J Hypertens. 1992;10(3):271-277. doi:10.1097/00004872-199203000-00011 [ Links ]
47. Packer M, Califf RM, Konstam MA, et al. Comparison of Omapatrilat and Enalapril in Patients With Chronic Heart Failure. Circulation. 2002;106(8):920-926. doi:10.1161/01.CIR.0000029801.86489.50 [ Links ]
48. McMurray JJV, Packer M, Desai AS, et al. Angiotensin-Neprilysin Inhibition versus Enalapril in Heart Failure. N Engl J Med. 2014;371(11):993-1004. doi:10.1056/NEJMoa1409077 [ Links ]
49. Velazquez EJ, Morrow DA, DeVore AD, et al. Angiotensin-Neprilysin Inhibition in Acute Decompensated Heart Failure. N Engl J Med. 2019;380(6):539-548. doi:10.1056/NEJMoa1812851 [ Links ]
50. Senni M, McMurray JJV, Wachter R, et al. Initiating sacubitril/valsartan (LCZ696) in heart failure: results of TITRATION, a doubleDblind, randomized comparison of two uptitration regimens. Eur J Heart Fail. 2016; 18(9):1193-1202. doi:10.1002/ejhf.548 [ Links ]
51. Wachter R, Senni M, Belohlavek J, et al. Initiation of sacubitril/valsartan in haemodynamically stabilised heart failure patients in hospital or early after discharge: primary results of the randomised TRANSITION study. Eur J Heart Fail. 2019;21(8):998-1007. doi:10.1002/ejhf.1498 [ Links ]
52. Januzzi JL, Prescott MF, Butler J, et al. Association of Change in N-Terminal Pro-B-Type Natriuretic Peptide Following Initiation of Sacubitril-Valsartan Treatment With Cardiac Structure and Function in Patients With Heart Failure With Reduced Ejection Fraction. JAMA. 2019;322(11):1085. doi:10.1001/jama.2019.12821 [ Links ]
53. Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 2015;373(22):2117-2128. doi:10.1056/NEJMoa1504720 [ Links ]
54. Hallow KM, Helmlinger G, Greasley PJ, McMurray JJ V., Boulton DW. Why do SGLT2 inhibitors reduce heart failure hospitalization? A differential volume regulation hypothesis. Diabetes, Obes Metab. 2018;20(3):479-487. doi:10.1111/dom.13126 [ Links ]
55. Matthews VB, Elliot RH, Rudnicka C, Hricova J, Herat L, Schlaich MP. Role of the sympathetic nervous system in regulation of the sodium glucose cotransporter 2. J Hypertens. 2017;35(10):2059-2068. doi:10.1097/HJH.0000000000001434 [ Links ]
56. Santos-Gallego CG, Requena-Ibanez JA, San Antonio R, et al. Empagliflozin Ameliorates Adverse Left Ventricular Remodeling in Nondiabetic Heart Failure by Enhancing Myocardial Energetics. J Am Coll Cardiol. 2019;73(15):1931-1944. doi:10.1016/j.jacc.2019.01.056 [ Links ]
57. Nassif ME, Windsor SL, Tang F, et al. Dapagliflozin Effects on Biomarkers, Symptoms, and Functional Status in Patients With Heart Failure With Reduced Ejection Fraction. Circulation. 2019;140(18):1463-1476. doi:10.1161/CIRCU-LATIONAHA.119.042929 [ Links ]
58. McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2019;381(21):1995-2008. doi:10.1056/NEJMoa1911303 [ Links ]
59. Packer M, Anker SD, Butler J, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med. 2020;383(15):1413-1424. doi:10.1056/NEJMoa2022190 [ Links ]
60. Bhatt DL, Szarek M, Steg PG, et al. Sotagliflozin in Patients with Diabetes and Recent Worsening Heart Failure. N Engl J Med. November 2020:NEJ-Moa2030183. doi:10.1056/NEJMoa2030183 [ Links ]
61. Cannon CP, Pratley R, Dagogo-Jack S, et al. Cardiovascular Outcomes with Ertugliflozin in Type 2 Diabetes. N Engl J Med. 2020;383(15):1425-1435. doi:10.1056/NEJMoa2004967 [ Links ]
62. Cosentino F, Cannon CP, Cherney DZI, et al. Efficacy of Ertugliflozin on Heart Failure-Related Events in Patients With Type 2 Diabetes Mellitus and Established Atherosclerotic Cardiovascular Disease. Circulation. 2020;142(23):2205-2215. doi:10.1161/CIRCULATIONAHA.120.050255 [ Links ]
63. Fox K, Ford I, Steg PG, Tendera M, Ferrari R. Ivabradine for patients with stable coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a randomised, double-blind, placebo-controlled trial. Lancet. 2008;372(9641):807-816. doi:10.1016/S0140-6736(08)61170-8 [ Links ]
64. Fox K, Ford I, Steg PG, Tendera M, Robertson M, Ferrari R. Heart rate as a prognostic risk factor in patients with coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a subgroup analysis of a randomised controlled trial. Lancet. 2008;372(9641):817-821. doi:10.1016/S0140-6736(08)61171-X [ Links ]
65. Swedberg K, Komajda M, Bohm M, et al. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study. Lancet. 2010;376(9744):875-885. doi:10.1016/S0140-6736(10)61198-1 [ Links ]
66. Kotecha D, Flather MD, Altman DG, et al. Heart Rate and Rhythm and the Benefit of Beta-Blockers in Patients With Heart Failure. J Am Coll Cardiol. 2017;69(24):2885-2896. doi:10.1016/j.jacc.2017.04.001 [ Links ]
67. Cullington D, Goode KM, Cleland JGF, Clark AL. Limited role for ivabradine in the treatment of chronic heart failure. Heart. 2011;97(23):1961-1966. doi:10.1136/heartjnl-2011-300041 [ Links ]
68. Cohn JN, Archibald DG, Ziesche S, et al. Effect of Vasodilator Therapy on Mortality in Chronic Congestive Heart Failure. N Engl J Med. 1986;314(24):1547-1552. doi:10.1056/NEJM198606123142404 [ Links ]
69. Cohn JN, Johnson G, Ziesche S, et al. A Comparison of Enalapril with Hydralazine-Isosorbide Dinitrate in the Treatment of Chronic Congestive Heart Failure. N Engl J Med. 1991;325(5):303-310. doi:10.1056/NEJM199108013250502 [ Links ]
70. Taylor AL, Ziesche S, Yancy C, et al. Combination of Isosorbide Dinitrate and Hydralazine in Blacks with Heart Failure. N Engl J Med. 2004;351(20):2049-2057. doi:10.1056/NEJMoa042934 [ Links ]
71. Gheorghiade M, Greene SJ, Butler J, et al. Effect of Vericiguat, a Soluble Guanylate Cyclase Stimulator, on Natriuretic Peptide Levels in Patients With Worsening Chronic Heart Failure and Reduced Ejection Fraction. JAMA. 2015;314(21):2251. doi:10.1001/jama.2015.15734 [ Links ]
72. Armstrong PW, Pieske B, Anstrom KJ, et al. Vericiguat in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2020;382(20):1883-1893. doi:10.1056/NEJMoa1915928 [ Links ]
73. Teerlink JR, Diaz R, Felker GM, et al. Cardiac Myosin Activation with Omecamtiv Mecarbil in Systolic Heart Failure. N Engl J Med. November 2020:NEJMoa2025797. doi:10.1056/NEJMoa2025797 [ Links ]
74. Gheorghiade M, Adams KF, Colucci WS. Digoxin in the Management of Cardiovascular Disorders. Circulation. 2004;109(24):2959-2964. doi:10.1161/01.CIR.0000132482.95686.87 [ Links ]
75. The Effect of Digoxin on Mortality and Morbidity in Patients with Heart Failure. N Engl J Med. 1997;336(8):525-533. doi:10.1056/NEJM199702203360801 [ Links ]
76. Gheorghiade M, Patel K, Filippatos G, et al. Effect of oral digoxin in high-risk heart failure patients: a pre-specified subgroup analysis of the DIG trial. Eur J Heart Fail. 2013;15(5):551-559. doi:10.1093/eurjhf/hft010 [ Links ]
77. Hood Jr. WB, Dans AL, Guyatt GH, Jaeschke R, McMurray JJ. Digitalis for treatment of heart failure in patients in sinus rhythm. Cochrane Database Syst Rev. April 2014. doi:10.1002/14651858.CD002901.pub3 [ Links ]
78. Patterson JH, Adams KF, Applefeld MM, Corder CN, Masse BR. Oral Torsemide in Patients With Chronic Congestive Heart Failure: Effects on Body Weight, Edema, and Electrolyte Excretion. Pharmacother J Hum Pharmacol Drug Ther. 1994;14(5):514-521. doi:10.1002/j.1875-9114.1994.tb02848.x [ Links ]
79. Anand IS, Kalra GS, Harris P et al. Diuretics as initial and sole treatment in chronic cardiac failure. Cardioscience. 2(4):273-8. [ Links ]
80. Faris RF, Flather M, Purcell H, Poole-Wilson PA, Coats AJ. Diuretics for heart failure. Cochrane Database Syst Rev. April 2016. doi:10.1002/14651858.CD003838.pub4 [ Links ]
81. Gattis W a, Connor CMO, Adams KF, et al. Effects of Tolvaptan Heart Fail. 2004;291(16):1963-1971. [ Links ]
82. Konstam MA. Effects of Oral Tolvaptan in Patients Hospitalized for Worsening Heart Failure The EVEREST Outcome Trial. JAMA. 2007;297(12):1319. doi:10.1001/jama.297.12.1319 [ Links ]
83. Jankowska EA, Rozentryt P, Witkowska A, et al. Iron deficiency: an ominous sign in patients with systolic chronic heart failure. Eur Heart J. 2010;31(15):1872-1880. doi:10.1093/eurheartj/ehq158 [ Links ]
84. Comín-Colet J, Enjuanes C, González G, et al. Iron deficiency is a key determinant of health-related quality of life in patients with chronic heart failure regardless of anaemia status. Eur J Heart Fail. 2013;15(10):1164-1172. doi:10.1093/eurjhf/hft083 [ Links ]
85. Enjuanes C, Klip IjT, Bruguera J, et al. Iron deficiency and health-related quality of life in chronic heart failure: Results from a multicenter European study. Int J Cardiol. 2014;174(2):268-275. doi:10.1016/j.ijcard.2014.03.169 [ Links ]
86. Klip IjT, Comin-Colet J, Voors AA, et al. Iron deficiency in chronic heart failure: An international pooled analysis. Am Heart J. 2013;165(4):575-582.e3. doi:10.1016/j.ahj.2013.01.017 [ Links ]
87. Ponikowski P, van Veldhuisen DJ, Comin-Colet J, et al. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J. 2015;36(11):657-668. doi:10.1093/eurheartj/ehu385 [ Links ]
88. Anker SD, Comin Colet J, Filippatos G, et al. Ferric Carboxymaltose in Patients with Heart Failure and Iron Deficiency. N Engl J Med. 2009;361(25):2436-2448. doi:10.1056/NEJMoa0908355 [ Links ]
89. Ponikowski P, Kirwan B-A, Anker SD, et al. Ferric carboxymaltose for iron deficiency at discharge after acute heart failure: a multicentre, double-blind, randomised, controlled trial. Lancet. 2020;396(10266):1895-1904. doi:10.1016/S0140-6736(20)32339-4 [ Links ]
90. Lewis GD, Malhotra R, Hernandez AF, et al. Effect of Oral Iron Repletion on Exercise Capacity in Patients With Heart Failure With Reduced Ejection Fraction and Iron Deficiency. JAMA. 2017;317(19):1958. doi:10.1001/jama.2017.5427 [ Links ]
91. Maisel WH, Stevenson LW. Atrial fibrillation in heart failure: epidemiology, pathophysiology, and rationale for therapy. Am J Cardiol. 2003;91(6):2-8. doi:10.1016/S0002-9149(02)03373-8 [ Links ]
92. Mamas MA, Caldwell JC, Chacko S, Garratt CJ, Fath-Ordoubadi F, Neyses L. A meta-analysis of the prognostic significance of atrial fibrillation in chronic heart failure. Eur J Heart Fail. 2009;11(7):676-683. doi:10.1093/eurjhf/hfp085 [ Links ]
93. Agarwal M, Apostolakis S, Lane DA, Lip GYH. The Impact of Heart Failure and Left Ventricular Dysfunction in Predicting Stroke, Thromboembolism, and Mortality in Atrial Fibrillation Patients: A Systematic Review. Clin Ther. 2014;36(9):1135-1144. doi:10.1016/j.clinthera.2014.07.015 [ Links ]
94. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. August 2020. doi:10.1093/eurheartj/ehaa612 [ Links ]
95. Cadrin-Tourigny J, Shohoudi A, Roy D, et al. Decreased Mortality With Beta-Blockers in Patients With Heart Failure and Coexisting Atrial Fibrillation. JACC Hear Fail. 2017;5(2):99-106. doi:10.1016/j.jchf.2016.10.015 [ Links ]
96. Marrouche NF, Brachmann J, Andresen D, et al. Catheter Ablation for Atrial Fibrillation with Heart Failure. N Engl J Med. 2018;378(5):417-427. doi:10.1056/NEJMoa1707855 [ Links ]
97. MERIT-HF Study Group. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in-Congestive Heart Failure (MERIT-HF). Lancet. 1999;353(9169):2001-2007. doi:10.1016/S0140-6736(99)04440-2 [ Links ]
98. Al-Khatib SM, Stevenson WG, Ackerman MJ, et al. 2017 AHA/ACC/HRS Guideline for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death. J Am Coll Cardiol. 2018;72(14):e91-e220. doi:10.1016/j.jacc.2017.10.054 [ Links ]
99. Moss AJ, Hall WJ, Cannom DS, et al. Improved Survival with an Implanted Defibrillator in Patients with Coronary Disease at High Risk for Ventricular Arrhythmia. N Engl J Med. 1996;335(26):1933-1940. doi:10.1056/NEJM199612263352601 [ Links ]
100. Moss AJ, Zareba W, Hall WJ, et al. Prophylactic Implantation of a Defibrillator in Patients with Myocardial Infarction and Reduced Ejection Fraction. N Engl J Med. 2002;346(12):877-883. doi:10.1056/NEJMoa013474 [ Links ]
101. Al-Khatib SM, Fonarow GC, Joglar JA, et al. Primary Prevention Implant-able Cardioverter Defibrillators in Patients With Nonischemic Cardiomyopathy. JAMA Cardiol. 2017;2(6):685. doi:10.1001/jamacardio.2017.0630 [ Links ]
102. Køber L, Thune JJ, Nielsen JC, et al. Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure. N Engl J Med. 2016;375(13):1221-1230. doi:10.1056/NEJMoa1608029 [ Links ]
103. Khan NK, Goode KM, Cleland JGF, et al. Prevalence of ECG abnormalities in an international survey of patients with suspected or confirmed heart failure at death or discharge. Eur J Heart Fail. 2007;9(5):491-501. doi:10.1016/j.ejheart.2006.11.003 [ Links ]
104. Cleland JGF, Daubert J-C, Erdmann E, et al. The Effect of Cardiac Resynchronization on Morbidity and Mortality in Heart Failure. N Engl J Med. 2005;352(15):1539-1549. doi:10.1056/NEJMoa050496 [ Links ]
105. Bristow MR, Saxon LA, Boehmer J, et al. Cardiac-Resynchronization Therapy with or without an Implantable Defibrillator in Advanced Chronic Heart Failure. N Engl J Med. 2004;350(21):2140-2150. doi:10.1056/NEJMoa032423 [ Links ]
106. Moss AJ, Hall WJ, Cannom DS, et al. Cardiac-Resynchronization Therapy for the Prevention of Heart-Failure Events. N Engl J Med. 2009;361(14):1329-1338. doi:10.1056/NEJMoa0906431 [ Links ]
107. Borggrefe MM, Lawo T, Butter C, et al. Randomized, double blind study of non-excitatory, cardiac contractility modulation electrical impulses for symptomatic heart failure. Eur Heart J. 2008;29(8):1019-1028. doi:10.1093/eurheartj/ehn020 [ Links ]
108. Neelagaru SB, Sanchez JE, Lau SK, et al. Nonexcitatory, cardiac contractility modulation electrical impulses: Feasibility study for advanced heart failure in patients with normal QRS duration. Hear Rhythm. 2006;3(10):1140-1147. doi:10.1016/j.hrthm.2006.06.031 [ Links ]
109. Kadish A, Nademanee K, Volosin K, et al. A randomized controlled trial evaluating the safety and efficacy of cardiac contractility modulation in advanced heart failure. Am Heart J. 2011;161(2):329-337.e2. doi:10.1016/j.ahj.2010.10.025 [ Links ]
110. Abraham WT, Nademanee K, Volosin K, et al. Subgroup Analysis of a Randomized Controlled Trial Evaluating the Safety and Efficacy of Cardiac Contractility Modulation in Advanced Heart Failure. J Card Fail. 2011;17(9):710-717. doi:10.1016/j.cardfail.2011.05.006 [ Links ]
111. Abraham WT, Kuck K-H, Goldsmith RL, et al. A Randomized Controlled Trial to Evaluate the Safety and Efficacy of Cardiac Contractility Modulation. JACC Hear Fail. 2018;6(10):874-883. doi:10.1016/j.jchf.2018.04.010 [ Links ]
112. Grigioni F, Enriquez-Sarano M, Zehr KJ, Bailey KR, Tajik AJ. Ischemic Mitral Regurgitation. Circulation. 2001;103(13):1759-1764. doi:10.1161/01.CIR.103.13.1759 [ Links ]
113. Goliasch G, Bartko PE, Pavo N, et al. Refining the prognostic impact of functional mitral regurgitation in chronic heart failure. Eur Heart J. 2018;39(1):39-46. doi:10.1093/eurheartj/ehx402 [ Links ]
114. Mirabel M, Iung B, Baron G, et al. What are the characteristics of patients with severe, symptomatic, mitral regurgitation who are denied surgery? Eur Heart J. 2007;28(11):1358-1365. doi:10.1093/eurheartj/ehm001 [ Links ]
115. Obadia J-F, Messika-Zeitoun D, Leurent G, et al. Percutaneous Repair or Medical Treatment for Secondary Mitral Regurgitation. N Engl J Med. 2018;379(24):2297-2306. doi:10.1056/NEJMoa1805374 [ Links ]
116. Stone GW, Lindenfeld J, Abraham WT, et al. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. N Engl J Med. 2018;379(24):2307-2318. doi:10.1056/NEJMoa1806640 [ Links ]
117. Pibarot P, Delgado V, Bax JJ. MITRA-FR vs. COAPT: lessons from two trials with diametrically opposed results. Eur Hear J-Cardiovasc Imaging. 2019;20(6):620-624. doi:10.1093/ehjci/jez073 [ Links ]
118. Grayburn PA, Sannino A, Packer M. Proportionate and Disproportionate Functional Mitral Regurgitation: A New Conceptual Framework That Reconciles the Results of the MITRA-FR and COAPT Trials. JACC Cardiovasc Imaging. 2019;12(2):353-362. doi:10.1016/j.jcmg.2018.11.006 [ Links ]
119. Hagendorff A, Knebel F, Helfen A, Stobe S, Doenst T, Falk V. Disproportionate mitral regurgitation: another myth? A critical appraisal of echocardiographic assessment of functional mitral regurgitation. Int J Cardiovasc Imaging. August 2020. doi:10.1007/s10554-020-01975-6 [ Links ]
120. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. December 2020. doi:10.1161/CIR.0000000000000923 [ Links ]
121. Angermann CE, Assmus B, Anker SD, et al. Pulmonary artery pressure D guided therapy in ambulatory patients with symptomatic heart failure: the Cardio MEMS European Monitoring Study for Heart Failure (MEMSDHF). Eur J Heart Fail. 2020;22(10):1891-1901. doi:10.1002/ejhf.1943 [ Links ]
122. Shavelle DM, Desai AS, Abraham WT, et al. Lower Rates of Heart Failure and All-Cause Hospitalizations During Pulmonary Artery Pressure-Guided Therapy for Ambulatory Heart Failure. Circ Hear Fail. 2020;13(8). doi:10.1161/CIRCHEARTFAILURE.119.006863 [ Links ]
123. Givertz MM, Stevenson LW, Costanzo MR, et al. Pulmonary Artery Pressure-Guided Management of Patients With Heart Failure and Reduced Ejection Fraction. J Am Coll Cardiol. 2017;70(15):1875-1886. doi:10.1016/j.jacc.2017.08.010 [ Links ]
124. Dhruva SS, Krumholz HM. Championing Effectiveness Before Cost-Effectiveness D. JACC Hear Fail. 2016;4(5):376-379. doi: 10.1016/j.jchf.2016.02.001 [ Links ]
125. Rose EA, Gelijns AC, Moskowitz AJ, et al. Long-Term Use of a Left Ventricular Assist Device for End-Stage Heart Failure. N Engl J Med. 2001;345(20):1435-1443. doi:10.1056/NEJMoa012175 [ Links ]
126. Aaronson KD, Slaughter MS, Miller LW, et al. Use of an Intrapericardial, Continuous-Flow, Centrifugal Pump in Patients Awaiting Heart Transplantation. Circulation. 2012;125(25):3191-3200. doi:10.1161/CIRCULATIONAHA.111.058412 [ Links ]
127. Rogers JG, Pagani FD, Tatooles AJ, et al. Intrapericardial Left Ventricular Assist Device for Advanced Heart Failure. N Engl J Med. 2017;376(5):451-460. doi:10.1056/NEJMoa1602954 [ Links ]
128. Mehra MR, Uriel N, Naka Y, et al. A Fully Magnetically Levitated Left Ventricular Assist Device - Final Report. N Engl J Med. 2019;380(17):1618-1627. doi:10.1056/NEJMoa1900486 [ Links ]
129. Potapov EV, Antonides C, Crespo-Leiro MG, et al. 2019 EACTS Expert Consensus on long-term mechanical circulatory support. Eur J Cardio-Thoracic Surg. 2019;56(2):230-270. doi:10.1093/ejcts/ezz098 [ Links ]
130. Docherty KF, Campbell RT, Jhund PS, Petrie MC, McMurray JJV. How robust are clinical trials in heart failure? Eur Heart J. October 2016:ehw427. doi:10.1093/eurheartj/ehw427 [ Links ]
131. Greene SJ, Butler J, Fonarow G. Simultaneous or Rapid Sequence Initiation of Quadruple Medical Therapy for Heart Failure- Optimizing Therapy With the Need for Speed. JAMA Cardiol 2021 Mar 31. doi: 10.1001/jamacardio.2021.0496 [ Links ]
132. Mehra MR, Canter CE, Hannan MM, et al. The 2016 International Society for Heart Lung Transplantation listing criteria for heart transplantation: A 10-year update. J Hear Lung Transplant. 2016;35(1):1-23. doi:10.1016/j.healun.2015.10.023 [ Links ]
Anexo
Tratamiento de comorbilidades
Suplementación de hierro
La deficiencia de hierro está estrechamente relacionada con la gravedad de la FC y se asocia a un mayor riesgo de muerte, independientemente de la presencia de anemia 83, peor clase funcional, pobre capacidad máxima al esfuerzo y peor calidad de vida 84,85. La deficiencia de hierro afecta al 50% de los pacientes con FC 86.
La administración intravenosa de hierro se ha estudiado específicamente en dos estudios aleatorizados (FAIR-HF y CONFIRM-HF) 87,88 en pacientes con FC y déficit de hierro demostraron que el hierro carboximaltosa intravenoso mejora el estado general de los pacientes, la calidad de vida y la clase funcional de la NYHA. Como objetivo secundario, se observó una reducción significativa de la hospitalización por empeoramiento de la FC. El reciente ensayo AFFIRM AHF en 1132 pacientes con hospitalización por FC aguda y asociada a deficiencia de hierro, demostró impacto sobre el desenlace combinado de hospitalizaciones totales por FC y muerte de origen cardiovascular, aunque casi exclusivamente a expensas de la reducción en las hospitalizaciones (57.2 pacientes/año vs 72.5 pacientes/año) 89,90.
Fibrilación auricular
Se reporta una prevalencia de FA del 4.2% en pacientes NYHA I y hasta el 49.8% en pacientes NYHA IV 91. El desarrollo de FA en esta población se asocia a un peor pronóstico, asociándose con un aumento significativo de la mortalidad global (OR 1.4, IC 1.32-1.48) 92; en todos los pacientes con disfunción ventricular y FA está indicada la anticoagulación dado que la presencia de FC confiere un aumento de 1.7-2.6 veces en el riesgo fenómenos embólicos 93. Para el control de la respuesta ventricular se pueden emplear betabloqueadores, digoxina y como último recurso amiodarona. Los calcioantagonistas no dihidropiridínicos están contraindicados. A pesar de que no ha sido estudiado específicamente, en estos pacientes se propone una meta de frecuencia cardiaca entre < 100-110 latidos por minuto 94.
Aunque ciertos betabloqueadores tienen claro beneficio sobre la mortalidad en FC-FEVIr, el beneficio de esta terapia parece atenuarse en los pacientes que de manera concomitante presentan FA. Así, estudios muestran que los betabloqueadores disminuyen la mortalidad del paciente en ritmo sinusal (HR 0.73, IC 0.67-0.8) pero no en ritmo de FA (0.97, IC 0.83-1.14). A pesar de esto, los betabloqueadores son seguros y algunos estudios sugieren que podría haber un efecto benéfico por lo que se recomienda su uso 95; como alternativa puede utilizarse la digoxina con menores efectos secundarios de acuerdo con los resultados del ensayo RATE-AF 32.
El aislamiento eléctrico de venas pulmonares es una alternativa atractiva; el estudio CASTLE-AF encontró que los pacientes con FEVI < 35% y FA con pobre respuesta al tratamiento que se asignaron a ablación por catéter tuvieron una disminución en el desenlace combinado de muerte u hospitalización por FC al compararse con la terapia estándar (HR 0.62, IC 0.43-0.87) 96; sin embargo, el efecto solo pudo ser manifiesto después de dos años de seguimiento. Estudios adicionales en esta área son necesarios para definir el papel definitivo de esta terapia.
Tratamiento con dispositivos
Desfibrilador automático implantable (DAI)
La causa de muerte en el paciente con FC varía según la clase funcional 97. En NYHA II, 64% de las muertes son de origen súbito y 12% por progresión de la FC; mientras que la mayoría de las muertes en NYHA IV son secundarias a progresión de la enfermedad (56%). Así, la mayoría de los estudios evaluando el papel del DAI han incluido pacientes sintomáticos NYHA II/III. En NYHA IV se desaconseja el uso de esta terapia (recomendación clase III) dado que esta población fue excluida de la mayoría de los estudios y que su pronóstico es pobre sin trasplante cardiaco 98.
El uso del DAI está recomendado para prevención primaria en pacientes con FEVI <35% luego de tres meses de tratamiento cuando se tiene una expectativa de vida superior a un año. El MADIT I fue el primer estudio en evaluar esta intervención. En éste, pacientes con cardiopatía isquémica, FEVI <35% y episodios de taquicardia ventricular no sostenida, tuvieron una reducción en la mortalidad con el uso de DAI (HR 0.46; IC 0.26-0.82) 99. En el MADIT II, los pacientes con cardiopatía isquémica y FEVI <30% que fueron asignados a DAI, tuvieron una menor mortalidad global a dos años (14.2% vs 19.8%; HR 0,69, IC 0.51-0.93) 100.
El uso de DAI en cardiopatía no isquémica tiene una evidencia menos sólida, aunque hay estudios que avalan su uso 101. El 50% de la población incluida en el SCD-HeFT tenía una cardiopatía no isquémica. En este ensayo, pacientes con FEVI <35% y clase funcional NYHA II/III se asignaron a placebo, amiodarona o DAI. El uso de DAI se asoció a una reducción en el riesgo de muerte (HR 0.77, IC 0.62-0.96) sin haber diferencias en el subanálisis según la etiología de la FC.
Por otro lado, el estudio DANISH incluyó paciente específicamente de origen no isquémico. Aunque en el estudio, hubo diferencias en el desenlace secundario de muerte súbita (HR 0.5, IC 0.31-0.82), no hubo diferencias en el desenlace primario de mortalidad (HR 0.87, IC 0.681.12) 102.
Terapia de resincronización cardiaca (TRC)
La disincronía ventricular es un hallazgo frecuente en los pacientes con FC. Aunque existen diferentes maneras para estimar la misma, la duración del QRS sigue siendo el método más adecuado. Un QRS prolongado (>120 milisegundos) es un hallazgo frecuente en el paciente con FC (28% de los casos) 103. La TRC busca mejorar la disincronía electromecánica mediante la estimulación biventricular e impacta de manera favorable la FEVI, el remodelamiento cardiaco, el grado de insuficiencia mitral y los niveles de NTproBNP 104. Además, algunos estudios han demostrado beneficio en desenlaces de mortalidad y hospitalización por FC 104-106.
La FEVI, la duración del QRS, la morfología del bloqueo de rama y la clase funcional son los parámetros empleados para definir la necesidad de TRC. El COMPANION, evaluó la utilidad de la TRC en pacientes NYHA III/IV, con FEVI <35% y QRS >120 milisegundos. Este estudio comparó de manera aleatoria los grupos de manejo farmacológico, TRC, o TRC con DAI. El uso de TRC disminuyó de manera significativa el desenlace combinado de muerte y hospitalización (HR 0.81; IC 0.69-0.96). En el análisis por subgrupos, no hubo beneficio de la intervención en presencia de bloqueos diferentes a rama izquierda 105.
El estudio MADIT-CRT incluyó pacientes con FEVI <30%, QRS >130 milisegundos y una clase funcional NYHA I/II. Los pacientes se asignaron a TRC con DAI vs DAI de manera aislada. El ensayo encontró que los pacientes asignados a TRC con DAI tenían un menor desenlace combinado de muerte o eventos asociados a FC (17.2% vs 25.3%, HR 0.66; IC 0.52-0.84). En el análisis por subgrupos se encontró que las personas con QRS <150 milisegundos no tenían un beneficio de la intervención (HR 1.06, IC 0.74-1.52) 106.
Modulación de la contractilidad cardiaca
La modulación de la contractilidad cardiaca consiste en la estimulación eléctrica con señal bifásica, de alto voltaje y larga duración de la pared septal del ventrículo derecho durante el periodo refractario absoluto; la señal no produce una nueva contracción, sino que influencia la biología del miocardio en falla. Esto resulta en un incremento de la contractilidad cardiaca sin aumentar el consumo de oxígeno y genera remodelado reverso. Después de completar con éxito un estudio doble ciego y doble cruzado en Europa (FIX-HF-4) 107 y un estudio piloto en los Estados Unidos 108 se diseñó el estudio FIX-HF-5 para estudiar prospectivamente la seguridad y eficacia de la modulación de la contractilidad cardiaca en pacientes con FC con síntomas NYHA III o IV y FEVI <35% 109. Se incluyeron 428 pacientes, alcanzando el desenlace primario de seguridad (una evaluación de no inferioridad de la combinación de mortalidad por todas las causas y hospitalizaciones por todas las causas). Sin embargo, el desenlace primario de eficacia, que consistía en un análisis de los respondedores de los cambios en el umbral anaeróbico ventilatorio en las pruebas de esfuerzo cardiopulmonar, no se cumplió. Un análisis de subgrupos preespecificado mostró efectos significativos del tratamiento en los desenlaces primarios y secundarios (incluido el VO2 pico y el cuestionario Minnesota Living With Heart Failure Questionnaire) en pacientes con FEVI que oscilaban entre el 25% y el 45% 110. Con base en estos hallazgos se diseñó el estudio confirmatorio FIX-HF-5C 111, con el fin de confirmar prospectivamente la eficacia de la modulación de contractilidad cardiaca en pacientes con FEVI 25%-45%, encontrando mejoría en la tolerancia al ejercicio y la calidad de vida en el grupo especificado de pacientes con FC, y menores hospitalizaciones por FC.
Clip mitral
Se sabe que en los pacientes con FC e insuficiencia mitral secundaria hasta el 62% habrán muerto a cinco años 112-114. En este escenario surge, como una modificación a la técnica ideada por Alfieri en 1991, el reparo borde a borde por método percutáneo, más conocido como Mitra-Clip®, con el objetivo de obtener las presuntas ventajas de la reducción de la insuficiencia mitral funcional, mediante un método menos invasivo como es la implantación con catéter percutáneo.
Los estudios clínicos en este escenario han sido contradictorios así en el estudio MITRA-FR 115 en pacientes con FEVI 15-40% y NYHA >II a pesar de tratamiento óptimo con insuficiencia mitral secundaria con volumen regurgitante ≥30 cc u orificio regurgitante ≥20 mm2, los cuales no fuesen candidatos quirúrgicos no se logró demostrar la superioridad del MitraClip® aunado al manejo médico frente al manejo médico exclusivo en disminución de hospitalización por FC o muerte cardiovascular; en contraposición, en el estudio COAPT 116 pacientes con FEVI 20-50% y NYHA ≥II a pesar de tratamiento óptimo con insuficiencia mitral secundaria clasificada como 3+ o 4+, los cuales no fuesen candidatos quirúrgicos se demostró la superioridad del MitraClip® aunado al manejo médico frente al manejo médico exclusivo en disminución de hospitalización por FC (HR 0.53 IC 0.40- 0.70) o muerte (HR 0.62 IC 0.46-0.82).
Estos hallazgos generaron el concepto de regurgitación mitral proporcionada y desproporcionada, en el cual se plantea que existen pacientes cuya regurgitación mitral secundaria es proporcional al grado de dilatación ventricular por lo que en teoría responderían a terapias para reducir el volumen de fin de diástole ventricular izquierdo, en contraposición a otro grupo cuya severidad de la regurgitación es desproporcionada con respecto al volumen ventricular, por lo que se beneficiarían de intervenciones dirigidas a la válvula mitral 117-118; la propuesta es bastante seductora y ha sido aceptada hasta ahora, aunque sigue generando controversia 119, por lo que es importante estar atentos a nueva evidencia.
Por lo anteriormente expuesto, se puede considerar que en aquellos pacientes con FEVI 20-50% con un diámetro de fin de diástole del ventrículo izquierdo ≤ 70 mm con presión arterial pulmonar ≤ 70 mmHg, que persistan en NYHA ≥II a pesar de tratamiento óptimo y que tengan regurgitación mitral secundaria severa, el uso de MitraClip® estaría indicado 120.
CardioMEMS
La vigilancia remota de las variables hemodinámicas es un campo actual de investigación, de especial interés entre los pacientes con síntomas graves o FC avanzada. De forma convencional los DAI y TRC proporcionan información y alertas remotas que conducen a ajustes en el tratamiento del paciente. El dispositivo CardioMEMS, mide variables hemodinámicas en la arteria pulmonar y envía información de manera remota, su uso en pacientes con FC clase funcional NYHA III, se asoció con una reducción en el riesgo de hospitalizaciones por FC (HR 0.72 IC95% 0.59-0.88), con una presentación de complicaciones que no superaba el 1%, resultados reproducidos en el estudio MEMES HF 121, que se mantienen a un año de seguimiento 122. A pesar de tener aprobación por entidades regulatorias, las recomendaciones de las sociedades científicas son débiles dada la incertidumbre generada por el diseño de los estudios mencionados y por su costo-efectividad 123,124.
Asistencia ventricular
El estudio clásico fue el REMATCH publicado en 2001 incluyó pacientes con FC avanzada con contraindicación para trasplante, el cual demostró reducción de mortalidad comparado con placebo (RR 0.52 IC 95% 0.34-0.78) 125. Los desarrollos posteriores se centraron en mejorar el tamaño, la biocompatibilidad, durabilidad y disminuir la tasa de infecciones, pasando por dispositivos de segunda generación como el Heart Mate II, hasta llegar a los actuales, de tercera generación, con flujo continuo generado por bombas centrifugas como el Heart Ware y el Heart Mate III.
El ADVANCE trial con el dispositivo Heart Ware demostró supervivencia de 86% al año de seguimiento 126; posteriormente el ENDURANCE Trial demostró no inferioridad comparado con otros dispositivos de asistencia ventricular, con menor tasa de disfunción o falla del dispositivo, pero con aumento de la tasa de eventos cerebrovasculares y similar ganancia en calidad de vida 127. Finalmente, el MOMENTUM 3 Trial con el dispositivo Heart Mate 3 demostró superioridad con respecto a los dispositivos convencionales en cuanto a supervivencia y libre de enfermedad cerebrovascular o necesidad de reemplazo o remoción por disfunción a los dos años de seguimiento (RR 0.84 IC 95% 0.78-0.91) 128.
Por lo anterior el soporte mecánico circulatorio a largo plazo debe ser considerado en pacientes con estado funcional NYHA III-IV a pesar de manejo médico óptimo, con FEVI ≤ 25% y al menos otro criterio como: clasificación INTERMACS 2-4, dependencia de inotrópicos, disfunción de órgano progresiva, VO2 pico < 12 ml/Kg/minuto o dependencia de soporte mecánico temporal 129.
Recibido: 08 de Febrero de 2021; Aprobado: 20 de Agosto de 2021











 text in
text in