Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Medica Colombiana
Print version ISSN 0120-2448
Acta Med Colomb vol.47 no.2 Bogotá Apr./June 2022 Epub Jan 07, 2023
https://doi.org/10.36104/amc.2022.2253
Presentación de casos
Mejoría del ACV con estimulación magnética recapitula la ontogenia
a Neuró logos Clínica Reina Sofía, Hospital Infantil Universitario de San José; Bogotá, D.C. (Colombia).
bFisioterapeuta. Therapy at home; Bogotá, D.C. (Colombia).
c Radiólogas Hos pital Infantil Universitario de San José. Bogotá, D.C. (Colombia).
d Genética. Grupo de Investigación en Psiquiatría, GIPSI, Uni versidad de Antioquia. Medellín (Colombia).
Una paciente con secuelas crónicas de un ACV del tallo cerebral recibió un ciclo de estimulación magnética para el manejo de la disfagia y, por serendipia obtuvo mejoría leve del movimiento axial. Dos ciclos adicionales le permitieron mejoría del control postural y luego la aparición de movimiento distal, precedidos por la visualización de los potenciales evocados motores ipsilateral y contralateral, respectivamente. La estimulación magnética a 10 Hertz produce desinhibición cortical y reabre los periodos críticos del neurodesarrollo. Es posible, que el patrón ontogénico de recuperación de la hemiplejía en esta paciente se explique por el incremento y rejuvenecimiento de la plasticidad cerebral debido a la reapertura de los periodos críticos, por medio de la desinhibición cortical. (Acta Med Colomb 2022; 47. DOI:https://doi.org/10.36104/amc.2022.2253).
Palabras clave: estimulación magnética transcraneal; potenciales evocados motores; rehabilitación de accidente cerebrovascular; plasticidad neuronal; inhibición neural
A patient with chronic brainstem CVA sequelae received one cycle of magnetic stimulation to treat her dysphagia and serendipitously obtained a minimal improvement in her axial movement. Two additional cycles gave her improved postural control and then distal movement, preceded by a display of ipsilateral and contralateral motor evoked potentials, respectively. Magnetic stimulation at 10 Hertz produces cortical disinhibition and reopens the critical neurodevelop ment periods. The ontogenic pattern of hemiplegia recovery in this patient may be explained by an increased and rejuvenated brain plasticity due to critical period reopening through cortical disinhibition. (Acta Med Colomb 2022; 47. DOI:https://doi.org/10.36104/amc.2022.2253).
Keywords: transcranial magnetic stimulation; motor evoked potentials; cerebrovascular ac cident; neural plasticity; neural inhibition.
Introducción
La recuperación espontánea de la hemiplejía, posterior al ataque cerebrovascular (ACV), tiene un patrón ontogénico 1 que está acompañado del incremento de proteínas de los periodos críticos del neurodesarrollo 1. La reapertura de los periodos críticos se ha propuesto como tratamiento del ACV 2,3. En los pacientes adultos con ambliopía, se ha sugerido que la EMTr a 10 Hertz puede reabrir los periodos críticos 4. Es posible que en los pacientes con hemiplejía postACV, la EMTr a 10 Hertz reabra los periodos críticos y produzca recuperación del movimiento con un patrón ontogénico.
Se trata de una paciente de 38 años con déficit neurológico severo, después de diecisiete meses de haber presentado una hemorragia de tallo cerebral, secundaria a la ruptura de una malformación arteriovenosa que no requirió manejo quirúrgico (Figura 1). El examen neurológico mostró una paciente alerta, con comprensión normal del lenguaje, disartria severa, movimiento mínimo de la úvula y el pa ladar blando, reflejo nauseoso muy disminuido, hemiplejía derecha, hemiparesia izquierda, la cabeza permanecía con postura en flexión, tenía inestabilidad severa del tronco, y no podía pararse. La paciente se comunicaba por medio de un tablero alfabético que utilizaba su cuidadora en respuesta a los movimientos de parpadeo. Un experto en neurorrehabilitación le recomendó el uso de estimulación cerebral no invasiva como adyuvante de la rehabilitación. Se le ad ministró EMTr para el ACV, en una modalidad terapéutica fuera de etiqueta 5-7. Este manuscrito fue aprobado por los comités de ética de la Fundación Universitaria Sanitas, CEIFUS 1382-20, y del Hospital Universitario Infantil de San José, 113/2020.
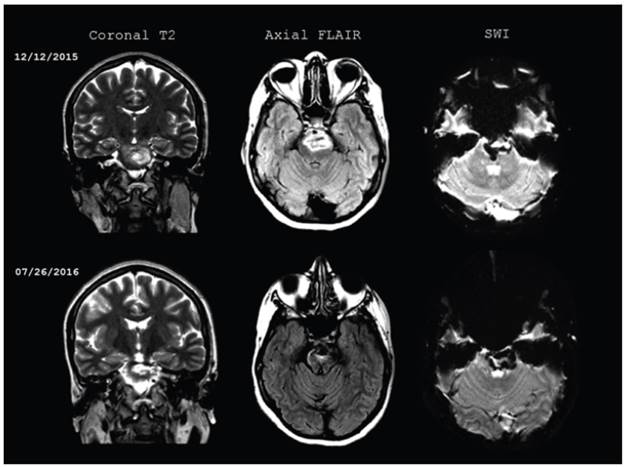
Figura 1 La resonancia cerebral inicial y un control siete meses después del ACV. Hemorragia del tallo cerebral que se extiende desde el mesencéfalo hasta la protuberancia, con señal hete rogénea en T2, edema perilesional en FLAIR. En SWI la sangre permanece en diferentes estadios de evolución, sin cambios de tamaño con respecto a las imágenes iniciales.
Primer ciclo
Adaptamos un protocolo con EMTr bilateral a 10 Hertz que se utiliza para disfagia 10, pues el déficit motor se vero de la paciente contraindicaba el uso de estimulación inhibitoria 8,9 y la paciente podía asistir máximo tres días a la semana. Administramos veinte sesiones de EMTr, utilizando un equipo MagPro R30, una bobina en forma de ocho (MCF-B65), y una frecuencia de dos o tres sesiones por semana. Toda sesión comenzaba con la ubicación del "hot spot" y la determinación del umbral motor en reposo (UMr). El UMr se basó en la visualización de una contracción mus cular mínima. Debido al déficit motor orofaríngeo severo y la flexión continua de la cabeza, utilizamos el miembro superior como "hot spot". El "hot spot" fue posible localizar sobre la corteza motora primaria (M1) del lado derecho, y el UMr se obtuvo del músculo abductor pollicis brevis iz quierdo. El pulso magnético sobre el hemisferio izquierdo no indujo contracción muscular, por lo que localizamos el "hot spot" izquierdo en un sitio homotópico de M1 derecho, y utilizamos el UMr derecho. Sobre M1 derecho, la EMTr se aplicó en trenes de 5 segundos de duración, a frecuencia de 10 Hertz e intensidad de 90% de UMr, con un intervalo entre trenes de 55 segundos, durante 15 minutos y un total de 750 pulsos; seguido del mismo protocolo sobre M1 iz quierdo. Al finalizar este ciclo, la paciente presentó mejoría en la deglución, e inesperadamente apareció contracción voluntaria de los músculos rhomboideus derechos.
Segundo ciclo
Después de dos meses de rehabilitación no se observó me joría adicional, y se aplicó un segundo ciclo. Se agregó una bobina en forma de cono (D-B80), para estimular la corteza motora de los miembros inferiores. Esa bobina se colocaba en el sitio del plano sagital medio, donde fuera visible la mayor contracción del músculo tibialis anterior izquierdo. Se aplicaron trenes de EMTr de 10 segundos de duración, a 10 Hertz y 90% del UMr, con un intervalo entre trenes de 50 segundos, durante 20 minutos, y un total de 2000 pulsos 11. La frecuencia de las sesiones era la misma del primer ciclo, y se alternaba cada sesión para aplicar el protocolo del primer ciclo o el protocolo para los miembros inferiores. Al inicio de este ciclo se observó que la búsqueda de rutina del "hot spot" sobre el hemisferio derecho, produjo contracción muscular del brazo pléjico derecho, es decir se visualizó el potencial evocado motor ipsilateral (PEMi). Pocos días después la paciente empezó a tener movimiento voluntario proximal en el miembro superior e inferior, del hemicuerpo derecho. Luego de 14 sesiones, la recuperación del movi miento proximal era significativa y se decidió suspender la estimulación magnética. Un mes después la paciente podía sostener la cabeza, permanecer sentada, y estar de pie de manera independiente (Figura 2).
Tercer ciclo
Cuatro meses después del segundo ciclo la paciente continuaba con la mano derecha pléjica, no tenía equilibrio dinámico en la bipedestación y se realizó un tercer ciclo de 20 sesiones con los mismos parámetros del segundo ciclo. En este ciclo se observó que la búsqueda rutinaria del "hot spot" sobre M1 izquierdo, produjo contracción de la mano derecha, es decir apareció el potencial evocado motor (PEM). Al final de este ciclo la paciente tenía movimiento voluntario leve del músculo abductor pollicis brevis derecho.
Discusión
Una paciente adulta con ACV crónico del tallo cerebral obtuvo mejoría de su hemiplejía luego de recibir tres ciclos de EMTr, que inicialmente estaba dirigida para la disfagia.
Al final del primer ciclo mejoró la deglución, y apareció de forma inesperada movimiento voluntario en los músculos rhomboideus derechos. La deglución es el modelo para es tudiar la reorganización del control motor de la musculatura axial postACV 12. La musculatura axial esta inervada por el tracto corticorreticuloespinal (TCRE) 13. Nosotros aplicamos EMTr bilateral sobre M1, sitio donde se origina parte del TCRE 13. Así, sospechamos que la aparición del movimiento voluntario axial se produjo por la activación del TCRE 14.
Con el segundo ciclo se visualizó el PEMi en el brazo pléjico, seguido de la recuperación del movimiento proxi mal y el control postural. Esto confirmó nuestra sospecha de activación del TCRE 14, debido a que este tracto es responsable del PEMi 15,16 e inerva la musculatura axial-proximal encargada del control postural 13. En los adultos, el PEMi está sujeto a inhibición cortical 16. La desinhibición cortical permite el desenmascaramiento de vías latentes 17. Especulamos que la desinhibición cortical que produce la EMTr a 10 Hertz 18, fue la responsable del desenmascaramiento del TCRE ipsilateral a la hemiplejia. Esto apoya la propuesta del efecto terapéutico que tiene el TCRE ipsilateral para la rehabilitación del movimiento proximal 19, y la contraindicación para aplicar estimula ción inhibitoria ipsilateral en los pacientes con ACV severo 8,9, debido a que inhibe el TCRE 9.
Ontogénicamente, el PEMi desaparece a los 10 años debido a procesos inhibitorios 20. En los pacientes adul tos con déficit motor severo postACV, la desinhibición del TCRE produce la reaparición de PEMi 21, pero esto se asocia con mal pronóstico 21. Lo contrario ocurre en los adolescentes hemipléjicos, en quienes la aparición del PEMi marca el inicio de la recuperación 22. Los niños recuperan mejor que los adultos después del ACV, debido en parte a la plasticidad cerebral 23. La mayor plasticidad de los cerebros jóvenes se debe a que tienen un menor nivel de inhibición cortical que los adultos 24. La desinhibición cortical, aumenta y rejuvenece la plasticidad del cerebro al reabrir los periodos críticos (25). La EMTr a 10 Hertz pro duce desinhibición cortical 18. Se ha sugerido que la EMTr a 10 Hertz produce reapertura de los periodos críticos 3,4, debido a que mejora los pacientes adultos con ambliopía 4. Adicionalmente la EMTr a 10 Hertz sobre M1 aumenta la expresión de las proteínas c-fos y zif268 26, cuyos genes participan en los periodos críticos 27. Especulamos que, en nuestra paciente la EMTr a 10 Hertz sobre M1 reabrió los periodos críticos y aumentó la plasticidad cerebral a un nivel que permitió la aparición de PEMi y el inicio de la recuperación, como ocurre en los adolescentes 22. Esto apoyaría la reapertura de los periodos críticos como tratamiento del ACV 2,3. Y nos permite sugerir que el mal pronóstico de PEMi en los pacientes adultos con ACV severo 21 podría relacionarse con una plasticidad cerebral insuficiente, y que la desinhibición cortical con EMTr a 10 Hertz podría ayudar a solucionarlo.
Durante el tercer ciclo apareció el PEM en la mano pléjica seguido de la aparición de movimiento voluntario distal mínimo, eventos que están relacionados con el tracto corticoespinal (TCE) 15. La activación del TCE utili zando EMTr de alta frecuencia, corresponde a un efecto similar a la PLP 5-7. Hemos especulado que la recupe ración de nuestra paciente comenzó con un movimiento axial-proximal debido al desenmascaramiento del TCRE ipsilateral, y continuó con el movimiento distal debido a la PLP del TCE. El desenmascaramiento y la PLP son dos mecanismos de plasticidad cerebral que requieren de la desinhibición cortical 17,28. Así, apoyamos que la desinhibición cortical maximiza la eficiencia de las vías corticoespinales en los pacientes con ACV 5,29, permitiendo una reorganización cerebral efectiva 5,29. También apoyamos que la desinhibición cortical es una estrategia terapéutica novedosa del ACV 30, y sugerimos que se puede lograr con la aplicación de EMTr a 10 Hz.
Ontogénicamente, el movimiento distal se produce sólo después de existir un movimiento proximal adecuado 31. Este patrón ontogénico también se presenta durante la recuperación espontánea de la hemiplejía postACV 1 y fue el patrón que obtuvimos en nuestra paciente. En el 2008 el grupo de Londres propuso que la recuperación del ACV mayor requiere del reclutamiento escalonado de M1 ipsilesional y del área premotora contralesional 29, y que esta última no se requiere en la recuperación del ACV menor 29. Nuestra paciente tenía un déficit motor axial-proximal severo, y por esto requirió el reclutamiento del TCRE. La mayoría de las fibras del TCRE se originan del área premotora 13. Especulamos que el reclutamiento del área premotora depende de si existe o no movimiento axial-proximal adecuado y así la propuesta del grupo de Londres correspondería al correlato neurofisiológico del modelo de recuperación ontogénica postACV 29.
Este estudio tiene varias limitaciones. En primer lugar debido a que sólo se informa un caso, no se puede excluir la mejoría espontánea, ni se puede excluir el efecto pla cebo en ausencia de cegamiento. Además no realizamos estudios neurofisiológicos ni de tractografía, ni obtuvimos sistemáticamente el PEMi. Se necesitan estudios futuros que incorporen una evaluación detallada en una muestra de estudio más grande para confirmar estos hallazgos.
References
1. Cramer SC, Chopp M. Recovery recapitulates ontogeny. TrendsNeurosci. 2000; 23(6): 265-71. [ Links ]
2. Sanes JR, Jessell TM. Experience and the refinement of synaptic connections. In: Kandel ER, Schwartz JH, Jessell TM, Siegelbaum SA, Hudspeth AJ eds. Principles of neural science. 5th ed. New York: McGraw-Hill; 2012. p. 1259-82. [ Links ]
3. Hensch TK, Bilimoria PM. Reopening windows: Manipulating critical periods for brain development. Cerebrum. 2012; 12: 11. [ Links ]
4. Thompson B, Mansouri B, Koski L, Hess RF. Brain plasticity in the adult: modu lation of function in amblyopia with rTMS. Curr Biol. 2008; 18(14): 1067-71. [ Links ]
5. Castillo G, García G, Bojacá G. La estimulación magnética transcraneal (EMT) en la evaluación y el tratamiento del ataque cerebrovascular (ACV). Acta Neurol Colomb 2009; 25(4): 262-266. [ Links ]
6. Lefaucheur JP, André-Obadia N, Antal A, Ayache SS, Baeken C, Benninger DH, et al. Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS). Clin Neurophysiol. 2014; 125(11): 2150-206. [ Links ]
7. Filippo TRM, Alfieri FM, Cichon FR, Imamura M, Battistella LR. Neuroplasticidade e recuperação funcional na reabilitação pós-acidente vascular encefálico. Acta Fisiatr. 2015; 22(2): 93-96. [ Links ]
8. Bradnam LV, Stinear CM, Barber PA, Byblow WD. Contralesional hemisphere control of the proximal paretic upper limb following stroke. Cereb Cortex. 2012;22(11): 2662-71. [ Links ]
9. Bradnam LV, Stinear CM, Byblow WD. Ipsilateral motor pathways after stroke: implications for non-invasive brain stimulation. Front Hum Neurosci. 2013; 7:184. [ Links ]
10. Park E, Kim MS, Chang WH, Oh SM, Kim YK, Lee A, et al. Effects of bilat eral repetitive transcranial magnetic stimulation on post-stroke dysphagia. Brain Stimul. 2017; 10(1): 75-82. [ Links ]
11. Kakuda W, Abo M, Watanabe S, Momosaki R, Hashimoto G, Nakayama Y, et al. High-frequency rTMS applied over bilateral leg motor areas combined with mobility training for gait disturbance after stroke: A preliminary study. Brain Inj. 2013; 27(9): 1080-6. [ Links ]
12. Hamdy S, Rothwell JC. Gut feelings about recovery after stroke: the organization and reorganization of human swallowing motor cortex. Trends Neurosci. 1998;21(7): 278-82. [ Links ]
13. Jang SH, Lee SJ. Corticoreticular tract in the human brain: A mini review. Front Neurol. 2019; 10:188. [ Links ]
14. Castillo G, Tuso L, Rodriguez J, Arcos-Burgos M, Ramirez S. Recovering postural control with rTMS. Case report [abstract]. Brain Stimul. 2019; 12(2):422. [ Links ]
15. Ziemann U, Ishii K, Borgheresi A, Yaseen Z, Battaglia F, Hallett M, et al. Dissociation of the pathways mediating ipsilateral and contralateral motor-evoked potentials in human hand and arm muscles. J Physiol. 1999; 518(Pt 3): 895-906. [ Links ]
16. McCambridge AB, Stinear JW, Byblow WD. Are ipsilateral motor evoked po tentials subject to intracortical inhibition?. J Neurophysiol. 2016; 115(3): 1735-9. [ Links ]
17. Jacobs KM, Donoghue JP. Reshaping the cortical motor map by unmasking latent intracortical connections. Science. 1991; 251(4996): 944-7. [ Links ]
18. Pascual-Leone A, Tormos JM, Keenan J, Tarazona F, Cañete C, Catalá MD. Study and modulation of human cortical excitability with transcranial magnetic stimulation. J Clin Neurophysiol. 1998; 15(4): 333-43. [ Links ]
19. Jankowska E, Edgley SA. How can corticospinal tract neurons contribute to ipsilateral movements? A question with implications for recovery of motor func tions. Neuroscientist. 2006; 12(1): 67-79. [ Links ]
20. Müller K, Kass-Iliyya F, Reitz M. Ontogeny of ipsilateral corticospinal projec tions: a developmental study with transcranial magnetic stimulation. Ann Neurol. 1997; 42(5): 705-11. [ Links ]
21. Netz J, Lammers T, Homberg V. Reorganization of motor output in the non-affected hemisphere after stroke. Brain. 1997; 120(Pt 9): 1579-86. [ Links ]
22. Maegaki Y, Maeoka Y, Seki A, Ueno M, Yamamoto T, Takeshita K. Facilitation of ipsilateral motor pathways during recovery from hemiplegia in two adolescent patients. Eur J Paediatr Neurol. 1997; 1(2-3): 79-84. [ Links ]
23. National Institute of Neurological Disorders and Stroke. Stroke: Hope through research. NIH Publication No. 20-NS-2222 February 2020. Disponible en: https://www.ninds.nih.gov/sites/default/files/stroke_hope_through_research_february_2020_508c.pdf [ Links ]
24. Mall V, Berweck S, Fietzek UM, Glocker FX, Oberhuber U, Walther M, et al. Low level of intracortical inhibition in children shown by transcranial magnetic stimulation. Neuropediatrics. 2004; 35(2): 120-5. [ Links ]
25. Patton MH, Blundon JA, Zakharenko SS. Rejuvenation of plasticity in the brain: opening the critical period. Curr Opin Neurobiol. 2019; 54: 83-9. [ Links ]
26. Aydin-Abidin S, Trippe J, Funke K, Eysel UT, Benali A. High- and low-frequency repetitive transcranial magnetic stimulation differentially activates c-Fos and zif268 protein expression. Exp Brain Res. 2008; 188(2): 249-61. [ Links ]
27. Kaczmarek L, Zangenehpour S, Chaudhuri A. Sensory regulation of immediate-early genes c-fos and zif268 in monkey visual cortex at birth and throughout the critical period. Cereb Cortex. 1999; 9(2): 179-87. [ Links ]
28. Hess G, Aizenman CD, Donoghue JP. Conditions for the induction of long-term potentiation in layer II/III horizontal connections of the rat motor cortex. J Neurophysiol. 1996; 75(5): 1765-78. [ Links ]
29. Swayne OB, Rothwell JC, Ward NS, Greenwood RJ. Stages of Motor Output Reorganization after Hemispheric Stroke Suggested by Longitudinal Studies of Cortical Physiology. Cereb Cortex 2008; 18(8): 1909-22. [ Links ]
30. Kim YK, Yang EJ, Cho K, Lim JY, Paik NJ. Functional recovery after ischemic stroke is associated with reduced GABAergic inhibition in the cerebral cortex: A GABA PET study. Neurorehabil Neural Repair. 2014; 28(6): 576-83. [ Links ]
31. Rosenbaum D. Reaching and Grasping. In: Rosenbaum DA, editor. Human Motor Control. 2nd ed. New York: Academic Press; 2009. p. 208-250. [ Links ]
Recibido: 16 de Julio de 2021; Aprobado: 14 de Octubre de 2021











 text in
text in 



